甜瓜抗霜霉病KASP分子标记的开发与验证
2024-02-22沈悦凌悦铭段晓宇杨文莉李寐华王懿柔王惠林张学军



摘"要:【目的】""开发及验证与甜瓜霜霉病抗性基因紧密连锁的KASP分子标记,为甜瓜抗霜霉病分子标记辅助育种提供理论基础。
【方法】""以高抗霜霉病甜瓜品种“PI 438685”与高感霜霉病甜瓜品种“黄旦子”为亲本,构建F2代分离群体。利用BSA-seq技术,对甜瓜霜霉病抗性基因进行QTL定位,根据SNP分布位置在定位区间内开发66对与甜瓜霜霉病抗性基因紧密连锁的KASP分子标记,并使用F2代分离群体进行筛选验证。
【结果】""霜霉病抗性基因定位到9号染色体末端区域,筛选出9对在双亲间具有多态性的KASP分子标记。获得1对与甜瓜霜霉病抗性基因紧密连锁的KASP分子标记(KASP_24832572),其基因分型准确率为79%,准确度较高。
【结论】""在9号染色体上定位到1个与甜瓜霜霉病抗性相关的区间,在此区间内开发并筛选出1对与甜瓜霜霉病抗性基因紧密连锁的KASP分子标记,该标记有助于甜瓜抗霜霉病分子标记辅助育种。
关键词:""甜瓜;霜霉病;BSA-seq;KASP分子标记;分子标记辅助育种
中图分类号:"S436.5""""文献标志码:"A""""文章编号:"1001-4330(2024)11-2626-09
0"引 言
【研究意义】甜瓜(Cucumis melo L)是葫芦科(Cucurbitaceae)甜瓜属(Cucumis)一年蔓生草本植物[1]。瓜类霜霉病病原菌为古巴假霜霉菌(Pseudoperonospora cubensis),是一种气传性专性寄生菌[2],其成熟的孢子囊可随气流广泛传播,从而导致病害不断扩大蔓延,对葫芦科作物的危害大[3]。瓜类霜霉病多于高温、高湿时发生,多个病斑汇合成片导致全叶卷缩干枯,严重时可至整株干枯死亡。瓜类霜霉病对甜瓜的栽培生产带来了严重的不利影响[4],如在甜瓜霜霉病流行年份,霜霉病的发生可使甜瓜减产30%~50%,严重时高达70%~80%,甚至绝产[5]。在甜瓜实际生产中,往往会使用化学药剂防治霜霉病[6]。而选育具有霜霉病抗性的甜瓜种质资源才是提高甜瓜霜霉病抗性经济有效的方法之一。【前人研究进展】随着分子标记技术的成熟,不少研究者相继开发出与霜霉病抗性基因连锁的简单重复序列(SSR)标记[7-10]。SSR标记虽然在构建遗传图谱中发挥着重要作用,但通常与目标基因距离较远且其通用性未得到检验,因此限制了SSR标记在分子标记辅助育种中的应用[11]。随着分子生物技术的发展,序列信息的可用性促进了单核苷酸多态性(SNP)标记的识别与开发。SNP标记具有遗传稳定性好、分布密度高以及可批量筛选和检测等优点,被广泛应用于分子标记辅助育种的研究中[12]。基于SNP位点所开发的KASP分子标记,结合竞争性等位基因特异性PCR技术,可以对SNP以及InDel位点进行精准的双等位基因分型。加之KASP分子标记相较于其他分子标记具有批量化、自动化和标准化的特点,适用于群体的高通量检测,使其逐渐成为主要的分子标记检测方法之一[13]。目前,KASP分子标记在构建遗传图谱、基因定位和种质资源分析等方面均发挥了重要作用。此外,KASP分子标记在甜瓜重要性状的品种选育中得到广泛应用,如果皮外观[14]、果实形状[15]、果肉颜色[16]、抗硫[17]和抗病[18,19]等。【本研究切入点】目前KASP分子标记在甜瓜抗霜霉病分子标记辅助育种中的开发及应用却鲜有报道。利用传统杂交育种手段选育抗霜霉病的甜瓜品种具有周期长、筛选效率低等缺点,在一定程度上限制了甜瓜霜霉病抗性品种选育的进程。而分子标辅助育种可以克服传统育种的缺点,加快霜霉病抗性品种选育的步伐,因此亟需开发与甜瓜霜霉病抗性紧密连锁的分子标记。【拟解决的关键问题】分别以高抗品种“PI 438685”与高感品种“黄旦子”为亲本,构建F2代分离群体。利用BSA-seq技术对甜瓜霜霉病抗性基因进行QTL定位,并开发具有多态性的KASP分子标记。利用F2代分离群体对KASP分子标记进行验证,最终获得与甜瓜霜霉病抗性紧密连锁的KASP分子标记,可用于甜瓜霜霉病的抗性鉴定,为选育甜瓜抗霜霉病的品种提供理论依据。
1"材料与方法
1.1"材 料
采用高感品种“黄旦子”(P1)为母本,高抗品种“PI 438685”(P2)为父本,均由新疆农业科学院哈密瓜研究中心提供。通过P1与P2杂交获得F1代,F1代植株通过自交获得F2代分离群体,该群体用于甜瓜霜霉病的抗性鉴定以及KASP分子标记的筛选与验证。植物材料于2叶1心时定植于新疆农业科学院哈密瓜研究中心试验基地并进行常规管理。
1.2"方 法
1.2.1"试验设计
供试菌株为古巴假霜霉病菌,取自海南三亚早期自然发病的甜瓜叶片。接种前对发病叶片进行预处理,首先将采集的霜霉病叶片使用无菌水清洗,去除叶片表面杂菌与老化的霜霉病孢子囊;随后,使用干净毛刷蘸取无菌水轻柔地将叶片背面的新鲜孢子刷在无菌烧杯中,配置成孢子悬浮液。利用显微镜检测孢子悬浮液中孢子的状态,镜检合格后,通过血球计数板将其最终浓度调整为5×10 3 个/ mL,待后续接种使用。
在甜瓜幼苗第3片真叶完全展开时,选取2片真叶作为接种对象并做好标记,于16:00之后接种。接种方法采用喷雾法,使用手持微型喷雾器将孢子悬浮液均匀喷洒在叶片背面,直到叶片滴落水珠为止。将接种后幼苗覆盖遮光膜进行24 h黑暗培养,保持相对湿度为80%~90%,24 h后进行常规管理,即昼温为23~25℃,湿度为80%~85%;夜温为18~20℃,湿度为85%~90%。
1.2.2"霜霉病抗性等级鉴定
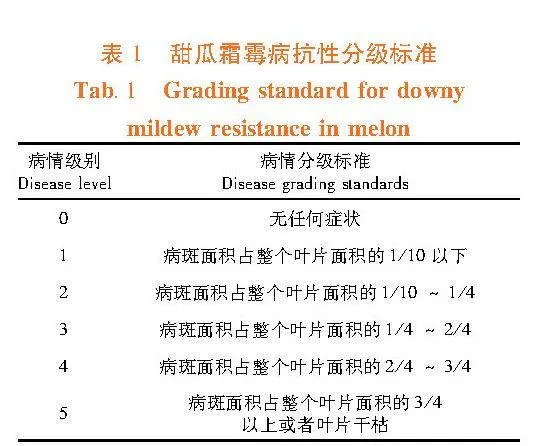
待接种霜霉病病原菌的叶片充分发病时(约接种后10~15 d),调查P1、P2、F1和F2分离群体发病情况。参照Criswell[20]和Epinat C[21]的抗性分级标准对P1、P2、F1和F2分离群体评估霜霉病抗性等级。病情级别为0和1级被视作抗病,其余被视作感病。表1
1.2.3"DNA提取及BSA-seq分析
取双亲及F2代分离群体植株幼嫩叶片(0.5~1 g)置于2 mL离心管中,用于提取基因组DNA。使用DNA提取试剂盒(Plant Zol,北京全式金)提取DNA,具体操作流程参照说明书依次进行。随后,通过超微量分光光度计(Quawell,美国)对DNA浓度测定,并利用1%琼脂糖凝胶电泳检测DNA质量。依据F2代分离群体霜霉病抗性评估结果,选取30株极端抗病单株和30株极端感病单株,将其检测合格的DNA分别等量混合,构建极端抗感基因池。并委托北京诺禾致源生物信息科技有限公司(北京),对2个亲本和2个极端抗感基因池分别进行全基因组重测序。将测序得到的Clean resds比对到甜瓜参考基因组(DHL92_4.0),采用GATK3.3软件检测SNP,根据ΔSNP-index阈值确定与甜瓜霜霉病抗性相关的候选区域,筛选与甜瓜霜霉病抗性连锁的SNP位点。
1.2.4"KASP分子标记开发及验证
在候选区域内检测双亲中具有差异的SNP位点,并选取纯和的SNP位点开发KASP分子标记。根据选取的SNP位点侧翼序列设计2个特异的上游引物和1个通用的下游引物,引物委托生工有限公司(上海)合成。分别以“PI 438685”、“黄旦子”及极端抗感池的DNA为模板,通过PCR扩增筛选在双亲及极端抗感池中具有多态性的KASP分子标记,并利用135株F2代分离群体进行进一步验证。依据F2代分离群体单株表型及基因型鉴定结果,计算KASP分子标记的基因分型准确率。
PCR总反应体系为:2× KASP Mix 1 μL、Primer1 0.003 μL、Primer2 0.003 "μL、Primer Common 0.008 "μL和DNA 1 μL。PCR反应程序如下:94℃ 10 min,1个循环;94℃ 20 s,61℃ 45 s,10个循环;94℃ 20 s,55℃ 20 s,40个循 环;4℃保存。PCR程序在Gene Matrix TM高通量基因分型系统(HC Scientific,成都)的Matrix Cycler和Matrix Scanner上进行;利用Matrix Master软件进行基因型数据分析。
2"结果与分析
2.1"甜瓜亲本及F2分离群体霜霉病抗性鉴定
研究表明,“PI 438685”植株生长状态良好,叶片表面无病斑未发生霜霉病,病情级别为0级,即高抗霜霉病;“黄旦子”叶片表面形成黄褐色角斑并伴有灰黑色霉层产生,且病斑面积占整个叶片面积的3/4以上,病情级别为5级,即高感霜霉病。图1
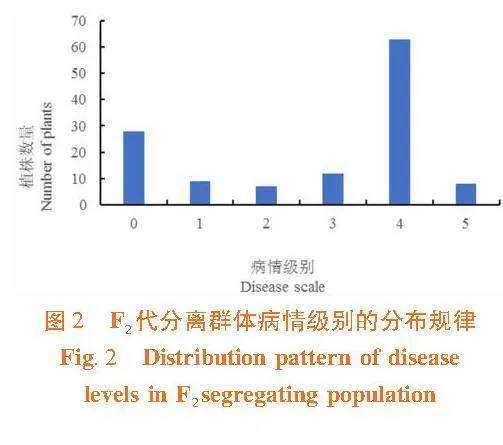
以“PI 438685”和“黄旦子”为双亲,杂交获得135株F2代分离群体。对F2代分离群体于幼苗期进行霜霉病接种,待接种幼苗充分发病后观察其表型,并统计其病情级别。共有28株幼苗抗性级别为0级,9株为1级,7株为2级,12株为3级,63株为4级,8株为5级。F2分离群体霜霉病抗性级别分布规律为连续分布,甜瓜霜霉病抗性为数量遗传性状。图2
2.2"BSA-seq分析
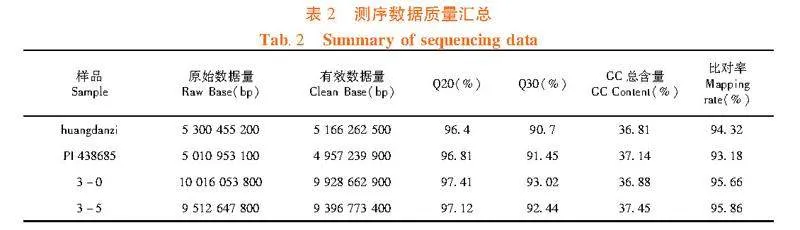
研究表明,对2个亲本池、极端抗病池(3-0)和极端感病池(3-5)进行基因组重测序。此次测序共产生29.84 G Raw data。其中,“PI 438685”的Clean Base约为5 G, “黄旦子”的Clean Base约为5.2 G,后代极端抗感混池的Clean Base分别约为10 G和9.4 G。测序样品Q20百分比均大于96.4%,Q30百分比均大于96.7%。GC含量百分比在36.81%~37.45%,Clean Base与甜瓜参考基因组比对率在93.18%~95.86%。测序样本数据量充足,测序质量较高,可用于后续SNP位点变异检测及目标性状的QTL定位。表2
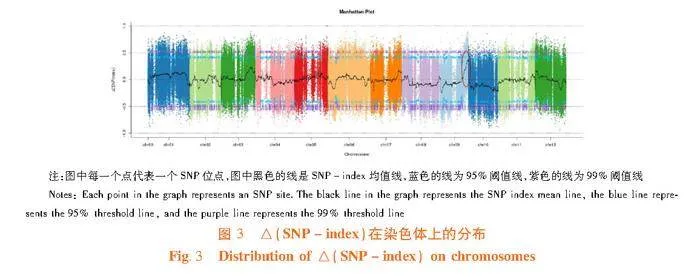
得到2 461 802个高质量SNP位点。以亲本“PI 438685”基因组作为参考,计算两个子代间Δ(SNP-index)值。9号染色体末端区域的Δ(SNP-index)值高于95%置信水平的阈值线。因此,将该区间作为甜瓜霜霉病抗性基因的候选区间。图3
2.3"KASP标记开发及多态性筛选 "
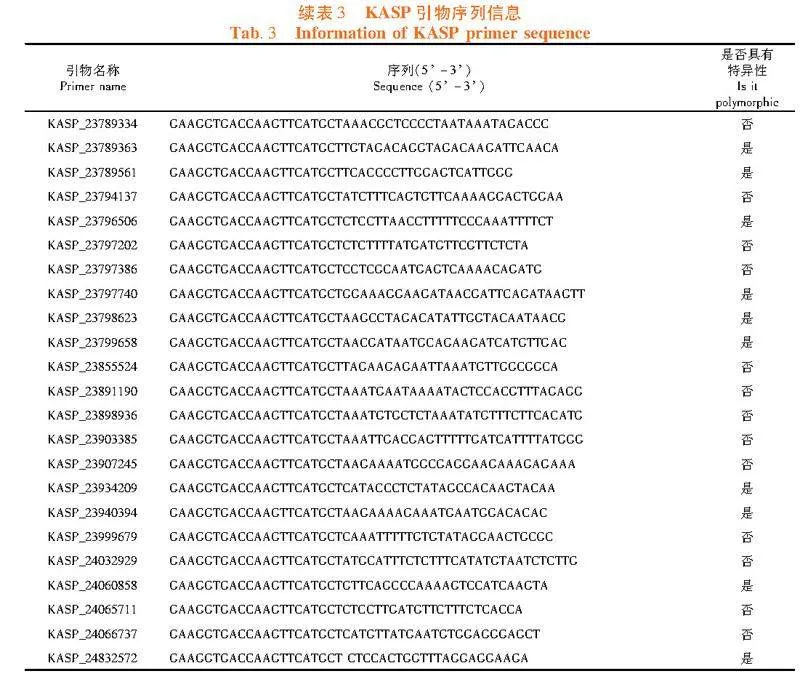
研究表明,缩小甜瓜霜霉病抗性基因的候选区间,在9号染色体23~24 Mb均匀地开发66个KASP分子标记。分别以“PI 438685”和“黄旦子”的DNA为模板进行PCR扩增,筛选在亲本中具有多态性的KASP分子标记。33对KASP分子标记在双亲中具有多态性,多态性效率为50%。表3
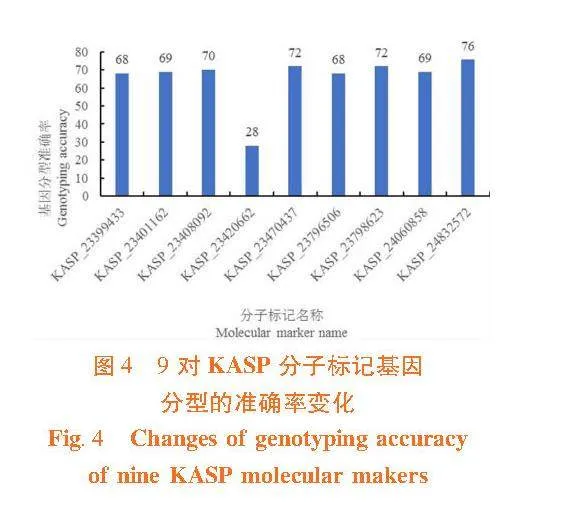
以极端抗感池的DNA为模板,利用具有多态性的33对分子标记进行PCR扩增,共有9对KASP分子标记(KASP_23399433、KASP_23401162、KASP_23408092、KASP_23420662、KASP_23470437、KASP_23796506、KASP_23798623、KASP_24060858和KASP_24832572)能够对极端抗感单株进行基因型鉴定。计算9对KASP分子标记的基因分型准确率,其中KASP_24832572分子标记的基因分型准确率最高,可达76%。图4
2.4"KASP分子标记在F2分离群体中的验证
研究表明,在135株F2代分离群体中共检测到28株基因型为aa的抗病植株、67株基因型为Aa的杂合感病植株以及30株基因型为AA的纯和感病植株。结合前期F2代分离群体表型鉴定结果,计算KASP_24832572分子标记对F2代分离群体基因型鉴定的准确率,其基因型鉴定准确率高达79%。KASP_24832572分子标记与甜瓜霜霉病抗性基因紧密连锁,可用于甜瓜抗霜霉病分子标记辅助育种中。图5
3"讨 论
3.1
不适当的栽培管理措施以及不适宜的光照条件均会引起甜瓜霜霉病的发生[22-23]。甜瓜霜霉病病原菌主要通过气流传播,因此发病速度极快,防治较为困难,严重影响甜瓜产量及品质[24]。在实际生产中,杀菌剂的长期使用导致甜瓜霜霉病病原菌产生了极强的耐药性,同时也对环境造成了不利的影响。因此,培育具有霜霉病抗性的甜瓜品种是最安全有效的防治措施[25]。
目前,已有大量与霜霉病抗性遗传规律相关的研究报道。Epinat的研究结果显示,在抗病品系PI 414723、MR-1和PI 124112中,MR-1和PI l241l2的抗性则是由单隐形基因控制的[26];而抗病材料MR-1[27]、PI 124111[28]以及来源于印度的PI 124111F[29]中霜霉病的抗性是由多个不完全显性基因所控制。研究通过对“PI 438685”与“黄旦子”杂交得到的F2代分离群体病情级别的统计分析得知,“PI438685”中霜霉病抗性是由多基因控制,与Thomas等[29]的研究结果相似。目前,甜瓜霜霉病抗性的遗传规律至今没有明确的定论,可能是由于植物材料、霜霉病病原菌以及表型鉴定标准等存在差异,导致研究结果有所不同。"""3.2
随着遗传学和分子生物学的发展,不少研究者利用分子生物学手段开发与目标性状紧密连锁的分子标记,对目标性状进行了选择与跟踪定位[30]。Perchepied等[31]通过PI 124112×Védrantais 的RIL群体开发了17对SSR标记,用于构建遗传连锁图谱,并定位到了11个与霜霉病抗性相关的QTLs。张学军等[32]将BSA-seq技术与SSR标记相结合,在霜霉病抗性材料“PI 390452”的5、9和10号染色体上各定位到一个与霜霉病抗性相关的候选区间。此外,Toporek利用MR-1×Ananas Yok'neam的RIL群体开发的SSR标记将霜霉病抗性候选区间定位到9号染色体上[33]。研究利用“PI 438685”与“黄旦子”杂交得到的F2代分离群体,通过BSA-seq技术在9号染色体末端区域定位到了与甜瓜霜霉病相关的QTL。在此候选区间内成功开发了KASP_24832572分子标记,其基因分型的准确率为79%,可用于甜瓜霜霉病抗性鉴定及分子标记辅助育种。今后将在此基础上进一步结合F2: 3家系的基因型和表型对甜瓜霜霉病抗性基因进行精细定位,并明确甜瓜霜霉病抗性基因具体的分子作用机制。"
4"结 论
利用“PI 438685”和“黄旦子”为亲本构建F1代,F1代自交形成F2代分离群体,对F2代分离群体进行霜霉病抗性等级评估。在F2分离群体中各选取30株极端抗感单株用于构建极端抗感混池,并进行BSA-seq分析,在9号染色体末端区域定位到1个与霜霉病抗性相关的QTL。在此候选区间内开发了1对与甜瓜霜霉病抗性紧密连锁的KASP分子标记(KASP-24832572),该标记在F2代分离群体中的基因分型准确率高达79%,可用于甜瓜抗霜霉病品种的选育。
参考文献"(References)
[1]"Tabara M, Nagashima Y, He K, et al.Frequent asymptomatic infection with tobacco ringspot virus on melon fruit[J].Virus Research, 2021, 293: 198266.
[2] Thomas A, Carbone I, Lebeda A, et al.Virulence structure within populations of Pseudoperonospora cubensis in the United States[J].Phytopathology, 2017, 107(6): 777-785.
[3] 李晨光.黄瓜、甜瓜霜霉病流行学初步研究[D].长春: 吉林农业大学, 2008.
LI Chenguang.Primary Epidemicological Studies of Cucumber and Muskmelon Downy Milew[D].Changchun: Jilin Agricultural University, 2008.
[4]Hamza A M , Essa T A , Derbalah A S ,et al.Performance of Some Fungicide Alternatives for Controlling Powdery Mildew on Cucumber under Greenhouse Conditions[J].Egyptian journal of pest control, 2015, 25(3):647-654.
[5] Wallace E C, D’Arcangelo K N, Quesada-Ocampo L M.Population analyses reveal two host-adapted clades of Pseudoperonospora cubensis, the causal agent of cucurbit downy mildew, on commercial and wild cucurbits[J].Phytopathology, 2020, 110(9): 1578-1587.
[6] 张猛.防治甜瓜霜霉病药剂筛选试验[J].新农业, 2019,(1): 39-40.
ZHANG Meng.Screening test of chemicals for controlling melon downy mildew[J].New Agriculture, 2019,(1): 39-40.
[7] Innark P, Panyanitikoon H, Khanobdee C, et al.QTL identification for downy mildew resistance in cucumber using genetic linkage map based on SSR markers[J].Journal of Genetics, 2020, 99: 81.
[8] Wallace E C, Quesada-Ocampo L M.Analysis of microsatellites from the transcriptome of downy mildew pathogens and their application for characterization of Pseudoperonospora populations[J].PeerJ, 2017, 5: e3266.
[9] 张学军, 杨俊涛, 李寐华, 等.甜瓜PI414723抗霜霉病基因SSR分子标记[J].华北农学报, 2016, 31(S1): 86-91.
ZHANG Xuejun, YANG Juntao, LI Meihua, et al.SSR molecular marker of downy mildew resistance gene of melon PI414723[J].Acta Agriculturae Boreali-Sinica, 2016, 31(S1): 86-91.
[10] 贺玉花, 徐永阳, 徐志红, 等.甜瓜霜霉病抗性基因的SSR标记[J].江苏农业科学, 2014, 42(7): 54-55.
HE Yuhua, XU Yongyang, XU Zhihong, et al.SSR markers of resistance genes to downy mildew in melon[J].Jiangsu Agricultural Sciences, 2014, 42(7): 54-55.
[11] 李丽, 王海岗, 张晓丽,等.SSR分子标记在作物遗传育种中的应用[J].山西农业科学, 2008, 36(3): 15-18.
LI Li, WANG Haigang, ZHANG Xiaoli, et al.SSR marker and its application to plant genetics and breeding[J].Journal of Shanxi Agricultural Sciences, 2008, 36(3): 15-18.
[12] Grover A, Sharma P C.Development and use of molecular markers: past and present[J].Critical Reviews in Biotechnology, 2016, 36(2): 290-302.
[13] Semagn K, Babu R, Hearne S, et al.Single nucleotide polymorphism genotyping using Kompetitive Allele Specific PCR (KASP): overview of the technology and its application in crop improvement[J].Molecular Breeding, 2014, 33(1): 1-14.
[14] Yang X Q, Li Y, Zhang W W, et al.Fine mapping of the uniform immature fruit color gene u in cucumber (Cucumis sativus L.)[J].Euphytica, 2014, 196(3): 341-348.
[15] Cheng Z K, Liu Z G, Xu Y C, et al.Fine mapping and identification of the candidate gene BFS for fruit shape in wax gourd (Benincasa hispida)[J].Theoretical and Applied Genetics, 2021, 134(12): 3983-3995.
[16] 许勇, 张春秋, 宫国义,等.用于鉴定甜瓜果肉颜色的高通量分子标记及其专用引物: CN105200144A[P].
XU Yong, ZHANG Chunqiu, GONG Guoyi, et al. High throughput molecular markers and specific primers for identifying the color of melon flesh: CN 201510691195 [P].
[17] Branham S E, Daley J, Levi A, et al.QTL mapping and marker development for tolerance to sulfur phytotoxicity in melon (Cucumis melo)[J].Frontiers in Plant Science, 2020, 11: 1097.
[18] Branham S E, Kousik C, Mandal M K, et al.Quantitative trait loci mapping of resistance to powdery mildew race 1 in a recombinant inbred line population of melon[J].Plant Disease, 2021, 105(12): 3809-3815.
[19] Cao Y Y, Diao Q N, Chen Y Y, et al.Development of KASP markers and identification of a QTL underlying powdery mildew resistance in melon (Cucumis melo L.) by bulked segregant analysis and RNA-seq[J].Frontiers in Plant Science, 2021, 11:593207.
[20]Criswell A D , Wehner T C , Klosinska U ,et al.Use of sporulation and other leaf and vine traits for evaluation of resistance to downy mildew in cucumber1[J].Research Gate, 2008..
[21] pinat C, Pitrat M.Inheritance of resistance to downy mildew (Pseudoperonospora cubensis) in muskmelon (Cucumis melo).I.Analysis of a 8 x 8 diallel table[J].Agronomie, 1994, 14(4): 239-248.
[22] Thomas A, Carbone I, Choe K, et al.Resurgence of cucurbit downy mildew in the United States: Insights from comparative genomic analysis of Pseudoperonospora cubensis[J].Ecology and Evolution, 2017,7(16): 6231-6246.
[23] Wang Kexin, Li Shumin, Meng Fanjun, et al. The occurrence patterns and comprehensive control methods of melon downy mildew in Jilin Province [J].Agricultural Development and Equipment, 2017 (12): 1.
[24] Zhang S P, Liu M M, Miao H, et al.Chromosomal mapping and QTL analysis of resistance to downy mildew in Cucumis sativus[J].Plant Disease, 2013, 97(2): 245-251.
[25] 衣杰, 李晓红, 刘晓红, 等.利用芽孢杆菌防治甜瓜霜霉病试验研究[J].河南农业科学, 2004,(2): 44-46.
YI Jie, LI Xiaohong, LIU Xiaohong, et al.Studies on the effect of Bacillus on muskmelon downy mildew[J].Journal of Henan Agricultural Sciences, 2004,(2): 44-46.
[26] Epinat C, Pitrat M, Bertrand F.Genetic analysis of resistance of five melon lines to powdery mildews[J].Euphytica, 1992, 65(2): 135-144.
[27] Thomas C E.Inheritance of resistance to downy mildew in Cucumis melo[J].Plant Disease, 1988, 72(1): 33.
[28] Ivanoff S S.Resistance of cantaloupes to downy mildew and the melon aphid[J].Journal of Heredity, 1944, 35(2): 35-39.
[29] MORE T A,SESHADRI V S.Studies on genetic divergence inmuskmelon (Cucumis melo L.)[J].Journal of Maharashtra Agricultur-al Universities,2002,27(2),121-137.
[30] Hayward A C, Tollenaere R, Dalton-Morgan J, et al.Molecular marker applications in plants[J].Methods in Molecular Biology, 2015, 1245: 13-27.
[31] Perchepied L, Dogimont C, Pitrat M.Strain-specific and recessive QTLs involved in the control of partial resistance to Fusarium oxysporum f.sp.melonis race 1.2 in a recombinant inbred line population of melon[J].TAG Theoretical and Applied Genetics Theoretische Und Angewandte Genetik, 2005, 111(1): 65-74.
[32] 张学军, 宁雪飞, 杨永, 等.甜瓜PI390452霜霉病抗性基因的QTL定位[J].新疆农业科学, 2016, 53(12): 2157-2165.
ZHANG Xuejun, NING Xuefei, YANG Yong, et al.QTL Mapping of Resistance Genes to Downy Mildew in Cucumis melo ssp.melo PI390452[J].Xinjiang Agricultural Sciences, 2016, 53(12): 2157-2165.
[33] Toporek S M, Branham S E, Katawczik M L, et al.QTL mapping of resistance to Pseudoperonospora cubensis clade 1, mating type A2, in Cucumis melo[J].TAG Theoretical and Applied Genetics Theoretische Und Angewandte Genetik, 2021, 134(8): 2577-2586.
Development and verification of KASP marker for resistance""to downy mildew in muskmelon
SHEN Yue1,LING Yueming2,DUAN Xiaoyu2,YANG Wenli2,LI Meihua2,""WANG Yirou2,WANG Huilin1,ZHANG Xuejun2
(1. College of Horticulture,Xinjiang Agricultural University, Urumqi "830052, China; 2. Hami Melon Research Center, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China)
Abstract:【Objective】 ""This study aims to develop and validate KASP molecular markers closely linked to melon downy mildew resistance genes, in the hope of providing a theoretical basis for downy mildew resistance molecular marker assisted breeding of downy mildew resistance in melons.
【Methods】 ""The accession ‘PI 438685’ with high resistance of downy mildew, and the accession ‘Huangdanzi’ with high sensitivity of downy mildew were used as parents to construct a separate population.QTL mapping of downy mildew resistance genes in melon was drawn through a combination of BSA and whole genome sequencing.KASP molecular markers closely linked to downy mildew resistance genes were developed within this interval, and then screened and validated using F2 separate populations.
【Results】 ""The downy mildew resistance gene was located on chromosome 9 through BSA analysis.We developed 66 pair of KASP molecular markers in the candidate region, screened 9 pairs of KASP molecular markers with high specificity.Subsequently, the 9 pairs of KASP molecular markers were validated, the KASP molecular marker (KASP-24832572), closely linked to downy mildew resistance genes was obtained, and its accuracy of distinguish genotype could reach 79%.
【Conclusion】 ""One QTL related to downy mildew resistance has been located on chromosome 9 by BSA analysis, and a pair of KASP molecular markers closely linked to downy mildew resistance genes are developed in this interval , which has contributed to downy mildew resistance breeding in melons.
Key words:""melon; downy mildew; BSA-seq;KASP molecular markers; molecular markers assisted breeding
Fund projects:"""Tianshan Innovation Team of Xinjiang Uygur Autonomous Region (2022D14015);Project of National Natural Science Foundation of China(32060689);MOF and MARA “China Agriculture Research System” (CARS-25); Hainan Provincial Academician Innovation Platform Scientific Research Special Project (Academician WU Mingzhu Team Innovation Center); Hainan Provincial Academician Innovation Platform Scientific Research Special Project(YSPTZX202141);Xinjiang Uygur Autonomous Region Key Research and Development Program for Special Projects(2022B02002)
Correspondence author:"""WANG Huilin (1965-), male, from Henan, associate professor, master's supervisor, research direction: watermelon cultivation and breeding,(E-mail) wanghuilin@126.com
ZHANG Xuejun (1980-), male, from Siping, Jilin, researcher, master's supervisor, research direction: disease resistant breeding of watermelon and melon,(E-mail) zxj333@126.com
收稿日期(Received):"2024-04-19
基金项目:""新疆维吾尔自治区天山创新团队(2022D14015);国家自然科学基金项目(32060689);财政部和农业农村部“国家现代农业产业技术体系资助”项目(CARS-25);海南省院士创新平台科研专项(吴明珠院士团队创新中心);海南省院士创新平台科研(YSPTZX202141);新疆维吾尔自治区重点研发任务专项(2022B02002)
作者简介:"沈悦(1999-),女,新疆人,硕士研究生,研究方向为甜瓜霜霉病抗性基因精细定位,(E-mail)shenyue052442@163.com
通讯作者:""王惠林(1965-),男,河南人,副教授,硕士生导师,研究方向为西甜瓜栽培与育种,(E-mail)wanghuilin@126.com
张学军(1980-),男,吉林四平人,研究员,硕士生导师,研究方向为西瓜甜瓜抗病育种,(E-mail) zxj333@126.com
