泛甲壳动物激素调控卵黄蛋白原合成的分子机制研究进展
2024-02-22谢持真邱高峰
谢持真, 陆 颖, 邱高峰*
(1. 上海海洋大学水产与生命学院,农业农村部淡水水产种质资源重点实验室,上海 201306;2. 上海海洋大学,上海水产养殖工程技术研究中心,水产科学国家级实验教学示范中心,上海 201306)
节肢动物包括四大类群∶六足动物(Hexapoda) (昆虫)、甲壳动物(Crustacea) (如虾和螃蟹)、多足动物(Myriapoda) (如千足虫和蜈蚣)和螯肢动物(Chelicerata) (如蜘蛛和马蹄蟹)。系统发育分析与形态学分析表明,六足动物与甲壳动物在系统发育树上接近,故又被统称为泛甲壳动物(Pancrustacea) (图1)[1-2]。由于亲缘关系接近,昆虫与甲壳动物的许多生理调控机制也非常相似,但也存在各自的特异性,对其开展生理过程调控的比较研究,不仅能够解析调控机制的异同,还有助于更深入理解它们的进化关系[3]。
卵黄发生是繁殖过程中重要的细胞生理学事件,直接关系到卵生动物是否繁殖成功。大多数卵黄蛋白原(vitellogenin, Vg)是一类由糖、磷、脂蛋白组成的雌性特异性蛋白,是卵黄蛋白(yolk protein)的前体[4]。已有研究表明,卵黄的发生主要通过两种方式∶一是外源性卵黄合成,即由卵母细胞以外的器官或组织合成,然后进入卵母细胞;二是内源性卵黄合成或自动合成,即由卵母细胞自身合成[5]。在卵巢中,组织蛋白酶D将Vg分解为各种卵黄蛋白成分。Vg作为卵黄蛋白的前体,为卵生动物胚胎发育提供能源物质,与卵生动物的繁殖性能密不可分。除此之外,它还可以作为一些非极性分子的载体,转运脂类、维生素等,并能够作为离子载体向卵母细胞运输Ca2+、Zn2+[6]。另外,Vg还具有一定的免疫防御功能[7]。Chaverra-Rodriguez等[8]利用昆虫卵黄蛋白前体(yolk protein precursors , YPP)开发了一种被称为受体介导的卵巢货物转导(receptor-mediated ovary transduction of cargo , ReMOT Control)的基因编辑技术,该技术利用卵母细胞通过受体介导内吞卵黄蛋白原的特性,将Cas9核糖核蛋白(ribonucleoprotein , RNP)复合物等分子货物与YPP结合,在卵黄发生时期注射到母体血淋巴,直接递送入卵母细胞,实现胚胎基因组编辑,从而绕过了通过胚胎显微注射递送基因编辑元件的繁琐步骤。因此,卵黄蛋白原不仅仅对泛甲壳动物的生殖起重要作用,也可为泛甲壳动物基因编辑技术革新带来突破。
昆虫卵黄蛋白原是由Telfer[9]首次于雌性刻克罗普斯蚕蛾 (Hyalophoracecropia) 的个体中发现,分子质量约为200~800 ku。大多数昆虫Vg都是外源性合成的,由脂肪体合成并分泌到血淋巴中,运送至卵巢,卵母细胞选择性地摄取而成为卵黄蛋白[10]。例如马德拉蜚蠊(Leucophaeamaderae)、刻克罗普斯蚕蛾的Vg都是由脂肪体合成[11-12]。但近年来也有研究发现少数昆虫Vg是内源性合成,如双翅目的家蝇(Muscadomestica)、黑腹果蝇(Drosophilamelanogaster)[13]。昆虫Vg合成的调控机制已经得到了较为广泛、系统地研究。雌性Vg的合成受到保幼激素(juvenile hormone, JH)、蜕皮激素(molting hormone)、胰岛素样肽(insulinlike peptides, ILP)及其他神经肽(neuroparsins,NPs)的调节[14-17]。其中保幼激素及蜕皮激素占主导地位,而高等昆虫,如黑腹果蝇和埃及伊蚊(Aedesaegypti)等双翅目昆虫主要的调控因子并不是保幼激素,而是蜕皮激素[18]。
甲壳动物卵黄蛋白原的生化结构与昆虫载脂蛋白(insect apoLp-II/I)及脊椎动物载脂蛋白B-100(apolipoprotein B-100, B-100)极为接近[19]。卵黄蛋白原的发生方式既有内源性方式,也有外源性方式,甚至有的物种兼具两种发生方式。大部分物种的Vg合成场所是肝胰腺,如真虾类、螯虾类、短尾类,卵巢起辅助作用;对虾类则以卵巢为主,特别是在卵黄发生早期,卵巢起到更重要的作用[20]。如凡纳滨对虾(Litopenaeusvannamei)[21]等,但也有些虾类如罗氏沼虾(Macrobrachiumrosenbergii)[22]、日本沼虾(M.nipponense)[23]等Vg产生的主要场所是肝胰腺,而非卵巢。甲壳纲卵黄蛋白原的发生机制在一些物种中也得到了较为深入的研究,例如罗氏沼虾的Vg在肝胰腺中合成后,被枯草杆菌蛋白酶切分为2个亚基∶VgA和VgproB,然后在血淋巴中proB进一步被分为B和C/D 2个亚基[19]。以往研究认为,卵黄蛋白原对雌性甲壳动物的生殖发育起着十分重要的作用,并且只存在于雌性中[24]。但近年的研究表明,卵黄蛋白原基因也在雄性中表达[25]。甲壳动物卵黄蛋白原合成的调控机制尚不十分明确,目前研究的较为系统的是甲基法尼酯(methyl farnesoate,MF)[26],一种未环氧化的JHⅢ,能够作为保幼激素调节卵黄蛋白原的发生;眼柄神经肽如甲壳动物高血糖激素家族(crustacean hyperglycemic hormone,CHH)的蜕皮抑制激素(molt-inhibiting hormone,MIH)[27]、卵黄/性腺抑制激素(vitellogenesis-inhibiting hormone/gonad-inhibiting hormone, VIH/ GIH)[28-29]等也对Vg合成的调控十分重要;另外,甲壳动物特有的促雄腺激素(insulin-like androgenic gland factor,IAG)可抑制Vg的合成[30]。
除了JH、蜕皮激素、胰岛素样肽以及神经肽这些激素以外,还有许多其他因子也对泛甲壳动物卵黄蛋白原的合成起重要作用,譬如热休克蛋白(heat shock protein,HSP)[31]、视黄醇X受体(retinoid X receptor,RXR)[32]、脂肪动力激素(adipokinetic hormone,AKH)[33]、褪黑素(melatonin)[34]、视蛋白(opsin)[35]等。这些因子大多作为JH、蜕皮激素、胰岛素样肽或者神经肽调控通路中的一员。昆虫及甲壳动物卵黄蛋白原合成的调控因子如表1和表2所示。
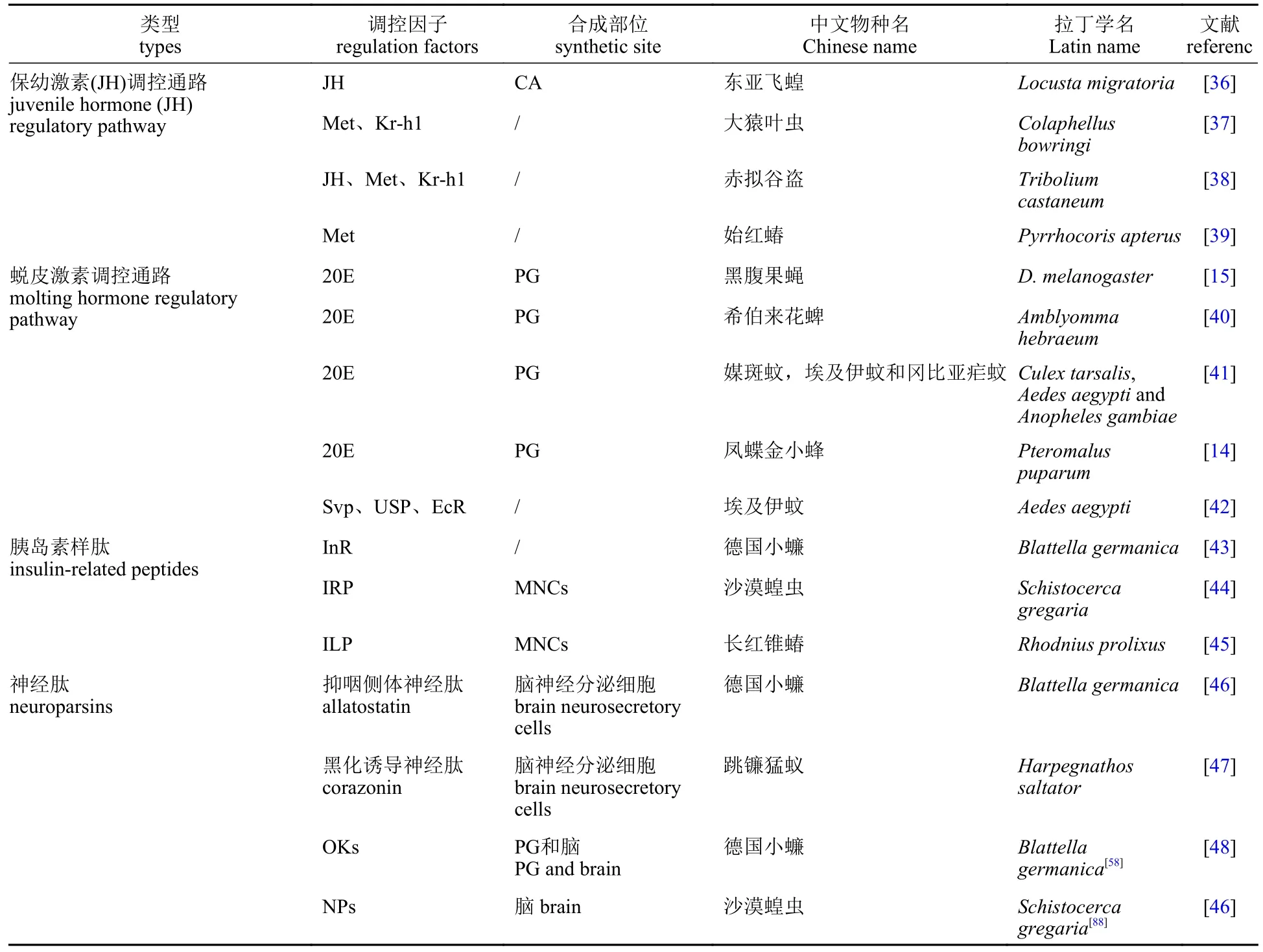
表1 昆虫卵黄蛋白原合成的调控因子Tab. 1 Types of regulation factors of vitellogenin synthesis in Insecta
1 JH在泛甲壳动物卵黄蛋白原合成调控中起主要作用
1.1 JH调控昆虫卵黄蛋白原合成
JH是昆虫咽侧体分泌的激素,故又称咽侧体激素、幼虫激素。JH在幼虫时期阻止昆虫的变态,在成虫时期能够刺激生殖系统的发育,促进卵黄生成[63]。昆虫体内JH信号通路如图1所示。JH能通过脂肪细胞内的激活磷脂酶C (phospholipase C,PLC)和钙/钙调蛋白依赖性蛋白激酶Ⅱ (calcium/calmodulin-dependent protein kinaseⅡ, CaMKⅡ)途径,与胞内受体耐甲氧丙烯(methoprene-tolerant, Met)结合,传导给下游。JH可以通过调控该途径的中间产物蛋白激酶C (protein kinase C,PKC)来影响卵母细胞对Vg 的吸收,因为卵黄蛋白原受体(vitellogenin receptor,VgR)能够响应JHPKC 信号通路的诱导,并加强VgR质-膜迁移以促进卵母细胞对Vg的吸收,为胚胎的发育提供能量贮存[64-65,36]。一项关于亚洲飞蝗的研究表明,JH通过GPCR-PLC-PKC-ι信号级联促进 VgR的Ser1361磷酸化,VgR磷酸化后在卵母细胞膜上与Vg结合[36]。而在JH与Met结合的同时,Met也能够调控一种JH反应性转录因子(JH-responsive transcription factor)∶Krüppel 同源物 1 (Krüppel homolog 1,Kr-h1),进一步传递JH信号[66]。
1.2 甲基法尼酯(MF)调控甲壳动物卵黄蛋白原合成
在甲壳动物中,例如三疣梭子蟹(Portunus trituberculatus)[27,67]、中华绒螯蟹(Eriocheirsinensis)[52]体内也发现了未环氧化的JHⅢ,即甲基法尼酯(methyl farnesoate, MF),由大颚器(mandibular organ, MO)合成分泌,调控雌性卵黄蛋白原合成[68]。Hopkins等[69]研究表明,MF与视黄醇X受体(retinoid X receptor, RXR)结合具有较高的亲和力,并证实MF与蜕皮激素能够协同作用,增强RXR与蜕皮激素受体(ecdysteroid receptor, EcR)形成的异二聚体介导的基因转录作用。淡水蟹的MF和17α-羟基孕酮(17α-hydroxyprogesterone,17α-OHP)能够通过刺激肝胰腺Vg基因的表达来促进雌蟹的卵巢成熟。MF诱导的卵巢成熟速率快于眼柄摘除,缩短雌性个体的生殖周期;体外共培养雌性肝胰腺与MF,3~6 h肝胰腺Vg基因的表达量升高,表明MF直接影响雌蟹肝胰腺Vg合成[49]。在中华绒螯蟹中发现,法尼酸氧-甲基转移酶(farnesoic acid O-methyltransferase, FAMeT)作为一种催化酶将法尼酸(farnesoic acid, FA)催化为MF,并参与卵黄蛋白原的合成[52]。三疣梭子蟹的胞内受体耐甲氧丙烯(methoprene-tolerant, Met)可以作为MF的受体,并在Met与MF结合时,激活肝胰腺Vg基因的转录[26]。而另一项研究表明,Met下游的Kr-h1因子在三疣梭子蟹MF介导的卵黄发生中起重要作用。RNA干扰敲降Met和Krh1基因均导致Vg基因表达量减少,表明MF对卵黄原蛋白合成的调控可能通过与Met和Kr-h1的相互作用来实现[67]。
由上述研究可知,甲壳动物MF调控通路与昆虫JH通路大体类似(图2),即由大颚器产生的MF前体FA,被催化酶FAMeT催化之后转化为成熟的MF,MF与受体Met结合之后,刺激下游Kr-h1因子,Kr-h1的激活进一步促进卵黄蛋白原的合成(图3)。相较于昆虫,MF在甲壳动物的Vg调控通路相关研究较少,只在个别种类如三疣梭子蟹中有较为系统的研究,在大部分物种中缺乏系统性、机制性探索,有待进一步阐明。

图2 昆虫JH调控卵黄蛋白原合成通路示意图JH. 保幼激素,PLC. 磷脂酶C,GPCR. G蛋白偶联受体,PKC. 蛋白激酶C,VgR. 卵黄蛋白原受体,P. 磷酸,CaMKII. 钙/钙调蛋白依赖性蛋白激酶Ⅱ。Fig. 2 Schematic diagram of the vitellogenin synthesis pathway regulated by JH in insectsJH. juvenile hormone, PLC. phospholipase C, GPCR. G protein-coupled receptors, PKC. protein kinase C, VgR. vitellogenin receptor, P. phosphate,CaMKII. Calcium/Calmodulin-dependent protein kinase Ⅱ.
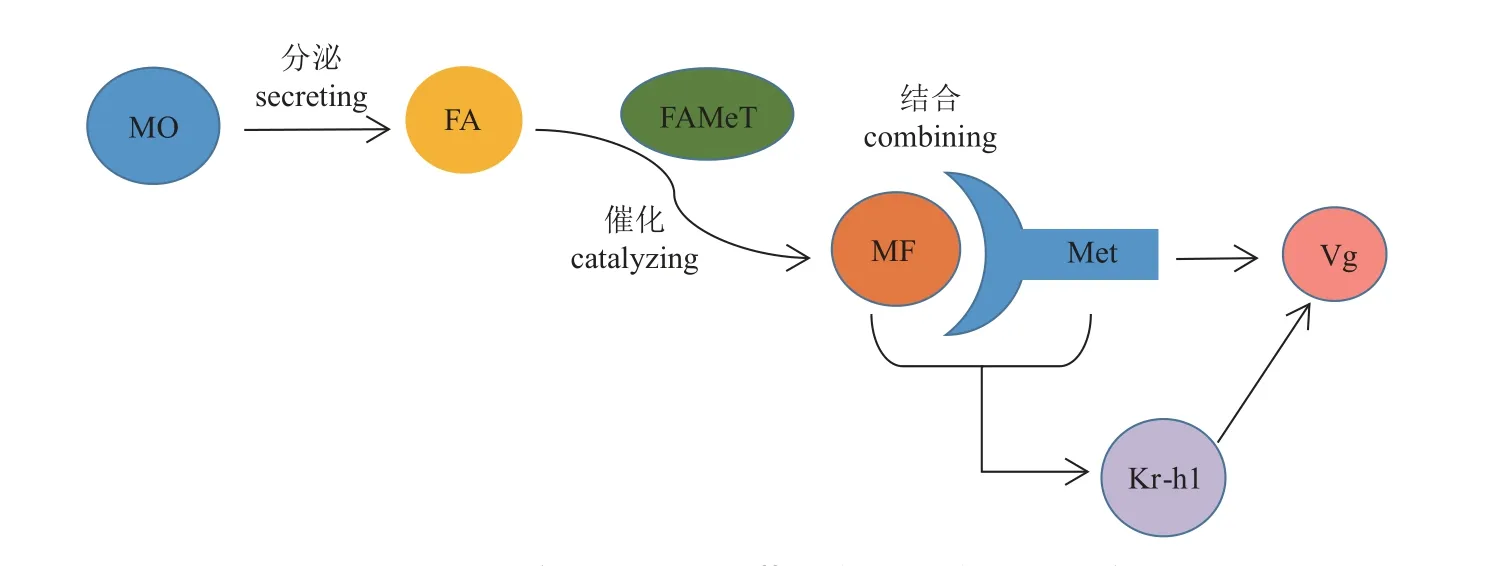
图3 甲壳动物MF调控卵黄蛋白原合成通路示意图FA. 法尼酸,FAMeT. 法尼酸氧-甲基转移酶。Fig. 3 Schematic diagram of the vitellogenin synthesis pathway regulated by MF in CrustaceaFA. farnesoic acid, FAMeT. farnesoic acid O-methyltransferase.
2 蜕皮激素调控泛甲壳动物卵黄蛋白原的合成
2.1 蜕皮激素调控昆虫卵黄蛋白原的合成
蜕皮激素是一种类固醇激素,由昆虫的前胸腺合成,在昆虫的变态发育、蜕皮生长以及生殖中有不可或缺的作用。蜕皮激素调控昆虫卵黄蛋白原合成通路如图4所示。其活化形式20-羟基蜕皮酮(20-hydroxyecdysone,20E)是调节生殖功能的甾体激素,对卵黄蛋白原的合成起重要作用[70]。20E一般通过与其受体EcR与视黄醇受体RXR或其同源物超气门蛋白(ultraspiracle protein, Usp)一起构成的异源二聚体相互结合,刺激Vg合成[71]。Usp/20E二聚体形成后,蜕皮激素受体与其一起组成复合物,调控Vg的合成。Usp还能与其他的核转录因子,例如Svp (seven-up)结合形成二聚体,促进蜕皮激素的调控作用。细胞色素P450酶作为蜕皮激素的关键调节因子,对蜕皮激素的合成起重要作用,也间接作用于Vg合成[42]。

图4 昆虫中蜕皮激素调控卵黄蛋白原合成通路示意图Fig. 4 Schematic diagram of the vitellogenin synthesis pathway regulated by ecdysterone in insects
2.2 蜕皮激素调控甲壳动物卵黄蛋白原的合成
甲壳动物的蜕皮贯穿整个生活史,并且与繁殖密切相关。当雌性完成最后一次蜕皮(生殖蜕皮)后,生长终止,卵巢发育迅速加快,摄入的营养物质与能量由满足于生长需要转向满足于生殖需要。蜕皮激素尤其是其活性形式20E,对蜕皮发生和卵巢发育都起到了重要的调控作用[72]。甲壳动物蜕皮激素由Y器官分泌,是昆虫前胸腺的同源器官[73]。与昆虫EcR/Usp/20E调控通路相似,甲壳动物也存在EcR/RXR/20E调控卵黄蛋白原合成的通路,但与EcR形成异二聚体的是Usp的同系物RXR。例如,通过原位杂交(in situhybridization)实验和液相色谱-质谱联用技术(high performance liquid chromatography-mass spe,HPLC-MS),证实了拟穴青蟹EcR与20E共同调节卵黄蛋白原的合成[34]。另一项研究证明,褪黑素处理后,拟穴青蟹的血淋巴中MF和20E水平显著增加,肝胰腺和卵巢中RXR和EcR的mRNA水平也同样升高。由此推断,褪黑素能够通过刺激YO产生更多的蜕皮激素并促进MO产生MF,作为一种促进因子将MF与蜕皮激素两条调控通路联系起来,共同促进卵黄蛋白原的合成[54]。此外,一种与蜕皮有关的因子(核受体Ftz-f1),以及催化蜕皮激素成为20E的上游因子P450酶(Spook和Phantom),能够协同促进日本沼虾卵黄蛋白原的合成[74]。综上,蜕皮激素调节卵黄蛋白原的通路是由褪黑素促进蜕皮激素的生成,P450酶催化蜕皮激素形成20E起始的,随后再由20E与RXR形成二聚体,与EcR结合,向下游促进卵黄蛋白原的生成(图5)。至于EcR/RXR/20E复合物形成后又作用于哪些下游基因,最终刺激卵黄蛋白原生成,仍然不明确。

图5 甲壳动物中蜕皮激素调控卵黄蛋白原合成通路示意图Fig. 5 Schematic diagram of the vitellogenin synthesis pathway regulated by ecdysterone in Crustacea
3 神经肽网络调节卵黄蛋白原的合成
除了以上两种激素,神经肽(neuropeptide ,NP)对卵黄蛋白原合成的调控也十分重要。神经肽是由神经系统合成,储存并释放的多肽类化学物质[75]。多种神经肽组成了一个广泛多样的分子群,对泛甲壳动物的多种生理行为如蜕皮变态、滞育、代谢、生殖等都有影响[76]。
3.1 昆虫神经肽对卵黄蛋白原合成的调控作用
Martin等[46]在德国小蠊中发现了一种小分子神经肽,即抑咽侧体神经肽(allatostatin),能够抑制脂肪体卵黄蛋白原的释放。它通过作用于甲羟戊酸(mevalonate)途径和多萜醇(dolichol)的合成,抑制卵黄蛋白原的糖基化,从而阻止Vg的释放。近年来又发现了OKs (orcokinins),一种具有亲肌活性的神经肽,能够促进德国小蠊脂肪体内Vg基因的表达[48]。在跳镰猛蚁中也发现了一种与脊椎动物促性腺激素释放激素同源的神经肽∶黑化诱导神经肽(corazonin),能够抑制脂肪体Vg基因的表达,降低卵巢的活性[47]。此外,短神经肽F(short neuropeptide F, sNPF)能够抑制美洲大蠊(Periplanetaamericana)卵母细胞成熟和VgR基因转录,尤其是在卵母细胞摄取Vg的过程中,能够抑制20E的合成。说明sNPF也可以影响卵黄蛋白原的合成[17]。
脂肪动力激素(adipokinetic hormone , AKH)作为一种神经肽,不仅可以调动昆虫体内的脂质和碳水化合物用于能量消耗,还能够调控雌性卵黄蛋白原的合成。敲降雌性稻褐飞虱(Nilaparvata lugens)的脂肪动力激素受体(adipokinetic hormone receptor, AKHR)基因后,卵巢的Vg水平显著降低,表明在卵母细胞成熟过程中,AKHR是调控Vg进入卵母细胞过程的关键因子[33]。
综上表明,昆虫的神经肽由于其种类的多样性而对卵黄蛋白原合成的调控作用不同,一些种类能够促进卵巢成熟,刺激卵黄蛋白原的合成,而另一些种类则相反,可能作为一种反馈机制,控制卵黄蛋白原的发生,在卵巢成熟前期起促进作用,在卵黄蛋白原大量产生的后期,又对其进行抑制。
3.2 甲壳动物眼柄神经肽对卵黄蛋白原合成的调控作用
对甲壳动物卵黄蛋白原合成起主要调控作用的神经肽是眼柄神经肽,这些眼柄神经肽主要由眼柄的XO-SG分泌。目前已经纯化并进行氨基酸序列结构分析和功能鉴定的甲壳动物眼柄神经肽类激素主要有6种,分子质量较小的为一类红色素聚集激素(red-pigment concentrating hormone,RPCH)以及色素分散激素 (pigment-dispersing hormone, PDH)[77];另一类分子质量较大的激素为甲壳动物高血糖激素(crustacean hyperglycemic hormone, CHH)家族,包括CHH、MIH、VIH/GIH以及大颚器抑制激素(mandibular organ inhibiting hormone, MOIH)[78-79]。研究表明,摘除雌性的眼柄能够促进个体生长及卵巢成熟,如在切除沼虾属中M.lanchesteri的雌性个体单侧眼柄之后,能够使其成熟期提前[80],说明眼柄因子对卵巢发育起抑制作用。
众多研究表明,CHH家族对甲壳动物卵巢发育的抑制主要体现在对卵黄蛋白原合成的抑制作用。在寻常球鼠妇中发现,VIH对卵黄合成产生有效抑制[57]。同样,凡纳滨对虾的VIH也能够抑制卵黄发生,雌虾在经过眼柄摘除后,卵巢的生长速率加快,而继续注射重组VIH蛋白后,卵巢的生长发育又重新受到抑制;在体外用重组VIH蛋白处理雌虾的肝胰腺能有效抑制Vg基因的转录,说明VIH能够抑制卵巢和肝胰腺Vg的合成[28]。通过RNA干扰敲降斑节对虾的GIH基因后,雌虾卵巢中卵黄蛋白原基因的转录水平显著增加,说明GIH对Vg基因表达有抑制作用[29]。除此之外,MIH对卵黄蛋白原的合成也有可能起促进作用,在凡纳滨对虾中发现一种蜕皮抑制激素(LivMIH2),在体外与肝胰腺共同培养能够提高Vg基因的表达水平[27]。
小分子神经肽AKH家族的RPCH和GnRH也能够影响甲壳动物卵黄蛋白原的合成。注射RPCH和PDH后,中华绒螯蟹卵母细胞平均直径及Vg基因表达量显著降低,说明RPCH和PDH能够抑制Vg合成[58]。而对雌性拟穴青蟹注射合成的RPCH时,Vg水平提高[81],说明RPCH在不同物种中对卵黄蛋白原合成的作用可能不同。鉴于RPCH主要产生于眼柄,而去除眼柄能够促进Vg合成,更倾向于认为RPCH对卵黄蛋白原合成有抑制作用。凡纳滨对虾注射GnRH之后,雌性各时期的卵母细胞平均直径显著增加,卵巢成熟期缩短,血淋巴Vg水平也明显提高[59]。说明GnRH也可以促进Vg的合成和卵巢的成熟。
3.3 其他神经肽调控甲壳动物卵黄蛋白原合成
除了眼柄神经肽,还有其他一些神经肽也能够调节甲壳动物卵黄蛋白原合成。例如罗氏沼虾的NPF可以促进雌性卵巢发育以及早期产卵[61]。另一项研究表明,敲降罗氏沼虾神经肽基因MrNP1和MrNP2,可以显著降低VgR基因的表达,而RNA干扰敲降MrNP1和MrNP2的体外实验并没有降低肝胰腺中的Vg水平。因此,MrNP1和MrNP2可能在Vg从肝胰腺到卵巢的转运中发挥重要作用[82]。而拟穴青蟹的NP1因子,作为神经肽家族的一员,能够释放至血淋巴中抑制肝胰腺Vg的合成[60]。
神经肽对卵黄蛋白原的调控机制复杂,甲壳动物与昆虫的不同在于其独特的眼柄神经肽能够抑制卵黄蛋白原的发生,但总体而言,神经肽对卵黄蛋白原发生的调控通路尚未解明,因种类的不同,实验结果也不尽相同,甚至相互矛盾,有待更深入的研究。
4 胰岛素样肽通过20E、JH通路协同调控卵黄蛋白原的合成
4.1 胰岛素样肽对昆虫卵黄蛋白原的合成起促进作用
胰岛素是一类调控生物体生殖、发育、代谢等多种功能的肽类激素。它在进化上十分保守,ILP与脊椎动物的胰岛素在结构上同源,也具有调控生殖发育与生长代谢的作用。昆虫的脑、脂肪体、卵巢、唾液腺和中肠等组织和器官均能产生胰岛素类肽,其中脑部的MNCs是主要的合成场所[83]。刻纹棱胸切叶蚁(Pristomyrmexpunctatus)2个不同的ILP同源物PripuILP1和PripuILP2a之间可能存在由JH信号转换控制的平衡,并且这种相互作用对于调控Vg合成很重要,其中PripuILP2a可以促进Vg的合成[84]。另一项关于埃及伊蚊的研究表明,20E和胰岛素同时作用时,会产生强烈的协同效应[85]。而InR同样能够影响卵黄蛋白原的发生。对德国小蠊进行饥饿实验和RNA干扰敲降InR基因,都能够显著减少雌性个体JH和Vg的合成[43,86],说明InR能够促进JH合成和Vg表达。而InR途径主要的转录效应子FoxO基因的敲降,能够使饥饿雌性个体的JH和Vg水平重新升高[87]。由此可知,胰岛素样肽对于昆虫卵黄蛋白原的调控可能通过与20E、JH通路协同完成。胰岛素样肽作为桥梁,在昆虫20E、JH调控通路中起连接作用。
4.2 胰岛素样促雄性激素对甲壳动物卵黄蛋白原合成的调控作用
甲壳动物雄性特有的IAG,由AG合成分泌,对雄性性别分化和第二性征的维持发挥重要作用。IAG除了参与雄性生殖过程,也可能抑制雌性生殖[30]。RNA干扰敲降红螯光壳螯虾雄虾的IAG基因后,除了精巢出现退化、精子数量减少之外,Vg基因也开始表达,并且卵母细胞的卵黄蛋白也开始积累[56],表明IAG对于Vg基因的表达有抑制作用。
5 其他因子参与卵黄蛋白原的合成
除了JH、20E、神经肽、胰岛素类肽这些激素调控雌性卵黄蛋白原的合成之外,还有很多其他因子也能参与调控。日本沼虾性别相关基因DMRT11E的敲降能够显著降低Vg基因的表达,说明其对卵黄蛋白原的合成有促进作用[88]。RNA干扰敲降日本沼虾的视蛋白(Opsin)基因,MnLW能够显著降低Vg基因的表达,表明MnLW可能对卵巢成熟过程中Vg的合成和积累发挥重要作用[35]。由此可见,与蜕皮相关的因子,性别决定或性腺发育相关因子,以及眼柄内高度表达的因子都有可能参与卵黄蛋白原的合成。
6 结语
综上所述,昆虫JH、20E、神经肽及胰岛素样激素对卵黄蛋白原合成的调控通路的研究较为系统且全面,并且每一种信号通路并不是独立的,而是相互作用的,如JH能够抑制20E的作用,MIH能够抑制蜕皮激素的生成等。一些因子对两种通路都存在影响,譬如胰岛素样肽和褪黑素都能够作用于JH通路和20E通路。甲壳动物卵黄蛋白原合成的调控通路的研究虽然起步较晚,但也在参考昆虫Vg合成调控机制的研究基础上得以逐步完善,已经发现了许多因子与卵黄蛋白原的合成相关,图6与图7分别总结了历年来虾蟹类与昆虫卵黄蛋白原合成调控通路的研究结果∶①昆虫的卵黄蛋白原主要是由脂肪体产生,然后运输至卵母细胞中。故大部分调控因子都是通过促进或抑制脂肪体中卵黄蛋白原的生成来作用的,Vg合成的主要调控激素是JH和20E。然而对卵黄蛋白原从脂肪体运输到卵母细胞过程的相关因子没有太多的研究,除了JH能够通过促进卵母细胞上VgR的磷酸化来转运Vg之外,其他的相关研究很少。②甲壳动物的VgR主要是由肝胰腺产生的,卵巢也能够合成,但产生VgR的量一般远低于肝胰腺,主要调控甲壳动物VgR合成的激素是MF和眼柄激素。几乎所有的调控因子都能对肝胰腺中VgR的发生产生影响,但不是所有的因子都能影响卵巢中VgR的发生。例如MF在红螯螯虾和三疣梭子蟹[26]中只能促进肝胰腺VgR的合成,而对卵巢没有刺激作用。拟穴青蟹[60]的神经肽能够降低肝胰腺的VgR水平,而对卵巢的VgR没有显著影响。目前对甲壳动物Vg合成的调控机制研究的较为透彻的为外源性分泌器官肝胰腺的VgR合成的调控机制,而对于卵巢内源性发生的研究较少。

图6 昆虫卵黄蛋白原合成的调控机制示意图AKH. 脂肪动力激素;Vg. 卵黄蛋白原;JH. 保幼激素。“(+)”表示促进作用,“(–)”表示抑制作用,“(±)”表示可能有促进作用也可能有抑制作用,下同。Fig. 6 Regulation mechanism of vitellogenin synthesis in insectsAKH. adipokinetic hormone; Vg. vitellogenin; JH. juvenile hormone. "(+)" indicates the promotion effect, "(–)" indicates the inhibition effect,"(±)" indicates that there may be promotion or inhibition effect, the same below.
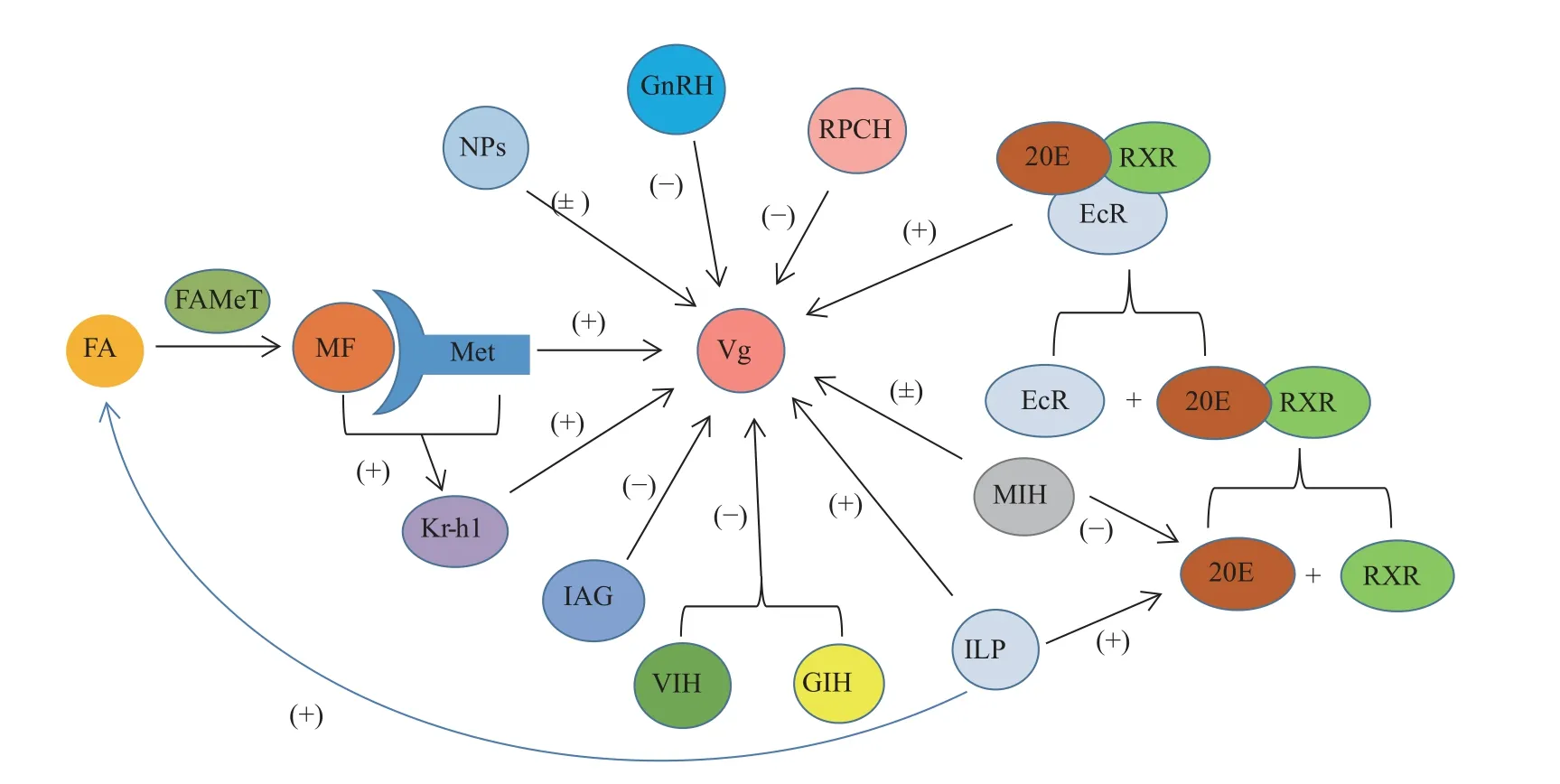
图7 甲壳动物卵黄蛋白原合成调控机制示意图蓝色箭头表示ILP可能影响MF对卵黄蛋白原合成的调控作用,但在甲壳动物中尚未得到验证。Fig. 7 Regulation mechanism of vitellogenin synthesis in CrustaceaThe blue arrow indicates that ILP may affect the regulation of MF on vitellogenin synthesis, but it has not been verified in Crustacea.
VgR对生殖起着十分重要的作用,泛甲壳动物血淋巴VgR含量是判断母体成熟的重要参考指标[89]。水产类甲壳纲动物种类十分丰富,如十足目的虾蟹类等。这些水产物种经过养殖驯化,脱离了野生环境,且由于养殖密度大,导致环境胁迫,常常由于卵黄蛋白积累不够而难以繁育成功,需要采取人工干预[90]。例如摘除眼柄促进母虾成熟,但眼柄摘除不仅去除了VIH,同时也去除了其他必需的眼柄激素,从而降低个体的存活率和产卵量。因此,激素对VgR合成的调控机制的研究可为养殖甲壳动物的人工繁殖提供重要理论参考,以期提高育苗成活率和生产量。
(作者声明本文无实际或潜在的利益冲突)
