固固加热法制备氨氧混合气及其催化氧化条件的研究
2024-02-22陈寅杰
陈寅杰
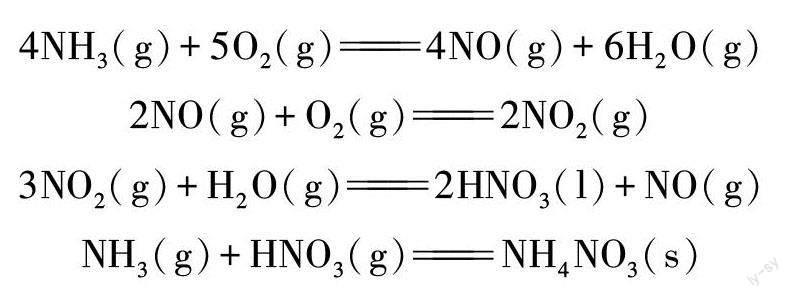
摘要: 通过对比固固加热法、液体常温法制备氨氧混合气,对比没有催化剂载体、玻璃纤维载体和泡沫氧化铜载体的催化效果,试图找到氨催化氧化反应的最佳反应条件,提高演示实验的成功率。与传统实验相比,增加了热成像仪监控反应进程,使用常见药品代替危险化学品和昂贵试剂。实验发现,选用硫酸铵和过碳酸钠按质量比2:3混合时,氨氧混合气催化氧化效果最好。
关键词: 氨的催化氧化; 实验改进; 固固加热法; 氨气的还原性
文章编号: 10056629(2024)01009403
中图分类号: G633.8
文献标识码: B
1 问题提出
教育部颁布的《普通高中化学课程标准(2017年版2020年修订)》中提到:结合真实情境中的应用实例或通过实验探究,了解氯、氮、硫及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响[1]。氨的催化氧化是指氨气通过催化剂与空气、氧气、臭氧等氧化剂进行的氧化反应,无论在工业、农业还是实际教学中都占有非常重要的地位。在工业中,该反应是制取三酸中硝酸的重要一环;在农业中,该反应可以制取硝态氮肥;在教学中,该反应便于学生理解氨气的还原性,进一步完善氮元素的价类二维图,从价态角度理解氮及其化合物之间的转化。不少一线教师对该实验作了改进与开发,提升了实验的成功率和实验效果[2~5]。笔者发现传统氨的催化氧化实验装置复杂,氨气极易过量,所用药品涉及危险化学品,且铂催化剂成本较高,重现性较差,不适宜在课堂演示。
2 实验设计
2.1 实验主要仪器与药品
实验仪器:试管1支(长20cm,直径20mm);石英玻璃管1根(长40cm,直径30mm);红外热成像仪FILR ONE Pr 1个(热像素尺寸12μm,热分辨率19200像素,热灵敏度70mK,对象温度范围-20℃至400℃)
实验药品:氧化铜、三氧化二铬、二氧化锰、氯化钙、氧化钙、增氧片(过碳酸钠)、碳酸氢铵、氯化铵、硫酸铵、泡沫铜、3%过氧化氢、2mol·L-1氨水
2.2 氨氧混合气的制取方法的对比
首先,使用过氧化氢和氨水的混合溶液,加入二氧化锰催化过氧化氢分解得到氨氧混合气,通过控制氨水和过氧化氢的比例,调节氨氧混合气的比例。
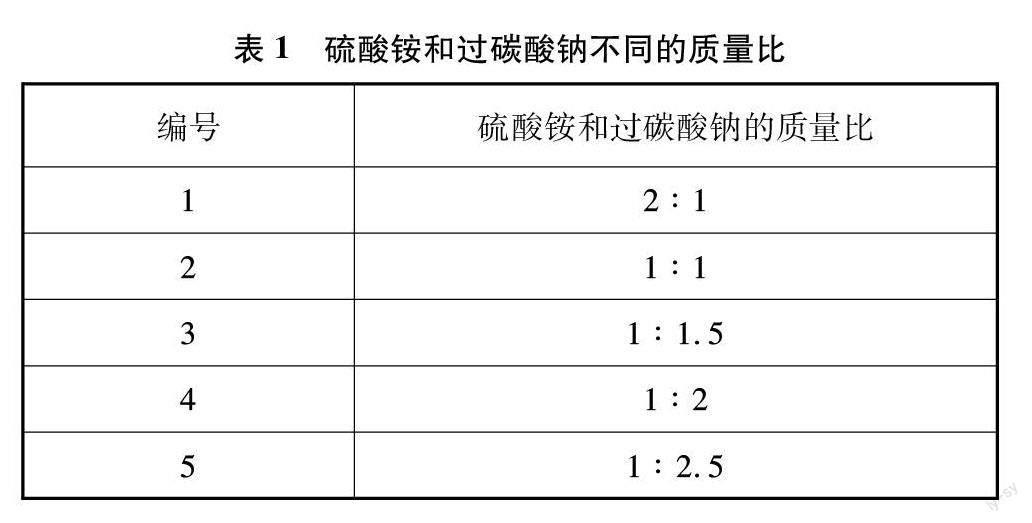
其次,使用铵盐与过碳酸钠粉末在二氧化锰以及加热条件下得到氨氧混合气,通过控制铵盐与过碳酸钠粉末的比例,调节氨氧混合气的比例。选用硫酸铵和过碳酸钠制备氨氧混合气时,两组分的质量比如表1所示。
使用液体常温法制取氨氧混合气的实验过程中,由于受过氧化氢浓度限制,氧气浓度较低,导致氨气大大过量,同时液体常温法制取过程中水含量较高,极易超过干燥剂的吸水能力,导致石英玻璃管壁上有水滴附着,同时生成大量白烟,无法清晰观察到红棕色气体。测得玻璃管壁上的水滴pH为碱性,初步分析导致出现该现象的原因是氨气过量,生成的二氧化氮直接与水蒸气反应生成硝酸,再与过量的氨气生成硝酸铵。相关反应如下:
4NH3(g)+5O2(g)4NO(g)+6H2O(g)
2NO(g)+O2(g)2NO2(g)
3NO2(g)+H2O(g)2HNO3(l)+NO(g)
NH3(g)+HNO3(g)NH4NO3(s)
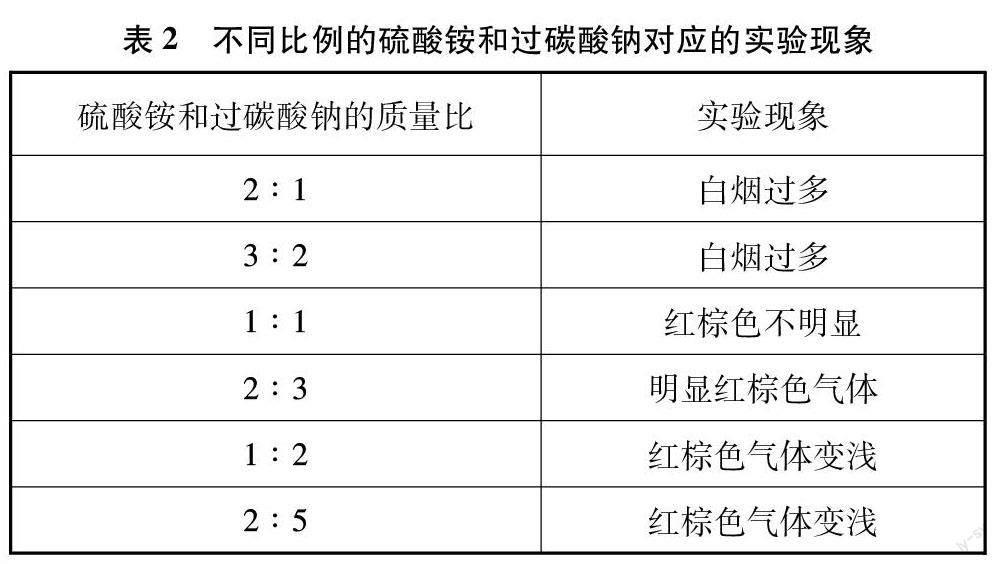
使用固固加热法制取氨氧混合气的过程中,发现碳酸氢铵同时受热分解生成大量的水,依旧在石英玻璃管壁上有水滴附着,实验现象与液体常温法相似。而氯化铵的氨含量过高,制得的氨氧混合气中氨含量也远高于硫酸铵,同时分解产生氯化氢气体,可与过碳酸钠反应生成二氧化碳,引入杂质。因此硫酸铵作为氨的来源是最佳选择。在加热过程中,产生白烟,符合预期的实验现象。硫酸铵与过碳酸钠的最佳质量比确定为2∶3(见表2)。
2.3 催化剂及其载体的选择
本实验选用的催化剂为三氧化二铬和氧化铜1∶1(质量比)混合物,三氧化二铬起到主要的催化作用;氧化铜起到防爆作用,提升实验的安全性。由于该混合物为粉末,因此考虑选用不同种类的催化剂载体作为负载进行实验。催化剂载体选择了玻璃纤维与泡沫氧化铜。
泡沫铜是一种在铜基体中均匀分布着大量连通或不连通孔洞的新型多功能材料。而泡沫氧化铜由泡沫铜在空气中灼烧得到,具有较大的比表面积,可以起到较好的催化剂负载作用。
在表3中的实验1为空白实验,直接将三氧化二铬和氧化铜粉末填充在石英玻璃管中。实验2首先将三氧化二铬和氧化铜粉末混合均匀,包裹在玻璃纤维上,再填充在石英玻璃管中。在实验3中,首先灼烧泡沫铜至黑色,将混合均匀的三氧化二铬和氧化铜粉末卷在泡沫氧化铜内,再填充在石英玻璃管中。填充催化剂及其载体后,加热石英玻璃管至红外热成像仪中观察到催化剂全部受热后,通入氨氧混合气。
不使用催化剂载体往往会难以把控催化剂的填充程度,填充过松则使得过量氨气未充分反应就通过催化剂,填充过紧则使得气体难以通过催化剂而造成容器内压强增大。经过实验发现若使用玻璃纤维作为催化剂载体几乎无法反应,初步分析是由于玻璃纤维的耐热程度高,保温效果好,温度上升缓慢,需要加热较长时间才能达到催化剂的活性温度。而使用泡沫氧化铜可达到较高温度,同时多孔结构可以使得氨氧混合气与催化剂充分接触,提高转化率。因此使用泡沫氧化铜作为催化剂载体实验效果较好。红外熱成像仪的使用,便于确定通入氨氧混合气的时机,若过早通入则催化剂未达到其活性温度,催化效果较差,若过晚通入则浪费能源。
2.4 干燥剂的选择
由于该反应生成水,而水又能使得催化剂中毒,降低催化剂的催化活性,因此在反应前后填充干燥剂。本实验选取了常见的几种干燥剂——无水氯化钙、氧化钙。
当反应前后均使用氯化钙作干燥剂时,发现反应难以发生,初步分析是由于存在反应CaCl2+8NH3CaCl2·8NH3,氯化钙不仅吸收水蒸气还吸收氨气,因此只能作为反应后的干燥剂,吸收过量氨气以免生成白烟。当反应前后均使用氧化钙作干燥剂时,反应后产生少量白烟,初步分析是由于氧化钙不能吸收氨气,因此氨气容易过量。
通过实验发现反应前用氧化钙干燥,吸收可能存在的水蒸气,反应后用氯化钙干燥,吸收反应生成的水蒸气以及过量氨气,红棕色气体的现象、催化剂红热现象最为明显。
3 设计特点与结论
通过上述实验确定氨氧混合气的制备流程如图1所示,整个实验装置如图2所示。运用红外热成像仪观察催化剂的受热情况,更好地控制氨氧混合气通入的时机。使用氧化钙-氯化钙干燥剂组合对混合气体有选择性的干燥与除杂作用。使用增氧颗粒作为氧化剂,所用的所有试剂均不属于危险化学品,提高了实验的安全性。使用泡沫氧化铜作为催化剂载体,现象更加明显、重复性更高。全封闭体系安全环保。通过对比干湿两种方法制备氨氧混合气,固固加热法制取时的药品的种类,催化剂及其载体的种类搭配,并结合数字化仪器进行分析改进。具体研究结论如下:
(1) 药品使用:选用硫酸铵和过碳酸钠按质量比2∶3混合时,氨氧混合气催化氧化效果最好。
(2) 催化剂使用:氧化铜和三氧化二铬按质量比1∶1混合并加入少量二氧化锰,催化活性较高。使用红外热成像仪可以很好地监控反应进程。
(3) 干燥剂使用:反应前使用氧化钙干燥吸水,反应后使用氯化钙干燥吸水、吸氨,实验效果最好。
4 实验重现性
本实验的改进前后重现性对比如表4所示,各实验均重复20次,观察到红棕色气体视为实验成功。
通过上表数据,发现固固加热法制备混合气且在泡沫氧化铜载体的条件下进行反应,实验成功率和重现性最高。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020.
[2]沈美荣. 氨催化氧化后的白雾是什么[J]. 化学教学, 1994,(5): 42.
[3]齐俊林. 氨催化氧化实验的新设计[J]. 化学教学, 2007,(8): 11.
[4]王屹. 氨气催化氧化实验的分析及改进[J]. 化学教学, 2009,(8): 41~42.
[5]郑雅兰, 刘丽君. 合成氨实验组合装置的设计[J]. 化学教学, 2017,(5): 76~78.
