mRNA核苷碱基修饰开启疫苗新时代
2024-02-22郭晓强
郭晓强

疫苗接种是大多数传染病和部分慢性病(如宫颈癌等)预防的首选方法,成败关键依赖于高效疫苗的研制和应用。1980年代前,灭活疫苗和减毒疫苗是主要的应用类型。随着生物技术的出现和快速发展,亚单位疫苗、病毒载体疫苗和病毒颗粒样疫苗等先后出现,种类繁多的疫苗为人类健康的保驾护航发挥着至关重要的作用。新型冠状病毒感染(COVID-19)暴发后,疫苗应用更是在缓解疫情、减少伤亡中体现出难以估量的价值,其中新出现的mRNA疫苗尤为突出。
明星分子
1953年,双螺旋结构的提出确立了DNA遗传分子的中心地位;1957年底,克里克提出描述遗传信息传递的中心法则,认定某种RNA在将DNA信息传递给蛋白质过程中发挥着中介作用,这种RNA被命名为信使RNA(messenger RNA, mRNA);1961年,布雷内(S. Brenner)等利用细菌脉冲标记实验发现了mRNA,开启了对它的研究历程[1]。mRNA在体内为蛋白质编码、遗传密码解析的成果获得1968年诺贝尔生理学或医学奖;遗传信息从DNA传递到RNA(重点在mRNA)称为转录,转录过程的结构解析成果获得2006年诺贝尔化学奖;遗传信息从mRNA到蛋白质称为翻译,该过程的结构解析成果获得2009年诺贝尔化学奖。所以,mRNA可谓名副其实的明星分子。
1980年代,mRNA开始被应用于体外研究并探索其医学应用。1984年,梅尔顿(D. Melton)等在实验室里完成RNA体外转录(in vitro transcribed, IVT),为将来的应用打开了第一扇成功之门。1987年,马龙(R. Malone)采用脂质体包裹策略,将体外转录的mRNA转入细胞并成功翻譯出蛋白质。1990年,沃尔夫(J. A.Wolff)等首次将体外转录mRNA注射到小鼠肌肉并表达出蛋白质。1992年,吉里科夫斯基(G. Jirikowski)等在小鼠模型上证明体外转录mRNA可有效治疗糖尿病。这一系列成果说明了mRNA应用的理论可行性。
然而,后续研究发现,体外转录的mRNA存在激发机体先天免疫(导致不良反应)、易降解(稳定性差)、体内表达效率低(效果不佳)等诸多缺陷,从而限制了mRNA的实用性。许多科学家和药物公司多次尝试无果后,纷纷放弃而转向其他方向,直到2023年两位诺贝尔奖获得者的突破性发现,mRNA的应用才出现了巨大转机。
艰难探索
考里科(K. Karikó)是一位出生于匈牙利的生物化学家,1982年从匈牙利科学院塞格德生物中心获得博士学位,1985年来到美国天普大学开展博士后研究,1990年加入宾夕法尼亚大学开启独立科研生涯。考里科一直对mRNA情有独钟,并对其应用前景充满信心,积极尝试申请科研基金以支持自己的进一步研究。遗憾的是屡战屡败,但从未气馁的她仍坚持年年申请,中间经历了身体状况不佳、实验进展不顺、学校待遇下降等诸多困难,不屈的性格使她从未放弃,直到1998年才获得第一笔科研经费,为自己建立mRNA研究平台提供了资金保证。
由于经费有限,年近半百的考里科不得不亲自做实验。考里科系统研究了体外转录出的多种mRNA一级结构,以确定它们在细胞和组织内的最佳表达条件:她将特定mRNA(如编码尿激酶型纤溶酶原激活物受体)递送到体外培养的人骨肉瘤细胞后,发现可立即实现蛋白质的大量表达;她将编码荧光素酶的mRNA借助脂质体输送到大鼠脑中也得到高效表达,且在mRNA的3末端添加多聚腺嘌呤可显著提升蛋白质表达量。这些成果使考里科更坚信mRNA的应用前景是光明的,但对真正阻碍mRNA应用的瓶颈问题(如免疫原性),一直无法解决。
科研挚友
1997年,考里科在一次复印论文时偶遇刚到宾夕法尼亚大学不久的免疫学家韦斯曼(D. Weissman),交谈中双方都对彼此的研究内容很感兴趣,并开始合作研究。
韦斯曼是一位美国本土的免疫学家,1987年从波士顿大学获得免疫学和微生物学博士学位,随后进入美国国立卫生研究院开展博士后研究,重点关注人类免疫缺陷病毒(HIV)感染免疫细胞的机制,希望开发出有效疫苗。1997年,韦斯曼在宾夕法尼亚大学成立研究小组,最初准备研发预防HIV和流感的DNA疫苗,了解到考里科在mRNA方面的工作后,他果断转向mRNA疫苗研究。
考里科和韦斯曼的合作堪称集天时、地利、人和于一体,他们的成功有点水到渠成的感觉。
天时方面,从1990年代开始,斯坦曼(R. Steinman)发现树突细胞在免疫系统中的重要性,并得到科学界普遍认可,斯坦曼因此分享了2011年诺贝尔生理学或医学奖的一半奖金,树突细胞成为韦斯曼等开展免疫学研究的重要实验材料;1996年,霍夫曼(J. Hoffmann)在果蝇中首先鉴定出天然免疫中能识别不同病原体的Toll样受体(Toll-like receptor, TLR),两年后巴特勒(B. Beutler)克隆出第一个哺乳动物的TLR,两人因此分享2011年诺贝尔生理学或医学奖另外的一半奖金,TLR识别是mRNA产生免疫原性的重要原因,这两项成果为后续的突破奠定了重要基础。
地利方面,两人在同一学校,可随时沟通实验进展和遇到的问题,保证实验顺利进行。人和方面,两人性格都非常随和,关键是专业上互补性强,考里科有生物化学专业背景,熟悉mRNA的制备和改造,韦斯曼有免疫学背景,精于免疫机制研究,他们面临的首要问题是消除mRNA的免疫原性。
考里科首先合成了一系列mRNA,韦斯曼将这些mRNA转染树突细胞,结果树突细胞肿瘤坏死因子-α(tumor necrosis factor, TNF-α)等炎症因子的合成和释放量显著增加,说明树突细胞被高度激活了。这一结果的重要性还在于,它提供一个非常理想的操作系统,相比动物实验,树突细胞测试mRNA的免疫原性既快速又价廉,这大大加快了研究步伐。
树突细胞存在多种TLR,它们可感知不同外源物进而激活下游信号,如TLR3可由双链RNA激活,TLR9由DNA触发。他们进一步证实了体外转录mRNA通过识别TLR3等激活树突细胞[2],下一关键问题是如何规避这种激活效应。
重大突破
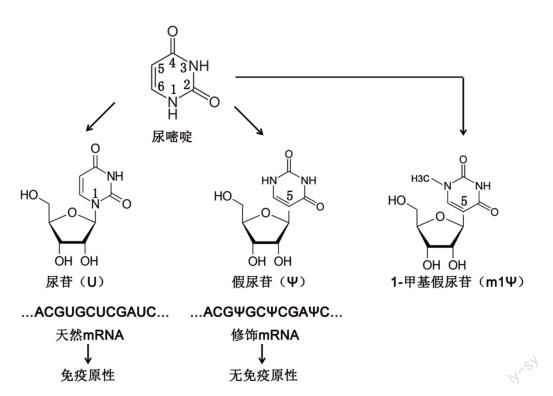
2004年,考里科和韦斯曼测试了不同来源的RNA对树突细胞的激活作用,结果迥异。体外转录的RNA和细菌RNA可激活树突细胞,而作为对照的哺乳动物tRNA则几乎对树突细胞没有任何影响。 tRNA和其他类型RNA的最大区别在于其存在广泛的核苷修饰(修饰核苷数量可达总核苷数量25%),因此他们推测通过修饰核苷可能会消除对树突细胞的激活。为验证这一假说,他们将多种修饰核苷,如假尿苷(Ψ)、5-甲基胞苷(m5C)、5-甲基尿苷(m5U)、N6-甲基腺苷(m6A)和2-硫尿苷(s2U)等掺入体外转录合成的mRNA,然后测试这些修饰后的mRNA对树突细胞的激活效应,结果出现明显差异。相比较于未修饰mRNA,掺入m5C和m6A对树突细胞释放TNF-α无显著影响,而掺入m5U、s2U或Ψ则几乎完全消除了TNF-α的生成,这意味着对尿苷的修饰可能是最佳选择。这一重要结果表明体外转录mRNA经过对其特定核苷的修饰,竟然能起到对树突细胞的隐身效果,尤其用Ψ替代体外转录mRNA中相应的尿苷(uridine,U)可实现在不影响编码序列的前提下,消除免疫原性。
2005年,考里科和韦斯曼将实验结果发表在《免疫》(Immunity)杂志上[3],为mRNA的应用扫清了一个重要障碍,成为具有里程碑意义的成果。
砥砺前行
然而,这一重大突破在当时并未引起过多的关注,但考里科和韦斯曼继续在该领域深入探索,以解决更多实际问题。
考里科研究发现,核苷修饰(Ψ替代U)后的体外mRNA不再与TLR结合,即使結合也无法激活下游炎症信号,从而无法启动对mRNA的降解,这样可增加mRNA在细胞内的存留时间,进而增加翻译效率[4]。因此,核苷修饰的mRNA一方面可以消除先天免疫,另一方面还增加了体内表达效率,可谓“一箭双雕”。他们还将核苷修饰的mRNA递送到小鼠脾脏,发现确实可以实现蛋白质产量增加和免疫激活降低的双重效果,这一发现为未来的治疗应用提供了重要佐证。
体外合成的单链mRNA通常无法避免一定量的双链RNA污染,而双链RNA可被细胞TLR识别引发免疫应答。考里科为此采用高效液相色谱法(HPLC)去除双链RNA并获得高纯净度的单链mRNA[5]。这种操作既减少炎症因子生成,又增加蛋白质翻译效率(10~1000倍),为mRNA的应用进一步扫清了障碍。
2012年,考里科将编码促红细胞生成素(EPO)的人工合成修饰mRNA注射到小鼠体内,6小时后小鼠血清中EPO含量开始迅速升高,一段时间后网织红细胞和成熟红细胞数量也显著增加。随后,在非人灵长类动物实验上也获得类似结果。这说明mRNA具有用作蛋白药物临床治疗的可行性。
韦斯曼和考里科对mRNA核苷修饰技术进行了多方面改进,大大提升其实用性[6]:利用脂质纳米颗粒(lipid nanoparticle, LNP)递送mRNA;采用1-甲基假尿苷(m1Ψ)代替尿苷(这是新冠病毒疫苗研发的基础);对mRNA在疫苗应用中的潜力也做了进一步探索。
2017年,韦斯曼开发出针对寨卡病毒(Zika virus)包膜糖蛋白的mRNA疫苗,该疫苗在人体内可产生强大而持久的中和抗体反应[7]。由于寨卡病毒疫情暴发在2013年,当时只有零星病例,因此无法开展有价值的临床试验。2018年,韦斯曼和考里科等进一步联合开发HIV和流感的mRNA疫苗,动物实验显示这类疫苗表现出强烈且持久的保护作用。这一系列重要进展确立了mRNA作为疫苗的可行性,但鉴于是新兴疫苗,因此尚待严格临床实验以确定其安全性和有效性。
为加快mRNA应用,一些生物技术公司先后成立。2006年,韦斯曼和考里科亲自创立mRNA应用公司RNARx,申请了多项mRNA核苷修饰方面的专利,虽然后续发展并不顺利,但却鼓舞了越来越多的研究人员进入该领域。2008年,德国生物制药新技术公司(BioNTech)成立,目标是开发癌症个体化mRNA疫苗。2010年,美国莫德纳公司(Moderna)成立,公司名字本身就是修饰mRNA(modified mRNA)两个单词的缩写。遗憾的是,mRNA的实际应用却迟迟没有到来,许多公司都放弃了研发,这种情况下仍能苦苦支撑下来的公司无疑承担着巨大的压力。
大显身手
2020年初,新型冠状病毒感染的突然暴发打破了mRNA应用的平静。为应对日趋严重的流行病形势,亟需高效疫苗的出现,此时,mRNA修饰技术的价值开始显现。
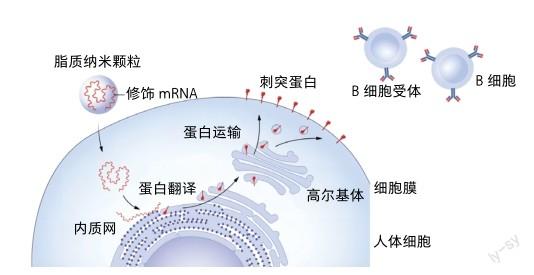
2020年1月,中国科学家公布了新冠肺炎病毒(SARS-CoV-2)基因组序列,莫德纳公司、生物制药新技术公司和美国辉瑞公司立即启动mRNA疫苗研制计划。首先设计出基于SARS-CoV-2刺突蛋白的mRNA序列(用m1Ψ代替相应的U);进一步体外转录出携带修饰核苷的mRNA并包装入LNP,转入体内后可检测到大量针对刺突蛋白的中和抗体,初步证明有效性;最后采用严格生产标准制备出疫苗(莫德纳公司生产的疫苗名为mRNA-1273,生物制药新技术公司和辉瑞公司生产的疫苗名为BNT162b2),随后开启一系列临床试验,Ⅲ期临床结果显示,这两种疫苗保护效率均达到90%以上[8]。随后在美国食品药品监督管理局(FDA)紧急使用授权的前提下,这两种修饰mRNA疫苗迅速在2020年底投入使用。
新型冠状病毒mRNA疫苗通常在上臂通过肌肉注射,携带修饰mRNA的LNP进入人体后,通过淋巴引流到达淋巴结,被树突细胞吸收并翻译出刺突蛋白,刺突蛋白被进一步递呈给B细胞和T细胞,随后启动免疫应答。免疫细胞拥有记忆功能,待真正的新冠病毒感染时,可及早启动保护作用,将病毒危害降到最低,同时也避免了病毒传播。由于新冠病毒是一种全新病毒,首次产生免疫应答较弱,因此需间隔两周后再次注射疫苗,方可真正体现保护作用。
相较传统疫苗,mRNA疫苗具有自己独特的优势:工艺简单、耗时短;安全性高;适应性好(对于易突变病毒,新疫苗研制较快,且可以多种亚型疫苗同时应用)[9]。
与此同时,其他几种类型的SARS-CoV-2疫苗也迅速推出,全球共接种130多亿剂疫苗,挽救了数百万人的生命,同时也避免了更多感染者发展为重症,为社会的逐步开放恢复正常发挥了重要作用。
功成名就
随着新型冠状病毒mRNA疫苗的推广应用及其价值体现,考里科和韋斯曼在mRNA核苷修饰发现方面的贡献逐渐得到科学界的认可。他们在短短3年时间内共同分享了几十项重大科学奖励,比较著名的有阿尔巴尼医学中心奖(Albany Medical Center Prize)、拉斯克临床医学研究奖(Lasker Clinical Medical Research Award)、路易莎·格罗斯·霍维茨奖(Louisa Gross Horwitz Prize)、生命科学突破奖(Breakthrough Prize in Life Sciences)、盖尔德纳国际奖(Gairdner International Award)和唐奖(Tang Prize)等,可谓能获得的奖项基本拿遍,直到分享2023年度诺贝尔生理学或医学奖[10]。此外,他们在2022年共同入选美国国家发明家名人堂。
mRNA修饰技术在新型冠状病毒疫苗方面的成功算是牛刀小试,其更大的意义在于它广泛的应用潜力,如可以部分替代传统的蛋白治疗、开发针对癌症预防或治疗的疫苗等。包括考里科在内的多位科学家都对修饰mRNA技术的应用前景充满信心,现在的成果只是起点而非终点,它的未来不可限量。
[1]Dolgin E. The tangled history of mRNA vaccines. Nature, 2021, 597(7876): 318-324.
[2]Karikó K, Ni H, Capodici J, Lamphier M, et al. mRNA is an endogenous ligand for Toll-like receptor 3. J Biol Chem, 2004, 279(13): 12542-12550.
[3]Karikó K, Buckstein M, Ni H, et al. Suppression of RNA recognition by Toll-like receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity,2005, 23(2): 165-175.
[4]Karikó K, Muramatsu H, Welsh F A, et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther, 2008, 6(11): 1833-1840.
[5]Karikó K, Muramatsu H, Ludwig J, et al. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, proteinencoding mRNA. Nucleic Acids Res, 2011, 39(21): e142.
[6]Ruffell D. The future in an RNA molecule: from mRNA vaccines to therapeutics - An interview with Drew Weissman. FEBS Lett, 2021, 595(18): 2305-2309.
[7]Pardi N, Hogan M J, Pelc R S, et al. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature, 2017, 543(7644): 248-251.
[8]Sahin U, Muik A, Derhovanessian E, et al. COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses. Nature, 2020, 586(7830): 594-599.
[9]Shapiro L, Losick R. Delivering the message: How a novel technology enabled the rapid development of effective vaccines. Cell, 2021, 184(21): 5271-5274.
[10]Callaway E, Naddaf M. Pioneers of mRNA COVID vaccines win medicine Nobel. Nature, 2023, 622(7982): 228-229.
关键词:mRNA 核苷修饰 疫苗 诺贝尔奖 ■
