电针对2型糖尿病大鼠胰岛素抵抗及炎症因子表达水平的影响
2024-02-21王香张月陈炫宜杨怡然洪肖娟
王香,张月,陈炫宜,杨怡然,洪肖娟
(成都中医药大学,四川 成都 610075)
2型糖尿病(Type 2 Diabetes Mellitus,T2DM)是由于胰岛素抵抗和胰岛β细胞功能缺陷导致血糖升高的一种慢性疾病。根据国际糖尿病联盟[1]发布的《全球糖尿病地图(第10版)》数据显示,2021年全球成年糖尿病患者人数达到5.37亿,且此病引发的大血管病变、微血管病变等并发症的致残率和致死率逐年上升,已成为人类健康的第三大“杀手”[2- 3]。胰岛素抵抗(IR)作为2型糖尿病的核心病理机制,改善IR是目前治疗 T2DM 糖代谢紊乱的重要切入点。研究发现胰岛素抵抗的发生主要与各种促炎或氧化应激介质诱导的特异性炎症反应有关,尤其是促炎细胞因子,如白细胞介素1β(IL- 1β)、白细胞介素6(IL- 6)、肿瘤坏死因子α(TNF- α)、大量趋化因子(MCP- 1)等[4],认为T2DM是一种炎性疾病的状态[5]。慢性炎症会导致糖脂代谢紊乱、加剧胰岛素抵抗而加速T2DM进程[6- 7]。
针灸治疗T2DM疗效确切,能有效控制血糖。荟萃分析[8- 9]表明针灸有较好的降糖效果,可降低患者血糖、血脂水平,改善糖化血红蛋白水平。同时针灸操作简单、方便,费用低廉、疗效显著、无副作用的特点在 T2DM 慢病管理中具有显著优势[10]。2003年世界卫生组织便认可针灸是治疗T2DM可行的有效手段之一,但目前针灸降糖机制尚不完全明确。大量研究显示,针灸改善胰岛素抵抗疗效显著[11- 12],但针刺是否通过改善慢性炎症从而缓解胰岛素抵抗状态、降低血糖尚未可知。因此本研究选用SD雄性大鼠为研究对象,以电针刺激“足三里”“三阴交”“胃脘下俞”等穴位为干预手段,通过观察电针对 T2DM大鼠血糖、胰岛素抵抗以及MCP- 1、TNF- α、IL- 6、IL- 1β、TGF- β1、IL- 10等炎症因子水平的影响,探讨电针改善T2DM糖脂代谢紊乱的潜在机制,为针灸治疗T2DM提供更多的科学研究证据。
1 实验材料
1.1 实验动物
24只SPF级雄性SD大鼠,体质量(200±20)g,鼠龄2月,由北京斯贝福实验动物有限公司提供,生产许可证号为【SCXK(京)2019- 0008】。全部大鼠饲养于恒温(23±1)℃,相对湿度50%- 60%,12 h光照与12 h黑暗交替循环,所有动物均自由摄食饮水。该实验方案已得到成都森威动物中心动物伦理委员会的批准。
1.2 主要仪器及试剂
仪器:华佗牌一次性无菌0.20 mm× 25 mm针灸针(苏州医疗用品厂有限公司),华佗 SDZ- II 型电针仪(苏州医疗用品厂有限公司),冷冻高速离心机(Minispin plus/Eppendorf),孵育箱(赛默飞世尔科技),酶标仪(RT- 6100/Rayto),石蜡切片机(RM2245/ Leica),Image J 图像分析软件(美国 NIH),血糖试条及血糖仪(GA- 3/三诺官方旗舰店)。
试剂:STZ(Sigma 公司,美国,货号:102559123)、ELISA试剂盒HbAc、TG、FINS、TNF- α、IL- 6、IL- 1β、MCP- 1、TGF- β1、IL- 10(江苏酶免实业有限公司,中国,货号分别为:MM- 21055R1、MM- 0610R1、MM- 0690R1、MM- 0180R1、MM- 0190R1、MM- 0047R1、MM- 0099R1、MM- 0181R1、MM- 0195R1),4%多聚甲醛溶液(武汉塞维尔生物科技有限公司,中国,货号:BL539A)、苏木精- 伊红染色液(北京索莱宝科技有限公司中国,货号:G1140)。
2 实验方法
2.1 T2DM大鼠模型的建立及分组
大鼠适应性喂养一周后,采用随机数字表随机分为空白组8只和造模组16只。空白组予普通饲料并灌胃0.9%氯化钠溶液 3 mL/d,造模组予高脂高糖饲料并灌胃高脂高糖乳剂3 mL/d,连续喂养 4周后,进行腹腔注射2%链脲佐菌素30 mg/kg(溶于 0.1 mol/L 的柠檬酸- 柠檬酸钠配制成 1%的溶液,pH值为4.2- 4.5),同时空白组大鼠注射同样体积的缓冲液。注射STZ 72 h 后,进行OGTT及随机血糖检测,两次随机血糖值均大于 16.7 mmol/L 且 OGTT 实验 2 h的血糖值大于11.1 mmol/L 表示 T2DM 造模成功。16只造模成功的大鼠随机分为T2DM 模型组(模型组)8只、T2DM 模型电针组(电针组)8 只。
2.2 干预方式
本研究针刺干预选用足三里、三阴交、胃脘下俞三个腧穴,穴位参照国家经穴部颁标准(GB12346- 90)及《中国兽医针灸学》定位取穴,选用0.20 mm× 25 mm一次性毫针,毫针刺入3- 5 mm后针柄接电极,电针治疗采用连续波,频率为 10 Hz,强度 1.5- 2 mA(以引起大鼠肌肉轻微抖动为宜),留针30 min,1次/d,连续治疗6 d为1个疗程,休息1 d,共治疗4个疗程。空白组、模型组同一时间进行抓取固定,不进行干预。
2.3 标本采集及指标监测
2.3.1 一般情况
实验期间对各组大鼠精神状态、活动情况、毛发色泽、饮水量、饮食量、尿量等进行观察。
2.3.2 体质量、空腹血糖及糖耐量检测
使用电子天平每周测量一次大鼠空腹体重(前一晚 22∶00- 次日早 8∶00禁食),使用一次性血糖试纸测空腹血糖(次日早8∶00)并记录;腹腔注射STZ 72 h后及干预完成后,各组大鼠禁食12 h,进行糖耐量检测(OGTT)。
2.3.3 观察各组大鼠胰腺组织HE染色病理切片
干预结束后处死各组大鼠,解剖后迅速采样胰腺组织置于4%多聚甲醛中固定,24小时后通过常规脱水、浸渍、石蜡包埋制作切片,并进行HE染色,显微镜下观察胰腺组织结构变化,观察胰岛细胞的病理性改变。
2.3.4 ELISA法检测各组大鼠糖化血红蛋白、甘油三酯、空腹胰岛素及血清炎症因子表达水平
称重后用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉。大鼠完全麻醉后,腹主动脉取血,收集大鼠血浆,肝素钠抗凝,静置30 min,3000 r·min-1,离心半径14 cm,4℃离心 15 min,取上层血清用于ELISA检测。使用ELISA试剂盒,严格按照说明书检测大鼠糖化血红蛋白(HbAc)、甘油三酯(TG)及空腹胰岛素(FINS)、TNF- α、IL- 6、IL- 1β、MCP- 1、IL- 10、TGF- β1等炎症因子含量。计算各组大鼠胰岛素抵抗指数HOMA- IR=空腹血糖×空腹胰岛素/22.5。
2.4 统计学方法

3 实验结果
3.1 各组大鼠一般情况及行为学观察
4个疗程干预后,空白组大鼠精神状态佳,动作敏捷,毛发光亮,饮食、二便正常。模型组大鼠精神倦怠,反应迟钝,毛色晦暗而粗糙、易脱落,同时日饮食量、日饮水量、尿量增多及体重逐渐消瘦,表现典型的T2DM 大鼠的多饮、多食、消瘦的症状。电针组大鼠精神状态、反应灵敏度明显改善,大鼠日饮水量、日饮食量、尿量有所改善,体重减轻不明显。见图1。
注:A为空白组、B为模型组、C为电针组
3.2 各组大鼠实验干预前后的体重、血糖及OGTT变化
造模后,与空白组相比,模型组和电针组体重较重(P<0.05),模型组与电针组之间体重无统计意义;干预4周后,与空白组相比,模型组体重明显降低(P<0.01),电针组体重有所减轻(P<0.05);与模型组相比,电针组体重较高(P<0.05);各组治疗前后均有差异。见图2。

注:与空白组比较,*P<0.05;与空白组比较,**P<0.01;与模型组比较,#P<0.05;与治疗前相比,△P<0.05;与治疗前相比,△△P<0.01
造模72 h后,模型组及电针组大鼠血糖及OGTT AUC明显高于空白组,差异具有统计学意义(P<0.01),血糖值>16.7 mmol/L 且 OGTT 实验2 h血糖>11.1 mmol/L,说明模型建立成功,模型组与电针组之间无显著差异(P>0.05);干预4周后,与空白组相比,模型组血糖及OGTT AUC明显升高(P<0.01);与模型组相比,电针组大鼠血糖及OGTT AUC有所降低(P<0.05);且电针组血糖及OGTT AUC较治疗前有所降低(P<0.05)。见图2。
3.3 各组大鼠胰腺组织形态学的变化观察
正常组大鼠胰腺组织结构完整,胰岛呈规则的椭圆形,边界清晰,胰岛内β细胞丰富均匀、形态饱满、排列紧密,未见明显病理变化;模型组大鼠胰腺组织结构不完整,胰岛形态不规则,边缘模糊,胰岛面积缩小,胰岛内β细胞减少、排列紊乱,分布不均,部分变形;电针组大鼠胰腺组织结构较完整,胰岛边界清晰,胰岛面积及β细胞形态结构有所恢复,且β细胞数目较模型组增多。见图3。
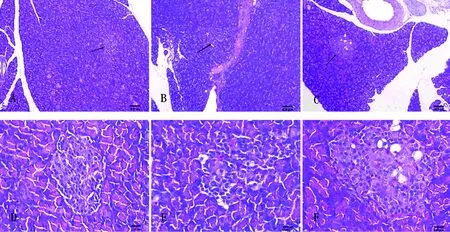
注:A为空白组100×,B为模型组100×,C为电针组100×,D为空白组400×,E为模型组400×,F为电针组400×;黑色箭头示胰岛β细胞
3.4 各组大鼠HbAc、TG、FINS及HOMA- IR 的比较
干预后,与空白组相比,模型组HbAc及TG含量升高(P<0.05);与模型组相比,电针组HbAc、TG含量有所降低(P<0.05),与空白组比较无显著性差异(P>0.05)。见图4。
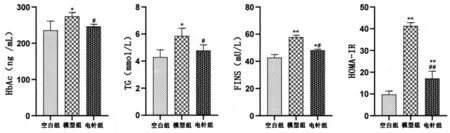
注:与空白组比较,*P<0.05;与空白组比较,**P<0.01;与模型组比较,#P<0.05;与模型组比较,## P<0.01
电针4周后,与空白组相比,模型组FINS含量显著升高(P<0.01),电针组FINS含量有所升高(P<0.05),与模型组相比,电针组FINS含量降低(P<0.05);进一步分析计算各组大鼠HOMA- IR 值,结果显示:与空白组相比,模型组及电针组的HOMA- IR 值显著升高(P<0.01),与模型组相比,电针组 HOMA- IR 值显著降低(P<0.01)。见图4。
3.5 各组大鼠血清MCP- 1、TNF- α、IL- 6、IL- 1β、TGF- β1、IL- 10炎症因子表达水平的比较
促炎因子结果显示,与空白组相比,模型组MCP- 1、TNF- α、IL- 1β含量明显升高(P<0.01),模型组IL- 6及电针组MCP- 1、TNF- α、IL- 6较于空白组有所升高(P<0.05);与模型组相比,电针组的MCP- 1、TNF- α、IL- 6、IL- 1β有所降低(P<0.05)。抗炎因子结果显示,与模型组相比电针组的TGF- β1含量(P<0.01)、IL- 10含量(P<0.05)升高,见图5。

注:与空白组比较,*P<0.05;与空白组比较,**P<0.01;与模型组比较,#P<0.05;与模型组比较,##P<0.01
4 讨论
糖尿病属中医学“消渴”的范畴,古籍关于其记载颇丰,最早出现在《黄帝内经》的《素问·奇病论篇》中:“有病口甘者,病名为何?何以得之?岐伯曰:此五气之溢也,名曰脾瘅。”[13]针灸治疗本病历史悠久,在《针灸甲乙经》中已有治疗糖尿病的取穴记载,如:“阴气不足,热中消谷善饥,腹热身烦狂言,三里主之;嗜卧,四肢不欲动摇,身体黄,灸五里,左取右,右取左。”[14]说明本病与脾胃关系密切。本研究选穴基于古籍记载及相关数据挖掘[15- 16],发现足三里、三阴交、胃脘下俞治疗2型糖尿病临床使用频率较高且疗效确切。足三里为足阳明胃经的合穴和下合穴,是胃经经气汇聚之处,对于脾胃的推动和气血运行具有较好的作用;三阴交为肝脾肾三经交会穴,可调补肝肾、调理气血、疏经通络;胃脘下俞为背俞穴,中医认为背俞穴与相应的器官之间存在体表- 神经阶段- 内脏联系,本穴处于第八胸椎棘突下后正中线旁开1.5寸,该穴所处位置有支配胰腺的神经传入,且该穴是治疗糖尿病的经验穴。结合团队前期研究基础[17],发现电针双侧足三里、三阴交和胃脘下俞穴可改善 T2DM 大鼠糖代谢紊乱和胰岛素抵抗状态。
胰岛素抵抗是引发 T2DM 的始动因素,发生胰岛素抵抗后,机体对葡萄糖的摄取利用降低,血糖持续升高,机体代偿性的分泌过多胰岛素从而导致高胰岛素血症,并进一步导致糖尿病的发生发展[18]。流行病学调查显示,约24.4%的糖尿病患者是由胰岛素抵抗所致[19]。因此,研究胰岛素抵抗的病理机制及改善胰岛素抵抗尤为重要。已有研究表明电针能够调控线粒体动力学相关蛋白,增加T2DM大鼠葡萄糖代谢能力以减轻胰岛素抵抗状态[20];针刺通过胰腺内在神经系统的神经调节,增加胆碱乙酰转移酶和神经肽Y表达,促进胰高血糖素样肽- 1的分泌,实现降糖作用,提高胰岛素敏感性,改善胰岛素抵抗[21]。本次研究也证实电针干预足三里、三阴交、胃脘下俞可降低 T2DM 大鼠 FBG、HOMA- IR。
研究表明T2DM是一种炎性疾病[22- 23],IL- 1β、IL- 6水平升高可预测T2DM的发生[24]。在2型糖尿病患者与健康人的研究中发现,前者IL- 6、TNF- α和 C 反应蛋白 (C- reactive protein,CRP)水平显著升高,会对胰岛细胞产生细胞毒性作用,加速糖尿病的发生[25]。慢性炎症与胰岛素抵抗的发生关系密切,是诱导胰岛素抵抗的重要机制[26- 27],如TNF- α会损害胰岛素信号通路从而诱导胰岛素抵抗[28]。部分学者认为,在2型糖尿病患者中,全身的炎症因子含量增加会导致IR的发生[29]。而已有相关研究证明,电针耳甲可降低T2DM模型大鼠促炎因子TNF- α,升高抗炎细胞因子IL- 10[30];“标本配穴”针刺干预结合其他疗法可降低T2DM患者IL- 6、1L- 1β及TNF- α等炎性细胞因子[31]。动物实验[32]及临床试验[33]也证实温针灸可有效改善糖尿病糖脂代谢及胰岛素抵抗状态。因此,改善慢性炎症状态从而改善胰岛素抵抗可能是针刺治疗T2DM的重要途径。基于此,发现电针干预4周后,2型糖尿病大鼠FBG、HbAc、FINS、HOMA- IR指数水平均下降且抗炎因子(TGF- β1 、IL- 10)含量明显升高,促炎因子(TNF- α、IL- 6、IL- 1β、MCP- 1)明显降低,说明电针可以缓解T2DM大鼠慢性炎症状态、改善胰岛素抵抗发挥降低血糖的作用。
综上所述,电针可以调控T2DM大鼠炎症因子表达水平,抑制低度炎性状态,有效改善2型糖尿病大鼠的糖脂代谢水平、胰岛素抵抗状态及胰岛β细胞的形态结构。但电针调节T2DM炎症因子水平的作用机制还需进一步探讨研究,因此,后续还需从相关炎症信号通路着手,探究电针是否通过调控相关信号通路抑制低度炎症从而起到改善2型糖尿病相关症状的作用。
