胰激肽原酶对背部皮瓣损伤大鼠皮瓣存活及炎症因子与氧化应激的影响
2024-02-21何金俊岑瑛
何金俊 岑瑛

[摘要]目的:探讨胰激肽原酶对大鼠背部超长随意皮瓣存活、炎症因子和氧化应激的影响。方法:将SPF级SD大鼠分为假手术组、生理盐水组、胰激肽原酶低剂量组和胰激肽原酶高剂量组。假手术组仅切开皮瓣,其余组做皮瓣损伤模型,生理盐水组不给予药物处理,胰激肽原酶低剂量组给予7.2 U/kg胰激肽原酶,胰激肽原酶高剂量组给予14.4 U/kg胰激肽原酶,治疗7 d。实验结束后,观察大鼠皮瓣成活率,HE染色观察大鼠皮瓣病理变化,使用原位末端转移酶标记技术(Terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)染色观察皮瓣细胞凋亡情况,CD31染色观察血管形成情况,ELISA检测大鼠血清中TNF-α和IL-6含量,皮瓣中Nrf2/HO-1水平。结果:与生理盐水组相比胰激肽原酶组提高了大鼠皮瓣存活率,减轻了皮瓣组织损伤,降低了血清TNF-α和IL-6含量,增高了Nrf2/HO-1水平。结论:胰激肽原酶能够提升皮瓣存活率,减轻大鼠炎症反应和氧化应激反应。
[关键词]胰激肽原酶;皮瓣存活;氧化应激;Nrf2/HO-1
[中图分类号]R622 [文献标志码]A [文章编号]1008-6455(2024)01-0054-04
Effects of Pancreatic Kallikrein on Flap Survival,Inflammatory Factors and Oxidative Stress in Rats with Dorsal Flap Injury
HE Jinjun,CEN Ying
(Department of Plastic Surgery/Burn,West China Hospital,Sichuan University,Chengdu 644000,Sichuan,China)
Abstract: Objective To investigate the effects of pancreatic kininogenase on the survival,inflammatory factors and oxidative stress of super-long random skin flap in rats. Methods SPF SD rats were divided into sham operation group, control group, low dose pancreatic kininogenase group and high dose pancreatic kininogenase group. The sham operation group only cut open the skin flap, the other groups made the skin flap injury model, the control group was not given drug treatment, the pancreatic kininogenase low dose group was given 7.2 U/kg pancreatic kininogenase, and the pancreatic kininogenase high dose group was given 14.4 U/kg pancreatic kininogenase for 7 days. At the end of the experiment, the survival rate of rat skin flap was observed, the pathological changes of rat skin flap were observed by HE staining, the apoptosis of skin flap was observed by TUNEL staining, the angiogenesis was observed by CD31 staining, the contents of TNF-α and IL-6 in serum and the level of Nrf2/HO-1 in skin flap were detected by ELISA. Results compared with the control group, pancreatic kininogenase increased the survival rate of skin flap, reduced the tissue injury of skin flap, decreased the content of serum TNF-α and IL-6, and increased the level of Nrf2/HO-1. Conclusion pancreatic kininogenase can improve the survival rate of skin flap and reduce inflammatory reaction and oxidative stress in rats.
Key words: pancreatic kininogenase; flap survival; oxidative stress; Nrf2/HO-1
皮瓣移植是整形、美容和重建手術中广泛使用的一种主要方式,用于治疗皮肤缺损。这种方法因其方便性和弹性而被用于治疗创伤性皮肤损伤、难治性伤口、癌症切除、烧伤和下肢血管溃疡[1-3]。然而,皮瓣组织损失率从占皮瓣长度的25%~50%是最具挑战性的问题[4]。胰激肽原酶又称胰激肽释放酶,是哺乳动物胰腺等器官中提取的一种蛋白水解酶,具有血管舒张、改善血液循环和微循环、防止血栓形成等作用[5]。基于此,本研究通过测定皮瓣存活率、平均血管密度、炎症因子、抗氧化物和Nrf-2、HO-1蛋白表达来探讨胰激肽原酶对大鼠皮瓣存活的影响。
1 材料和方法
1.1 试剂和仪器:细胞因子的酶联免疫吸附法检测试剂盒(上海酶联生物科技有限公司),蛋白特异性一抗(英国Abcam公司)。显微镜(麦克奥迪实业集团有限公司),凝胶电泳系统及成像系统(上海天能科技有限公司)。
1.2 动物造模及分组:SPF级6~8周雌性SD大鼠24只,体质量200~300 g,购自成都达硕实验动物有限公司[SCXK(川)2020-0030]。实验动物经华西医院动物实验室动物伦理委员会审批,审批编号:20230425001。适应性饲养1周,随机分为A组(假手术组)、B组(0.9%生理盐水对照组)、C组(胰激肽原酶低剂量组,7.2 U/kg)、D组(胰激肽原酶高剂量组,14.4 U/kg)组,每组6只。A组仅切开皮瓣,其余组给予腹腔内注射2%戊巴比妥钠(20 mg/kg)进行麻醉后,固定、背部手术区域刮毛,设计一蒂部在尾侧端长宽约8 cm×2 cm皮瓣,碘伏消毒、铺巾,沿设计线切开皮肤至肉膜层,全层游离掀起,止血满意后皮瓣予4-0丝线原位缝合。于术后开始给药,C组和D组分别腹腔注射7.2 U/kg和14.4 U/kg的胰激肽原酶[6],A组和B组等量生理盐水腹腔注射,1次/天,连续7 d。
1.3 皮瓣成活率观察:术后7 d,测量皮瓣存活区面积百分比。皮瓣成活率=皮瓣存活面积/皮瓣总面积×100%。
1.4 HE染色:术后7 d切取大鼠皮瓣距尾端3~4 cm处组织,10%多聚甲醛溶液中固定48 h,石蜡包埋;制3 μm切片,HE染色,于显微镜下观察。
1.5 TUNEL染色:用末端脱氧核苷酸转移酶(Terminal deoxynucleotidyl transferase,TDT)介导的缺口末端标记(TUNEL)染色检测DNA断裂程度。脱蜡、复水、封闭、10.2 mmol/L柠檬酸盐缓冲液处理,PBS洗涤后,37℃原位细胞死亡检测试剂盒(罗氏中国,中国上海)染色30 min,DAPI染色细胞核。最后,在荧光显微镜(奥林巴斯,日本东京)下捕获每张玻片的6个随机场,对TUNEL阳性细胞进行计数。
1.6 CD31染色:切片按照免疫组化试剂盒说明书进行CD31染色。先将染色切片置于低倍镜下确定血管密度最高区域,再在高倍镜下选取3个密度较多视野进行微血管计数并取平均值,计算出单位面积微血管数目。
1.7 ELISA检测:术后7 d于皮瓣蒂部抽取腹壁浅动脉血液1.5 ml,4 000 r/min条件下离心15 min分离血清,按照ELISA试剂盒说明书进行操作,根据标准曲线计算各组大鼠血清中TNF-α和IL-6含量。选取部分皮瓣组织称重后用超声匀浆机制成10%匀浆液,于4℃下10 000 r/min离心20 min后取上清液,按照试剂盒说明书步骤进行操作,采用比色法检测皮瓣组织中SOD活性和MDA含量。
1.8 WB检测:取各组大鼠皮瓣组织剪碎匀浆,加入RIPA裂解液提取总蛋白,采用BCA法测定样品浓度,取等量蛋白进行凝胶电泳分离后,转印至PVDF膜上。用脱脂奶粉封闭1 h后,4℃孵育稀释后的一抗(VEGF-A、HIF-1α和GAPDH,1∶1 000)12 h。次日清洗后加入相应二抗孵育2 h。洗涤后,加入显影液显影成像。使用GAPDH抗体进行内参校正,曝光图像用Image J软件对条带灰度值进行分析,用目的蛋白與GAPDH灰度值比表示目的蛋白的相对表达量。
1.9 统计学分析:采用GraphPad 8.0统计软件对实验结果进行分析,实验结果用(x¯±s)表示,两组数据之间比较采用t检验,三组间及三组以上数据分析采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
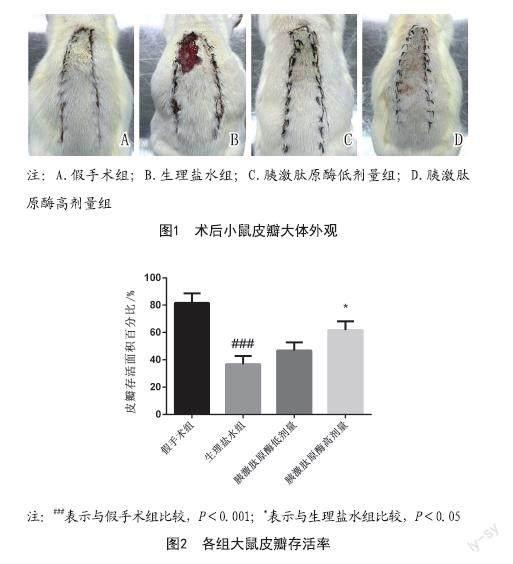
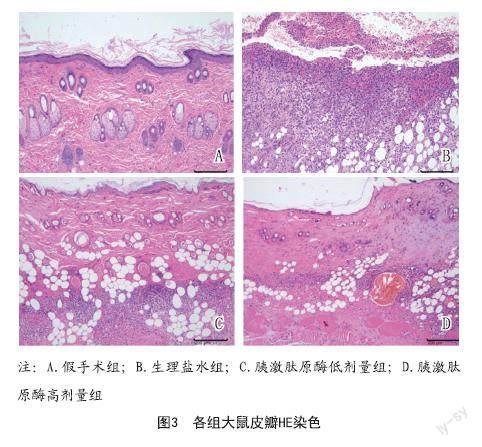
2.1 皮瓣外观观察及成活率:各组皮瓣存活率显著差异,与假手术组对比,生理盐水组大鼠皮瓣存活率显著降低(P<0.001),与生理盐水组对比,胰激肽原酶高剂量组大鼠皮瓣存活率显著升高(P<0.05),见图1~2。
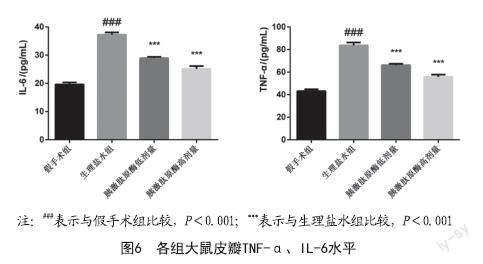
2.2 皮瓣组织病理学观察:通过HE染色,假手术组皮瓣组织表皮结构完整清晰,角质层明显,结构完整。生理盐水组皮瓣组织大面积变性坏死,见坏死区域细胞结构消失,胞质溶解,胞核固缩或消失,可见皮瓣组织内不同程度出血。胰激肽原酶低剂量组皮瓣组织表皮结构较完整清晰,角质层明显,复层扁平上皮层较薄,细胞排列整齐紧密,真皮层内胶原纤维不同程度变性坏死,见胶原纤维结构消失。胰激肽原酶高剂量组皮瓣组织表皮结构完整清晰,角质层明显,细胞排列整齐紧密;真皮层内见少量的炎性细胞浸润,毛囊和皮脂腺等附属器结构完整。见图3。TUNEL染色发现,与假手术组对比,生理盐水组细胞凋亡率显著升高(P<0.001);与生理盐水组对比,胰激肽原酶低剂量组和胰激肽原酶高剂量组细胞凋亡率显著降低(P<0.001)。见图4。
2.3 各组大鼠血管形成情况:与假手术组对比,生理盐水组大鼠血管数量显著降低(P<0.01);与生理盐水组对比,胰激肽原酶高剂量和胰激肽原酶低剂量组大鼠血管数量显著增加(P<0.01)。见图5。
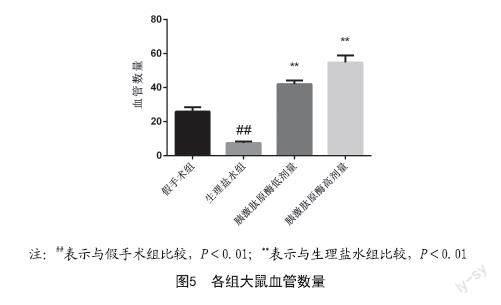
2.4 皮瓣中TNF-α、IL-6水平:与假手术组对比,生理盐水组大鼠TNF-α、IL-6含量显著升高(P<0.001);与生理盐水组对比,胰激肽原酶高剂量和胰激肽原酶低剂量组大鼠TNF-α、IL-6含量显著降低(P<0.001)。见图6。
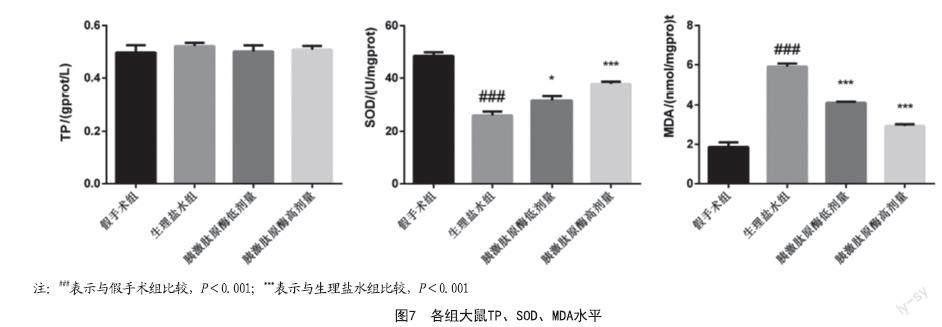
2.5 皮瓣中生化试剂盒检测总蛋白TP、超氧化物歧化酶SOD、丙二醛MDA水平:各组大鼠的总蛋白含量无显著差异。与假手术组对比,生理盐水组大鼠SOD含量显著降低(P<0.001),MDA含量显著增加(P<0.001);与生理盐水组对比,胰激肽原酶高剂量和胰激肽原酶低剂量组大鼠SOD含量显著升高(P<0.05),MDA含量显著降低(P<0.001)。见图7。
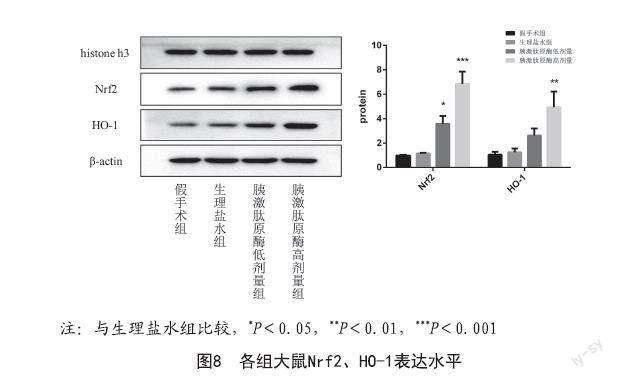
2.6 皮瓣中Nrf2/HO-1水平:Nrf2(细胞核,内参用histone h3)、HO-1(总蛋白,内参用β-actin)。与假手术组对比,生理盐水组大鼠Nrf2和HO-1表达量无明显差异;与生理盐水组对比,胰激肽原酶高剂量和胰激肽原酶低剂量组大鼠Nrf2表达显著升高(P<0.05),胰激肽原酶高剂量大鼠HO-1表达显著升高(P<0.01)。见图8。
3 讨论
胰激肽原酶为蛋白类水解酶,可调节血糖、血压及炎症反应等[7]。有研究报道,胰激肽原酶在糖尿病肾病中发挥抗氧化应激、抗炎症反应及抗组织纤维化等重要调控作用[8]。本研究结果表明,高剂量胰激肽原酶可显著改善大鼠背部皮瓣存活情况,促进组织结构完整,降低细胞凋亡率,促进血管生成,改善炎症。
有研究发现,胰激肽原酶能够有效降低血液黏稠度,抑制血小板聚集,扩张毛细血管,改善机体微循环[9-10]。本研究前期检测了各组大鼠的皮瓣损伤,结果显示,经胰激肽原酶治疗后大鼠的皮瓣组织表皮结构变得完整清晰,细胞凋亡也显著减少,血管数量显著增加。这表明胰激肽原酶对皮瓣损伤具有修复作用。
皮瓣存活受到三重因素的威胁,包括灌注不良、炎症机制和氧化应激[11-12]。随意皮瓣无特殊血管存在,主要依靠新的毛细血管网供血[13]。由于不受特定血管的限制,造成皮瓣的柔韧性,但也容易导致组织缺血和坏死[14]。一旦血管生成和血液灌注,就会发生缺血再灌注损伤[15],这意味着氧化应激发生在缺血组织和损伤的皮瓣上,伴有细胞凋亡[16-17]。本研究对大鼠皮瓣匀浆中炎症因子TNF-α、IL-6和超氧化物歧化酶SOD、丙二醛MDA检测,结果显示,经过胰激肽原酶干预后,大鼠皮瓣SOD水平显著升高,MDA水平显著降低,说明大鼠的氧化应激反应改善较好。
Nrf2/HO-1信号通路是细胞抗氧化防御机制的一个组成部分[18],研究报道NRF2可通过上调HO-1表达,对抗氧化应激水平升高,减轻细胞损伤[19]。有研究表明,当Nrf2/HO-1表达上调时,活性氧类、促炎因子等显著减少[20]。本研究结果显示经胰激肽原酶干预后,Nrf2和HO-1的表达水平均增高,这表明胰激肽原酶能有效缓解皮瓣损伤的氧化应激和细胞损伤。
综上所述,胰激肽原酶对皮瓣损伤大鼠表皮组织、氧化应激和炎症反应中具有调控作用,本实验从动物水平上初步说明了胰激肽原酶对皮瓣损伤的调节作用,后续将计划进一步探究胰激肽原酶的具体调节作用机制,为胰激肽原酶的临床应用及药物研发提供更加充分的理论依据。
[参考文献]
[1]Li D,Zhang R,Zhang Q,et al.Clinical results of ear elevations in patients with microtia using skin grafts from three donor sites: a retrospective study[J].Aesthetic Plast Surg,2020,44(5):1545-1552.
[2]Li Y,Zhang R,Zhang Q,et al.An alternative posterosuperior auricular fascia flap for ear elevation during microtia reconstruction[J].Aesthetic Plast Surg,2017,41(1):47-55.
[3]Aryannejad A,Gandominejad A,Tabary M,et al.Protective effect of modafinil on skin flap survival in the experimental random-pattern skin flap model in rats: The role of ATP-sensitive potassium channels and nitric oxide pathway[J].J Plast Reconstr Aesthet Surg,2021,74(6):1346-1354.
[4]Kane A J,Barker J E,Mitchell G M,et al.Inducible nitric oxide synthase (iNOS) activity promotes ischaemic skin flap survival[J].Br J Pharmacol,2001,132(8):1631-1638.
[5]杨海霞,刘国良,郝成伟,等.胰激肽原酶治疗糖尿病综述[J].临床医药文献电子杂志,2017,4(90):17799-17800.
[6]杜萍,冷吉燕,付军,等.胰激肽原酶对自发性高血压大鼠氧化损伤和心肌纤维化的影响[J].中国老年学杂志,2006(7):941-942.
[7]赵静,段莉莉,李超.胰激肽原酶肠溶片联合厄贝沙坦片治疗对2型糖尿病肾病伴高血压患者TM、TNF-α、IL-18的影响[J].临床和实验医学杂志,2021,20(16):1703-1707.
[8]Cheng Y,Yu X,Zhang J,et al.Pancreatic kallikrein protects against diabetic retinopathy in KK Cg-A(y)/J and high-fat diet/streptozotocin-induced mouse models of type 2 diabetes[J].Diabetologia,2019,
62(6):1074-1086.
[9]胡崇宇,李雅嘉,王晨旭,等.普羅布考联合胰激肽原酶治疗老年糖尿病周围神经病变的临床效果[J].中国老年学杂志,2018,38(5):1034-1036.
[10]Jin J Z,Li H Y,Jin J,et al.Exogenous pancreatic kininogenase protects against renal fibrosis in rat model of unilateral ureteral
obstruction[J].Acta Pharmacologica Sinica,2020,41(12):1597-1608.
[11]Ma X,Lin Y,Liu Y,et al.Effects of apigenin treatment on random skin flap survival in rats[J].Front Pharmacol,2021,12:625733.
[12]Souza R a C,Martinelli-Kläy C P,D'acampora A J,et al.Effects of sildenafil and tadalafil on skin flap viability[J].Arch Dermatol Res,2022,314(2):151-157.
[13]Zhang P,Feng J,Liao Y,et al.Ischemic flap survival improvement by composition-selective fat grafting with novel adipose tissue derived product-stromal vascular fraction gel[J].Biochem Biophys Res Commun,2018,495(3):2249-2256.
[14]冯润荷,张金财,李小倩,等.小剂量过氧化氢预处理对大鼠心肌缺血/再灌注损伤的保护作用[J].中国应用生理学杂志,2013,29(3):247-250.
[15]Pu C-M,Liu C-W,Liang C-J,et al.Adipose-derived stem cells protect skin flaps against ischemia/reperfusion injury via IL-6 expression[J].J Invest Dermatol,2017,137(6):1353-1362.
[16]Enzmann G,Kargaran S,Engelhardt B.Ischemia-reperfusion injury in stroke: impact of the brain barriers and brain immune privilege on neutrophil function[J].Ther Adv Neurol Disord,2018,11:1756
286418794184.
[17]Lou Z,Wang A P,Duan X M,et al.Role of ALK5/SMAD2/3 signaling in the regulation of NOX expression in cerebral ischemia/reperfusion injury[J].Exp Ther Med,2018,16(3):1671-1678.
[18]Yu L,Li S,Tang X,et al.Diallyl trisulfide ameliorates myocardial ischemia-reperfusion injury by reducing oxidative stress and endoplasmic reticulum stress-mediated apoptosis in type 1 diabetic rats: role of SIRT1 activation[J].Apoptosis,2017,22(7):942-954.
[19]Amata E,Pittalà V,Marrazzo A,et al.Role of the Nrf2/HO-1 axis in bronchopulmonary dysplasia and hyperoxic lung injuries[J].Clin Sci,2017,131:1701-1712.
[20]Wang Z,Guo S,Wang J,et al.Nrf2/HO-1 mediates the neuroprotective effect of mangiferin on early brain injury after subarachnoid hemorrhage by attenuating mitochondria-related apoptosis and neuroinflammation[J].Sci Rep,2017,7(1):11883.
[收稿日期]2022-12-09
本文引用格式:何金俊,岑瑛.胰激肽原酶對背部皮瓣损伤大鼠皮瓣存活及炎症因子与氧化应激的影响[J].中国美容医学,2024,33(1):54-58.
