水稻秸秆生物炭对土壤理化性质及不同形态硫含量的影响
2024-02-20贾愿红赵保卫DOUANGDALANGSYKhamhak
贾愿红,赵保卫,DOUANGDALANGSY Khamhak
(兰州交通大学 环境与市政工程学院,甘肃 兰州 730070)
硫(S)是水稻生长、发育所必需的重要元素之一,充足的S供给是水稻产量和品质的重要保证。植物体内的S除少部分是通过叶片直接从大气中吸收SO2外,绝大部分来自于土壤中的硫酸盐。S在土壤中以有机S和无机S两种形态存在,其中有机S约占土壤中总硫(TS)的98%。大部分有机S以有机化合物的形式赋存于作物残茬和土壤有机质(SOM)中,需经微生物分解为无机S和小分子有机硫化物后方能被植物吸收利用。近年来,随着农业生产的不断扩张和低S化肥的施用,导致土壤缺S问题日益严重[1-3]。
生物炭是生物质在完全或部分缺氧的条件下经高温(低于700 ℃)热裂解的产物,含有C、H、O、N、S等元素,具有比表面积大、吸附性强、性质稳定等特点[4-5]。有研究表明,生物炭可作为土壤缓释肥料,用于改善土壤性质、增强土壤肥力[6-8]。王媛等[9]研究发现,向土壤中施加生物炭,可有效提高土壤pH及土壤中速效N、P、K的含量。QIAN等[10]认为,生物炭有利于提高土壤对养分的保留和利用能力。总之,关于生物炭对土壤中N、P、K等营养元素影响方面的研究报道较多,而有关生物炭对土壤中S影响的报道还比较少。
本工作以不同炭化温度下制备的水稻秸秆生物炭为对象,通过厌氧培育实验,考察了生物炭对土壤pH、电导率(EC)、SOM含量和酶活性的影响,重点研究了生物炭对稻田土中各种形态S含量的影响,以期为改善土壤环境,提高土壤中S利用率作参考。
1 材料与方法
1.1 材料、试剂和仪器
水稻秸秆和土壤样品均取自某农田(17°59′28″N,102°39′42″E)。水稻秸秆经清洗后,置于阴凉通风处晾干,粉碎,过40目筛,装入棕色瓶中待用。
土壤样品采集深度为0~20 cm,于室内阴凉通风处自然风干,去除石子和凋落物等,研磨,过3 mm筛备用。经检测,pH 6.47、EC 0.28 mS/cm、SOM含量0.95 mg/g。
实验所用试剂均为分析纯。
JW-BK112型比表面积及孔径分析仪:美国MICROMERITICS 公司;Vario EL cube型元素分析仪:德国 Elementar 公司;DDS-11A型电导仪:杭州奥立龙仪器有限公司;SX2-4-10型马弗炉:上海嘉占仪器设备有限公司;UV-1800型紫外-可见分光光度计:上海双旭电子有限公司;SP-3520AAC2TI型火焰原子吸收分光光度计:上海光谱仪器有限公司。
1.2 生物炭的制备
将水稻秸秆粉末置于300 mm的瓷坩埚内压实,盖盖儿后置于马弗炉中,在300 ℃下热解6 h,冷却至室温,取出、研磨,过60目筛,制得水稻秸秆生物炭,记作BC300。
改变热解温度和热解时间分别为600 ℃和4 h,制得水稻秸秆生物炭,记作BC600。两种生物炭的理化性质见表1。
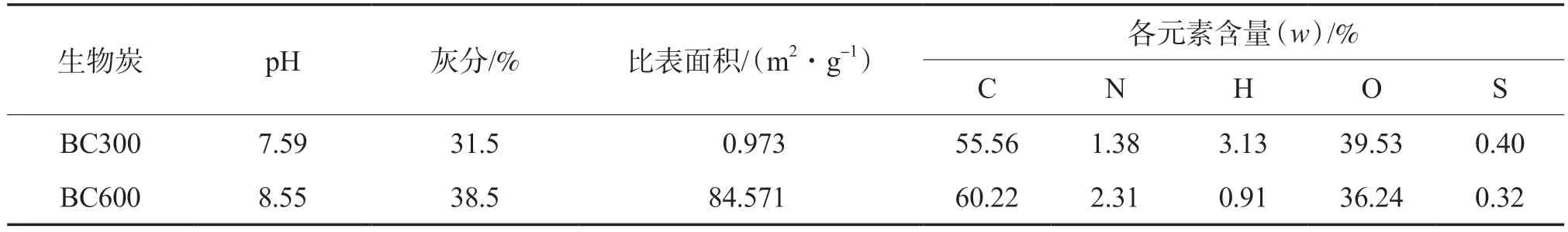
表1 两种生物炭的理化性质
1.3 厌氧培育实验
向塑料培养盒中加入100 g土壤,按照土壤质量的1%、3%和5%分别加入BC300和BC600,搅拌均匀,缓慢添加蒸馏水至土面以上2 cm位置;在25℃恒温培养箱中培养15周(为保证厌氧环境,培养过程中需定期添加蒸馏水,保证水面位置不变)。分别在初始阶段和15周时取样,测定土壤pH、EC、SOM、脲酶和过氧化氢酶活性,比较土壤理化性质和酶活性随时间的变化。测定土壤中TS、水溶性S、吸附性S和盐酸可溶性S的含量,比较土壤中各种S形态和含量随时间的变化。
本实验设置3组平行样,以未添加生物炭的土壤作为对照(CK)。
1.4 分析方法
依据《木质活性炭试验方法 pH值的测定》(GB/T 12496.7—1999)[11]测定生物炭的pH;采用化学元素分析仪测定土壤中各元素的含量;采用比表面积及孔径分析仪测定生物炭的比表面积;采用电极法[12]测定土壤pH;采用电导率仪测定土壤EC;采用分光光度法[13]测定SOM含量;采用比色法[14]测定土壤脲酶活性(以NH3-N计,单位 mg/g)和过氧化氢酶活性;采用火焰原子吸收分光光度计测定土壤中TS含量;依据文献[15]的检测方法,测定土壤中水溶性S、吸附性S和盐酸可溶性S的含量。
2 结果与讨论
2.1 生物炭对土壤理化性质的影响
2.1.1 pH
生物炭添加量对土壤pH的影响见图1。由图1可见:向土壤中添加BC300和BC600后,土壤pH有所增加,且随着生物炭添加量的增大,pH逐渐增大;在生物炭添加量相同的条件下,BC600对土壤pH的增强作用更加显著;15周后,与CK组相比,BC600添加量分别为1%、3%、5%时,土壤pH从4.50分别增加至5.48、6.54和7.42,增加了21.7%、45.3%和64.9%。生物炭之所以能够提高土壤pH,是因为生物炭本身为碱性,且含有大量的Ca、K和Mg等碱性物质,施入土壤后能够对土壤pH产生直接影响,另外,随着作用时间的延长,生物炭逐渐老化也会释放碱性物质,提高土壤pH[16-18]。
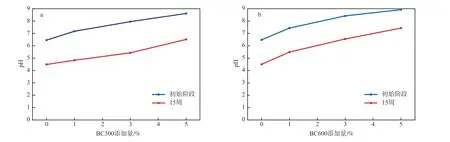
图1 生物炭添加量对土壤pH的影响
2.1.2 EC
生物炭添加量对土壤EC的影响见图2。由图2可见:CK组中,土壤初始EC为0.28 mS/cm,培养15周后,降低至0.25 mS/cm,降幅为12.2%;与CK组相比,随着生物炭添加量的增加,土壤EC逐渐上升;当BC300添加量为1%、3%和5%时,初始阶段,相应的EC分别增加至0.36,0.43,0.63 mS/cm,增长了28.5%、53.6%和125.0%;当BC600添加量为1%、3%和5%时,初始阶段,相应的EC分别增加至0.31,0.43,0.54 mS/cm,增长了10.7%、53.6%和92.9%。生物炭中含有Ca2+、Mg2+、Na+等可溶性盐,加入土壤后,土壤中的总离子数量增加,EC也随之增大[19]。由图2还可看出:培养15周后,各组土壤的EC均明显降低,这是因为:添加生物炭后,土壤的孔隙度得到改善,土壤浇灌过程中,持续的淋洗作用会带走部分盐分,使土壤EC降低[20]。
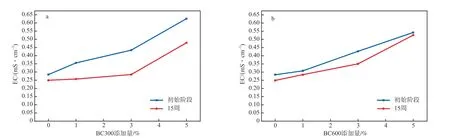
图2 生物炭添加量对土壤EC的影响
2.1.3 SOM含量
生物炭添加量对SOM含量的影响见图3。由图3可见:初始阶段,随着土壤中生物炭含量的增加,SOM含量逐渐增加,这是因为生物炭中含有可溶性有机碳(DOC),将生物炭添加到土壤中后,DOC会被释放出来,从而使SOM含量增加[21];相比较而言,初始阶段,在生物炭添加量相同的条件下,添加BC600后,SOM的增加量较为显著;培养15周后,添加BC300的土壤中,SOM含量明显增加,当BC300添加量为1%、3%和5%时,SOM含量分别为1.49,1.62,2.09 mg/g,与初始阶段相比,增加了26.3%、14.9%和37.5%;培养15周后,添加BC600的土壤中SOM含量明显下降,BC600添加量为1%、3%和5%时,与初始阶段相比,SOM含量分别下降了13.2%、11.8%和5.5%,这是由于生物炭对SOM具有矿化作用[22]。
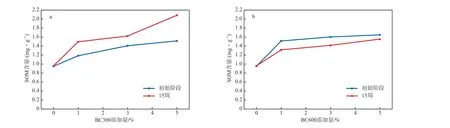
图3 生物炭添加量对SOM含量的影响
2.1.4 酶活性
土壤酶活性是评价土壤肥力和土壤活性的重要指标。土壤酶活性与土壤性质密切相关,因此,添加生物炭在一定程度上也会引起土壤酶活性的变化[18,23]。生物炭添加量对土壤脲酶活性的影响见图4a和图4b。由图4a和图4b可见:添加生物炭后,土壤脲酶活性受到抑制,且随着生物炭添加量的增加,土壤脲酶活性逐渐降低;当BC300或BC600添加量大于3%时,脲酶活性均降低了约20.0%;当生物炭添加量大于1%时,培养15周后,土壤脲酶活性继续降低。这可能是因为生物炭的添加阻碍了酶促反应的进行,从而使土壤脲酶活性降低[24]。
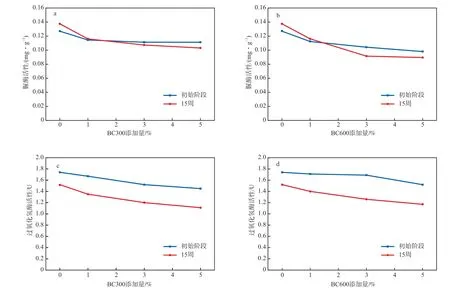
图4 生物炭添加量对土壤酶活性的影响
生物炭添加量对土壤过氧化氢酶活性的影响见图4c和图4d。由图4c和图4d可见:添加生物炭后,土壤过氧化氢酶的活性受到明显抑制,且随着生物炭添加量的增加,过氧化氢酶的活性逐渐降低,这是因为土壤pH是影响土壤酶活性的关键因素[25],添加生物炭后,土壤pH升高,酶活性受到抑制;另一方面,生物炭具有较强的吸附性能,能够吸附酶促反应底物,抑制酶促反应的进行,进而抑制了土壤酶活性[26]。
2.2 生物炭对TS和不同形态S含量的影响
2.2.1 TS含量
土壤中S元素的含量会影响植物的生物多样性和土壤微生物的活性[27-28]。生物炭添加量对土壤中TS含量的影响见图5。由图5可见:初始阶段,随着生物炭添加量的增加,TS含量缓慢增加;在生物炭添加量一定的条件下,培养15周后,土壤中TS含量明显增加,当BC600添加量为1%时,培养15周后,土壤中TS含量提高了22.6%;但当生物炭添加量大于1%时,培养15周后,随着生物炭用量的增加,土壤中TS含量变化不大,这可能与培养过程中生物炭中S的释放和土壤中微生物群落的变化有关[29]。
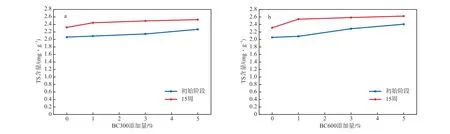
图5 生物炭添加量对土壤中TS含量的影响
2.2.2 不同形态S含量
生物炭添加量对土壤中水溶性S含量的影响见图6a和图6d。由图6a可见:初始阶段,随着土壤中BC300添加量的增加,土壤中水溶性S含量先减小后逐渐增大,当BC300添加量为1%,水溶性S含量最低,为0.26 mg/g;在BC300添加量一定的条件下,培养15周后,土壤中水溶性S含量均呈现降低趋势。由图6d可见:添加BC600后,土壤中水溶性S的变化情况与添加BC300的情况较为相似;当BC600的添加量为5%时,培养15周后,土壤中水溶性S含量由初始的0.39 mg/g降低至0.23 mg/g,降幅为41.3%。添加生物炭导致土壤中水溶性S含量降低的原因可能是生物炭对水溶性S具有强烈的吸附作用[30]。
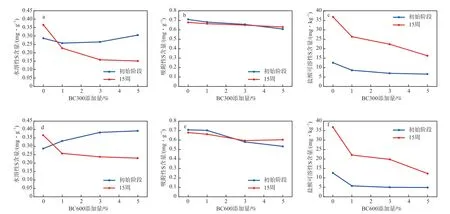
图6 生物炭添加量对土壤中不同形态S含量的影响
生物炭添加量对土壤中吸附性S含量的影响见图6b和图6e。由图6b可见:添加BC300后,土壤中吸附性S的含量略有降低,且随着BC300添加量的增大,土壤中吸附性S的含量逐渐降低;与初始阶段相比,当BC300的添加量为5%时,培养15周后,土壤中吸附性S的含量略有增加。添加BC600后,土壤中吸附性S含量的变化情况(图6e)与添加BC300的情况基本一致。
生物炭添加量对土壤中盐酸可溶性S含量的影响见图6c和图6f。由图6c可见:初始阶段,添加BC300后,土壤中盐酸可溶性S的含量明显降低;当BC300添加量由1%增加至3%时,土壤中盐酸可溶性S的含量由 8.65 mg/kg降至6.96 mg/kg;继续增加BC300添加量至5%时,土壤中盐酸可溶性S的含量变化不大;培养15周后,土壤中盐酸可溶性S的含量显著增加。添加BC600后,土壤中盐酸可溶性S含量的变化情况(图6f)与添加BC300的情况基本一致。
3 结论
a)向土壤中添加水稻秸秆生物炭,能显著提高土壤的 pH和EC;添加生物炭后,初始阶段,土壤中SOM含量增加,培养15周后,添加BC300的土壤中,SOM含量增加,添加BC600的土壤中,SOM含量有所降低。
b)水稻秸秆生物炭对土壤中脲酶和过氧化氢酶的活性具有一定的抑制作用。
c)添加水稻秸秆生物炭后,土壤中TS含量明显提高;当BC600添加量为1%时,培养15周后,土壤中TS含量提高了22.6%。
d)随着水稻秸秆生物炭添加量的增大,初始阶段,土壤中水溶性S含量明显增加、吸附性S和盐酸可溶性S的含量有所降低;培养15周后,土壤中水溶性S含量明显降低,吸附性S含量略有降低,盐酸可溶性S含量明显升高。
