水体与沉积物中氮、硫的还原过程及相互作用机理研究进展
2024-02-20孔祥民盛彦清
孔祥民,盛彦清,王 政
(1. 中国科学院 烟台海岸带研究所,山东 烟台 264003;2. 山东省海岸带环境工程技术研究中心,山东 烟台 264003;3. 中国科学院大学,北京 100049)
随着工农业生产的迅速发展和城市化进程的不断加快,水体和沉积物污染问题日益严峻。造纸、制革、制药、屠宰、食品加工和石油精炼等行业会产生大量含氮、硫污染物的废水。其中氮污染物有硝酸盐(NO3-)和亚硝酸盐(NO2-),硫污染物有硫酸盐(SO42-)和硫化物(S2-)等[1],这些污染物不仅危害环境[2-3],同时也严重威胁人体健康[4-5]。氮、硫元素有着丰富的中间价态,能够形成不同形态的氮、硫物质,这些物质之间还能够彼此转化、相互耦合,进而造成更为严重的污染问题[6]。各种氮、硫污染物中,NO3-和SO42-由于性质稳定、溶解度较大,在水体和沉积物中最为常见。因此,研究不同形态氮、硫污染物间的相互作用过程,并对NO3-、SO42-污染问题进行有效治理迫在眉睫。
目前,关于NO3-和SO42-污染治理的方法较多,其中将NO3-和SO42-还原成无毒无害的N2和单质S被认为是污染物去除最彻底、最有效的方式。一些学者利用氮、硫元素之间的耦合循环,开发了同步去除氮、硫污染物的一系列新工艺[7-9],用于控制油田酸化[10]、排水管道中H2S、N2O的释放[11]等。然而,关于氮、硫元素之间的耦合循环以及不同形态氮、硫污染物之间的相互作用机理尚不明确。
本研究综述了水体与沉积物中NO3-/SO42-的同步还原过程以及该过程中氮、硫元素之间的相互作用,展望了未来同步脱氮除硫工艺的研究方向,以期为NO3-和SO42-污染控制技术的开发提供参考。
1 NO3-/SO42-的同步还原过程
1.1 NO3-/SO42-的生物还原过程
水体或沉积物中的NO3-和SO42-可以通过物理法、化学法和生物法进行处理。相比较而言,生物法具有效率高、成本低、不使用化学药剂、不产生化学污泥、在自然环境条件下即可运行的优点。在水体和沉积物中,微生物介导的传统氮循环过程包括硝化作用、反硝化作用和固氮作用。首先,在硝化作用中,NH4+被硝化菌氧化为NO2-或NO3-;然后,在反硝化作用中,NO2-或NO3-被硝酸盐还原菌(NRB)还原为N2;最后,N2在生物体内通过生物固氮作用被还原为NH4+,完成氮的循环。在氮循环过程中,反硝化、异化NO3-还原为NH4+(DNRA)和厌氧氨氧化(Anammox)是实现NO3-还原的3种主要途径,合称为“NO3-异化还原过程”[12]。其中,反硝化和Anammox将NO3-或NO2-转化为N2的过程被认为是生态系统中彻底去除活性氮的过程;DNRA可以将NO3-还原为NH4+,从而被固定在生态系统中[13]。
以微生物介导的硫循环主要包括SO42-还原和S2-氧化两个重要过程。在厌氧条件下,SO42-通过SO42-运输、 SO42-激活、5-磷酸腺苷(APS)还原和SO32-还原4个步骤[14]被还原为S2-或H2S等硫化物。SO42-还原的途径有同化SO42-还原(ASR)和异化SO42-还原(DSR)两种。ASR是SO42-在微生物作用下合成有机硫化物的过程,即在微生物的作用下,SO42-首先被转化为还原态硫,参与微生物的代谢活动,最终转化为半胱氨酸和胱氨酸等有机硫化物,构成生物体的细胞组分;DSR是硫酸盐还原菌(SRB)通过有机化合物或氢气的氧化与SO42-的还原相结合来获取能量,并产生无机碳和硫化物的过程。ASR和DSR之间最明显的区别在于:SO42-通过ASR合成含硫氨基酸,而硫酸盐在DSR中用于产生能量。SO42-还原生成的还原态硫化物,在好氧或光照条件下,被硫氧化菌氧化成单质S、SO42-等产物,从而完成硫循环。
除上述传统的氮、硫循环途径外,随着研究的深入,人们还发现了一些新的氮、硫循环转化过程。FDZ-POLANCO等[15]利用厌氧流化床反应器进行甜菜酒糟废水处理时,首次发现了SO42-型厌氧氨氧化(SRAO)现象,该反应可以同时去除NH4+和SO42-,并且生成N2和S单质。WANG等[16]在研究湿地生态系统Anammox过程中发现:DNRA细菌可以利用S2-作为电子供体来生产NH4+和NO2-,DNRA的产物(即NH4+和NO2-)被Anammox细菌所利用,生产NO3-作为反应的最终产物;S2-驱动的DNRA通过支持Anammox细菌介导的Anammox,在湿地生态系统的氮、硫循环中发挥重要作用。近年来,以S2-、S0、S2O32-为电子供体驱动的反硝化反应得到了较为深入的研究,并在废水同步脱氮除硫工艺中得到应用,这些研究极大地拓宽了氮、硫循环的途径,加深了人们对微生物介导的氮、硫循环的理解。
NO3-/SO42-同步还原时氮、硫的循环模式见图1[16]。由图1可见:在SRB作用下,SO42-被还原为S2O32-、S0和S2-,这些物质可作为电子供体驱动NO3-、NO2-进行反硝化作用;在Anammox菌作用下,NH4+、NO2-可转化为N2和部分NO3-;硫自养反硝化菌和硫化物驱动的DNRA又可将部分NO3-还原,产生的中间产物NO2-、NH4+被Anammox菌利用,或进一步转化为N2排放,从而形成氮、硫共循环。

图1 NO3-/SO42-同步还原时氮、硫循环模式
1.2 NO3-/SO42-的化学还原过程
与NO3-/SO42-的生物还原相比,关于NO3-/SO42-化学还原的研究报道较少。NO3-的化学还原是指在碱性条件下,利用还原剂将水中的NO3-还原为N2,以去除NO3-的过程。根据还原剂种类的不同,化学还原法可以分为活性金属还原法和催化还原法两种。活性金属还原法一般使用Fe、Al、Zn和Cu等金属单质作还原剂。催化还原法则是将Pb、Pt、Ru和Rh等重金属催化剂负载于多孔介质上,利用氢气、甲酸等物质作为还原剂,将水中的NO3-催化还原为N2[17]。关于SO42-的化学还原过程和机理研究更少,目前鲜有将SO42-化学还原方法用于SO42-污染治理的报道。
发生化学还原的关键是电极电位差(ε0),因此,探究NO3-/SO42-同步化学还原过程,可以从电化学角度进行分析,表1列举了一些常见氮、硫物质的标准电极电位(E)[18-19]。E是用来推测氧化还原反应能否自发进行的重要指标,当氧化剂与还原剂的ε0为正值时,氧化还原反应才会发生。而且ε0越大,氧化还原反应越容易发生。因此,从理论上讲,氮、硫物质之间可能发生的氧化还原反应见表2。实际中,氮、硫物质之间的氧化还原反应还会受到反应速率及反应条件的影响,因此,需要进一步探究不同形态氮、硫物质之间的化学反应及其相互作用。
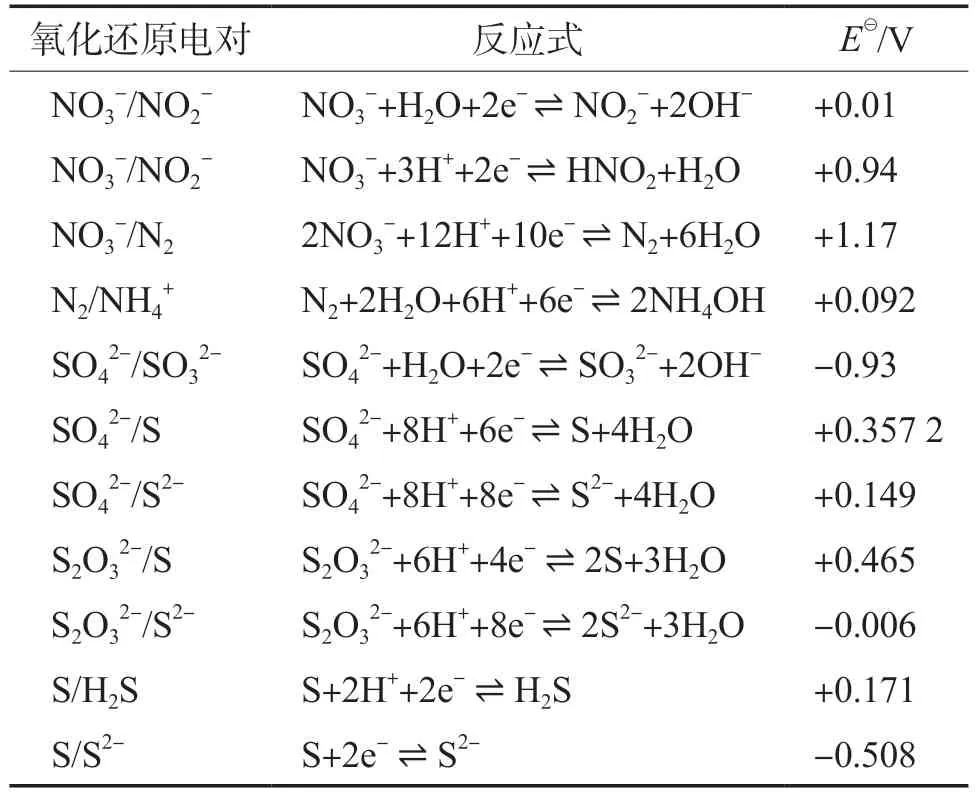
表1 常见氮、硫物质的E(25 ℃)

表2 常见氮、硫物质间可能发生的氧化还原反应
2 NO3-/SO42-同步还原过程中不同形态氮、硫物质间的相互作用
2.1 竞争作用
在NO3-/SO42-同步还原过程中,NRB和SRB由于生长环境相似,可以在同一厌氧环境中共存。当营养物质有限时,二者之间会发生激烈的竞争[20]。研究表明,在与SRB的竞争过程中,NRB通常会占据优势,从而优先利用电子供体[21]。当NRB和SRB以乙酸盐为基质时,相应的热力学和动力学常数见表3[22]。由表3可见:NRB的米氏常数(Km)值更低,这表明NRB对乙酸盐的亲和力高于SRB;从热力学角度看,反硝化反应的吉布斯自由能(ΔG)值更低,表明NO3-还原释放的能量高于SO42-还原释放的能量,所以NO3-还原反应更容易发生。此外,SRB所要求的氧化还原电位(ORP)(-100 mV)比NRB低(+400 mV),所以NO3-还原反应优先于SO42-还原反应发生[21]。当NO3-浓度较高时,NRB会通过基质竞争作用影响SO42-还原。但是,由于SRB的最大比基质降解速率(Vmax)高于NRB,因此能有效地转换基质,从而保持物质代谢平衡。所以,当基质充足时,NRB对SRB之间的基质竞争作用并不明显。
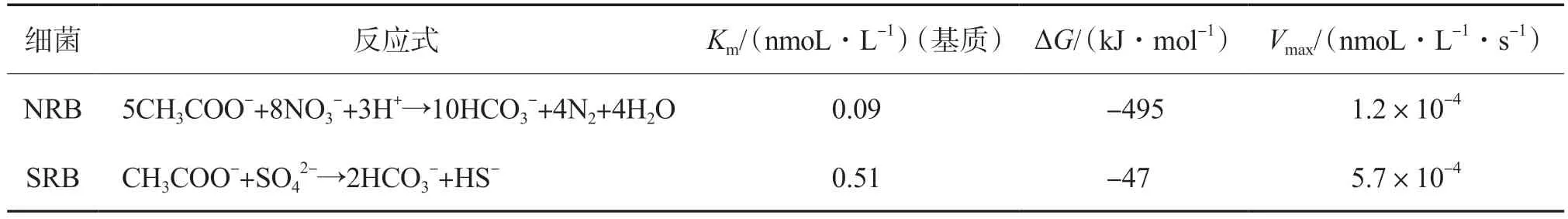
表3 NRB和SRB的热力学、动力学常数
基于NO3-/SO42-同步还原过程中的竞争作用,很多学者通过外加NO3-来控制SO42-还原产H2S和S2-。DAVIDOVA等[23]在研究NO3-对油田生产废水中微生物作用过程的影响时发现,向Oklahoma和Alberta油田生产废水中分别加入5 mmol/L和10 mmol/L的 NO3-可完全抑制S2-的产生,且NRB数量增加。YANG等[22]分别将Fe3+和NO3-加入到4个生物反应器中,考察它们对H2S控制的影响。结果发现:在反应器中添加NO3-后,异养硝酸盐还原菌(hNRB)陶厄氏菌(Thauerasp.)在与SRB竞争电子供体时占据优势,成为优势菌,抑制了硫化物的产生。
2.2 抑制作用
2.2.1 NO3-抑制SO42-还原
NRB除了与SRB竞争电子供体外,NO3-的加入还会抑制SRB的活性,其可能的原因有:
1)NO3-直接抑制SRB生长。NO3-通过增大细胞渗透压和影响细胞代谢对SRB产生负面影响,从而直接抑制SRB的活性。HE等[24]研究发现:加入NO3-会增大细胞渗透压,并影响甲基/S-腺苷甲硫氨酸(SAM)代谢和能量代谢等多个代谢途径,从而直接抑制变形杆菌(D. vulgaris)的生长;此外,加入NO3-后,丙酮酸分解代谢所产生的关键中间体的相关功能基因,如丙酮酸甲酸裂解酶(DVU2824)及其激活酶(DVU2825)的丰度明显增加,但NO3-抑制作用和变形杆菌能量代谢方式之间的关系尚不明确。
2)氧化还原电位的变化。在NO3-/SO42-同步还原过程中,NO3-被用作氧气的替代电子受体,NO3-浓度升高降低了溶解氧(DO)消耗,从而引发了DO的增加和ORP的升高[25]。SRB和NRB所要求的ORP不同,当系统ORP高于-100 mV时,SO42-还原会受抑制从而减少H2S产生[26]。ALLEN[27]研究发现,投加质量浓度为1.0 g/L 的NO3-至下水道污泥中,可以阻止S2-产生,并且认为加入NO3-后,系统的ORP得到提高,从而抑制了SRB的活性。
3)系统内部厌氧循环。NO3-作为NO3-还原硫离子氧化细菌(NR-SOB)的电子受体,可以将S2-氧化为SO42-。生成的SO42-又可以作为电子受体,还原为S2-后完成硫的循环。系统内部的厌氧循环也是NO3-抑制SO42-还原的原因,研究表明,NRSOB可通过生成NO2-或提高系统的ORP来抑制SO42-还原,同时S2-经NR-SOB重新氧化为SO42-也不利于含硫物质的彻底去除。NEMATI等[28]用分离的纯NR-SOB属的脱氮硫杆菌(Thiomicrospirasp.CVO)研究了NO3-抑制SO42-还原产H2S的机理,结果表明:可能是Thiomicrospirasp. CVO菌氧化S2-后提升了系统的ORP,从而对SO42-还原产生抑制作用。HAVEMAN等[29]向纯培养的SRB属的脱硫弧菌(Desulfovibrio)中加入脱氮硫杆菌后,SO42-还原受到了抑制,并且认为这种抑制作用主要是由NR-SOB还原NO3-产生的NO2-而引起的。LIU等[30]在研究添加NO3-对下水道沉积物中SO42-还原菌活性的影响时也发现,NO3-的加入刺激了硫自养反硝化菌的生长和繁殖,系统内部的厌氧循环导致S2-浓度降低。
4)中间产物NO2-、NO和N2O的抑制作用。NO3-加入后由于反硝化作用形成NO2-、NO和N2O等物质,这些中间产物也可能对SO42-还原产生抑制。NO2-是反硝化过程中最常见的中间产物,NO2-对SRB的抑制作用在于:NO2-抑制了SO42-还原为S2-过程中微生物酶的活性。有学者认为发生抑制作用的主要有毒物质是亚硝酸,细胞外的亚硝酸进入细胞内作为解联剂释放氢离子,细胞内质子直接影响三磷酸腺苷(ATP)合成所需的跨膜pH梯度,从而起到抑制作用[31];也可能是NO2-在酸性条件下生成游离亚硝酸,游离亚硝酸可使微生物失活,从而抑制SO42-还原。REINSEL等[32]在研究用NO3-、NO2-和戊二醛控制SO42-还原时发现,加入0.36 mmol/L的NO3-不能抑制SRB活性,而加入0.51mmol/L的NO3-后能产生 0.51~0.71 mmol/L的NO2-,从而有效抑制了SRB的活性。VESHAREH等[33]通过实验和现场数值模型比较了NO3-、NO2-和高氯酸盐在抑制海上油藏中S2-产生方面的作用,结果表明:NO2-对S2-积累的抑制作用最强,注入1 mmol/L的NO2-可减少92%的石油酸化。NO由于含有一个活化态的未成对电子,所以对许多细菌都有非专性的毒性抑制;N2O可与生物酶内的过渡金属形成复合键从而改变酶活性,进而抑制SRB的代谢[34]。
综上,NO3-抑制SO42-还原的不同机理之间紧密联系,且存在着连锁反应。如提高NO3-的浓度可能会直接抑制SRB的活性,且NO3-可以成为氧气的替代电子受体,提高系统的DO,进而使系统ORP提高,抑制SO42-还原。同时,反硝化反应的副产物NO2-、NO、N2O会抑制SO42-还原。而NO3-/SO42-同步还原过程中伴随的硫自养反硝化反应同样会通过生成NO2-或提高系统ORP来抑制SO42-还原。因此,关于NO3-抑制SO42-还原的机理还需要深入研究。
2.2.2 硫化物抑制
S2-可能对NRB和SRB均有毒性,从而对NO3-还原和SO42-还原过程均有抑制作用[35]。关于S2-的抑制机理目前争议较多。一种观点认为H2S能扩散进入细胞内使蛋白质失去活性进而产生抑制;另一些研究认为S2-的抑制效果与总硫化物或非离子态硫化物的浓度相关[36]。XU等[37]在反硝化脱硫工艺(DSR)条件下,同时去除S2-、NO3-和醋酸盐,发现:当S2-质量浓度达到718~1 485 mg/L时,对NO3-还原产生了抑制作用,同时,反硝化速率和醋酸氧化速率急剧降低,表明高浓度的S2-对自养和异养NRB均有毒性。OTWELL等[38]采用转录组学和代谢组学技术手段分析发现了S2-和半胱氨酸介导的抑制NRB生长代谢的机制:S2-和半胱氨酸通过破坏分支链氨基酸(BCAA)的生物合成、特定碳源的利用和辅助因子代谢等过程来抑制NRB的生长代谢。这进一步揭示了S2-抑制NO3-还原的机制。
2.3 协同作用
NO3-/SO42-同步还原过程中,除竞争作用和抑制作用外,还能互相利用代谢产物从而形成协同或共生体系。一方面,SO42-还原产物可在硫自养反硝化菌的作用下作为NO3-还原的电子供体,研究表明,S2-、单质S、S2O32-均可以作为电子供体[39],反应式见式(1)~(3)。
另一方面,S2-驱动的DNRA也是氮、硫之间进行协同作用的方式之一,S2-可作为DNRA的电子供体,其反应见式(4)。目前已在水体和沉积物中观察到高浓度S2-与DNRA的耦合[40-41]。
此外,NO3-还原的产物可在SO42-驱动下发生SRAO,从而使NO3-还原和SO42-还原产生协同作用。SRAO过程中,NH4+和SO42-反应生成N2和低价态的硫化合物,实现了高效、低能同步脱氮除硫的目的,因此受到了众多学者的关注。具体来说,SRAO的反应过程分为3个阶段:首先,SO42-与NH4+反应生成S2-和NO2-;然后,S2-与NO2-发生硫自养反硝化反应生成单质S和N2;最后,剩余的NH4+和NO2-进行Anammox反应,见式(5)~(7)[15]。
随着研究的深入,人们发现SRAO在有机碳源或无机碳源的条件下均可发生,并推理出多种SRAO反应过程[42]。这些研究加深了对氮、硫协同作用的认识,有助于开发出更多同步脱氮除硫新工艺,如硫自养反硝化工艺,该工艺无需外加有机碳源、有机残留物少、污泥产量少、处理成本低[43],已成为了废水脱氮除硫领域的研究热点。
3 结语
本文综述了NO3-/SO42-的同步还原过程,总结了该过程中不同形态氮、硫物质间的相互作用机理。与化学还原法相比,生物还原法由于成本低廉、效率高、适用范围广等优点而备受关注。利用NO3-/SO42-同步还原过程中氮、硫元素之间的竞争和抑制作用,人们已经开发出诸如控制油田酸化、控制排水管道H2S、N2O释放等技术;利用氮、硫循环之间的协同作用,硫自养反硝化、SRAO等同步脱氮除硫工艺得到了开发与应用。作为水体和沉积物中的主要污染物和重要生源要素,氮、硫元素的循环作用机理仍需进一步探讨,因此,今后的研究应着重于以下方面。
a)探究NO3-/SO42-发生同步化学还原的可能性,研究在化学还原条件和生物还原条件共存情况下NO3-/SO42-的还原路径,以及化学还原和生物还原对NO3-/SO42-同步还原的贡献及影响。
b)进一步剖析NO3-抑制SO42-还原的过程,明确各抑制过程的机理及可能产生的相互作用,从而为控制油田酸化、排水管道H2S释放等新技术的研究提供理论依据。
c)深入研究硫自养反硝化、硫驱动的DNRA和SRAO等同步脱氮除硫工艺及耦合关系,不断优化工艺运行条件,为工业化应用奠定基础。
