基于高效液相色谱-串联质谱测定孕妇血清中7种全氟和多氟化合物及新生儿神经行为评价
2024-02-20王梓皓梁凤至陈学蓉
王梓皓, 梁凤至, 陈学蓉, 吴 萍, 吴 微
(湖北中医药大学检验学院, 湖北 武汉 430065)
全氟和多氟化合物(PFASs)是一类新兴的环境内分泌干扰物,常被用于表面活性剂[1]、洗涤剂[2]、防火泡沫[3]、皮革制品和食品包装的制造等[4]。PFASs的半衰期很长,其从产品中释放后可广泛分布于空气、水、土壤中[5-7]。除此之外,PFASs也广泛存在于各种食品中(如蔬菜、乳制品、饮料、鸡蛋、肉类制品、鱼类和贝类),而饮食摄入也是人类接触PFASs的另一重要途径[8-10]。由于PFASs中的C-F键具有较强的稳定性,PFASs表现出极强的持久性,并具有生物蓄积性和毒性[11]。研究表明,PFASs在人体血液和肝脏中所检测到的含量最高[12,13]。血清蛋白是PFASs结合的主要目标物,这可能是因为PFASs具有生物富集性[14]。然而,目前PFASs的检测基质大多局限于水、食品、纺织品等,有关血液样品中PFASs的检测方法较少。因此,建立血液中多种PFASs的快速、准确定量检测方法,对监测人群PFASs的暴露水平具有重要意义。
孕妇作为特殊人群,其宫内遭遇的环境应激可以决定子代出生后的疾病风险[9,15]。日本的一项研究表明,孕妇体内全氟壬酸(PFNA)的含量与新生儿的体长呈负相关[16]。上海市疾病预防控制中心针对本辖区的一项调查发现,孕期全氟辛酸(PFOA)暴露会干扰孕妇体内的甲状腺水平,且孕妇体内的PFOA含量与新生儿的出生体重呈负相关[17]。陈晨春[18]通过调查1 000多对广西地区的孕产妇与新生儿发现,孕期全氟辛烷磺酸(PFOS)的暴露水平与胎儿宫内生长受限(intrauterine growth restriction, IUGR)呈正相关。除此之外,有关孕期PFASs暴露与新生儿神经行为发育影响的研究较少。
针对以上问题,本课题组建立了基于高效液相色谱-串联质谱(HPLC-MS/MS)检测孕妇血清中7种(PFASs)的分析方法。该方法采用液液萃取作为样品前处理方法,使用内标法定量。依托于已经建立的出生队列,将该法应用于孕妇血清中PFASs的监测,追踪并评估新生儿的神经行为发育,分析孕期PFASs暴露对新生儿神经发育的影响。
1 实验部分
1.1 仪器、试剂与材料
Xevo TQ-S Micro高效液相色谱-质谱联用仪(美国Waters公司); XH-B涡旋混匀器(江苏康健医疗用品有限公司); KQ-500VDE数控超声波清洗器(昆山市超声仪器有限公司); H2050R冷冻离心机(湖南湘仪实验室仪器开发有限公司); QYN100-1水浴氮吹仪(武汉泰仕德科技有限公司)。
超纯水仪(美国Millipore公司);甲醇、甲酸(均为HPLC级,美国Thermo Fisher公司);甲基叔丁基醚(MTBE)、四丁基硫酸氢铵(TBAS)(均为HPLC级,美国Sigma-Aldrich公司);碳酸钠(纯度≥99.5%)、碳酸氢钠(纯度≥99.8%)和乙酸铵(纯度≥99.0%)(国药集团)。
7种PFASs标准品和3种同位素内标单标溶液均购于加拿大威灵顿实验室。7种PFASs标准品:PFOA、PFOS、PFNA、全氟癸酸(PFDA)、全氟己烷磺酸(PFHxS)、全氟庚基磺酸(PFHpS)、全氟辛烷磺酰胺(PFOSA),溶剂均为甲醇,质量浓度均为5 μg/mL; 3种同位素内标单标溶液:13C4-PFOS、13C4-PFOA、13C4-PFHxS,溶剂均为甲醇,质量浓度均为2 μg/mL。其中,PFOSA、PFHxS以13C4-PFHxS为内标,PFHpS、PFOA以13C4-PFOA为内标,PFDA、PFOS和PFNA以13C4-PFOS为内标。
1.2 标准溶液的配制
混合标准工作溶液:分别吸取200 μL PFASs标准品(5 μg/mL)至同一5 mL容量瓶中,用甲醇定容,配制成质量浓度为200 ng/mL的混合储备液,于4 ℃保存待用。用甲醇对混合储备液进行逐级稀释,配制成系列质量浓度(0.1、0.5、2、10、50、100、200 ng/mL)的混合标准工作溶液,并于4 ℃保存。
混合内标工作液:先分别吸取500 μL的3种同位素内标单标溶液至同一10 mL容量瓶中,用甲醇定容至10 mL,配制成质量浓度为100 ng/mL的内标储备液;再用甲醇依次稀释成质量浓度为1.0、10、50 ng/mL的混合内标工作液,并分装为1 mL/支,于-20 ℃保存待用。

表1 7种PFASs及3种同位素内标的质谱参数
1.3 问卷调查及样本采集
本课题基于湖北省鄂州市妇幼保健院建立的出生队列展开研究,该队列以2019年招募的孕妇作为研究对象;在孕妇首次产检时,由护士对孕妇进行面对面问卷调查,以获得孕产妇的社会人口学信息。收集孕妇在孕晚期时(28~36周)的血液样本(10 mL),以4 000 r/min离心15 min,之后取出上层血清,置于-20 ℃冰箱中冻存,然后转入-80 ℃冰箱中长期保存。样本采集期间共收集456名孕妇孕晚期的血清样本。随访期间,排除流产、引产、信息不完整及子代失访者等情况,共有379名新生儿完成了新生儿神经行为评估。本研究已得到湖北中医药大学伦理委员会批准(No. 2021-IEC-015),招募志愿者均已签署知情同意书。
1.4 样品前处理
将采集的血清样本从-80 ℃冰箱中取出,放置在4 ℃冰箱中过夜,充分解冻后再转移至室温。先将5 μL混合内标工作液加入至15 mL聚丙烯离心管中,然后再依次加入200 μL血清样品、2 mL碳酸钠-碳酸氢钠缓冲液(pH 9.2)、1 mL TBAS,超声处理20 min;之后向离心管中加入4 mL MTBE,置于涡旋混匀器上充分振荡2 min,然后超声20 min,以4 000 r/min离心15 min。用聚丙烯材质吸管将有机相上清液转移至新的离心管中,向原离心管中再次加入4 mL MTBE,重复上述操作,合并两次上清液,于50 ℃恒温氮吹至干,再加入200 μL甲醇复溶,置于涡旋混匀器上充分振荡2 min,以4 000 r/min离心15 min,最后将上清液转移至进样小瓶中直接用于上机检测。
1.5 分析条件
色谱柱:Waters ACQUITY HPLC BEH C18柱(100 mm×2.1 mm, 1.7 μm);流动相:A相为甲醇,B相为2 mmol/L乙酸铵水溶液。梯度洗脱程序:0~5 min, 60%A; 5~10 min, 60%A~80%A; 10~12 min, 80%A~90%A; 12~15 min, 90%A; 15~20 min, 90%A~10%A。流速0.4 mL/min;进样体积10 μL;柱温40 ℃;样品室温度10 ℃。
离子源:电喷雾电离(ESI)源,负电离模式;扫描模式:多反应监测(MRM)模式;毛细管电压:0.5 kV;离子源温度:150 ℃;脱溶剂气温度:550 ℃;脱溶剂气流量:1 000 L/h;碰撞气:氩气。其他质谱参数见表1。
1.6 研究对象基本信息
纳入此次研究的共有379对孕产妇及其子代新生儿,其中男性新生儿的比例(52.8%)和体重((3 423.4±452.8) g)均略高于女性新生儿(47.2%, (3 326.4±602.8) g)。孕妇的平均孕龄为27.3岁,孕产妇的居住地区以城区为主(77.5%),学历大多为高中(37.2%)和大专(39.1%),家庭年收入以10万~20万居多(46.4%),且大多数孕妇为头胎妊娠(67.5%),居住房屋建筑类型主要为钢筋混凝土(61.0%),人均住房面积为10~20 m2(44.9%),相关信息见表2。
1.7 新生儿神经行为评价
依据北京协和医院鲍秀兰教授修订的20项新生儿神经行为测定法(neonatal behavioral neurological assessment, NBNA)[19],于孕妇分娩第3天(即新生儿出生72 h内),由儿科医师对新生儿的神经行为进行评估。NBNA的评估内容包括行为能力(6项)、被动肌张力(4项)、主动肌张力(4项)、原始反射(3项)和一般反应(3项),共20项指标,每项指标有3个评分水平(0、1、2分),NBNA满分为40分,本实验中共有379名新生儿完成了神经行为评价。
1.8 实验室样本质量控制
样本由统一的调查员专职采集并登记,运输过程中确保无污染。整理问卷及实验室检测数据,采用EpiData 3.1软件建立数据库,以平行双盲的方式录入数据,并对数据进行一致性检验和详细的逻辑纠错。实验试剂均为HPLC级或MS级试剂;前处理过程中使用的滴管、离心管等均为一次性材料,以避免PFASs污染。
2 结果与讨论
2.1 质谱条件的优化
按照1.5节分析条件,对待测物的母离子、子离子和碰撞能量等参数进行优化。先通过HPLC分离和一级质谱全扫描获得每种待测物的保留时间和母离子,然后优化碰撞能量获得子离子,最后采用MRM模式对待测物进行定性和定量分析。7种PFASs及3种同位素内标的总离子流色谱图见图1,相应的质谱参数见表1。
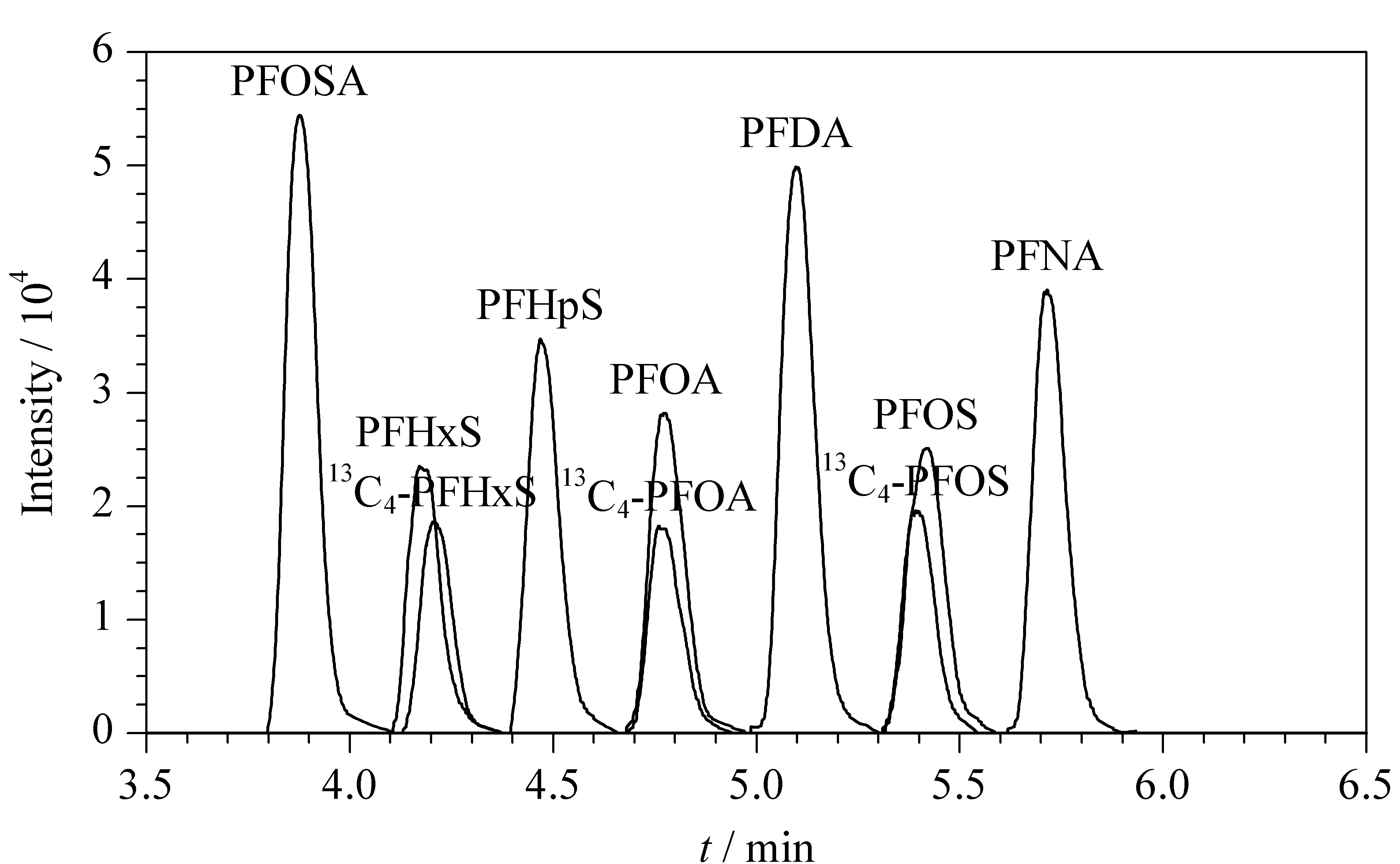
图 1 7种PFASs及3种同位素内标的总离子流色谱图Fig. 1 Total ion current chromatogram of the seven PFASs and three isotope internal standards
2.2 方法学评价
2.2.1线性范围、检出限与定量限
配制质量浓度为0.1、0.5、2、10、50、100、200 ng/mL的系列混合标准工作溶液并进样分析,以目标物与对应内标的定量离子峰面积之比为纵坐标(y)、目标物的质量浓度为横坐标(x,ng/mL),绘制标准曲线。结果如表3所示,7种PFASs在0.1~200 ng/mL内线性关系良好,相关系数(r2)均≥0.993;以3倍信噪比计算方法的检出限(LOD)、10倍信噪比计算定量限(LOQ), 7种PFASs的LOD为0.006~0.020 ng/mL, LOQ为0.020~0.066 ng/mL。
2.2.2回收率和精密度
在空白胎牛血清中分别添加低、中、高3个水平(1、10、50 ng/mL)的7种PFASs,进行加标回收试验,每个加标水平进行6次平行试验,并计算加标回收率和相对标准偏差(RSD)。如表4所示,7种PFASs在3个加标水平下的回收率分别为84.6%~116.8%、85.7%~112.5%和84.6%~107.8%,对应的RSD分别为5.8%~16.8%、3.8%~18.2%和6.7%~18.0%。实验结果说明,该方法准确可靠,能够用于实际样品的检测。

表3 7种PFASs的线性范围、回归方程、相关系数、检出限和定量限
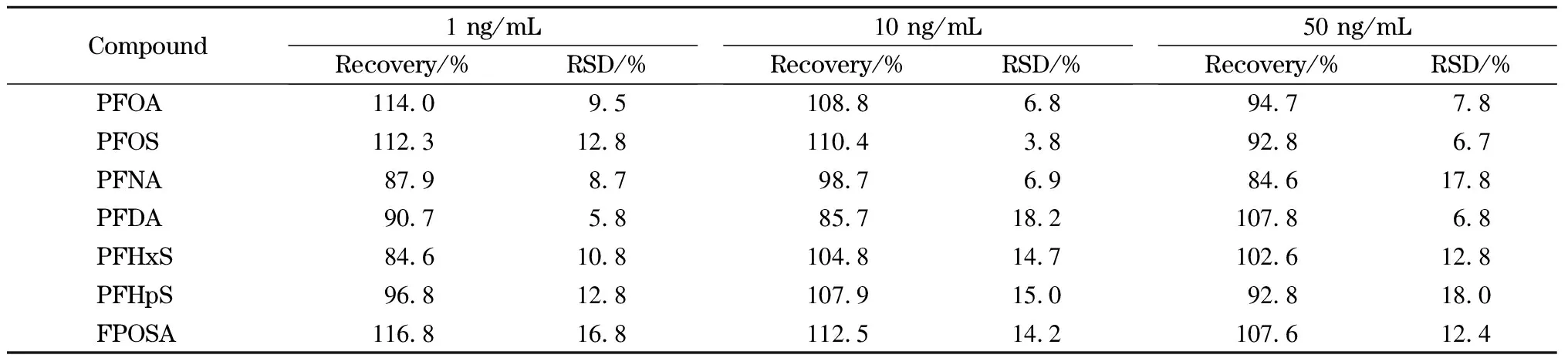
表4 7种PFASs在胎牛血清中的加标回收率和相对标准偏差(n=6)
2.3 与其他方法的比较
由于PFASs的种类较多,且血清基质较为复杂,一次检测血清中多种PFASs的方法并不多见[20,21]。Shafique等[21]基于气相色谱-串联质谱(GC-MS/MS)建立了血清中多种PFASs的分析方法,但所得到的回收率波动较大。Mazzoni等[22]开发了一种基于在线净化-液相色谱-串联质谱同时测定血清中两种全氟烷基磺酸盐(PFOS、PFHxS)、3种全氟烷基羧酸盐(PFOA、PFNA、PFDA)和一种全氟烷基磺酰胺(N-MeFOSA)的分析方法,6种目标物的回收率为84.0%~120.1%,LOD为0.16~0.34 ng/mL,但该方法在操作过程中需要两根色谱柱,且在线处理步骤较为复杂,样品用量大,因此推广性有限(见表5)。本方法可检测的PFASs种类多,准确度与精密度高,且试剂用量少,适用于人群中多种PFASs的快速分析测定。
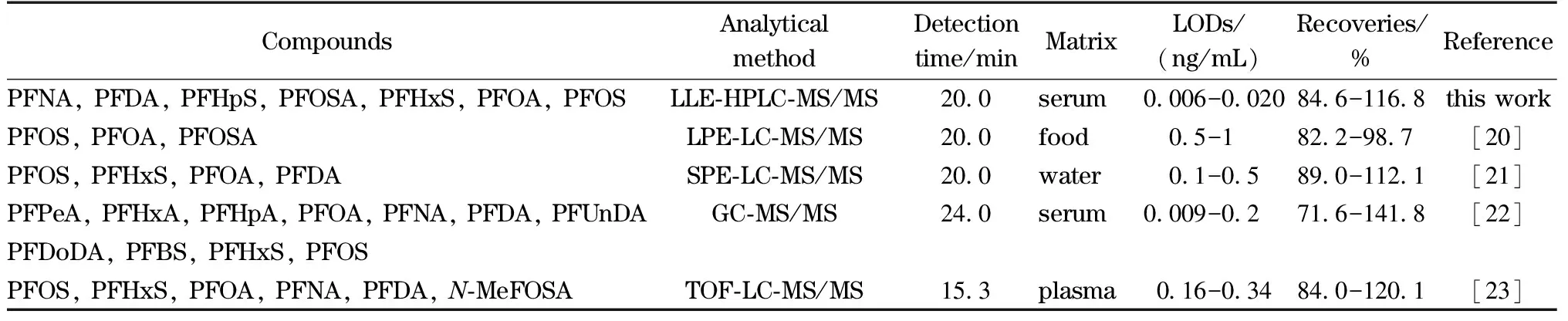
表5 本方法与其他文献方法的比较
2.4 孕妇血清中PFASs的暴露水平
456份孕妇血清样本中,暴露水平最高的是PFOA,中位数水平为19.4 ng/mL,检出率为100%;其次为PFOS,中位数水平为7.5 ng/mL,检出率为100%; PFHpS的中位数水平为5.62 ng/mL,检出率为98.5%; PFDA的中位数水平为2.01 ng/mL,检出率为97.6%; PFNA的中位数水平为1.92 ng/mL,检出率为100%; PFHxS的中位数水平为1.20 ng/mL,检出率为100%; PFOSA的中位数水平为0.55 ng/mL,检出率为97.4%。PFOA是血清中PFASs的最主要贡献者,其暴露水平最高的原因可能是其半衰期较长且使用广泛。研究发现,在食品包装、服装、家具、电器、炊具、化妆品等日常生活品中,PFOA的含量远高于其他PFASs[24]。此外,动物实验表明,血清中的白蛋白是PFASs的主要靶标,而PFOA与白蛋白的结合能力要强于其他PFASs,从而导致其在血清中的蓄积最高[25]。
2.5 新生儿神经行为评分
本研究中,379名新生儿的行为能力(满分12分)、被动肌张力(满分8分)、主动肌张力(满分8分)、原始反射(满分6分)、一般反应(满分6分)及NBNA总分(满分40分)分别为11.12±0.62、7.37±0.62、7.50±0.50、5.48±0.52、5.41±0.48和37.03±1.27分。如表6所示,性别分层分析结果显示,女性新生儿的行为能力(P=0.013)、主动肌张力(P=0.009)和原始反射(P=0.026)均高于男性新生儿。

表6 新生儿神经行为测定结果(n=379)
2.6 孕期PFASs暴露对新生儿各功能区得分的影响
由于血清中PFASs的水平呈偏态分布,在随后的分析中将PFASs的水平值作对数转换,使其呈正态分布,再采用线性回归分析方法来探究孕期PFASs暴露与新生儿神经行为间的关系。
在对总人群的各个混杂因素进行调整后发现,孕期母体体内的PFOS每增加一个自然对数(ln)水平,新生儿的主动肌张力及一般反应分别降低0.36分(95%置信区间(CI): -0.64~-0.08,P=0.036)和0.34分(95% CI: -0.61~-0.07,P=0.040);孕期母体体内的PFNA每增加一个ln水平,新生儿的被动肌张力和NBNA总分分别降低0.38分(95%CI: -0.74~-0.01,P=0.042)和0.37分(95% CI: -0.68~-0.06,P=0.042); PFDA每增加一个ln水平,新生儿的行为能力降低0.28分(95% CI: -0.54~-0.01,P=0.044);而PFHxS每增加一个ln水平,新生儿的NBNA总分上升0.27分(95% CI: 0.05~0.48,P=0.038),详细结果如图2所示。美国[26]和日本[27]的两项研究使用贝利婴幼儿发展量表第3版(BSID-Ⅲ)来评估新生儿的神经行为发育,结果显示,孕妇产前暴露PFOS和PFNA与新生儿的认知行为下降和语言功能评分降低有关;虽然这两项研究与本次研究所使用的评分方法不一致,但均能说明孕期PFASs暴露对儿童神经行为发育有负面影响。
2.7 孕期PFASs暴露对新生儿神经行为影响的性别差异
经性别分层后,孕期PFASs暴露对新生儿神经行为的影响如表7所示。在对各项混杂因素进行调整后,PFOS每增加一个ln水平,男性新生儿的主动肌张力及一般反应分别降低0.54分(95% CI: -0.73~-0.35)和0.50分(95% CI: -0.88~-0.13); PFNA每增加一个ln水平,男性新生儿的被动肌张力和NBNA总分分别降低0.67分(95% CI: -1.20~-0.14)和0.45分(95% CI: -0.91~-0.01); PFDA每增加一个ln水平,男性新生儿的行为能力降低0.44分(95% CI: -0.71~-0.17);而PFHxS每增加一个ln水平,男性新生儿的NBNA总分上升0.41分(95% CI: 0.02~0.80);同时,该性别分层研究未观察到PFASs与原始反射之间的统计关联。
在对各项混杂因素进行调整后,孕期母体PFASs暴露对女性新生儿神经行为的影响较小。如表7所示,仅观察到PFOA与一般反应之间呈负相关关系(回归系数(regression coefficient,β)=-0.27; 95% CI: -0.51~-0.02),而PFDA与行为能力之间呈正相关关系(β=0.46; 95% CI: 0.40~0.52)。这一结果与丹麦的一项出生队列研究类似,即PFASs对男性新生儿身长、体重、认知发育等方面的影响大于女性新生儿[28]。原因可能是孕期PFASs暴露会干扰母体甲状腺相关激素(如促甲状腺激素、游离三碘甲状腺原氨酸)的合成及转运,甲状腺相关激素的分泌又会影响儿童的神经行为发育;而由于性别差异,不同性别新生儿对甲状腺激素的敏感度不同,导致PFASs对神经行为的影响存在性别差异[29]。
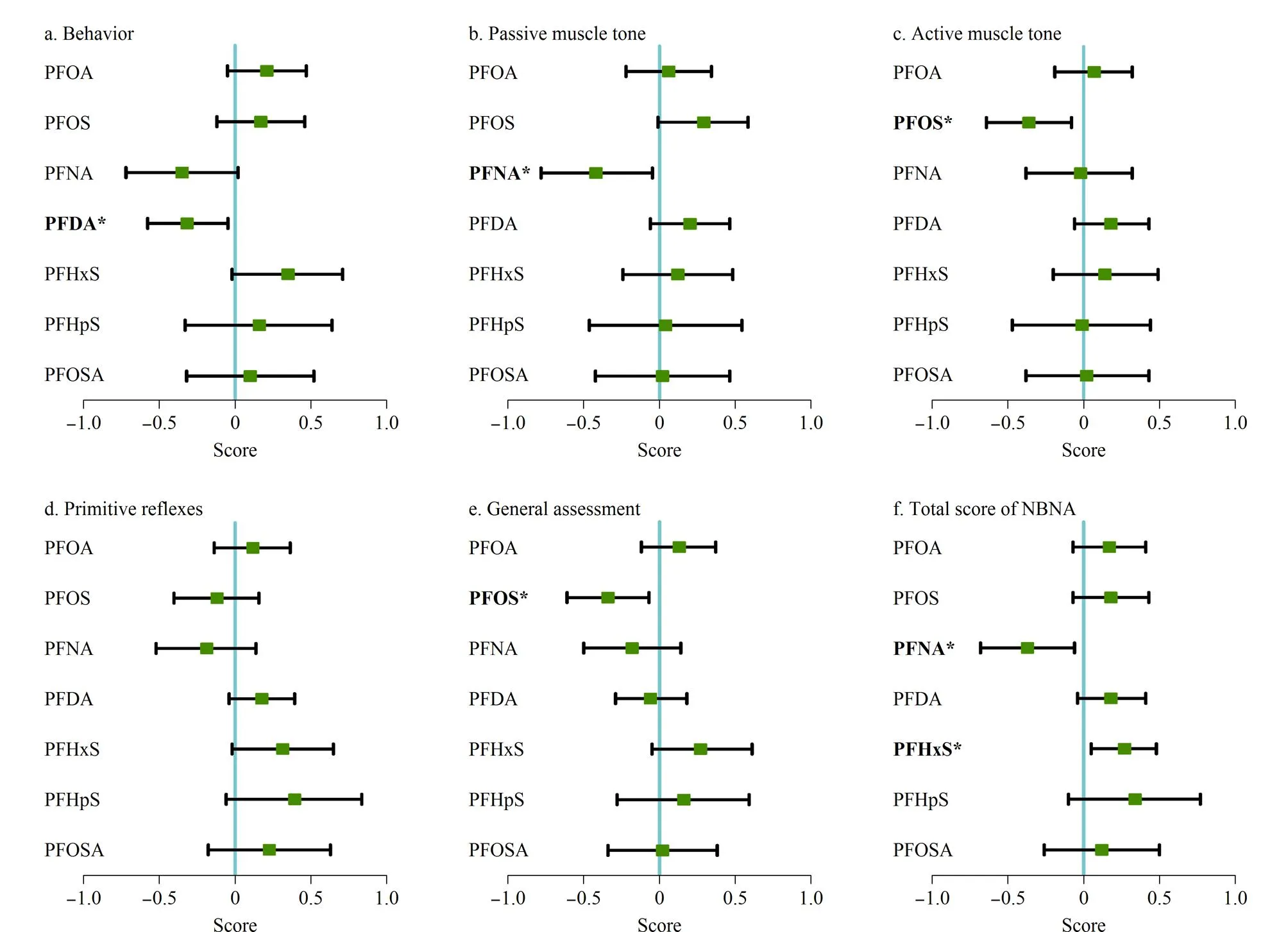
图 2 孕期PFASs暴露对新生儿各功能区得分的影响Fig. 2 Effects of PFASs exposure during pregnancy on the scores of newborn functional areas * Significant difference (P<0.05). All models were adjusted for maternal age, pre-pregnancy BMI, living zone, mother’s schooling time, annual household income, parity, residential building type and average living space.

表7 孕期PFASs暴露对不同性别新生儿神经行为的影响
3 结论
本研究建立了测定孕妇血清中7种PFASs的高效液相色谱-串联质谱法,该方法检出限低,回收率及精密度良好,且样品用量少。将该方法应用于已建立的出生队列,结果显示,孕妇血清中PFOA的暴露水平最高;同时,我们随访并测定了子代新生儿的神经行为评分,结果证实,孕期PFOS、PFNA和PFDA的暴露与新生儿NBNA的评分呈负相关。对子代新生儿进行性别分层分析后发现,孕期PFASs暴露对男性新生儿的神经行为影响更为明显。由于本研究只采集了孕妇孕晚期的血清样本,未能探索孕早期及孕中期PFASs暴露对新生儿神经发育的影响,无法确定孕妇暴露PFASs的敏感窗口期。今后可通过动物模拟实验,探究PFASs神经发育毒性的敏感窗口期及其致病机制。