高效液相色谱法同时测定明胶空心胶囊中苯甲酸和山梨酸
2024-02-20刘康连梁晓玲黎强樊文研庞云娟陈宇
刘康连,梁晓玲,黎强,樊文研,庞云娟,陈宇
[玉林市食品药品检验检测中心,玉林中药材(含香辛料)质量检测与评价工程技术中心,广西玉林 537000]
明胶空心胶囊是用明胶加辅料制成的空心硬胶囊,作为胶囊剂中的一种特殊辅料,广泛应用于中药制剂、保健食品等胶囊剂[1-2]。胶囊剂为除了片剂以外的口服固体制剂的主要剂型之一,明胶空心胶囊作为胶囊剂型药物的载体,随药物进入人体消化系统,最终被人体所吸收[2],因此明胶空心胶囊的质量安全直接影响药品和保健食品的质量安全[2-4]。《中华人民共和国药典》(以下简称《中国药典》)2020 年版四部对明胶空心胶囊有明确的微生物限度要求,而明胶空心胶囊的主要原料明胶是细菌繁殖的优良培养基,要使其达到药典规定的微生物限度要求,除了严格控制明胶的卫生指标与明胶空心胶囊的生产过程外,生产企业通常会加入一定量的防腐剂。《中国药典》对明胶空心胶囊中防腐剂的检查主要是针对其灭菌工艺涉及到的防腐剂残留,检查项目只有对羟基苯甲酸酯类、氯乙醇、环氧乙烷3 种,目前还没有明胶空心胶囊中苯甲酸、山梨酸等防腐剂的检查方法。苯甲酸钠和山梨酸钾因价格低廉且具有广谱的抑菌效果,在食品、药品、化妆品中应用广泛[5]。如果明胶空心胶囊生产者在生产过程中过多添加苯甲酸钠、山梨酸钾等防腐剂,达到一定浓度时会有过强的抑菌作用,不仅影响到明胶空心胶囊微生物限度检查方法的建立[6],也会影响到其药品制剂微生物限度检查方法的建立[7-9]。此外苯甲酸钠、山梨酸钾的使用安全性也不可忽略,苯甲酸钠ADI (每日人体每千克体重允许摄入的质量,单位为mg)为0~5 mg/kg,LD50 (半数致死量)为4 070 mg/kg[10],其安全性也会影响到患者用药的安全。
目前测定食品药品中苯甲酸、山梨酸的方法有高效液相色谱法[11-13]、气相色谱法[14-16]等。明胶空心胶囊中水溶性蛋白质含量较高,难以通过单一加入蛋白沉淀剂来去除样品溶液中蛋白质的影响。黄银波等[17-19]对食品中苯甲酸、山梨酸的测定分析结果表明,C18固相萃取小柱对苯甲酸、山梨酸有很好的吸附作用,且提取率高。笔者参考食品中苯甲酸、山梨酸的提取方法对明胶空心胶囊样品处理方法进行优化,样品经水浴溶解,加入蛋白质沉淀剂,用C18固相萃取小柱去除蛋白质,在此基础上建立了明胶空心胶囊中苯甲酸盐(以苯甲酸计)、山梨酸盐(以山梨酸计)的高效液相色谱检查方法。该方法能够有效地去除蛋白质、部分色素及其它杂质的干扰,提取方法操作简便,提取回收率高,满足明胶空心胶囊中苯甲酸和山梨酸的测定要求。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:1260型,配二极管阵列(DAD)检测器,美国安捷伦科技有限公司。
电子分析天平:XS-205Du 型,感量为0.01 mg,瑞士梅特勒-托利多公司。
高速冷冻离心机:ROTANTA 460R 型,德国Hettich科学仪器公司。
水浴恒温振荡器:SHZ-88 型,江苏金怡仪器科技有限公司。
pH计:FE20型,瑞士梅特勒-托利多公司。
苯甲酸对照品:批号为G139784,质量分数为99.9%,德国Dr·Ehrenstorfer GmbH公司。
山梨酸对照品:批号为C0005882,质量分数为99.7%,北京曼哈格生物科技有限公司。
甲醇:色谱纯,美国Fisher chemical公司。
甲酸:色谱纯,天津市科密欧化学试剂有限公司。
乙酸铵:分析纯,上海阿拉丁生化科技股份有限公司。
亚铁氰化钾[K4[Fe (CN)6]·3H2O]、乙酸锌[Zn(CH3COO)2·2H2O]:均为分析纯,广东光华科技股份有限公司。
冰乙酸:分析纯,国药集团化学试剂有限公司。
明胶空心胶囊样品:由药品生产企业单位提供。
实验用水为超纯水。
1.2 色谱条件
色谱柱:Agilent Zorbax SB-Aq 柱(250 mm×4.6 mm,5 μm,美国安捷伦科技有限公司);柱温:30 ℃;检测器:二极管阵列检测器;检测波长:230 nm;进样体积:10 μL;流动相:2 mmol/L甲酸与20 mmol/L乙酸铵混合溶液-甲醇(体积比为90∶10),流量为1.0 mL/min;洗脱方式:等度洗脱。
1.3 溶液配制
苯甲酸、山梨酸对照品储备液:质量浓度均为5 g/L,分别精密称取苯甲酸、山梨酸对照品各0.1 g(精确至0.000 1 g)于两只20 mL容量瓶中,用适量甲醇溶解并分别定容至标线,摇匀。
苯甲酸、山梨酸混合标准中间溶液:两组分质量浓度均为200 mg/L,分别精密移取苯甲酸、山梨酸对照品储备液各2 mL于同一只50 mL容量瓶中,用水定容至标线,摇匀。
苯甲酸、山梨酸系列混合标准工作溶液:分别准确吸取苯甲酸、山梨酸混合标准中间溶液0、0.05、0.25、0.50、1.00、2.50 mL,用水定容至10 mL,配制成苯甲酸、山梨酸质量浓度均分别为0、1、5、10、20、50 mg/L的系列混合标准工作溶液。
2 mmol/L甲酸-20 mmol/L乙酸铵混合溶液:称取1.54 g 乙酸铵,加入适量水溶解,再加入75.2 μL甲酸,用水定容至1 000 mL,摇匀,经0.45 μm 尼龙滤膜过滤。
1.4 样品处理
称取明胶空心胶囊样品约0.5 g 于50 mL 聚四氟乙烯具塞离心管中,精密称定,加入10 mL 水,于60 ℃水浴恒温振荡器中振荡溶解提取30 min,冷却至室温后分别加入0.25 mol/L 亚铁氰化钾溶液和1.0 mol/L 乙酸锌溶液各2 mL,用水稀释定容至20 mL,涡旋混匀,以4 600 r/min转速离心5 min,取5.0 mL上清液,加入冰乙酸约0.3 mL调pH至3~4。取一支C18固相萃取小柱,分别用5 mL甲醇和5 mL水活化后上样,用5 mL 水清洗一次,再用3 mL 60%(体积分数,下同)甲醇水溶液洗脱,收集洗脱液于15 mL离心管中,用60%甲醇水溶液稀释至5.0 mL,混匀,经0.45 μm尼龙滤膜过滤,作为样品溶液。
同法制备空白对照溶液(除不用明胶空心胶囊样品外,其余操作同样品溶液制备方法)。
1.5 测定方法
取苯甲酸、山梨酸系列混合标准工作溶液和样品溶液,按照1.3色谱条件进样分析,记录色谱峰面积,按外标法计算明胶空心胶囊中苯甲酸和山梨酸的含量。
2 结果与讨论
2.1 提取方法及浸提溶剂选择
明胶空心胶囊主要原料明胶属于蛋白类物质(骨胶或皮肤),为水溶性蛋白。样品预处理方法中苯甲酸、山梨酸的提取大多数为水提取。参考文献[20-21],采用水浸提,选用亚铁氰化钾溶液和乙酸锌溶液为蛋白沉淀剂。
通过样品加标的方法分别考察加入等量甲醇、等量乙醚的提取效果。结果表明,加入等量甲醇提取率虽然高,但是杂质多,对检测目标物干扰大,不利于准确定量,同时检测时间较长且容易对色谱柱造成污染,降低色谱柱柱效;加入等量乙醚提取,虽然杂质少,但是乙醚不仅挥发性大,对环境不友好,而且在提取过程中容易出现乳化,目标物损失较多。故样品第一步提取选择直接用水浸提,不需要进行反向提取。
样品经水浸提后,对蛋白沉淀剂的加入体积进行考察。结果表明,沉淀剂的加入体积分别为1、2、3、4、5 mL 时,沉淀物的湿重呈增加趋势,增重差约为1 g,表明当沉淀剂加入体积为5 mL时,样品溶液中蛋白质并未充分沉淀。当沉淀剂的加入体积为1 mL时,离心后上清液难以通过C18固相萃取小柱;而当沉淀剂的加入体积不小于2 mL时,离心后的上清液可以顺利通过C18固相萃取小柱。出于节约试剂考虑,选择蛋白沉淀剂加入体积为2 mL。
分别考察离心后的上清液不调节pH和调节pH至3~4 后过C18固相萃取小柱苯甲酸、山梨酸的回收率。结果表明,苯甲酸的回收率分别为79.4%和98.2%,山梨酸的回收率分别为83.7%和86.0%,上清液调节pH 至3~4 后再过C18固相萃取小柱的回收率明显更高,所以离心后的上清液调节pH至3~4后再过C18固相萃取小柱。
考察不同体积分数的甲醇水溶液洗脱时苯甲酸和山梨酸的回收率,结果见表1。由表1 可知,当甲醇体积分数为50%~80%时,苯甲酸和山梨酸的回收率为90%~110%,综合考虑苯甲酸、山梨酸高浓度时的洗脱效果,最终选择体积分数为60%的甲醇水溶液作为洗脱液。

表1 不同体积分数的甲醇水溶液洗脱时苯甲酸、山梨酸的回收率Tab.1 Recovery rates of benzoic acid and sorbic acid during washing with methanol aqueous solutions of different volume fractions %
2.2 色谱条件选择
2.2.1 检测波长
采用高效液相色谱-二极管阵列检测器对苯甲酸、山梨酸混合标准工作溶液于200~400 nm 范围内进行全波长光谱扫描,光谱图如图1和图2所示。由图1 和图2 可以看出,苯甲酸的最大吸收波长为228 nm,山梨酸的最大吸收波长为254 nm,为了同时检测苯甲酸和山梨酸,参考GB 5009.28—2016《食品安全国家标准 食品中苯甲酸、山梨酸和糖精钠的测定》,选择检测波长为230 nm。在此波长处苯甲酸、山梨酸均有较高吸收值,灵敏度较高。
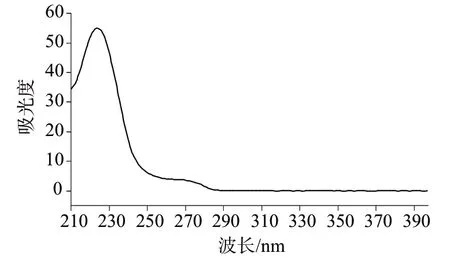
图1 苯甲酸光谱图Fig.1 Spectrogram of benzoic acid

图2 山梨酸光谱图Fig.2 Spectrogram of sorbic acid
2.2.2 色谱柱选择
分别选择Agilent Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm)、Agilent Zorbax SB-Aq 柱(250 mm×4.6 mm,5 μm)和Waters Atlanntis® T3 柱(250 mm×4.6 mm,5 μm)进行试验。结果表明,3 种色谱柱对苯甲酸、山梨酸均有良好的分离效果,且峰形尖锐对称,其中Agilent Zorbax SB-Aq 色谱柱保留时间最短,分析时间最短。此外Agilent Zorbax SB-Aq 色谱柱属于水相柱,具有亲水性的表面,即使使用水为流动相,也可以有效地防止固定相的塌陷,适用于难分离的酸性、碱性和极性化合物,其保留作用比C18色谱柱强,故选择Agilent Zorbax SB-Aq 色谱柱(250 mm×4.6 mm,5 μm)作为分析柱。
2.2.3 流动相选择
以苯甲酸、山梨酸混合标准溶液、加标样品溶液为待测溶液,考察2 mmol/L甲酸-20 mmol/L乙酸铵混合溶液与甲醇的体积比分别为95∶5、90∶10、85∶15 共3 种不同流动相的分离效果。结果表明,在3种不同流动相下,苯甲酸、山梨酸混合标准溶液的色谱峰分离度均大于1.5;当2 mmol/L甲酸-20 mmol/L乙酸铵混合溶液与甲醇的体积比为90∶10 时,加标样品溶液中苯甲酸、山梨酸与其相邻杂质峰的分离度均不小于1.5,且该流动相系统分析时间相对较短,所以最终选择以2 mmol/L甲酸-20 mmol/L乙酸铵混合溶液与甲醇的体积比为90∶10作为流动相。
2.2.4 其它色谱条件
柱温、流量、进样体积参考GB 5009.28—2016选择,苯甲酸、山梨酸均能够实现有效分离,且峰形良好。
2.3 专属性试验
分别吸取空白对照溶液、混合标准溶液及阳性样品溶液,按1.2色谱条件进行测定,色谱图分别如图3~图5 所示。图3~图5 结果表明,空白对照溶液无干扰,样品溶液中苯甲酸、山梨酸的保留时间分别约为6.0 min 和9.8 min,与混合标准溶液中苯甲酸、山梨酸的保留时间一致,两组分峰形良好,分离效果良好,表明该方法专属性良好。
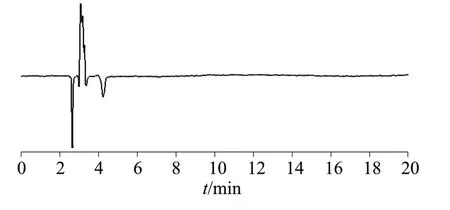
图3 空白对照溶液色谱图Fig.3 Chromatogram of blank control solution
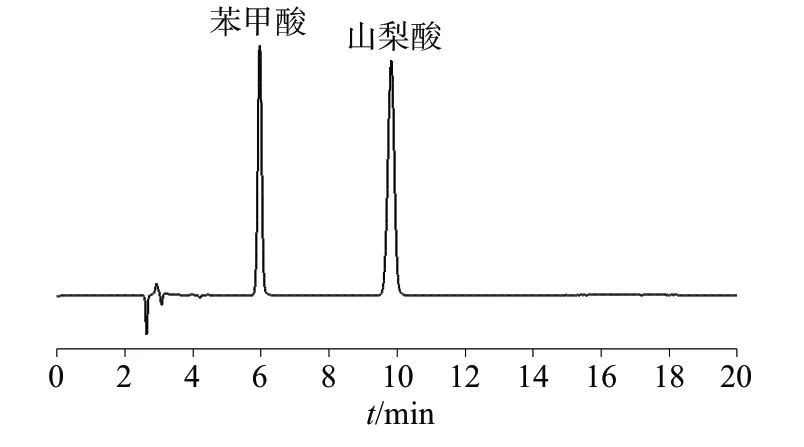
图4 混合标准溶液色谱图Fig.4 Chromatogram of mixed standard solution

图5 阳性样品溶液色谱图Fig.5 Chromatogram of positive sample solution
2.4 线性方程与检出限、定量限
按照1.2色谱条件分别测定苯甲酸、山梨酸系列混合标准工作溶液,以溶液的质量浓度为横坐标(x),以色谱峰面积为纵坐标(y),绘制标准工作曲线,计算线性方程和相关系数。
称取阴性样品2 份,每份约0.5 g,精密称定,分别加入苯甲酸、山梨酸混合标准中间溶液10、20 μL,按1.4 方法制备样品溶液,在1.2 色谱条件下测定,按取样质量为0.5 g,稀释体积为20 mL,以3 倍信噪比计算各组分的方法检出限,以10倍信噪比计算各组分的定量限。
苯甲酸、山梨酸质量浓度线性范围、线性方程、相关系数、检出限及定量限见表2。由表2 可知,苯甲酸、山梨酸的质量浓度在0~50 mg/L范围内与色谱峰面积线性关系良好,相关系数均大于0.999。
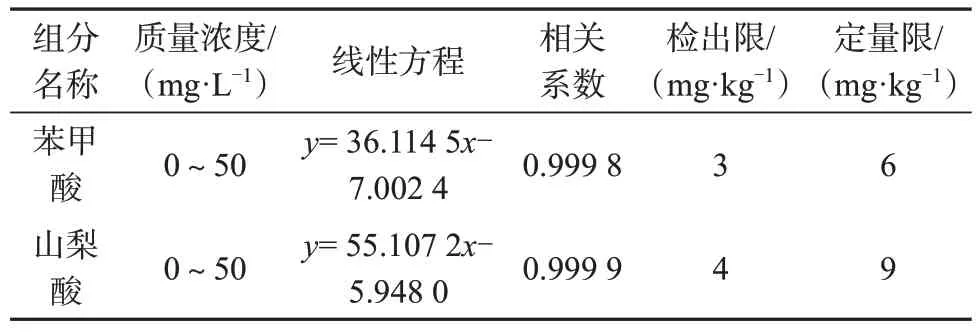
表2 质量浓度线性范围、线性方程、相关系数、检出限及定量限Tab.2 Linear range of mass concentration, linear equation,correlation coefficient,detection limit and quantification limit
2.5 精密度试验
取阳性样品6份,各0.5 g,精密称定,按照1.4方法制备样品溶液,在1.2色谱条件下分别测定,结果见表3。由表3 可知,苯甲酸、山梨酸测定结果的相对标准偏差分别为1.9%、2.2%,表明该方法精密度良好。
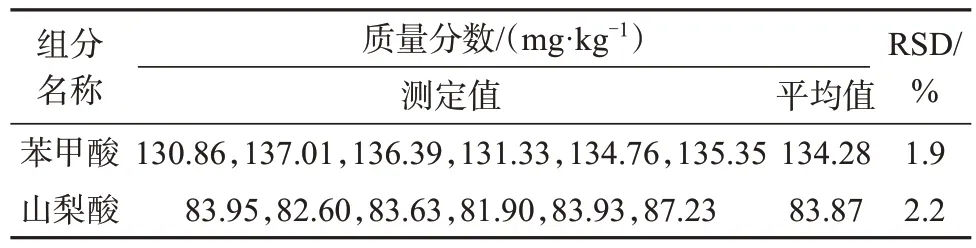
表3 精密度试验结果Tab.3 Precision test results
2.6 稳定性试验
取苯甲酸、山梨酸的质量浓度均为10 mg/L 的混合标准溶液,分别于配制完成后第0、2、4、8、16、24 h 进行测定,结果见表4。由表4 可知,两组分色谱峰峰面积测定结果的相对标准偏差分别为0.10%、0.22%,表明溶液在24 h内稳定性良好。

表4 稳定性试验结果Tab.4 Stability test results
2.7 加标回收试验
精密称取明胶空心胶囊9 份,每份0.5 g,置于50 mL聚四氟乙烯具塞离心管中,分别加入苯甲酸、山梨酸混合标准中间溶液0.5、1、4 mL,然后加入水至10 mL,按1.4方法制备加标样品溶液,在1.2色谱条件下测定,每种质量浓度的溶液平行测定3份,结果见表5。由表5 可知,苯甲酸加标平均回收率为101.3%~106.1%,山梨酸加标平均回收率为92.4%~96.0%,表明该方法具有较高的准确度,满足实际样品测定要求。加标样品溶液色谱图如图6所示。

图6 加标样品溶液色谱图Fig.6 Chromatogram of spiked sample solution
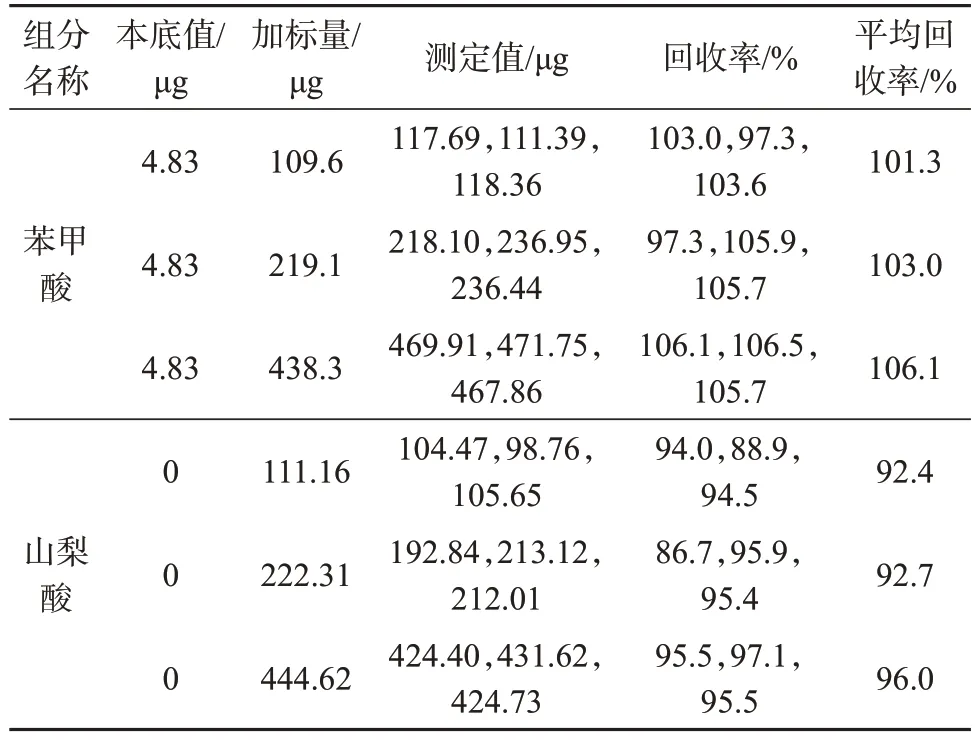
表5 样品加标回收率试验结果Tab.5 Sample addition recovery test results
3 结语
建立了高效液相色谱法同时测定明胶空心胶囊中苯甲酸盐(以苯甲酸计)、山梨酸盐(以山梨酸计)含量的检测方法。该方法专属性强,操作简便,灵敏度和准确度高,精密度良好,可用于明胶空心胶囊中除药典工艺防腐剂环氧乙烷、氯乙醇、对羟基苯甲酸酯类以外的防腐剂苯甲酸和山梨酸的测定。该方法补充了明胶空心胶囊在防腐剂质量控制方面的不足,可为药用辅料明胶空心胶囊的质量控制提供技术参考,也可为市场监管监测苯甲酸盐和山梨酸盐在明胶空心胶囊中的使用提供检测技术支持。
