神经内镜下基底节区脑出血手术治疗临床研究*
2024-02-20熊方令刘保华刘厚强朱宗锦张怀兵高明明
熊方令,刘保华,刘厚强,朱宗锦,张怀兵,高明明,袁 璞
南京鼓楼集团宿迁医院神经外科·徐州医科大学附属宿迁医院神经外科,江苏 宿迁 223800
高血压脑出血是神经外科的常见病、多发病,其致残致死率极高,前期临床研究表明,血肿去除可减轻脑出血(ICH)后的原发性和继发性脑损伤。尽管MisTie 试验没有证明总体结果的益处,但证明了有效减少血肿负担的益处[1]。综合目前的临床试验[2-3],深部血肿开颅清除以及穿刺手术均存在不足的情况下,一方面,产生的循证医学证据无法得出更高级别的建议,对治疗没有明显的推动作用;另一方面,大量的患者使得我们还要继续对幕上深部高血压脑出血进行分层细化,在现有条件下,探索治疗方案,以期找到一种措施,使得至少一部分患者从治疗中获益。微创神经内镜下ICH 清除可能为血肿清除提供另一种选择。本研究总结分析2019 年3 月—2021 年9 月样本医院收治的31例基底节区脑出血经内镜下手术治疗的患者与同期常规开颅显微镜下手术的38例患者的临床资料,探讨分析神经内镜在基底节区出血中应用效果及优势。现将结果报告如下。
1 资料与方法
1.1 临床资料
患者一般临床资料见表1。所有患者均有高血压病史,以头痛、意识不清、恶心呕吐及肢体偏瘫等为主要临床表现;均通过头颅CT 检查提示基底节区出血;采用多田公式计算出血量30~100 mL;术前格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分均≤12 分。排除标准:头部CT 血管造影(CTA)显示有血管畸形或动脉瘤者;伴有严重心肺功能、肝肾功能障碍者;严重凝血功能障碍者;孕产妇。按采用手术方式的不同将患者分为神经内镜下血肿清除组(内镜组)及显微镜下常规骨瓣开颅血肿清除组(显微组),患者的性别、年龄、合并症、术前血压、GCS 评分、术前合并症、术前出血量、术前时间、是否服用抗凝剂及抗血小板制剂等具有可比性(P>0.05)。本研究经医院伦理委员会审批。
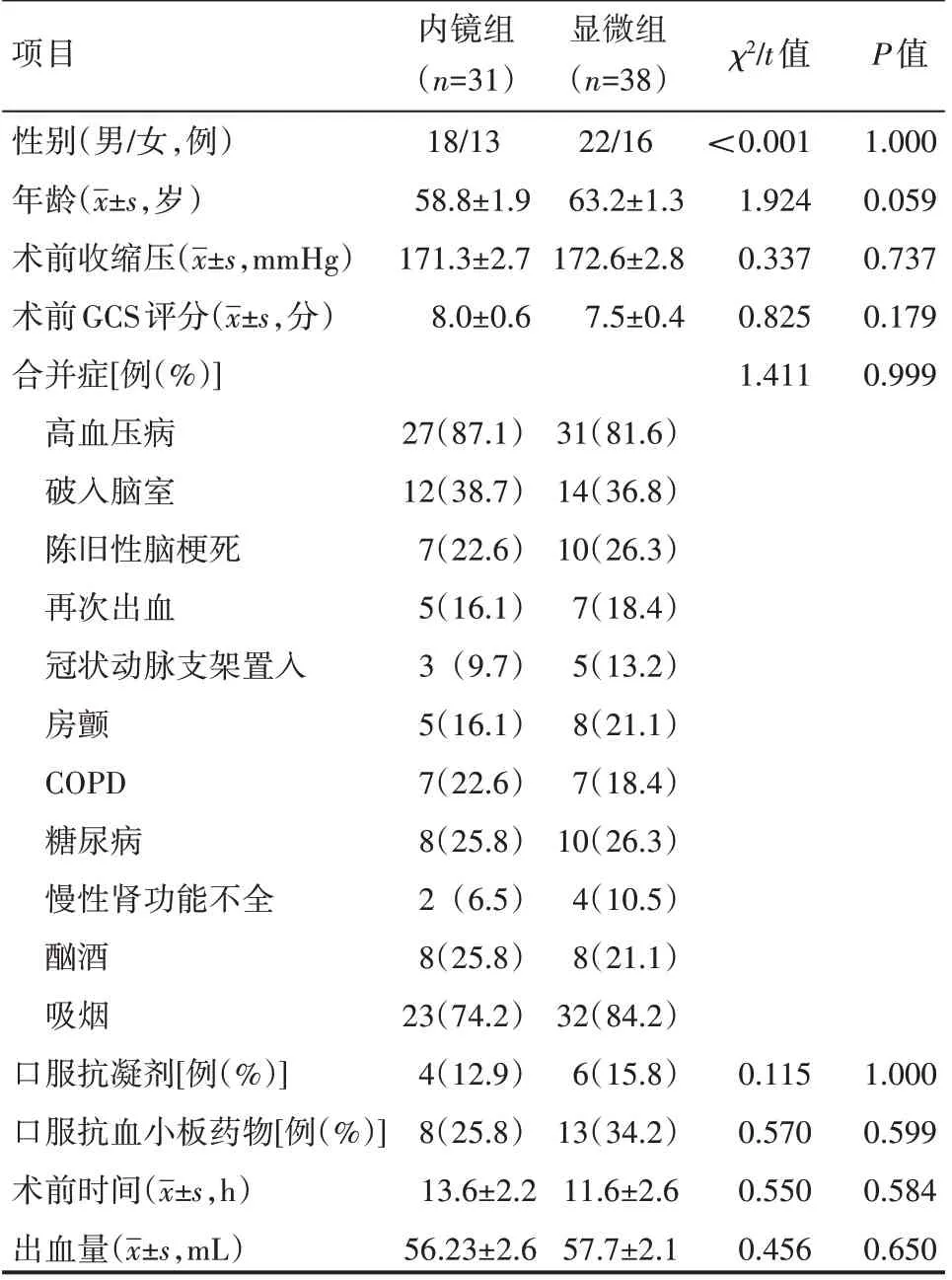
表1 患者临床资料
1.2 方法
1.2.1 手术方法 内镜组(图1A、B)使用全身麻醉,并在额部冠状缝前作弧形切口,长约6 cm,旁开中线的宽度由血肿位置及其长轴决定(图1C、D)。小骨瓣开颅(直径约3 cm),经额中回入路(图1E),皮质切开约1 cm,向术前根据头颅CT 定位血肿方向置入神经内镜鞘筒,采用德国STORZ 公司0°神经内镜系统清除血肿(图1F),必要时使用支架将内镜固定在其保护套上,可以用双手来清除血肿,满意止血。修补缝合硬膜,还纳骨瓣妥善固定(图1G),必要时皮下引流。术前存在脑疝者作标准大骨瓣手术切口术后去骨瓣减压。

图1 内镜组患者术前术中及术后情况
显微组经翼点或扩大翼点入路切口,长约15~25 cm,颅骨钻孔铣下骨瓣,显微镜下经侧裂-岛叶进入血肿腔,镜下止血后复位骨瓣,术前脑疝者去骨瓣减压。
1.2.2 围手术期管理 术前头颅CTA 检查以筛查与出血相关的血管病变,术后第1 d、出血后第4 d 的CT 以及如果患者仍在医院的第7 d 的头胸部CT。术后24 h 内收缩压维持在140 mmHg(1 mmHg=0.133 kPa)以下,以减少术后再出血的可能性。此外,对所有患者进行早期主动或被动肢体活动、积极撤离呼吸机、早期气管切开、日常言语和吞咽评估以及早期胃肠管放置。
1.2.3 疗效评价 比较两组患者手术时间、出血量、残余血肿量、术后第7 d GCS 评分,术后14 d 内术区再出血、颅内感染、肺部感染、气管切开、消化道出血、癫痫等并发症的发生率。术后半年内采用电话、门诊等方式进行随访,主要是对生活能力进行评价,按照ADL分级评价患者的预后[4]。
1.3 统计学方法
采用GraphPad Prism 5 软件进行分析。计数资料采用Fisher’s 精确概率法和χ2检验,计量资料以均数±标准差(±s) 表示,组间比较分别采用t检验、One-way ANOVA。以P<0.05为有统计学意义。
2 结果
2.1 两组患者术中术后情况
内镜组术中时间较显微组短,差异有统计学意义(P<0.05);术中出血量内镜组较显微组明显减少,差异有统计学意义(P<0.05);术后血肿残余量内镜组与显微组比较,差异无统计学意义(P>0.05);术后第7 d GCS 评分内镜组较显微组高,差异有统计学意义(P<0.05),见表2。
表2 两组患者术中术后情况(±s)
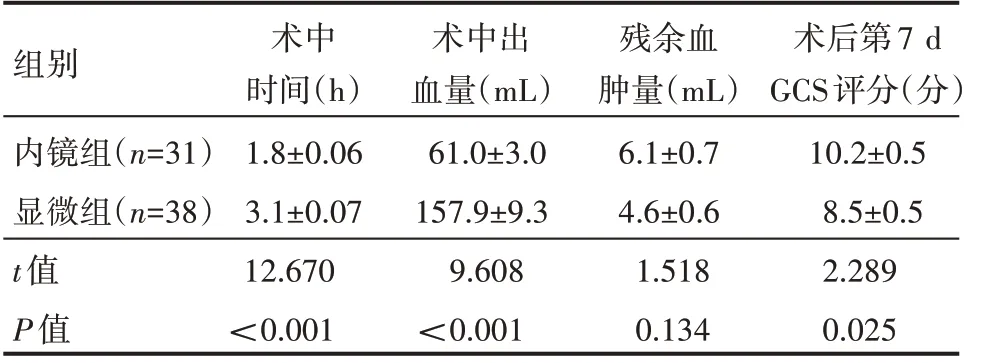
表2 两组患者术中术后情况(±s)
组别内镜组(n=31)显微组(n=38)t值P值术中时间(h)1.8±0.06 3.1±0.07 12.670<0.001术中出血量(mL)61.0±3.0 157.9±9.3 9.608<0.001残余血肿量(mL)6.1±0.7 4.6±0.6 1.518 0.134术后第7 d GCS评分(分10.2±0.5 8.5±0.5 2.289 0.025
2.2 两组患者术后并发症情况
如表3 所示,术后再出血、颅内感染、癫痫方面内镜组与显微组比较,差异无统计学意义(P>0.05);肺部感染患者显微组多于内镜组,差异无统计学意义(P>0.05);气管切开、消化道出血方面内镜组与显微组比较,差异有统计学意义(P<0.05)。

表3 两组患者术后并发症情况例
2.3 两组患者预后情况
术后随访半年,内镜组预后较显微组佳,差异有统计学意义(P<0.05);预后良好率(Ⅰ~Ⅲ级)内镜组较显微组高,差异有统计学意义(P<0.05);两组死亡率比较,差异无统计学意义(P>0.05)。
3 讨论
ICH 仍然是最具破坏性和最难治疗的中风形式。30 d死亡率约为40%,只有20% 的幸存者在6 个月时能回归社会[5-6]。临床试验研究了各种内科和外科治疗方法,以改善自发性ICH 患者的预后,均未证明这些方法有效[2-3]。但血肿对神经细胞的影响巨大,包括血肿压迫脑内结构和脑细胞,产生占位效应,升高颅内压,导致相应脑区血流量下降,甚至发生脑疝,危及生命。为了降低占位效应产生的脑损伤,神经外科医生试图通过外科干预清除血肿从而降低死亡率以及改善神经功能预后。脑内出血手术试验(STICH)和STICH Ⅱ试验评估了采用传统开颅手术清除血肿,但这两项研究均未显示出优于药物治疗的结论[7-8]。随着新方法的使用,包括立体定向穿刺尿激酶血肿腔注射溶解血肿以及神经内镜的应用,血肿清除方法不断发展。最近的一项随机临床试验的荟萃分析证明了ICH 微创血肿清除的整体益处[9]。
神经内镜下清除基底节血肿的安全性及有效性均得到广大神经外科医师的认可,与开颅手术相比,其在清除血肿方面更安全、更有效[10];与需要开颅手术的显微方法相比,内镜治疗促进了更早的功能恢复[11];与置管引流及尿激酶注射相比,它能更有效地清除血肿[10]。与接受立体定向手术的患者相比,接受内镜手术的患者血肿清除率更高,功能和神经学结果更好,并发症和死亡率更低[10]。与药物治疗组相比,内镜组的预后更好,生存机会更高,生活质量有改善的趋势[12]。我们能在神经内镜下清除绝大部分血肿,而手术本身不会对大脑功能区造成显著损害。神经内镜下血肿清除术符合精准神经外科理念即功能保护基础上最大程度切除病变。与开颅相比,内镜手术深部创伤小,平行于传导束进入血肿腔,训练有素的术者术中副损伤小;同穿刺相比,内镜直视下清除血肿,血肿清除率高,有助于迅速减压。术中发现出血可以迅速止血。
神经内镜下清除基底节血肿能够有效地控制出血,缩短手术时间。神经内镜实现了适当的可视化和良好的放大率。由于鞘管的透明性质,可以很好地看到周围的脑组织和血肿。大部分情况下不需要双极电凝止血,若有活动性出血,使用双极电凝和固定臂双手技术可以很好地控制出血血管。加之术中流体明胶可以直接应用于血肿腔壁起到迅速止血的作用,缩短手术时间[13],影响神经内镜应用的另一个重要因素就是术后血肿残留,本研究结果发现内镜组患者术后血肿残留量与显微组没有明显差别,说明这种术后可能存在的少量血肿残留对患者整体预后影响不大。
在大多数情况下,我们使用额中回入路。根据术前神经影像学评估为每位患者量身定制手术路径。沿血肿长轴进入,完全在血肿腔内操作,避免损伤白质纤维束,对正常大脑的损伤小。由于对皮质和白质纤维束的破坏小,因此比传统开颅手术技术更具优势[14]。同样也有经眉弓入路,沿血肿长轴清除血肿,这些技术已证明是安全有效的[15-16]。选择合适的患者可能更有助于神经内镜在基底节区脑出血中的应用,我们认为血肿形态边缘较光滑者比较合适,相反,对于边缘较毛糙或有多个出血灶者,内镜下手术需谨慎。对于出血部位不典型者需要排除脑血管性疾病。
