营养小肽对黄金鲫生长、血清生化和抗氧化能力的影响
2024-02-20胡贺,陈鹏,万兵,袁化
胡 贺,陈 鹏,万 兵,袁 化
(1.江苏福润德科技有限公司,江苏南京 210036;2.南京农业大学,江苏南京 210036;3.大连海洋大学,辽宁大连 116023)
黄金鲫(Carassius auratus)是我国传统淡水鲤鲫鱼类的杂交品种,具有较好的杂种优势。生长速度快、适应性强、饲料转化率高,是农业农村部向全国推广养殖的淡水养殖品种。小肽是一类由蛋白质水解,易被生物体消化吸收,具有多种生物活性的小分子物质(SHEN,2019)。随着动物营养学研究的不断深入,人们认识到小肽能以完整形式被肠道吸收进入血液循环,用于机体蛋白质的合成,具有促进养殖动物生长,提高抗氧化能力和非特异性免疫功能的作用(敬庭森等,2021;马良骁,2021;李晨晨等,2018)。本试验以黄金鲫为试验动物,探讨营养小肽对养殖黄金鲫生长、血清生化和抗氧化能力的影响,以期为完善营养小肽作为饲料添加剂的理论研究提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 基础饲料 基础饲料为混养鱼配合饲料(盐城海大生物饲料有限公司),产品符合《鱼用配合饲料》标准(Q/320924 YCHO 001-2021)。产品成分分析执行标准为《饲料检测结果判定的允许误差》。检测指标含量:粗蛋白质≥28.0%,粗脂肪≥2.5%,赖氨酸≥1.35%,水分≤12.2%,粗纤维≤11.5%,粗灰分≤15.0%,总磷≥0.7%。
1.1.2 营养小肽 试验用营养小肽由江苏福润德科技有限公司提供,商品名为天乐泰。部分检测指标含量:粗纤维0.9%,粗脂肪1.5%,粗蛋白质4.3%,酸溶蛋白(占总蛋白)33.5%,水苏糖和棉子糖均未检出,活菌数乳杆菌22.6×107CFU/g,酵母1.02×107CFU/g,芽孢杆菌105CFU/g,pH=3.5。
1.1.3 检测试剂 血清生化检测仪器和试剂为罗氏cobas C311全自动生化分析仪。抗氧化能力检测试剂盒均由南京建成生物工程研究所提供。
1.2 方法
1.2.1 饲养管理 试验在江苏省东台市弶港镇养殖区进行,试验A1和A2组为2个平行组,养殖面积为53360 m2和56695 m2。对照组养殖面积57362 m2。放养黄金鲫鱼种平均质量为50 g/尾,放养量2000尾/667 m2。鱼种放养7 d后开始投喂饲料,对照组饲喂基础饲料,试验组饲喂添加2.0%天乐泰的饲料。
每天投饵前用自来水(静置24 h)将天乐泰充分溶解,在基础饲料中均匀喷涂,待表面干燥后投喂。投饵量按鱼体重2.0%~3.0%计算。每天投饵4次,投喂时间为7:00、10:00、13:30和16:30。养殖期间水温为26~33℃,溶氧为3.5~8.3 mg/L,pH为8.5~8.8。
1.2.2 生长评估 饲养黄金鲫52、128 d,试验组和对照组随机抽样检测各10尾,进行体质量和体长检测。通过增重率(WGR)和特定生长率(SGR)进行生长情况评估。
WGR/%=[(终末体重—初始体重)/初始体重]×100;
SGR/%=[(ln平均末体重-ln平均初体重)/养殖天数]×100。
1.2.3 血清制备 投饵养殖黄金鲫52、128 d时,试验组和对照组随机取5尾,一次性注射器尾静脉取血(无抗凝剂),4℃静置24 h后2500 r/min,-5℃离心5 min,取上层血清,-20℃保存,备用。
1.2.4 血清生化检测 对养殖128 d黄金鲫进行血清总蛋白(TP2)、白蛋白(ALB2)和脂肪酶(LIPC)检测。
1.2.5 血清抗氧化性能检测 对养殖52 d和128 d黄金鲫进行血清总超氧化物歧化酶(T-SOD)活性、氧化氢酶(CAT)活力、谷胱甘肽过氧化物酶(GSH-PX)活力、总抗氧化能力(T-AOC)、丙二醛(MDA)和一氧化氮(NO)含量检测。
1.2.6 数据统计与分析 试验数据用Excel软件进行整理,采用GraphPad prism 8.0软件进行单因素方差分析(one-way ANOVA)和t检验(T-test),结果以“平均值±标准差”表示。P<0.01表示差异极显著,0.01<P<0.05表示差异显著,P>0.05表示无显著差异。
2 结果
2.1 对生长性能的影响 由表1可知,养殖52 d和128 d,试验组黄金鲫体质量、体长、WGR和SGR检测结果均大于对照组,且养殖52 d,试验组间、试验组与对照组间均无显著差异(P>0.05)。养殖128 d,试验组间无显著差异(P>0.05),试验组与对照组显著差异(0.01<P<0.05)。
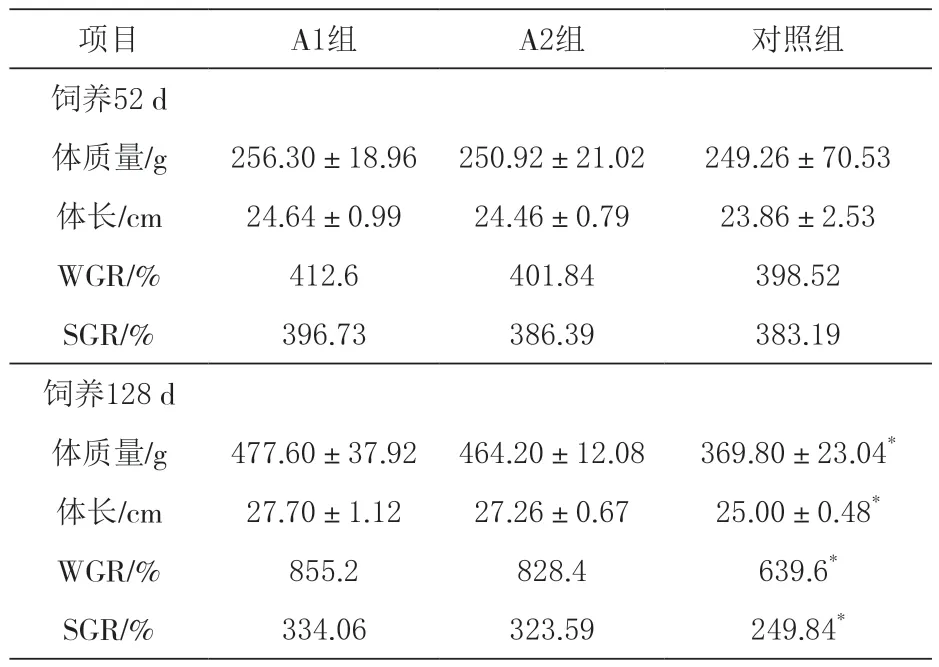
表1 营养小肽对黄金鲫生长性能的影响
2.2 对血清生化指标的影响 由表2可知,投喂营养小肽养殖128 d的黄金鲫,试验组血清总蛋白、白蛋白和脂肪酶均高于对照组,A1组血清总蛋白和白蛋白与对照组差异极显著(P<0.01),A2组与对照组相比无显著差异(P>0.05),试验组间无显著差异(P>0.05)。试验组血清脂肪酶与对照组相比无显著差异,试验组间也无显著差异(P>0.05)。

表2 营养小肽对黄金鲫血液生化指标的影响
2.3 对血清抗氧化指标的影响
2.3.1 对血清T-SOD活力的影响 由表3可知,养殖52 d,对照组血清T-SOD活性高于试验组。饲养126 d,试验组T-SOD活性均高于对照组。随着投喂时间的增加,A1组提高了14.94%,A2组提高了1.50%,对照组降低了13.70%,但均无显著差异(P>0.05)。
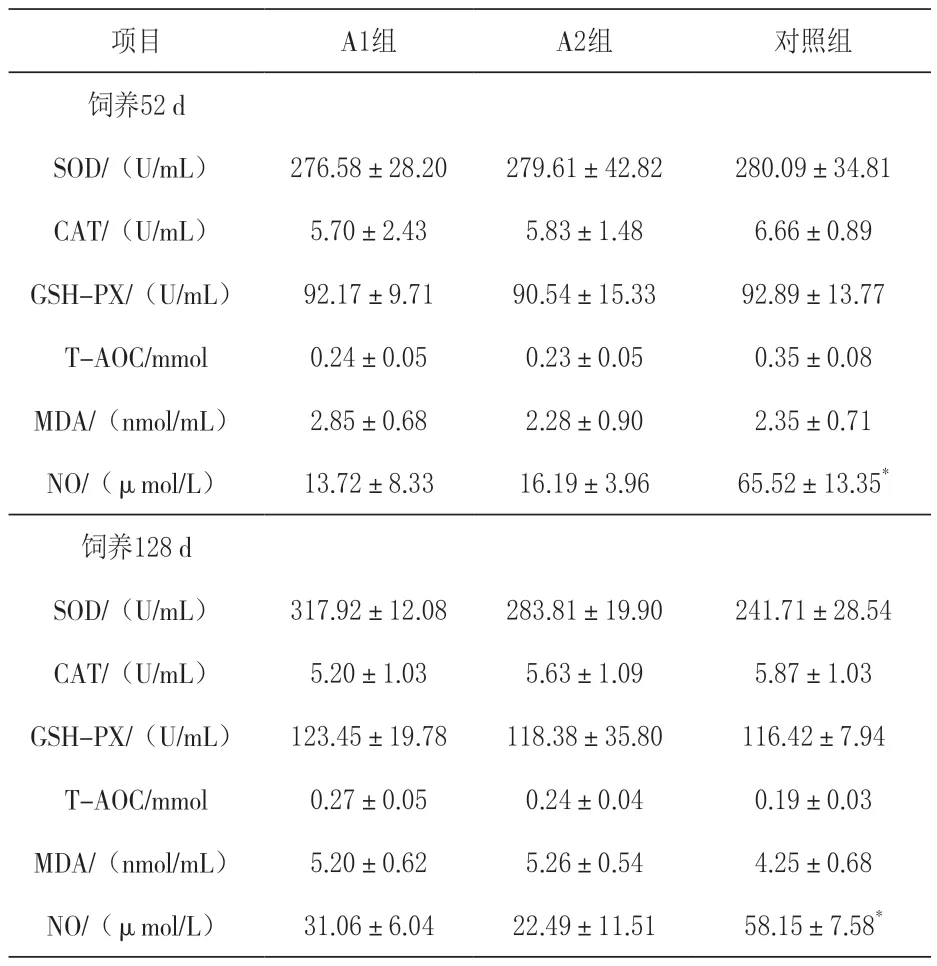
表3 营养小肽对黄金鲫血清抗氧化指标的影响
2.3.2 对血清CAT活力的影响 由表3可知,养殖52 d和126 d,对照组血清CAT活力均高于试验组随着投喂时间的增加,对照组降低了11.86%,试验组(A1和A2)分别降低了8.77%和3.43%,但均无显著差异(P>0.05)。
2.3.3 对血清GSH-PX活力的影响 由表3可知,养殖52 d,对照组血清GSH-PX活力略高于试验组。饲养126 d,试验组GSH-PX活力均高于对照组。随着投喂时间的增加,对照组提高25.33%,试验组(A1和A2)分别提高33.94%和30.75%,但均无显著差异(P>0.05)。
2.3.4 对血清T-AOC能力的影响 养殖52 d,对照组血清T-AOC能力高于试验组。饲养126 d,试验组均高于对照组(表1)。随着投喂时间的增加,对照组降低了45.71%,试验组(A1和A2)分别提高了12.5%和4.35%。单因素方差分析和t检验显示,均无显著差异(P>0.05)。
2.3.5 对血清MDA含量的影响 由表3可知,饲养52 d,A1组血清MDA含量大于对照组,A2组小于对照组。饲养126 d,试验组均大于对照组。随着投喂时间的增加,对照组提高80.85%,试验组(A1和A2)分别提高了45.19%和56.65%,但均无显著差异(P>0.05)。
2.3.6 对血清NO含量的影响 由表3可知,饲养52 d和126 d,对照组血清NO含量均高于试验组。随着投喂时间的增加,对照组降低了11.25%,试验组(A1和A2)分别提高了126.38%和38.91%,且试验组(A1和A2)与对照组均有极显著差异(P<0.01),试验组间无显著差异(P>0.05)。
3 讨论
3.1 营养小肽对黄金鲫生长的影响 营养小肽具有提高养殖动物饵料转化率,促进养殖动物生长和提高生产性能等作用(马良骁,2021;甘晖,2005)。用营养小肽饲养黄金鲫,试验组体质量、体长、增重率和特定生长率均高于对照组。在饲料中添加2%营养小肽对黄金鲫生长有一定的促进作用。
3.2 营养小肽对黄金鲫血清生化的影响 鱼类的血液与营养状况密切相关,不仅反映鱼类的生理代谢状态,还表现出营养对机体代谢变化的作用机制。血清总蛋白是反映动物营养水平、对蛋白质的消化程度以及健康状况的指标(黄林等,2009;尾崎久雄,1982)。检测数据分析,血清总蛋白含量试验组为(28.26±1.37)g/L和(25.54±3.41)g/L,对照组(25.20±0.92)g/L,均低硬骨鱼类血清总蛋白含量30~50 g/L范围(尾崎久雄,1982)。由于黄金鲫生长速度高于普通鲫2~3倍,基础饲料28%的粗蛋白质和2%的营养小肽添加量,没有满足35%饲料蛋白的需求量(程镇燕等,2013)。天乐泰作为饲料添加剂,对不同的基础饲料和养殖鱼类的添加量还有待深入研究。脂肪酶的活性与饵料中的脂肪含量呈正相关(李成等,2018;孙翰昌等,2010;李芹等,2009)。试验组血清脂肪酶略高于与对照组,多重比较无显著差异(P>0.05),反映了黄金鲫的脂质代谢状况良好,处于健康水平。
3.2 营养小肽对黄金鲫抗氧化性能的影响 养殖动物机体的抗氧化能力与健康程度存在密切联系。大量研究表明,在饲料中添加一定量的营养小肽具有促进养殖水生动物生长,提高抗氧化能力和非特异性免疫的功能(李文成等,2021;Ighodaro,2018;林浩然,1999)。血清T-SOD、CAT和GSH-Px是主要的内源性抗氧化酶,共同作用来保护机体免受氧化应激产生的损伤,对机体的氧化与抗氧化平衡具有重要作用(Halliwell,2012)。
饲料中添加营养小肽,随着养殖时间的增加,试验组血清T-SOD和GSH-PX活性提高,反映出机体清除自由基能力和细胞防御能力增强。CAT活力降低,显示试验组抗氧化酶活性有一定提高,提高了机体的抗氧化能力。试验结果与何吉祥等(2012)的研究结果一致。
T-AOC是衡量机体抗氧化功能的综合性指标,反映了酶促和非酶促两个防御体系协同防护鱼体的抗氧化能力。随着投喂营养小肽时间的增加,试验组分别提高了12.5%和4.35%(P>0.05),对照组降低了45.71%(P>0.05)。表现出黄金鲫机体抗氧化能力的增强,而且T-AOC能力与细胞抗氧化能力正相关,与机体脂质过氧化负相关。
MDA是体内自由基作用于脂肪发生过氧化反应的氧化终产物,其含量反映了机体细胞中氧自由基含量及受自由基攻击的严重程度(林浩然,1999)。随着投喂营养小肽时间的增加,试验组分别提高了45.19%和56.65%(P>0.05),对照组提高了80.85%(P>0.05)。MDA含量的升高表明黄金鲫体内产生了过多的氧自由基,生物膜系统受到氧自由基的攻击是否产生脂质过氧化还有待进一步扩大样本检测。
NO具有高度活跃的属性,能与多种自由基和金属离子发生反应,在免疫调节等方面具有十分重要的生物学作用。饲养52 d时,对照组高于试验组,饲养126 d时,试验组高于对照组(P<0.01)。对照组降低了11.25%,试验组分别提高了126.38%和38.91%。营养小肽中富含乳酸杆菌和芽孢杆菌,是影响试验组血清NO含量显著升高的主要原因,也是NO对脂质过氧化和组织器官保护作用的表现。朱宏友(2006)报道,NO可以增强水产动物自身抗病能力,减少抗菌药物的使用。但NO也可影响肝细胞蛋白质合成和能量代谢(钟慈声等,1977)。因此,NO对水产动物生理生化及代谢特征影响的研究具有重要的理论研究价值和应用前景。
营养活性小肽进入机体后主要发挥营养功能和生理调节功能。不同的小肽制品其生产工艺和营养成分不同,同时添加量的作用效果与养殖动物对小肽的最适量有关。作为一种新型的绿色营养添加剂应用于水生动物养殖,还需要进一步探讨营养小肽的添加剂量、添加周期和添加方式等,使其在鱼类不同的生长阶段和生理状态下充分发挥作用。
