外泌体在肝内胆管癌中的作用
2024-02-19唐晋元杨陈凤麟梁冬乐罗雨豪
唐晋元,杨陈凤麟,梁冬乐,罗雨豪
1 西南医科大学附属医院肿瘤科,四川 泸州 646000
2 廊坊市人民医院肿瘤科,河北 廊坊 065000
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是一种具有胆管细胞分化特征的胆管上皮恶性肿瘤,占所有类型原发性肝癌的10%~15%。ICC 恶性程度极高,其5 年生存率低于10%[1]。由于缺乏典型的症状和体征,早期ICC 很难通过常规筛查明确诊断。外泌体是细胞分泌到体液中的特殊囊泡,含有DNA、RNA、蛋白质和脂质等多种物质。外泌体将核酸或蛋白质递送至不同细胞,是细胞间通讯的重要介质。ICC 具有特定的外泌体表达谱,在肿瘤发生进展中起重要作用,具有潜在的肿瘤诊疗价值[2]。
1 ICC的发生发展
1.1 基因驱动促进ICC ICC 在基因组水平上具有高度异质性,这为个性化的靶向治疗开辟了新的机会。DNA测序研究表明多个基因以及信号通路参与了ICC的发生发展(图1)。FGFR融合以及TP53、KRAS、IDH1/2和BAP1突变是ICC 中最常见的改变。其中,KRAS 和IDH1/2 的突变发生在基因的易突变点G12A/C/D、R132C/G/L,而TP53的突变则发生在整个基因上。值得注意的是,一项全外显子组测序研究[3]表明,FGFR2 融合定义了ICC 的独特亚型。综合基因组研究[4-5]发现基因突变与ICC 患者预后相关。在3 个独立的患者队列中,TP53 或KRAS的肿瘤突变与ICC 手术切除后较低的总生存期(OS)相关,与IDH突变患者或这3个基因无突变的患者相比,肿瘤复发率更高[6]。大多数ICC是体细胞突变,然而,一部分患者(5%~10%)在BRCA1/2、ATM 或BAP1 中存在种系突变,这可能导致胆管癌[7-8]。
ICC发生的危险因素复杂,研究发现肿瘤病因可能影响癌基因相关突变。基因组测序显示,与肝吸虫阴性ICC相比,肝吸虫相关ICC 与体细胞突变数量增加之间存在关联[9]。TP53突变和ERBB2扩增是肝吸虫相关ICC中的主要基因组改变,而BAP1 和IDH1/2 在非肝吸虫相关病例中经常发生突变[10-11]。同样,TP53 缺陷的胆管癌与HBV显著相关[6]。ICC基因组的多样性反映了对不同肿瘤类别的个性化治疗的需求,对将来根据患者的基因突变谱进行肿瘤诊断和精准靶向治疗有着重要临床意义。
1.2 炎症和免疫失调介导ICC ICC 的分子发病机制见图2。慢性炎症是ICC 的危险因素。长期的胆道损伤、炎症应激和胆汁淤积后,大量的促炎因子、细胞生长因子和有毒胆汁酸会引起正常胆管细胞发生有丝分裂,进而导致肿瘤相关突变的积累和不受控制的细胞增殖产生。癌细胞和肿瘤基质之间的相互作用激活肿瘤细胞中TGF-β 信号通路、血管内皮生长因子(VEGF)信号通路、Wnt信号通路、IL-6/STAT3信号通路等多种信号通路,介导癌细胞存活、增殖、迁移、免疫细胞浸润、免疫抑制微环境形成、微卫星不稳定性、细胞外基质重塑和淋巴管生成,进而支持ICC 的发生发展。综合转录组学分析表明ICC 存在两个不同的生物亚类:炎症亚型(38%),主要以激活免疫相关信号通路为特征;以及增殖亚型(62%),这与OS减少有关,主要富集于经典致癌途径,如丝分裂原激活蛋白激酶(MAPK)、受体酪氨酸激酶和MET信号通路,以及KRAS突变增加[12]。

图2 ICC的分子发病机制Figure 2 Molecular pathogenesis of cholangiocarcinoma
2 外泌体简介
外泌体为直径40~100 nm细胞外囊泡,密度为1.13~1.19 g/mL,具有经典的“杯状”或“皿状”形态,其在大小、形态、组成等多个方面与其他细胞外囊泡存在差异(表1)。外泌体可携带参与细胞间信号通讯的多种分子(如蛋白质、脂质、DNA和RNA)[13]。蛋白质可分为结构蛋白和作为标记的特异蛋白,如CD9、CD63、CD81 和CD82 等[14]。核酸包括miRNA、DNA、mRNA、lncRNA等。外泌体可以由不同细胞释放,也可从多种体液中分离出来,如血浆[15]、尿液、支气管肺泡灌洗液[16]、唾液、母乳、羊水、腹水等。研究[17-19]表明外泌体核酸可被转运到受体细胞产生生理或病理效应,并介导细胞通讯、免疫反应、细胞迁移、细胞分化、肿瘤侵袭和血管生成在内的多种生物学行为。外泌体被认为在肿瘤的诊断和治疗中发挥着重要作用,参与ICC发生发展、侵袭及预后的各个环节。

表1 外泌体与其他传统细胞外囊泡的区别Table 1 Differences between exosomes and other traditional extracellular vesicles
3 外泌体在ICC中的诊断价值
3.1 外泌体蛋白在ICC 中的诊断价值 外泌体特异性蛋白可作为ICC 诊断的生物标志物。有研究[20]表明,热休克蛋白90(HSP90)在侵入性ICC细胞外泌体中差异磷酸化,随着肿瘤分期增加,HSP90B-S255位点磷酸化水平显著降低,提示HSP90 有望作为预测ICC 转移的生物学标志物。Ikeda 等[21]通过蛋白质组学分析发现,CLDN3在人胆汁来源的外泌体中富集,外泌体CLDN3对胆汁衍生型ICC预测的敏感度为87.5%,特异度为87.5%,提示其可能是ICC 的有效生物预测标志物。Arbelaiz 等[22]研究发现,表皮生长因子受体、黏蛋白1和整合素β4在ICC外泌体中高度富集,促进肿瘤细胞的生长、去分化、侵袭及迁移,并与不良结局相关。其中整合素β4 还能特异性预测肿瘤转移位置,以上结果表明外泌体蛋白在促进ICC细胞生长和转移过程中具有潜在的关键作用。
3.2 外泌体核酸在ICC中的诊断价值 外泌体中的核酸包括miRNA、lncRNA、circRNA等,研究发现其可能在ICC诊断中发挥重要价值。有文献[23]报道,外泌体中miR-200 家族中的4 个miRNA(miR-141-3p、miR-200a-3p、miR-200b-3p和miR-200c-3p)诊断ICC的受试者工作特征曲线下面积比传统肿瘤标志物CA19-9更高,被认为是ICC 潜在的新型诊断生物标志物。并且外泌体中miR-200a/c-3p的表达与ICC淋巴结转移和肿瘤分期之间存在显著正相关。Han等[24]和Gao等[25]的研究显示,抑制miR-10a可以通过下调PI3K-AKT途径来抑制胆管癌,研究中PI3K-AKT途径在胆汁外泌体中显著富集,因此胆汁外泌体中的miR-10a-5p 可以是潜在的诊断生物标志物,同时可作为个体化治疗靶点。此外,据报道[26],lncRNA NEAT1 在ICC 组织和细胞中过表达,通过与miR-186-5p 直接相互作用,促进ICC细胞生长、迁移和侵袭。在Sun等[27]的研究中,ICC 细胞中的lncRNA SNHG3 显著上调,通过miR-3173-5p/ERG 轴促进胆管癌进展。circRNA 是近年来新发现的非编码RNA,有文献[28]报道,circRNA Hsa_circ_0050898在ICC中显著上调,作为miR-424-5p的分子海绵以及与YBX1相互作用转录激活FZD7来促进ICC增殖和转移,是ICC的潜在预后标志物和治疗靶点。
4 外泌体参与ICC的发生发展
有研究[29-30]指出,癌细胞衍生的外泌体可以通过多种机制调节肿瘤进展。外泌体参与缺氧微环境的调控、新生血管的形成及免疫逃逸等过程,进而加速肿瘤的发生发展(图3)。
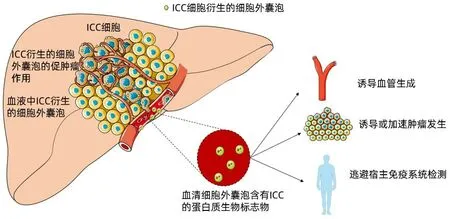
图3 ICC源性外泌体调节肿瘤进展的机制Figure 3 ICC derived exosomes can regulate tumor progression through a variety of mechanisms
4.1 外泌体促进ICC增殖转移 在Li等[31]研究中,肝癌肿瘤细胞通过分泌富含Shh蛋白的外泌体,激活Hedgehog信号通路促进细胞生长,而通过shRNA 降低Shh 表达水平时,肿瘤细胞源性的外泌体则失去相关功能,证明外泌体携带的Shh 是激活肝癌细胞中Hedgehog 信号通路的主要信号分子。
4.2 外泌体调控肿瘤微环境 Wang等[32]研究显示,缺氧本身会诱导炎性分子的增加,如IL-6、IL-1、TNF-α 和IL-10 等。另外,HSP70 激活NF-κB 信号后,间充质干细胞分泌大量的趋化因子CCL-2、CCL-7、CCL-12,增加微环境中的炎性因子浓度,促使单核细胞、巨噬细胞在肿瘤部位聚集和极化,塑造肿瘤免疫抑制环境[33-34]。
4.3 外泌体调控ICC 血管生成 有文献[35]报道,缺氧条件下肿瘤外泌体增加的同时诱导血管形成。肿瘤来源的外泌体本身富含TGF-β 以及VEGF,可以直接诱导肿瘤血管内皮迁移和增殖。同时,肿瘤细胞分泌的含有miR-205 的外泌体通过卵巢癌PTEN/AKT 途径诱导血管生成[36]。在癌症的情况下,富含可溶性E-钙黏蛋白的外泌体是血管生成的有效刺激物,可能与卵巢癌患者恶性腹水的形成和广泛的腹膜转移有关[37]。
4.4 外泌体介导ICC 免疫逃逸 研究[38]显示,肿瘤进展的另一个关键步骤是逃避宿主免疫系统监视,缺氧诱导的肿瘤外泌体在CSF-1、MCP-1 和TGF-β 等趋化因子和细胞因子中均丰富,可通过影响巨噬细胞募集和极化来改变宿主免疫微环境,增强肿瘤进展。Zhang[39]等研究发现,Circ-UHRF1存在于肝癌患者分泌的血浆外泌体中,通过循环UHRF1/miR-449c-5p/TIM-3 轴抑制自然杀伤细胞活性。除了外泌体中含有的成分外,它们的外部分子PD-L1 可以通过与PD-1 表面的直接结合来抑制T淋巴细胞、B淋巴细胞和单核细胞的免疫功能,以促进肿瘤免疫逃逸[40]。最近的研究[40-41]表明,来自癌细胞的外泌体也表达PD-L1,因此表达PD-L1 的外泌体也能损害免疫功能并促进肿瘤生长。
5 外泌体在ICC中的治疗价值
5.1 外泌体作为药物输送载体治疗ICC Moon等[42]研究显示,外泌体是理想的药物输送载体,外泌体具有组织特异性高、安全性好和稳定性好的特点。它们具有磷脂双分子层,可以直接与靶细胞的质膜融合,进而将药物靶向递送到肿瘤血管和肿瘤细胞中,从而发挥抗肿瘤作用。有基础和临床研究[43]表明,当药物加载到外泌体进行抗肿瘤治疗时,抗癌药物可以比仅单纯静脉给药时更有效地递送。
5.2 外泌体影响ICC 和肿瘤相关成纤维细胞(cancer associated fibroblasts,CAF)的相互作用 有文献[44-46]报道,CAF 在激活胆管癌细胞和控制癌症生长、侵袭和耐药性方面具有旁分泌功能(图4),CAF 通过旁分泌途径与ICC 细胞相互通信,介导癌症生长和侵袭,并获得对化疗药物(如吉西他滨)的耐药性[47]。Yang 等[48]将miR-206模拟物转染到肿瘤细胞或CAF中,IL-6和TGF-β1表达降低。ICC 细胞与CAF 之间的相互促进作用减弱,恶性肿瘤被抑制,表明miR-206 可用作抑制肿瘤生长和提高吉西他滨治疗效率的药物。Ota 等[49]研究发现,包含miR-30e 的外泌体可以通过靶向胆管癌细胞中的Snail来抑制TGF-β 诱导上皮间充质转化的侵袭和迁移。因此,miR-30e有可能成为一种肿瘤抑制基因,并且可能是人类ICC 的潜在治疗靶点。在肿瘤微环境中使用外泌体包裹的miR-30e靶向上皮间充质转化的治疗手段可能是晚期胆管癌患者的重要治疗方法。

图4 外泌体在ICC与CAF细胞通信中的作用Figure 4 Effects of exosomes on the interaction between ICC and CAF cells
6 小结及展望
综上所述,外泌体是肿瘤诊断的新型生物标志物,代表了一个热门的新兴研究领域。外泌体源性蛋白及miRNA 在ICC 诊断及治疗中发挥重要作用,ICC 患者早期外泌体源性蛋白、miRNA 含量及表达谱区别于健康人,且不同病因、病理类型及不同疾病间存在表达谱的差异,因此使用多种外泌体生物标志物可能可以预测早期ICC。同时,外泌体作为生物源性载体,具有兼容性好、安全性好、稳定性高等特点,基于外泌体的给药系统研发可能对未来肿瘤的治疗发挥重要作用。综上,外泌体在ICC 诊断、治疗和预后判断方面开辟了新的途径,具有重要临床价值。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:唐晋元负责课题设计与论文撰写;杨陈凤麟、梁冬乐负责绘制表格与图片;罗雨豪负责思路设计,文章修改和最后定稿。
