胰腺导管腺癌行腹腔镜下胰十二指肠切除术后早期复发的列线图模型及其预测价值分析
2024-02-19刘亚辉
刘 舜,谢 诚,刘亚辉
吉林大学第一医院普通外科中心肝胆胰外二科,长春 130021
胰腺癌是全球癌症相关死亡的主要原因之一[1],胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是胰腺癌的主要类型。目前,PDAC 已成为美国癌症相关死亡的第三大原因[2]。PDAC 的早期症状通常是非特异性的,因此大多数PDAC 患者确诊时肿瘤已不可切除或发生转移[3-4]。对于PDAC 患者,手术切除是唯一能够提供长期生存的根治性治疗,但只有约20%的患者可施行手术治疗[5]。而在接受手术切除的患者中,5年生存率仅为15%~25%[6]。PDAC患者切除术后的早期复发是影响患者术后生存率的重要因素[7]。据报道[8-10],胰腺癌术后中位复发时间为10~12个月。因此,有效预测PDAC术后早期复发,尽早采取针对性治疗措施,对于患者预后至关重要。胰十二指肠切除术(pancreaticoduodenectomy,PD)是治疗胰腺癌的标准术式,目前基于快速康复理念,腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)逐渐增多。与PD 手术相比,LPD 具有创伤更小,术后恢复更快等优势,因此在国内外广泛开展,但探究PDAC 患者行LPD 术后的早期复发影响因素的相关研究仍然较少。本研究对行 LPD 的PDAC 患者进行分析总结,探究术后肿瘤早期复发的危险因素并构建早期复发预测模型。
1 资料与方法
1.1 研究对象 回顾性收集2016 年4 月—2022 年7 月于吉林大学第一医院行LPD且术后病理为PDAC的患者的临床资料。纳入标准:(1)术后病理确诊为PDAC,术前未合并其他恶性肿瘤,可以耐受麻醉且术前未接受过针对PDAC 的各类新辅助治疗。(2)术前增强CT 或MRI、PET-CT 提示,未发现肿瘤存在远处转移。术前经血管三维重建评估肿瘤与周围脏器解剖关系,预计病变可以完整切除的病例(肿瘤未侵犯腹主动脉、肠系膜上动脉和肝总动脉,或肿瘤未侵犯肠系膜上静脉或门静脉,或侵犯范围≤180°但无静脉边缘不规则)[11]。(3)手术由同一术者完成。(4)患者术中快速病理与术后病理需满足R0切除。(5)术后患者遵医嘱进行影像检查和/或实验室检查形式的复查,密切随访。排除标准:(1)未遵医嘱复查者;(2)未能按计划实施LPD 者(如术中转为开腹手术或改行姑息性手术);(3)临床病理资料、随访资料存在缺失者;(4)围术期死亡患者:指患者在术后90 d 内死亡或在第一次住院期间死亡。
1.2 手术方式及围术期管理 所有患者均由同一手术团队完成,均采用“后入路、钩突先行、动脉优先”手术入路方式[12]。消化道的吻合重建采用Child 吻合方式,胰肠吻合的重建采用改良双荷包胰肠吻合方式,并分别于胰肠、胆肠吻合口旁及肠系膜上静脉旁各留置1 枚引流管。术后所有患者均给予抑酸,抑酶,抗炎,补液,补充白蛋白等对症治疗。
1.3 观察指标(1)术前资料:年龄、性别、BMI、CA19-9、CA125、术前血清总胆红素水平、是否患有高血压、是否患有糖尿病、上腹部手术史、术前是否行胆道引流、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级。(2)术中临床资料:术中失血量、术中输血情况、胰腺质地、胰管直径。(3)术后临床资料:胰瘘、胆瘘、腹腔感染、肺部感染、延迟性胃瘫、术后出血发生情况、术后辅助化疗。(4)病理学资料:肿瘤最大直径、分化程度、是否存在淋巴结转移、肿瘤是否有神经浸润或脉管浸润。所有患者术中均未行血管切除吻合重建。术后出血[13]、胆瘘、延迟性胃瘫等并发症的定义及分级均依据相应的指南[14-16]。腹腔感染参考《胰腺术后外科常见并发症诊治及预防的专家共识(2017)》[17]诊断标准。目前,术后肺部感染判定标准尚未统一,本研究依照《医院感染诊断标准(试行)》[18]及Clavien-Dindo分级[19]将肺部感染定义为:患者术后出现咳嗽、咳痰症状,影像学检查提示肺部感染征象,实验室检查结果显示白细胞计数明显升高,和/或痰培养明确病原菌。依据《胰腺术后外科常见并发症诊治及预防的专家共识(2017)》[17]将术后胰瘘定义为:术后≥3 d 任意量的引流液中淀粉酶浓度高于正常血清淀粉酶浓度上限3倍以上。
1.4 术后随访 通过门诊进行随访,患者前12 个月每3 个月复查一次,随后每6~12 个月复查一次。在每次门诊复查时,患者均行一次腹部和胸部CT、血常规、肝功能、肿瘤标志物等检查,CT 平扫结果提示可疑复发时均行腹部/胸部增强CT确认病灶情况。本研究随访以肿瘤出现早期复发为终点事件。目前国内外针对PDAC术后早期复发并无统一标准,参考相关研究[20-24],本研究将PDAC 早期复发定义为:行 LPD 且术后病理回报为PDAC 的患者,术后规律复查过程中,通过影像检查和/或实验室检查证实的手术区域新发(恶性)病变或远处转移,自手术后第1日起到确诊复发的时间≤12个月[25]。复发的诊断以影像学检查结果为主,同时参考肿瘤标志物(CA125和CA19-9)和临床表现,当临床症状提示可能存在复发时,即行影像学检查。随访截止日期为2023年8月31日,所有患者术后随访时间均>12个月。
1.5 统计学方法 采用SPSS 26.0 和R 4.1.3 统计软件进行数据分析。计数资料组间比较采用χ2检验或Fisher精确概率法。Logistic 回归分析影响术后早期复发的危险因素。采用受试者工作特征曲线下面积(AUC)评估模型的区分度,AUC>0.75 为该模型有足够的区分度。利用Bootstrap重采样法随机抽样1 000次验证,并利用验证组再次验证。使用校准曲线和Hosmer-Lemeshow 拟合优度检验评估校准度,决策曲线(Decision curve analysis,DCA)评估临床实用性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入240 例患者,采用随机数字表法,按照7∶3比例,分为训练组(n=168)与验证组(n=72)。其中男134 例,女106 例,年龄最大者为79 岁,最小者为27 岁,平均年龄(59.42±9.07)岁,BMI(22.8±2.9)kg/m2。所有患者均顺利完成LPD,术中出血量为(263.29±131.39)mL,淋巴结清扫数目为(20.39±3.58)枚。240例患者术后均获得随访,中位随访时间为17.23(3.10~91.70)个月。随访中,共102例(42.50%)术后早期复发,其中腹腔内复发89例(肝转移62例、术区转移12例、淋巴结转移15 例);腹腔外复发13 例(肺转移10 例,骨转移3例)。训练组术后早期复发70例(41.67%),非早期复发98例(58.33%)。验证组术后早期复发32 例(44.44%),非早期复发40例(55.56%)。两组患者基线数据比较差异均无统计学意义(P值均>0.05)(表1)。
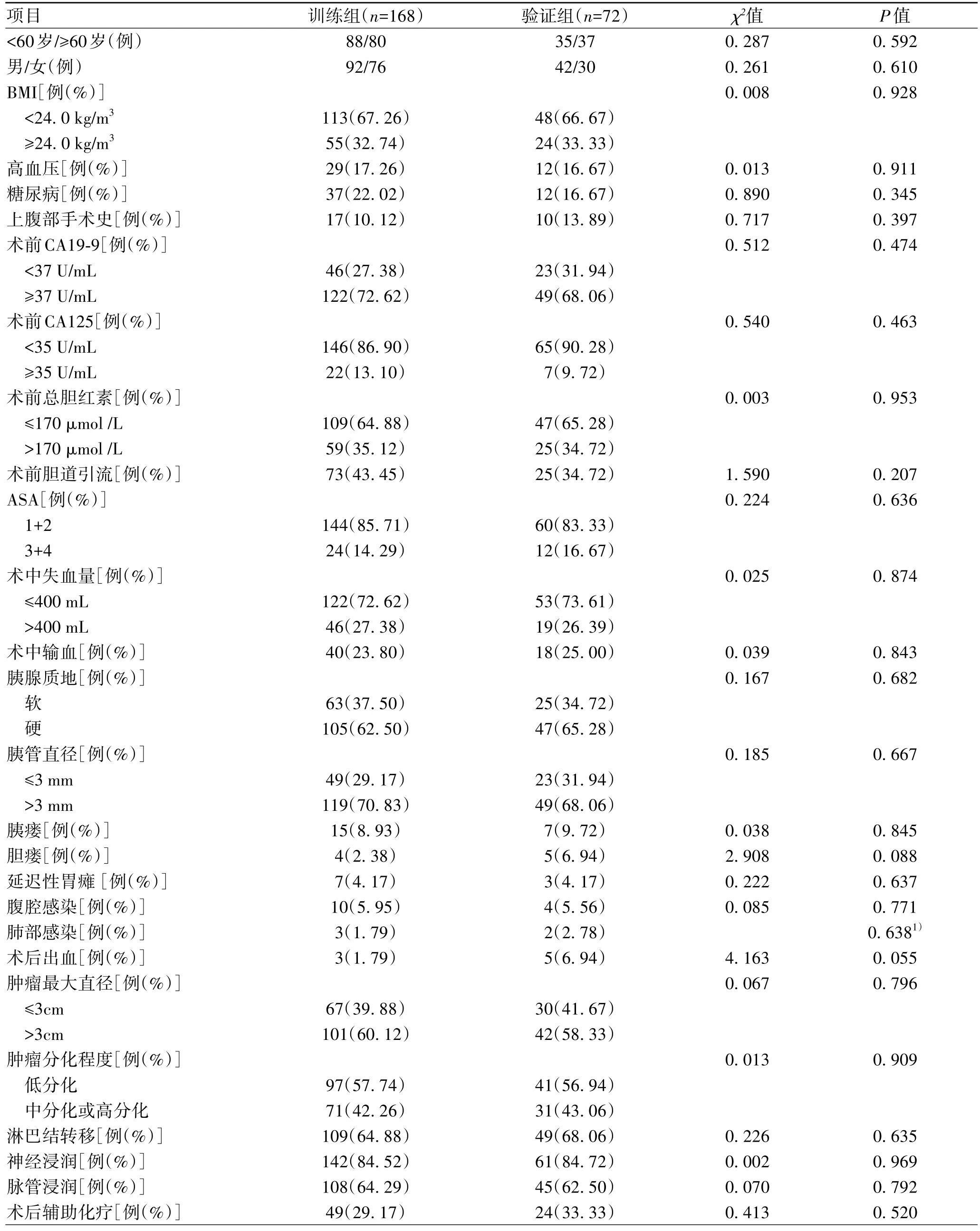
表1 训练组和验证组基线数据特征比较Table 1 Comparison of baseline data characteristics between training group and verification group
2.2 PDAC患者LPD术后早期复发的单因素分析 在训练组中,早期复发组和非早期复发组在术前CA19-9、肿瘤最大直径、肿瘤分化程度、淋巴结转移情况、术后辅助化疗方面比较差异均有统计学意义(P值均<0.05)(表2)。

表2 PDAC患者行LPD术后早期复发单因素分析Table 2 Univariate analysis of early recurrence after radical LPD in PDAC patients
2.3 PDAC患者行LPD术后早期复发多因素分析 基于训练组单因素回归结果进行的多因素分析结果显示:术前CA19-9 水平≥37 U/mL、肿瘤最大直径>3 cm、肿瘤低分化、有淋巴结转移、术后未行辅助化疗是影响PDAC患者行LPD术后早期复发的独立危险因素(P<0.05)(表3)。

表3 PDAC患者行LPD术后早期复发的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of early recurrence after radical LPD in PDAC patients
2.4 建立列线图模型 以术前CA19-9 水平、肿瘤最大直径、肿瘤分化程度、有无淋巴结转移、有无术后辅助化疗为预测因素构建预测PDAC患者行LPD术后早期复发的列线图,其中对预测复发影响最大的因素为肿瘤最大直径(图1)。

图1 预测 PDAC患者行LPD术后早期复发的列线图Figure 1 A nomogram predicting early recurrence after radical LPD with resectable PDAC
2.5 列线图预测价值检验 该列线图模型在训练组中的AUC=0.895(95%CI:0.846~0.943,P<0.001),最佳截断为0.270,学习率参数为0.201,敏感度为92.9%,特异度为73.5%,阳性预测为71.4%,阴性预测值为93.5%,该模型的区分度较好(图2)。Youden指数计算列线图最佳总分截断值为248.894 分,≥248.894 分为早期复发高风险人群,<248.894 分为早期复发低风险人群。验证组预测PDAC 患者发生LPD 术后早期复发的AUC=0.835(95%CI:0.741~0.930,P<0.001),最佳截断为0.270,学习率参数为0.309,敏感度93.8%,特异度70.0%,阳性预测值71.4%,阴性预测值93.3%(图3),表明预测模型准确度良好。
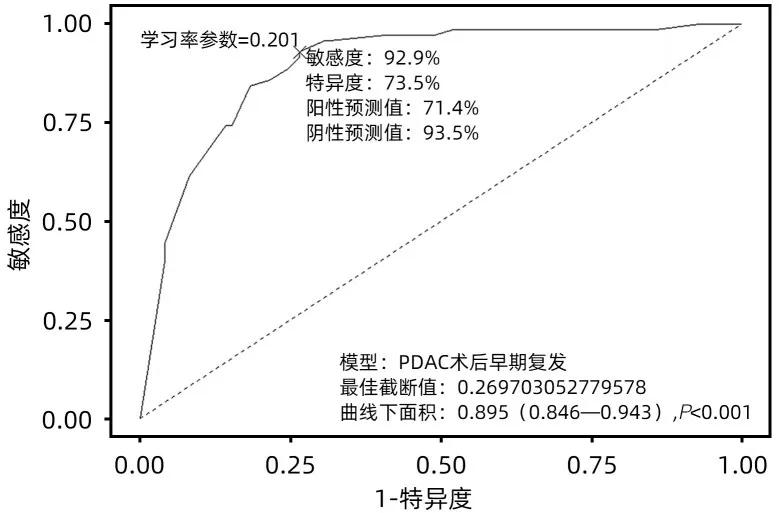
图2 列线图预测 PDAC患者行LPD术后早期复发的ROC曲线(训练组)Figure 2 The nomogram predicts the ROC curve of early recurrence after radical LPD with resectable PDAC(Training group)
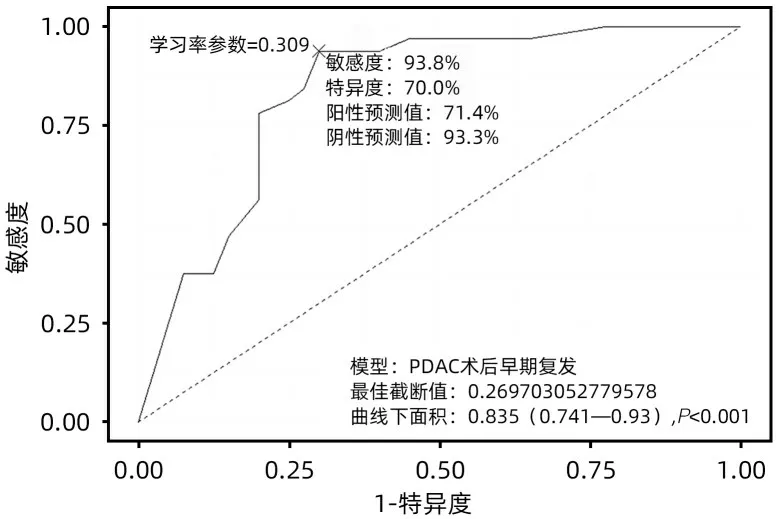
图3 列线图预测 PDAC患者行LPD术后早期复发的ROC曲线(验证组)Figure 3 The nomogram predicts the ROC curve of early recurrence after radical LPD with resectable PDAC(Validation group)
对训练组构建的模型行Hosmer-Lemeshow 检验,结果显示拟合良好(χ2=11.529,P=0.173),验证组Hosmer-Lemeshow 检验结果为(χ2=3.489,P=0.836),利用Bootstrap重采样法随机抽样1 000次对模型进行验证,校准曲线中标准曲线与校准预测曲线基本贴近(图4、5),表明列线图预测的早期复发与实际的早期复发的一致性良好。

图4 PDAC患者行LPD术后早期复发的校准曲线(训练组)Figure 4 Calibration curve for early postoperative recurrence of radical LPD with resectable PDAC(Training group)
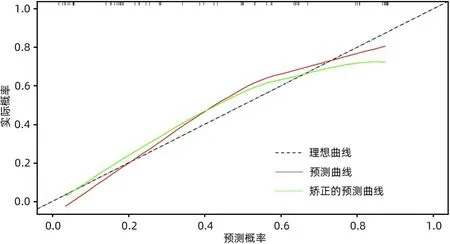
图5 PDAC患者行LPD术后早期复发的校准曲线(验证组)Figure 5 Calibration curve for early postoperative recurrence of radical LPD with resectable PDAC(Validation group)
DCA 分析显示该模型在训练组及验证组中具有明显的正向净收益,表明列线图具有较好的临床应用价值(图6、7)。

图6 PDAC患者行LPD术后早期复发的决策曲线(训练组)Figure 6 Decision curve for early postoperative recurrence of radical LPD with resectable PDAC(Training group)

图7 PDAC患者行LPD术后早期复发的决策曲线(验证组)Figure 7 Decision curve for early postoperative recurrence of radical LPD with resectable PDAC(Validation group)
3 讨论
虽然针对可切除胰腺癌的LPD 技术已经成熟,但术后仍有超过50%的患者出现肿瘤早期复发,严重影响患者术后生存质量[26-31]。
本研究用于构建模型的训练组中,早期复发组患者和非早期复发组患者在年龄、性别、BMI、是否患有高血压、是否患有糖尿病、上腹部手术史、术前总胆红素、术前胆道引流、ASA分级、术前CA125、术中失血量、术中是否输血、胰腺质地、胰管直径、胰瘘、胆瘘、术后腹腔感染、术后肺部感染、延迟性胃瘫、术后出血、肿瘤是否有神经浸润或脉管浸润方面进行比较,其差异均无统计学意义(P>0.05),两组数据均衡可比。单、多因素分析结果显示:术前CA19-9 水平≥37 U/ml、肿瘤最大直径>3 cm、肿瘤低分化、有淋巴结转移、术后未行辅助化疗是影响PDAC患者行LPD术后早期复发的独立危险因素(P<0.05)。
CA19-9 是目前评估胰腺癌最理想的生物标志物和异常糖基化的指标,其在胰腺癌中具有生物标志物、预测因子和启动剂的多重作用[32]。研究[33-37]表明,CA19-9升高提示肿瘤具有较高的恶性生物学行为,是PDAC 术后复发的可靠证据,与本研究结果提示术前CA19-9 水平>37 U/mL 可影响PDAC 早期复发的结论一致。既往研究[38-40]表明,肿瘤大小与肿瘤预后及术后复发关系密切,随着肿瘤体积增大,其侵袭能力及恶性程度也不断增加,术后更易出现复发转移。本研究结论中的肿瘤最大直径>3 cm的患者表现出了更高的早期复发风险,亦支持上述观点,且与Imamura 等[24]的研究结论相符。分化程度更低的肿瘤往往具有更强的侵袭性和转移倾向,低分化的原发肿瘤也被认为是术后复发的独立影响因素[34-41]。本研究表明,肿瘤分化程度越低,早期复发风险越高,与既往研究结论一致。因此,当术后病理报告提示低分化时,应警惕PDAC 术后早期复发可能。淋巴结转移是公认的影响胰腺癌切除预后的重要因素[42],国际胰腺外科研究小组[43]建议胰腺癌根治术中应至少清扫15 枚淋巴结,本研究结论也表明有淋巴结转移的患者术后早期复发风险明显增加,因此术中彻底清扫淋巴结并确认是否存在淋巴结转移对于患者预后极为重要。PDAC 恶性程度高且术后易复发,本研究结果提示根治术后行辅助化疗可有效降低早期复发风险。国内外多部胰腺癌诊治指南[11,44-45]建议根治术后的胰腺癌患者如无禁忌证,均应行辅助化疗,本研究结论一致。
本研究基于以上独立危险因素建立的列线图模型(AUC=0.895,95%CI:0.846~0.943,P<0.001)具有良好的区分度,校准曲线和Hosmer-Lemeshow 检验评估校准度良好,且在训练组及验证组中均具有明显的正向净收益,表明列线图具有较好的临床应用价值,在临床实践中可以综合分析影响患者术后肿瘤早期复发的风险,有助于指导临床医师制订个体化的肿瘤综合治疗方案,预防术后早期复发,改善患者预后。
本研究仍存在一些不足,为单中心回顾性的非随机化研究,研究样本量较小,具有一定局限性,希望后续能够开展大样本量的多中心研究并延长随访时间以进一步验证模型有效性。
伦理学声明:本研究方案于2023 年11 月30 日经由吉林大学第一医院伦理委员会审批,批号:(2023 年)临审第(2023-708)号。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘舜负责设计研究框架、数据收集、统计学分析、起草论文;谢诚负责数据收集、统计学分析、绘制图表;刘亚辉负责拟定写作思路,论文修改,指导撰写文章并最后定稿。
