四烯甲萘醌(MK-4)对CCl4诱导的急性肝损伤小鼠模型的保护作用分析
2024-02-19黄倩倩张佳怡王建青
叶 露,赵 凡,黄倩倩,张佳怡,王建青,
1 安徽医科大学药学院,合肥 230032
2 安徽医科大学第一附属医院药学部,合肥 230012
3 安徽省公共卫生临床中心,合肥 230012
急性肝损伤(acute liver injury,ALI)是由病毒感染、乙醇、毒物等原因引起的肝脏合成、代谢和排泄功能受损,严重时可进展为急性肝衰竭[1]。四氯化碳(CCl4)是典型的肝毒性化合物,广泛应用于诱导ALI的模型研究[2]。
铁死亡作为一种区别于其他细胞死亡形态和生化特征的新型细胞死亡形式[3],其发生机制主要与铁代谢紊乱、氧化系统功能受损和脂质过氧化物聚集有关[4]。Lin 等[5]发现,CCl4诱发小鼠ALI 时会促进肝脏铁死亡,且早在“铁死亡”一词之前,就已有报道维生素K 具有抗氧化作用[6-7],因此Mishima 等[8]通过用维生素K 处理不同种类的谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)缺失肿瘤细胞的研究中发现,维生素K 都可阻止这些细胞死亡,提示维生素K 是一种有效的铁死亡抑制剂,且四烯甲萘醌(menaquinone-4,MK-4)效果最佳,但MK-4是否可应用于ALI中还未可知。因此,该研究探索MK-4保护CCl4诱导的ALI小鼠模型的机制,为临床预防和治疗ALI提供新的思路和方向。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用48 只普通雄性ICR 小鼠,8 周龄,体质量为36~42 g,购买于北京维通利华研究动物技术有限公司,动物生产许可证编号:SCXK(京)2019-0010,实验动物使用许可证编号:SYXK(皖)2020-001。小鼠饲养在适宜的环境中,温度保持在(25±1)℃,湿度保持在(55±5)%,适应性喂养7 d后进行实验操作。
1.1.2 主要试剂 MK-4 购自美国MCE 公司;CCl4购自天津欧博凯化工有限公司;玉米油购自上海阿拉丁生化有限公司;AST、ALT检测试剂盒购自浙江伊利康生物技术有限公司;丙二醛(malondialdehyde,MDA)试剂盒和谷胱甘肽(glutathione,GSH)试剂盒购自上海碧云天生物技术有限公司;组织铁测定试剂盒购自南京建成生物工程研究所;逆转录聚合酶链式反应(RT-PCR)相关试剂购自上海元升生物科技有限公司;研究中引物均由研究室设计并交给江苏睿捷生物有限公司合成,GPX4 抗体购于英国abcam公司。
1.1.3 主要仪器 纯水仪(型号:Merck MILLIPORE QUOTATION)购于美国默克公司;多功能酶标仪(型号:SENERGY2)购于美国伯腾仪器公司;扩增仪(型号:ABI MiniAmp 热循环仪)购于美国赛默飞公司;荧光定量PCR 仪(型号:ABI7500)购于美国赛默飞公司;全自动生化分析仪(型号:CS-T300)购于长春迪瑞医疗科技股份有限公司;高速冷冻离心机(型号:1424)购于珠海黑马医学仪器有限公司,显影仪(型号:5200-multi)购于上海天能科技有限公司。
1.2 方法
1.2.1 实验动物分组 小鼠按照体质量S 形分组分为Control组、MK-4组、CCl4模型组(6、12、24 h)、MK-4+CCl4组(6、12、24 h),使每组小鼠体质量平均值基本一致,每组6只。Control组腹腔注射同等剂量玉米油;MK-4组腹腔注射40 mg/kg 的MK-4 溶液,1 h 后腹腔注射同等剂量玉米油;MK-4+CCl4组(6、12、24 h)先腹腔注射40 mg/kg的MK-4溶液,1 h后和CCl4模型组(6、12、24 h)同时腹腔注射0.3 mL/kg CCl4溶液,分别在6、12、24 h进行取材。
1.2.2 血清生化检测 使用生化分析仪检测血清中ALT、AST含量。
1.2.3 肝脏MDA 含量测定 精密称取30 mg 小鼠肝脏组织,放入细胞裂解液(占组织质量10%)进行匀浆或裂解。匀浆或裂解后,10 000~12 000×g离心10 min,取上清备用。提前配置好后续研究所需试剂,按照试剂盒中提供的说明书进行相关操作,使用酶标仪在532 nm测定吸光度,计算出样品溶液中的MDA 含量后,通过组织质量来表示最初样品中的MDA含量。
1.2.4 肝脏GSH 含量测定 精密称取30 mg 小鼠肝脏组织,加入300 μL 的蛋白去除M 液(用于去除样品中的其他蛋白)充分匀浆后,4 ℃放置10 min 后,10 000×g、4 ℃离心10 min,取上清备用。提前配置好后续研究所需试剂,按照试剂盒中提供的说明书进行相关操作,使用酶标仪在412 nm 处测定吸光度,计算出样品溶液中GSH 含量后,通过组织质量来表示最初样品中的GSH含量。
1.2.5 组织病理学检测 取小鼠新鲜肝大叶置于4%多聚甲醛溶液中,室温放置摇床固定24 h。进行脱水、包埋、切片、固定和苏木精-伊红(HE)染色后显微镜下观察并拍照。
1.2.6 组织铁测定 称取待测小鼠肝脏30 mg,加入270 μL的生理盐水,冰水浴条件机械匀浆,2 500 r/min,离心10 min,取上清液待测。按照说明书加入相关试剂混匀后,沸水浴5 min,流水冷却,3 500 r/min,离心10 min,取上清液200 μL,0.5 cm光径,波长520 nm,测定各管吸光度光密度值。利用说明书中提供的方法进行计算。
1.2.7 普鲁士染色 取小鼠新鲜肝大叶置于4%多聚甲醛溶液中,室温放置摇床固定24 h。常规脱水包埋、切片、脱蜡至水、Perls 染色15~30 min,脱水、透明、封固后于显微镜下观察并拍照。
1.2.8 Western Blot蛋白表达检测 称取50 mg左右的小鼠肝组织,加入500 μL裂解液低温匀浆后静置30 min,离心获取总蛋白,采用酶标仪对蛋白浓度定量。总蛋白经电泳分离再转至PCDF 膜上,采用5%脱脂牛奶封闭1 h,室温孵育一抗1 h(GPX4一抗浓度1∶2 000;GAPDH 一抗浓度1∶5 000),室温孵育对应二抗1 h(GPX4对应二抗浓度1∶50 000;GAPDH 对应二抗浓度1∶10 000)。配制显影液在显影仪上显影,Image Pro 软件分析蛋白条带,计算蛋白表达量。
1.2.9 RT-PCR 检测相关基因 采用TRlzol 法提取肝脏RNA,使用酶标仪将所提取的RNA 样品浓度定量到1 000 ng/μL,逆转录为cDNA 后进行扩增操作。选取18S核糖体RNA(18S ribosomal RNA,18S)为内参基因,计算长链脂酰辅酶A 合成酶4(long-chain acyl-CoA synthetase,ACSL4)、前列腺素内过氧化物酶2(prostaglandinendoperoxide synthase,PTGS2)、GPX4、铁调素调节蛋白(hemojuvelin,HJV)、膜转铁蛋白(ferroportin,FPN)、转铁蛋白受体1(transferrin receptor protein 1,TFR1)和18S 基因的相对表达水平。引物序列如表1所示。

表1 基因的引物序列Table 1 The primer sequence of the gene
1.3 统计学方法 采用SPSS 23.0 软件进行统计分析,计量资料以xˉ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 MK-4 提前干预对CCl4诱导的ALI 小鼠肝质量系数的影响 与Control组比,MK-4组小鼠的肝质量系数差异无统计学意义,CCl4(12、24 h)组肝质量系数增加,差异均有统计学意义(P值均<0.05);与CCl4(12 h)组相比,MK-4+CCl4(12 h)组的肝质量系数下降(P<0.05)(表2)。

表2 各组小鼠肝质量系数比较Table 2 Liver weight coefficient of mice in each group
2.2 MK-4提前干预对CCl4诱导的ALI小鼠肝细胞坏死情况的影响 与Control 组相比,MK-4 组对小鼠肝脏无明显损伤作用,且CCl4(6、12、24 h)组随着CCl4注射时间的延长,小鼠肝组织的炎症浸润区域和坏死面积也随之增加;与CCl4(12 h)组相比,MK-4+CCl4(12 h)组对小鼠肝脏组织中的炎症浸润和组织坏死有一定的改善作用(图1)。

图1 各组小鼠肝脏组织病理变化HEFigure 1 Pathological changes of liver tissue in each group
2.3 MK-4 提前干预对CCl4诱导的ALI 小鼠肝功能的影响 与Control 组相比,MK-4 组对小鼠的肝功能基本无影响,CCl4(6、12、24 h)组的血清ALT、AST水平明显增加,差异均有统计学意义(P值均<0.01);与CCl4(12 h)组相比,MK-4+CCl4(12 h)组的血清ALT、AST 水平下降(P值均<0.05)(表3)。
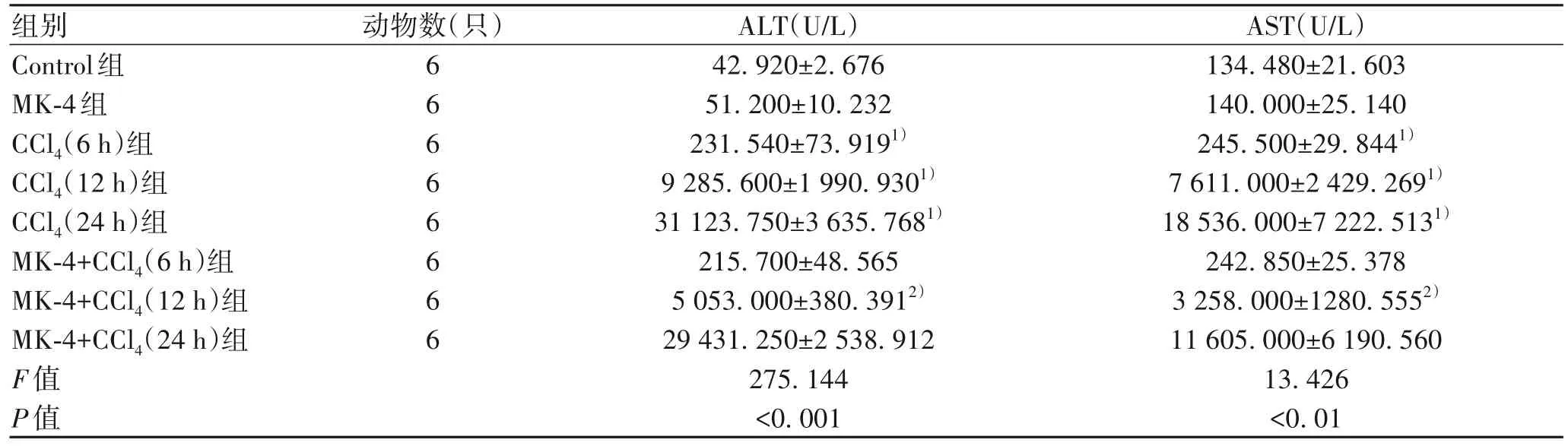
表3 各组小鼠血清中 ALT、AST 水平Table 3 Serum ALT and AST levels of mice in each group
2.4 MK-4提前干预对CCl4诱导的ALI小鼠肝脏中MDA和GSH 水平的影响 ALT、AST、肝质量系数和HE 染色结果均显示出在12 h 时MK-4 预处理可以明显减轻CCl4诱导的ALI,因此后续研究采用12 h的MK-4预处理小鼠肝组织进行检测。如图2 所示,与Control 组相比,MK-4组并不影响肝脏MDA 水平,但CCl4组却有显著增加(P<0.01);与CCl4组相比,MK-4+CCl4组肝脏MDA 水平显著下降(P<0.01);此外,肝脏GSH 水平在采用CCl4进行处理后明显下降(P<0.01);与CCl4组相比,MK-4+CCl4组肝脏GSH水平显著上升(P<0.05)。

图2 各组小鼠肝脏组织MDA及GSH水平Figure 2 MDA and GSH levels in liver tissue of mice in each group
2.5 MK-4提前干预可降低CCl4诱导的ALI小鼠铁死亡相关基因的表达 与Control 组相比,CCl4刺激后,小鼠肝脏组织中铁死亡标志基因ASCL4、PTGS2 的mRNA 水平上升,GPX4的mRNA 水平下降(P值均<0.05);与CCl4组相比,MK-4+CCl4组铁死亡标志基因ASCL4、PTGS2 的mRNA 水平显著下降,GPX4的mRNA 表达上升(P值均<0.05)(图3);CCl4组较Control组,GPX4蛋白表达量下降(P<0.01),但MK-4+CCl4组较模型组,GPX4 蛋白表达量上升(P<0.05)(图4)。

图3 各组小鼠肝脏组织铁死亡相关基因的表达Figure 3 Expression of genes related to ferroptosis in liver tissue of mice in each group
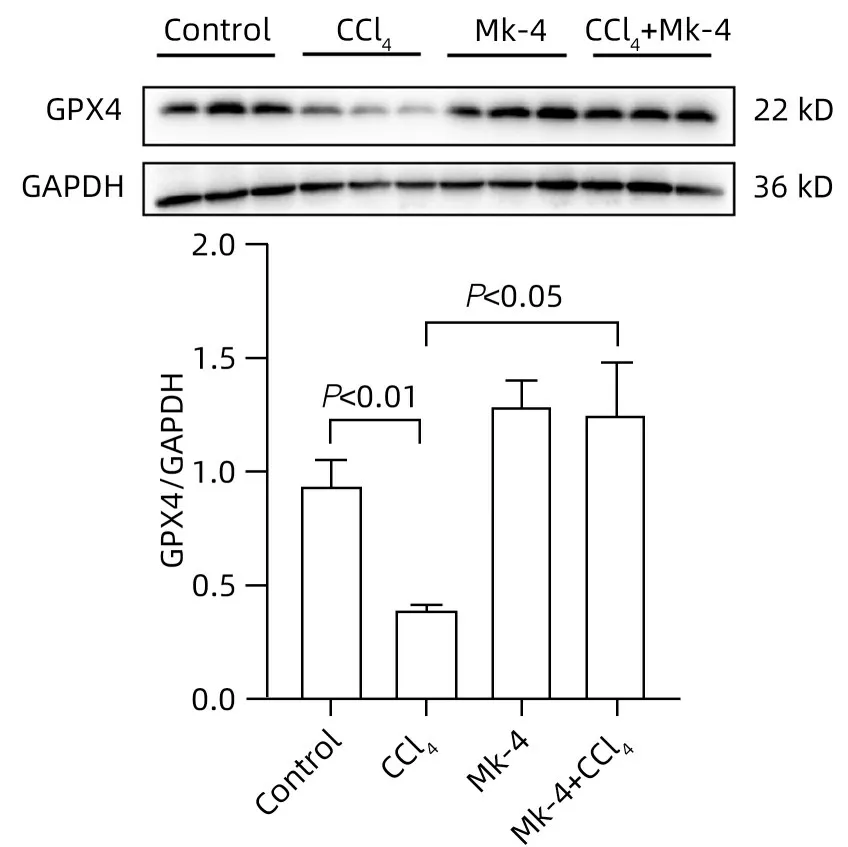
图4 Western Blot检测各组小鼠肝脏组织中GPX4蛋白水平Figure 4 The levels of GPX4 protein in liver tissues of mice in each group were detected by Western Blot
2.6 MK-4组预处理可改善CCl4诱导的ALI小鼠铁代谢紊乱 与Control组相比,CCl4刺激后,小鼠肝脏中铁聚集颗粒明显增多,给予MK-4干预后,与CCl4组相比,铁聚集下降(图5)。与Control 组相比,CCl4刺激后,小鼠肝脏中铁浓度显著升高(P<0.01),给予MK-4 干预后,与CCl4组相比,铁浓度下降(P<0.05);此外,与Control组相比,CCl4组小鼠肝组织中铁代谢标志基因FPN、HJV 的mRNA 水平均下降(P值均<0.05),TFR1 的mRNA 水平上升(P<0.05);给予MK-4 预处理后,与CCl4组相比,铁代谢标志基因FPN、HJV的mRNA水平均显著上升,TFR1的mRNA水平下降,差异均有统计学意义(P值均<0.05)(图6)。

图5 各组小鼠肝脏组织铁聚集变化(普鲁士蓝染色,×40)Figure 5 Iron accumulation in liver tissue of mice in each group Prussian dyeing(×40)
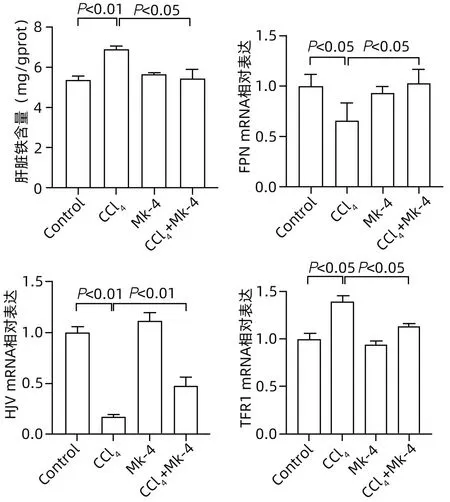
图6 各组小鼠肝脏组织铁含量以及铁代谢相关基因的表达Figure 6 Iron content and iron metabolism related gene expression in liver tissue of mice in each group
3 讨论
铁死亡作为一种新发现的非凋亡性细胞死亡形式,其特征为脂质过氧化物的过度积累,导致组织的损伤[9-10]。现有研究表明,CCl4诱导的ALI 中存在铁死亡的发生[5],而ALI作为肝病最突出的病因之一,与高发病率和死亡率有着密不可分的关系[11],因此寻找有效抑制ALI中铁死亡发生的药物有着重要的意义。
本研究为了确定MK-4 对CCl4诱导的ALI 是否有保护作用,分别在6、12、24 h 采用CCl4诱导ALI 的前1 h,使用MK-4 进行保护,观察在各自时间点内,MK-4 保护组和单纯CCl4组相比,其ALT、AST、肝质量系数和HE染色结果均显示出在12 h,而非24 h,MK-4 干预后明显减轻CCl4诱导的ALI。有文献[12]表明,MK-4在给药后在血浆中存在时间不超过24 h,MK-4+CCl4组(24 h)的MK-4 可能在体内已代谢完全,保护失效。此外,CCl4给药24 h后,与Control 组相比ALT、AST 水平上升近600 倍,肝损伤过于严重,这可能也是导致MK-4 对急性ALI 24 h 保护作用不明显的另一重要原因。
已有研究[13-16]表明,ACSL4、PTGS2 和GPX4 可作为铁死亡发生的关键标志物,ACSL4 和PTGS2 可促进脂质过氧化物的积累,而GPX4 可将有毒的脂质过氧化物转化成无毒的脂质醇,其中GPX4 作为抗氧化系统中的最关键调节蛋白,是验证铁死亡发生的金标准。在使用12 h 的小鼠各组织样本进行RT-PCR 检测时,CCl4组的ACSL4、PTGS2 的mRNA 表达上调,GPX4 的mRNA 表达下调,而使用MK-4 进行保护后,ACSL4、PTGS2 和GPX4三者的表达水平与CCl4组相比结果均相反,差异均有统计学意义。同时,Western Blot 检测GPX4蛋白时,CCl4组的GPX4 蛋白表达水平明显下降,而CCl4+MK-4 组GPX4蛋白表达水平比CCl4组显著上升。此外,MDA作为脂质过氧化的常用指标[17],其在CCl4组有明显升高,而经MK-4干预后呈下降趋势,GSH作为抗氧化系统中的核心成员[18],其结果与MDA相反。这些结果都表明ALI中确实存在铁死亡的发生,MK-4 预处理后ASCL4、PTGS2 的mRNA 水平下降和GPX4 的mRNA 水平上升以及GPX4蛋白水平的变化都提示MK-4 有抑制脂质过氧化的作用,而MDA 水平的下降和GSH 水平的上升再一次验证MK-4 可通过抑制脂质过氧化物的积累来抑制铁死亡的发生,从而对CCl4诱导的ALI产生一定的保护效果。
肝脏铁代谢紊乱会导致铁过载,从而加剧铁死亡的发生[13]。有研究[14]表明,FPN 负责将铁从铁储存细胞运输至血液中,以优化全身铁稳态,TFR1 则是将铁从细胞外环境导入细胞,HJV 作为铁调素的上游分子,与其共同维持细胞内的铁含量来防止铁代谢紊乱。三者都与铁死亡存在着密不可分的关系。本研究结果显示,小鼠在给予CCl4刺激后,FPN 和HJV 的mRNA 水平均不同程度地下降,TFR1 的mRNA 水平上升,MK-4 进行保护后,FPN 和HJV 的mRNA 水平均上升,TFR1 的mRNA 水平下降。同时,在给予MK-4 保护CCl4诱导ALI 的小鼠肝脏中,铁含量也明显下降。这些结果再次提示,MK-4不仅通过调节抗氧化系统来抑制铁死亡的发生,同时也可改善肝脏中铁代谢紊乱来保护CCl4诱导的ALI。
综上所述,本研究得出结论,CCl4诱导的ALI中发生铁死亡事件,而MK-4 可通过降低脂质过氧化物,抑制铁死亡以及调节铁代谢来改善CCl4诱导的ALI,使得MK-4及其类似物在未来可能用于预防和治疗ALI。
伦理学声明:本研究方案于2022 年5 月23 日经由安徽医科大学动物伦理委员会审批,批号:202200523,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:叶露、赵凡、张佳怡负责实验;叶露负责查阅文章,撰写论文;黄倩倩、王建青负责修改文章并最后定稿。
