植物雌激素鹰嘴豆芽素A(BCA)对肝纤维化去势小鼠模型的改善作用及机制
2024-02-19谭超容李小飘冉俊艳廖尚高张金娟
谭超容,李小飘,冉俊艳,熊 英,廖尚高,张金娟,c,何 迅
贵州医科大学 a.药学院,b.基础医学院,c.慢性病诊疗转化工程研究中心,贵阳 550025
肝纤维化是各种慢性肝病发展为肝硬化及肝癌的必经阶段,在早期阶段及时干预治疗则是可逆的[1],但若不及时干预,将进展为不可逆的肝硬化,甚至转变成肝癌[2-4],因此对肝纤维化的有效干预对于避免其恶性进展具有重要意义。
流行病学研究发现,女性比男性具有更低的肝纤维化和肝硬化的风险[5],但进入围绝经期雌激素分泌减少后,肝纤维化的发病率逐渐增加,这表明雌激素对肝脏具有保护作用[6]。内源性的雌激素参与抗肝纤维化的保护作用已有动物实验[7-9]证据。然而,由于雌激素效应较强,长期过度使用雌激素治疗肝纤维化可能导致广泛的不良反应[10]。相比之下,植物雌激素具有与雌激素相似的结构[11],被认为具有潜在的弱雌激素效应,临床应用相对安全[12-14]。鹰嘴豆芽素A(biochanin A,BCA)主要来源于豆科植物鹰嘴豆的种子胚芽部分、红车轴草全草,属于异黄酮类植物雌激素,有雌激素样作用[15-18]。BCA还可延缓高脂饮食诱导的非酒精性肝损伤[19],本课题组推测BCA 可能通过其弱雌激素作用发挥抗肝纤维作用,为此,本课题以CCl4诱导的雌性双侧卵巢切除(去势)肝纤维化小鼠为模型,观察植物雌激素BCA 对肝纤维化的作用及其机制,为开发安全有效的抗肝纤维化植物雌激素药物提供依据。
1 材料与方法
1.1 主要仪器 YP-SY96 型多功能酶标仪(山东优云谱光电科技有限公司);101 型恒温箱(上海市跃进医疗器械有限公司);AB104-S型电子天平(瑞士梅特勒-托利多公司,感量:0.1 mg);MIULAB 型离心机(杭州米欧仪器有限公司);Nikon Eclipse Eclipse E100 型正置光学显微镜(日本尼康仪器有限公司);DYY-6C 电泳液系统(北京六一生物有限公司);NIKON DS-U3 成像系统(日本尼康仪器有限公司)。
1.2 药物和试剂 BCA(批号N0901A,纯度≥97%)购自大连美仑生物技术有限公司;雌二醇(批号J20171038,规格:1 mg)购自DELPHARM Lille S.A.S;BCA蛋白浓度测定试剂盒(批号20220723)购自北京索莱宝科技有限公司;AST、ALT(批号分别为20220628、20220620)均购自南京建成生物工程研究所;TNF-α、IL-6(批号分别为FU02TDL61345、FU03N42H2910)均购自武汉伊莱瑞特生物科技股份有限公司;兔抗鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(批号#62U0922)购自美国Affinity公司;α-平滑肌肌动蛋白(α-SMA)多克隆抗体(批号14395-1-AP)购自武汉三鹰生物技术有限公司;Ⅰ型胶原蛋白(Collagen Ⅰ)单克隆抗体、雌激素受体β(ERβ)多克隆抗体(批号分别为bs-0578R、bs20471R)均购自北京博奥森生物技术有限公司;兔抗鼠转化生长因子-β1(TGF-β1)单克隆抗体(批号ab179695)购自美国Abcam公司;兔抗鼠细胞核因子-κB(NF-κBp65)、磷酸化细胞核因子κB(p-NF-κBp65)单克隆抗体(批号分别为D14E12、93H1)均购自美国Cell Signaling Technology 公司;PVDF膜(批号R1DB89779)购自德国Merck公司。
1.3 实验动物 60只昆明小鼠,雌性,体质量18~22 g,购于长沙市天勤生物技术有限公司,实验动物生产许可证号:SCXK(湘)2019-0014,实验动物使用许可证号:SYXK(黔)2018-0001,动物房温度保持在25 ℃左右,适应性饲养1周后用于实验。
1.4 实验方法
1.4.1 造模、分组与给药 造模方法根据文献[6,20]进行。取50只雌性小鼠切除双侧卵巢以获得去势小鼠,同时取10 只同批雌性小鼠切除双侧卵巢旁少量脂肪组织作为假手术组。术后3 天,给予去势小鼠腹腔注射20%CCl4橄榄油溶液,每周2 次,持续9 周,建立肝纤维化模型。假手术组小鼠以腹腔注射橄榄油代替CCl4。于CCl4诱导的第3周,将50只建模小鼠按体质量随机分成5组,即模型组、阳性对照组(雌二醇2 mg/kg)、BCA 低剂量组(25 mg/kg)、BCA 中剂量组(50 mg/kg)、BCA 高剂量组(100 mg/kg),每组10 只。分组后,阳性对照组,BCA 低、中、高剂量组分别灌胃溶于0.5%羧甲基纤维素钠溶液的对应药物,模型组与假手术组灌胃等体积0.5%羧甲基纤维素钠溶液,每天1次,连续7周。
1.4.2 取材 末次给药后24 h,麻醉各组小鼠,取血清,测定血清学指标;剖取小鼠肝脏及子宫,部分肝组织保存于-80 ℃冰箱中,另一部分肝组织固定于10%中性福尔马林中。
1.4.3 观察肝脏、子宫外观及计算肝指数、子宫指数肉眼观察肝脏及子宫大小、质地、颜色等外观表现,称重,按下列公式计算器官(肝、子宫)指数。器官指数(%)=器官质量/末次体质量×100%。
1.4.4 HE、Masson 染色观察肝组织学改变 固定的肝组织经不同浓度乙醇逐级脱水,浸蜡与包埋,切片,HE和Masson染色,镜下观察肝组织学变化。
1.4.5 检测血清AST、ALT 活性 取血清,采用微板法测定血清中AST、ALT活性。
1.4.6 检测肝组织中IL-6、TNF-α 水平 取-80 ℃冰箱中保存的肝组织制成匀浆液,采用ELISA 法测定肝组织中IL-6、TNF-α水平,操作步骤按说明书进行。
1.4.7 Wersten Blot 检测肝组织中Collagen Ⅰ、TGF-β1、α-SMA、ERβ、p-NF-κBp65、NF-κBp65蛋白表达检测 每组中随机选取3 只小鼠进行3 次Western Blot 重复实验。提取肝组织总蛋白,BCA试剂盒检测蛋白浓度。蛋白变性,SDS 凝胶电泳2 h,湿转至PVDF 膜,封闭2 h,TBST 缓冲液洗膜3次,分别加入Collagen Ⅰ(1∶2 000)、α-SMA(1∶2 000)、ERβ(1∶500)、TGF-β1(1∶1 000)、NF-κBp65(1∶1 000)、p-NFκBp65(1∶1 000)、GAPDH(1∶5 000)一抗,于4 ℃孵育过夜,随后用TBST缓冲液洗PVDF膜3次,加二抗孵育2 h,TBST 缓冲液洗膜3 次,ECL 发光显影,用Image J 软件对各条带的灰度值进行分析。
1.5 统计学方法 采用SPSS 24.0 软件进行数据分析,正态分布的计量资料以表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。非正态分布的计量资料以M(P25~P75)表示,多组间比较及进一步两两比较均采用Kruskal-WallisH检验。P<0.05为差异具有统计学意义。
2 结果
2.1 BCA对肝纤维化小鼠肝、子宫指数的影响 与假手术组比较,模型组小鼠的子宫指数显著降低(P<0.05),肝指数显著升高(P<0.05)。与模型组相比,BCA 各剂量组的肝指数均明显降低(P值均<0.05),子宫指数无明显变化(P>0.05);阳性对照组肝指数无明显变化(P>0.05),子宫指数明显增大(P<0.05)(表1)。

表1 BCA对CCl4诱导肝纤维化小鼠肝、子宫指数的影响Table 1 Effects of BCA on liver and uterus weight ratios in CCl4-induced liver fibrosis mice
2.2 BCA 对肝纤维化小鼠肝脏、子宫形态学及肝组织学的影响 肝脏外观观察发现:假手术组小鼠肝脏外观表面光滑,质地柔软,边缘锐;模型组小鼠肝脏表面有明显的粗颗粒状,质地硬,边缘圆钝;与模型组比较,阳性对照组和BCA 各剂量组肝脏表现有不同程度的改善。子宫:假手术组小鼠子宫形态正常,模型小鼠明显比假手术组小鼠子宫纤细;而阳性对照组小鼠子宫明显比模型组子宫增粗,BCA 各剂量组小鼠子宫大小与模型组小鼠无明显差异。HE 染色:假手术组肝细胞形态正常,小叶结构清晰且完整,未出现细胞坏死和脂肪变性、炎症等;模型组肝细胞有水肿、脂肪空泡、坏死等表现,细胞排列紊乱,小叶结构不完整,并伴有大量炎细胞浸润;与模型组比较,阳性对照组及BCA 各剂量组肝组织表现较不同程度减轻。Masson 染色:假手术组小鼠肝组织汇管区有少量蓝色胶原纤维,小叶结构正常;模型组肝组织内有大量粗大的蓝色胶原纤维,交错分布,导致小叶结构被破坏;与模型组比较,阳性对照组及BCA 各剂量组蓝色胶原纤维较细,肝小叶结构破坏程度减轻(图1)。
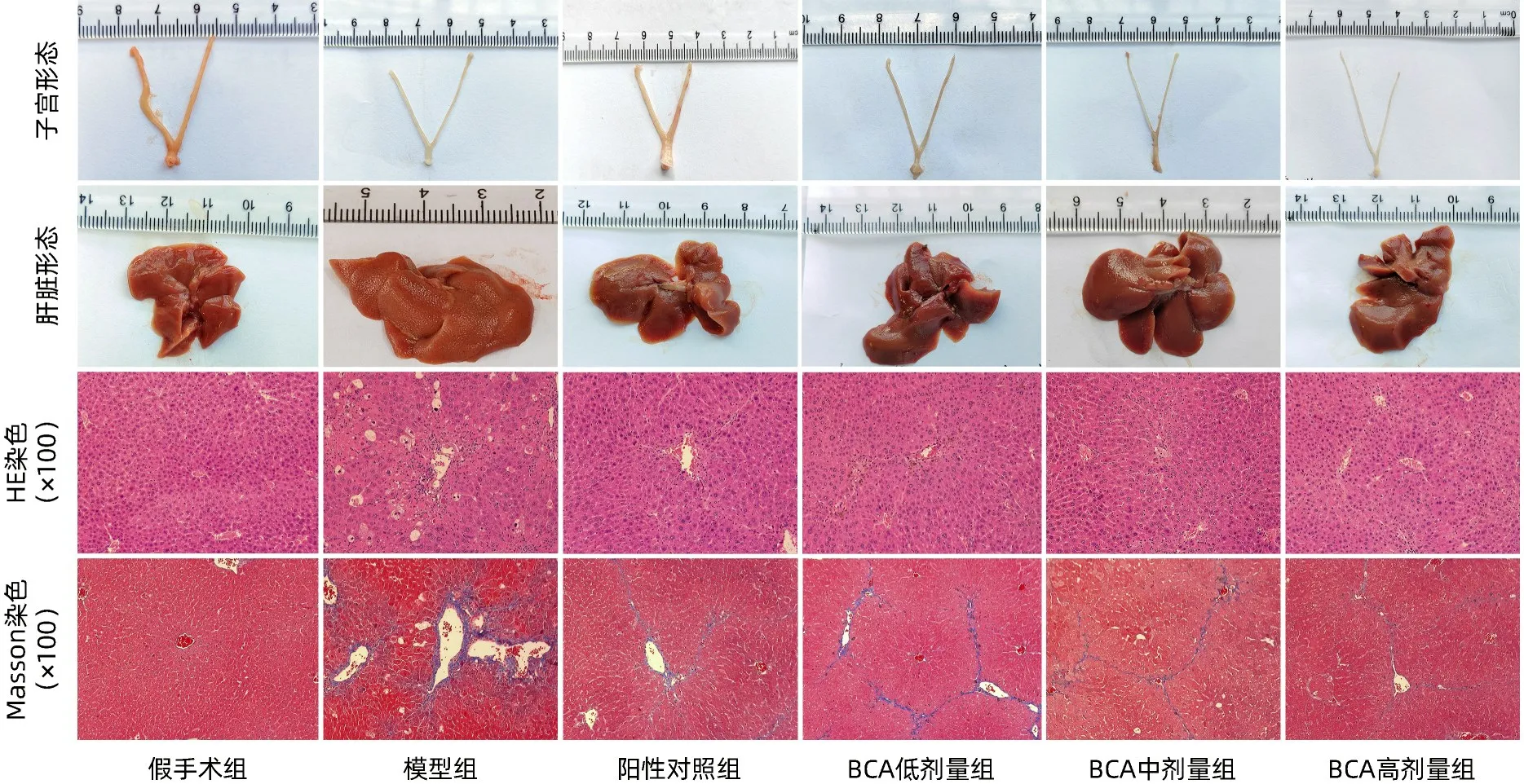
图1 BCA对CCl4诱导肝纤维化小鼠子宫、肝脏形态学及肝脏病理的影响Figure 1 Effects of BCA on the morphological and pathological changes of uterus and liver in CCl4-induced liver fibrosis mice
2.3 BCA 对肝纤维化小鼠血清中AST、ALT 活性的影响与假手术组相比较,模型组小鼠血清AST、ALT均显著升高(P值均<0.05);与模型组相比,阳性对照组及BCA各剂量组小鼠血清AST、ALT均显著降低(P值均<0.05)(表2)。

表2 BCA对CCl4诱导肝纤维化小鼠AST、ALT活性的影响Table 2 Effects of BCA on serum activities of AST and ALT in CCl4-induced liver fibrosis mice
2.4 BCA对肝纤维化小鼠肝组织中IL-6、TNF-α水平的影响 与假手术组相比,模型组小鼠肝组织中IL-6、TNF-α 均显著升高(P值均<0.05);与模型组相比,阳性对照组及BCA 各剂量组小鼠肝组织中IL-6、TNF-α 均显著降低(P值均<0.05)(表3)。

表3 BCA对CCl4诱导肝纤维化小鼠IL-6、TNF-α水平的影响Table 3 Effects of BCA on serum contents of IL-6 and TNF-α in CCl4-induced liver fibrosis mice
2.5 BCA对肝纤维化小鼠肝组织中Collagen Ⅰ、TGF-β1、α-SMA、ERβ、p-NF-κBp65/NF-κBp65 蛋白表达的影响与假手术组相比较,模型组小鼠肝组织Collagen Ⅰ、TGF-β1、α-SMA 相对表达量均显著升高(P值均<0.05),与模型组比,阳性对照组及BCA 低、中、高剂量组小鼠的肝组织Collagen Ⅰ、TGF-β1、α-SMA 相对表达量均显著降低(P值均<0.05)。
与假手术组相比,模型组小鼠肝组织ERβ相对表达量无明显差异(P>0.05);与模型组相比,阳性对照组及BCA 中、高剂量组小鼠肝组织ERβ 相对表达量均显著升高(P值均<0.05),BCA 低剂量组无明显差异(P>0.05)。与假手术组相比较,模型组小鼠的p-NF-κBp65/NF-κBp65相对表达量显著升高(P<0.05);与模型组相比,阳性对照组及BCA中、高剂量组小鼠中的p-NF-κBp65/NF-κBp65相对表达量均显著降低(P值均<0.05)(表4,图2)。

图2 BCA对CCl4诱导肝纤维化小鼠蛋白表达的影响Figure 2 Effects of BCA on protein expressions in CCl4-induced liver fibrosis mice
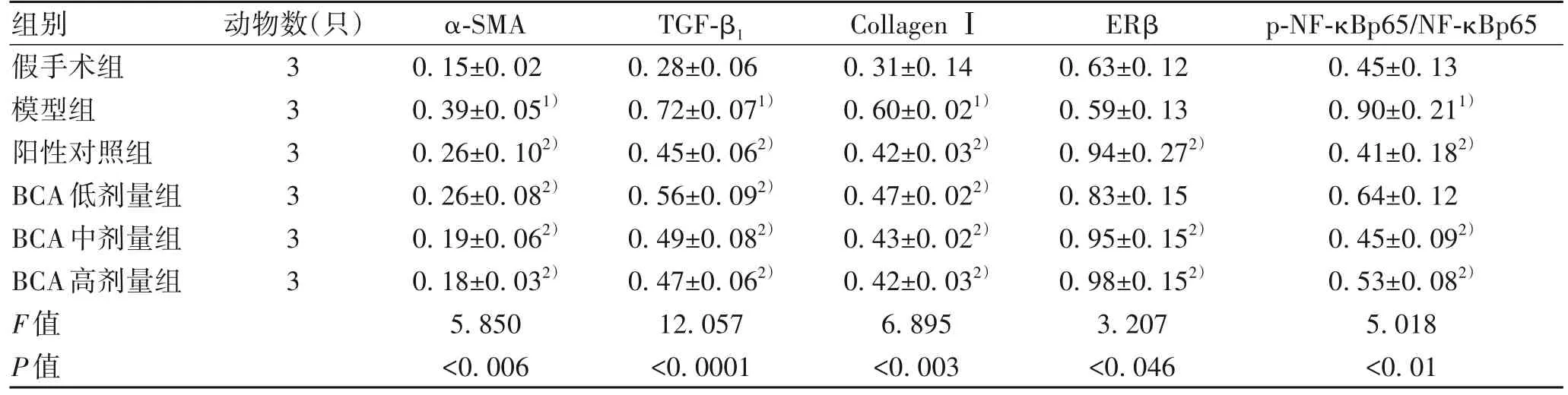
表4 BCA对CCl4诱导肝纤维化小鼠肝组织中蛋白表达的影响Table 4 Effects of BCA on protein expressions in CCl4-induced liver fibrosis mice
3 讨论
本研究在动物实验水平上对BCA 可能通过其弱雌激素作用发挥抗肝纤维化作用进行验证。本课题的创新点在于,为观察植物雌激素BCA 对子宫的影响选用了雌性小鼠,同时为了避免体内雌激素对实验的影响,对雌性小鼠进行了去势处理。CCl4具有肝毒性,以CCl4诱导动物肝纤维化是国内外公认的肝纤维化造模的经典方法[21-22]。本课题对去势雌性小鼠腹腔注射CCl4制作肝纤维化模型,结果在肉眼及镜下观察均可见模型组小鼠肝组织出现了典型的肝纤维化表现,表明造模成功。
血清中AST 和ALT 活性是检测肝功能损伤程度的灵敏指标[23],结果显示,模型组AST、ALT 活性较假手术组显著升高,表明模型组小鼠存在显著的肝损伤。肝星状细胞(HSC)的激活在肝纤维化进展中起着关键作用[24]。HSC 合成过量细胞外基质(ECM),在肝内沉积,促进肝纤维化的形成。Collagen Ⅰ是ECM 的主要成分之一,模型组小鼠肝组织中Collagen Ⅰ表达上调,表明模型组小鼠肝组织内存在过多ECM。α-SMA 是肝星状细胞活化的标志蛋白,其过量表达提示HSC 过度激活分泌ECM,加速肝纤维化的发生、发展[25],还间接反映HSC 在机体内活化增殖的进度与纤维化进展的严重程度[26]。TGF-β1是引起HSC 活化最有效的细胞因子之一,介导HSC 活化和生成ECM,是肝纤维化过程中的关键介质,参与肝纤维化的关键环节,在肝纤维化的发生、发展中起关键作用[27-28]。Western Blot 结果表明,模型组小鼠肝组织α-SMA、TGF-β1表达较假手术组明显增加,表明模型组小鼠肝组织中肝星状细胞显著活化,生成ECM能力明显增强。
与模型组相比,经高、中、低剂量的BCA 干预后,BCA 各组小鼠血清AST、ALT 活力明显降低,肝组织中Collagen Ⅰ、α-SMA、TGF-β1表达下调,肝组织病变程度也明显减轻,表明BCA 处理可减少小鼠肝组织中ECM的生成,降低HSC 的活化,减轻肝组织纤维化病变程度,提示BCA 可有效改善CCl4诱导的雌性去势小鼠的肝纤维化。与此同时,本实验还观察到模型小鼠因体内雌激素缺乏而出现子宫萎缩、子宫指数减小的表现;给予雌激素处理后,改善肝纤维化的同时也使子宫增大。而BCA 仅改善了肝纤维化,对子宫未产生明显影响,提示BCA 的雌激素样作用弱,对子宫等其他雌激素相关器官影响不大。可以推测,若将其替代雌激素用于肝纤维治疗,可一定程度上降低患子宫癌等疾病的风险。
肝纤维化发展的全过程中伴有炎症的发生[29],控制肝脏炎症可在一定程度上逆转肝纤维化[30]。NF-κB 是一类重要的核转录因子[31],是NF-κB信号通路中的关键分子。NF-κB 信号通路作为经典的炎症信号通路在炎症反应中发挥着重要作用。TNF-α、IL-6 等炎症因子可作为NF-κB 信号通路的配体激活NF-κB 通路,被激活的NF-κB 转位入核,调控靶基因转录。TNF-α、IL-6 等基因的启动子区具有NF-κB的结合点[32],被NF-κB激活后又进一步促进炎症因子表达,形成炎症反应恶性循环。NF-κB 家族由RelA(p65)、RelB、c-Rel、p50(NF-κB1)和p52(NF-κB2)5 个成员组成,可形成不同形式的同源二聚体或异二聚体。其中p65 蛋白的相关研究最多,是经典的NF-κB 信号通路传导过程中的关键分子,磷酸化后的p65为其活性形式。本研究发现,BCA中剂量、高剂量组肝纤维小鼠肝组织中p65 蛋白的磷酸化修饰水平降低,提示BCA 可抑制NF-κB 信号通路,打破炎症反应恶性循环,降低TNF-α、IL-6 等炎症因子水平,减轻肝脏炎症反应。
BCA 作为植物雌激素,往往可通过雌激素受体发挥作用。本研究发现,BCA 中剂量、高剂量干预的肝纤维化小鼠肝组织中ERβ 表达明显增高,以BCA 与ERβ 进行分子对接也显示结合能较好,提示BCA可通过ERβ发挥作用。通过文献研究发现,上调ERβ可抑制NF-κB信号通路。例如三阴性乳腺癌细胞过表达ERβ 时,NF-κB表达降低,两者表达呈明显的相关性[33]。此外,过表达ERβ 可通过降低IκBα 及p65 的磷酸化水平抑制NF-κB信号通路,进而抑制乳腺癌细胞的迁移及增殖[34]。由此,可以合理推测,BCA 可通过上调ERβ 的表达而抑制NF-κB 信号通路,从而减轻肝纤维化小鼠肝组织炎症反应,进而改善肝纤维化。
综上所述,BCA 可有效改善CCl4诱导的雌性去势小鼠的肝纤维化病变,且具有对子宫等雌激素靶器官影响较小的优势,其作用机制可能是通过上调ERβ 抑制NFκB信号通路,减轻炎症反应而实现的。
伦理学声明:本课题实验方案于2021年7月9日获得贵州医科大学实验动物伦理委员会审批,批号:2100313,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:谭超容参与课题的设计,负责课题实施,数据分析,撰写论文;李小飘、冉俊艳、熊英、廖尚高参与课题实施,数据收集,修改论文;张金娟、何迅负责课题设计,指导实验实施及文章撰写并定稿。
