CCl4诱导的肝纤维化大鼠模型肝小叶内卵圆细胞总体积与轮廓数密度变化的体视学分析
2024-02-19王川林刘全明杨正伟梅小平
王川林,刘全明,杨 霞,杨正伟,梅小平,彭 彬
1 川北医学院附属医院感染科,四川 南充 637000
2 川北医学院临床医学系,四川 南充 637000
3 川北医学院基础医学与法医学研究所,四川 南充 637000
肝纤维化和终末期肝硬化是严重的全球医疗问题,但肝纤维化发生机制目前仍未完全阐释清楚。肝星状细胞(HSC)活化被认为是肝纤维化的关键环节[1-3]。本课题组前期采用体视学方法结合电镜技术研究了CCl4所致肝纤维化大鼠肝组织超微结构的改变,发现肝纤维化大鼠窦周隙内HSC 数量显著增加[4]。同时,还在大鼠肝小叶内(主要是窦周隙以及肝细胞间)观察到了大量增生的幼稚细胞。通过查阅文献,根据这种幼稚细胞电镜下的形态学特征、位置,判断这种幼稚细胞可能是肝脏干细胞中的卵圆细胞(hepatic oval cell,HOC)[5-6]。HOC 是一类具有多向分化潜能的肝脏干细胞,研究表明,HOC 也参与了肝纤维化的过程,但是HOC在肝纤维化过程中所起的作用目前尚存争议。有研究[7]报道,HOC在HSC活化过程中通过合成结缔组织生长因子,促进HSC 的增殖和细胞外基质(ECM)的分泌,加重肝纤维化。但也有研究[8]发现体外诱导人胚胎干细胞分化为HOC,将其移植入CCl4诱导的肝纤维化大鼠体内,能有效减轻肝纤维化。HOC 在CCl4诱导的肝纤维化大鼠模型中扮演什么样的角色,究竟是加重肝纤维化还是改善肝纤维化,值得进一步思考。由于HOC在正常肝脏中数量极少,仅占正常肝细胞的1%~3%,且HOC 体积很小,光镜下很难被辨认。另外目前HOC 的表面标志物如胆管上皮角蛋白CK7、CK8、CK18、CK19、OV6、c-met、HEA-125 和HepParl 等缺乏特异性,不同亚群及不同发育阶段的HOC所表达的标志物也不尽相同,HOC 的分子鉴定研究也存在一定困难[9-10]。因此电镜研究HOC被认为是最可靠和最有价值的方法。电镜下HOC 形态学特征为胞体近似圆形或卵圆形,胞核大,胞浆相对较少,核质比高,核仁较明显,胞质内细胞器较少,含少量粗面内质网与线粒体[5-6]。为明确CCl4诱导的肝纤维化大鼠是否伴有肝小叶内HOC 总体积与轮廓数密度的变化,进一步探讨HOC在肝纤维化进程中的作用,本课题组采用体视学方法结合透射电镜技术测量了CCl4诱导的肝纤维化大鼠肝小叶内HOC 的总体积与轮廓数密度,以期为HOC在肝纤维化中的作用提供形态定量证据。
1 材料与方法
1.1 实验动物与分组 11 只3 月龄健康雄性SD 大鼠,体质量160~180 g,购买于川北医学院动物实验中心,SD 大鼠适应性饲养1 周后,随机分为2 组:对照组(n=5)、肝纤维化组(n=6)。
1.2 动物模型建立
1.2.1 肝纤维化组模型制备 将橄榄油(国药集团化学试剂有限公司)与CCl4(国药集团化学试剂有限公司)按体积比2∶3 配成40%橄榄油与CCl4混悬液,在大鼠背部皮下注射3 mL/kg的橄榄油与CCl4混悬液,每周注射2次,建立大鼠肝纤维化模型,造模5 周后取材。本研究模型组的6 只大鼠是从15 只建模大鼠中选取的按肝纤维化Metavir 分期标准成功达到Ⅱ~Ⅲ期肝纤维化大鼠。从造模开始的第2、3、4、5 周,分别在15 只模型大鼠中随机选取1 只取材判断肝组织的病理变化情况,并在第5 周观察到肝组织出现了Ⅱ期肝纤维化病理改变,即对剩下的大鼠全部取材,并选取其中6 只达到肝纤维化Ⅱ~Ⅲ期病理改变的大鼠纳入实验组[11]。
1.2.2 对照组模型制备 在大鼠背部皮下注射3 mL/kg的生理盐水,每周2次,造模5周后取材。
1.3 肝脏密度与体积测量方法 采用电子天平(精度0.1 mg)称量大鼠肝脏质量,并用已知密度的不同浓度的蔗糖或乙醇溶液测量肝脏密度,用大鼠肝脏质量除以肝脏密度,即可得到大鼠肝脏体积。
1.4 肝组织处理与切片制备
予以大鼠3%戊巴比妥(50 mg/kg)腹腔注射进行麻醉。随机剪取一小块肝组织切成1 mm3放入2.5%戊二醛固定,用于制作电镜超薄切片。剩余肝组织放入4%的多聚甲醛(成都市科龙化工试剂厂)浸润固定48 h 后用于制备石蜡包埋切片。
1.4.1 石蜡切片制备 从每只大鼠肝脏按照等距随机抽样抽选4个2 mm厚的组织块行石蜡包埋,每个肝组织块用半自动石蜡切片机切取2 张14 μm 厚的石蜡切片,按照Masson 三色染色试剂盒(福州迈新生物技术公司)说明书上的Masson染色方法染色肝组织切片,以显示胶原纤维。光镜下观察大鼠肝纤维化造模效果。
1.4.2 电镜超薄切片制备 肝组织块经2.5%戊二醛固定4 h后,从每只大鼠中随机抽选5个肝组织块制作电镜超薄切片,具体方法如下:首先在4 ℃温度下1% OSO4中固定2 h,乙醇和丙酮梯度脱水,环氧树脂812(SPICHEM,美国)渗透、包埋。利用超薄切片机(德国LEICA EM UC7)从每个组织块切取70 nm 厚的连续超薄切片放置在铜网上。用乙酸双氧铀(SPI-CHEM,美国)和柠檬酸铅(中国成都科龙化学试剂厂)染色后在透射电子显微镜下观察。
1.5 体视学分析
1.5.1 计算肝HOC总体积 在透射电子显微镜(HT7700)下观察肝组织超薄切片,发现放大倍数为1 200 倍时刚好能对一个圆形铜网内的组织结构随机抽选视野拍照,当在放大1 200 倍下分辨不清组织结构时,将放大倍数放大更高后拍照以准确地辨认结构,平均每只大鼠约获得25 张照片。在Adobe Photoshop CS6 软件里将每张电镜照片(1 200倍)上随机叠加7×7个测点,分别计数落在HOC 上的测点数以及落在肝组织上的总测点数。HOC的体积分数为该大鼠肝脏所有照片落在HOC 的测点数之和除以该大鼠肝脏所有照片肝组织上的总测点数之和,将HOC 体积分数乘以肝脏的总体积,即可得到HOC总体积。
1.5.2 计算肝HOC 的轮廓数密度 用Photoshop 软件在已获得的电镜照片(×1 200 倍)上,叠加无偏计数框(图1),体视框面积为2 354.45 μm2,按照禁线法则抽选并计数位于计数框内或与计数线相交,且不与禁线相交的HOC 的数量。单位面积内HOC 轮廓的数量(轮廓数密度,NA)为组内所有体视框所计数HOC 的总数除以每个体视框面积与体视框数量的乘积。

图1 体视框计数肝卵圆细胞数密度Figure 1 Contour number density of hepatic oval cells counted by stereoscopic frame
1.6 统计学方法 采用SPSS 27.0 统计软件进行数据分析。计量资料以表示,两组间比较采用成组t检验。P<0.05为差异有统计学意义。
2 结果
2.1 光镜下定性观察CCl4所致肝纤维化大鼠肝组织的主要病理改变 对照组大鼠肝细胞胞质内偶可见1~3个脂滴,肝组织内胶原纤维主要分布在门管区与窦周隙,中央静脉周围可见极少量胶原纤维。与对照组比较,肝纤维化组大鼠肝细胞体积明显增大,肝细胞出现了大量气球样变性、脂肪变性甚至坏死,肝细胞胞质内脂滴明显增多。汇管区胶原纤维大量增生,增生的纤维间隔向邻近肝小叶延伸,部分大鼠少数纤维间隔形成,部分大鼠多数纤维间隔形成,所有大鼠按照肝纤维化分期Metavir 评分标准达到Ⅱ~Ⅲ期。肝组织内窦周隙和中央静脉周围可见明显增厚的胶原纤维束,肝血窦变窄(图2)。

图2 Masson染色的肝组织结构Figure 2 Histological structure of liver by Masson staining
2.2 电镜下观察CCl4所致肝纤维化大鼠肝组织超微结构的主要病理改变 在对照组,大鼠肝细胞呈不规则六边形,肝窦周隙内可见少量胶原纤维,窦周隙内偶可见极个别HSC与HOC。HOC的胞体近似圆形或卵圆形,其胞核较大,胞质极少,部分HOC整个胞体几乎为细胞核,胞质内细胞器较少,主要为线粒体与粗面内质网。与对照组比较,肝纤维化组大鼠肝细胞部分脂肪变,部分细胞器溶解坏死,窦周隙显著增宽,其内胶原纤维明显增生,血窦腔明显变窄甚至塌陷。窦周隙内HSC 大量增生,HSC 胞体增大,胞质内脂滴明显增多。窦周隙内与肝细胞间HOC 大量增生,窦周隙内增生的HOC 主要位于HSC的附近(图3、4)。
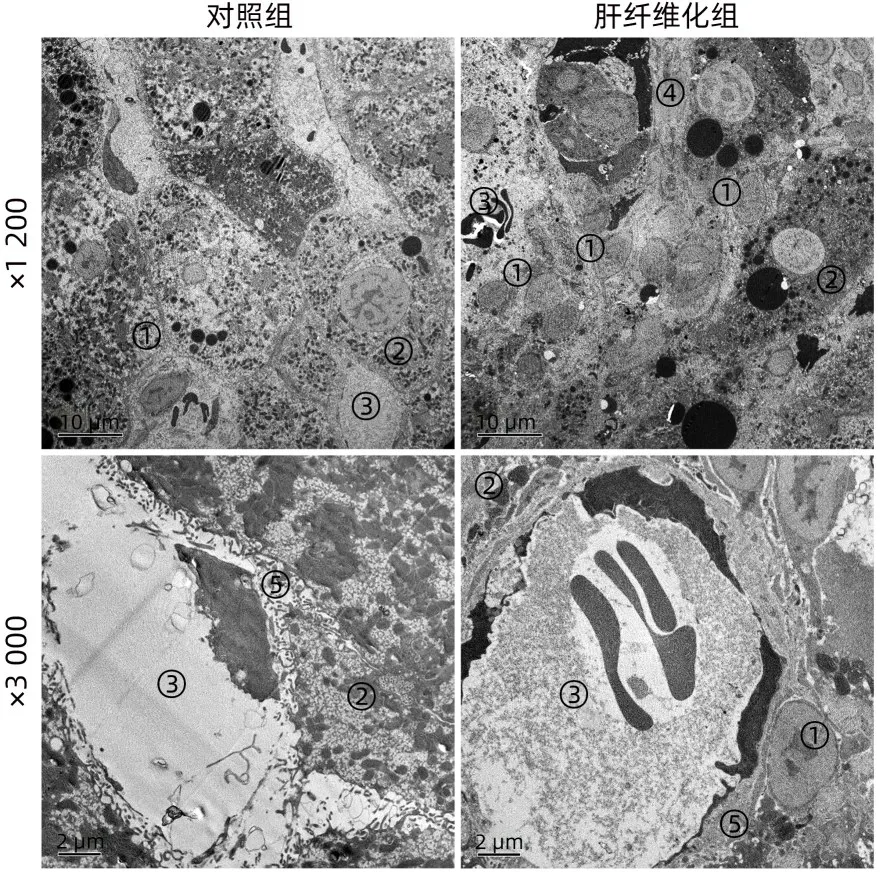
图3 电镜下肝组织超微结构Figure 3 Ultrastructure of liver tissue under electron microscope

图4 电镜下HOC超微结构(×7 000)Figure 4 Ultrastructure of hepatic oval cell under electron microscope(×7 000)
2.3 体视学形态定量研究结果 与对照组比较,肝纤维化组大鼠肝小叶内HOC 总体积显著增加了8.53 倍,其轮廓数密度显著增加了9.08倍(P<0.05)(表1)。

表1 各组大鼠肝小叶内肝HOC总体积与轮廓数密度(每mm2细胞数量)变化Table 1 Changes in total volume(mm3)and contour number density(number of cells per mm2)of hepatic oval cells in hepatic lobules of rats in each group
3 讨论
HOC 是肝脏中一种多潜能干细胞,在肝组织受到严重或慢性损伤时,能分化为肝细胞和胆管上皮细胞,修复组织损伤[12]。肝纤维化是一种以ECM过度积聚的创伤修复反应[13-14]。HOC参与了肝纤维化过程,但HOC的激活究竟是加重肝纤维化还是改善纤维化,各学者的观点并不一致。目前关于HOC在肝纤维化中活化增殖的研究主要是采用定性或半定量研究方法,对HOC增殖的定量研究缺乏实验数据。本研究电镜下观察发现,HOC 的胞体近似圆形或卵圆形,其胞核较大,胞质极少,部分HOC整个胞体几乎为细胞核,胞质内细胞器较少,主要为线粒体与粗面内质网。这与Lotowska 等[5]与de Vos[6]等报道的HOC形态学特征近似,体视学定量研究结果显示:与对照组比较,肝纤维化组大鼠肝小叶内HOC总体积显著增加了8.53倍,其轮廓数密度显著增加了9.08倍。本研究观察发现,单个HOC 细胞的体积并未显著增加,因此肝小叶内HOC 总体积的增加主要与HOC 数量的增加有关。该研究结果从形态学定量角度证实了CCl4所致肝纤维化过程中伴随着大鼠HOC 的大量增生。本研究结果为HOC 在肝纤维化过程中的增生提供了可靠的形态学定量证据。
HOC在肝纤维化中的作用尚存在争议,Awan等[15]通过将骨髓间充质干细胞诱导分化的HOC移植入肝纤维化小鼠中,发现其能有效减轻肝纤维化。Yang等[16]将TGF-β1处理WB-F344 HOC 12 h后发现,可通过上调人纤溶酶原激活抑制剂的表达抑制HSC 活化,从而减轻肝纤维化。也有报道[17]称,在肝纤维化动物模型和人肝纤维化组织中,HOC数量与肝纤维化程度呈正相关。邱德凯等[18]通过对慢性肝病患者肝组织病理分析发现,HOC 数量随着肝纤维化程度的加重而显著增高。本研究发现,与对照组比较,肝纤维化组窦周隙内胶原纤维大量增生,同时窦周隙内增生的胶原周围伴随着HSC 与HOC 大量增生。由此推测HOC可能与肝纤维化形成有关,其原因可能与HOC促进HSC增殖与活化有关。
本课题组前期研究[4]证实CCl4致肝纤维化大鼠窦周隙中胶原纤维总体积、HSC 的总体积与数量显著增加。本实验中发现,在肝纤维化大鼠窦周隙内HSC 增生的部位周围伴随着大量HOC 增生。HSC 活化转变成肌成纤维细胞分泌大量ECM 是肝纤维化的中心环节[19]。研究[20-21]表明,在HSC 激活的过程中,HOC 能够通过合成IL-6、血小板衍生因子、结缔组织生长因子、血管内皮生长因子与TGF-β1 等,促进HSC 的活化与增殖,分泌ECM,加重肝纤维化。HOC 除了能分化为肝细胞和胆管细胞外,还可以分化为HSC 或肌纤维母细胞,直接参与ECM 的沉积。Wang 等[22]用TGF-β1 处理肝纤维化小鼠模型中分离的HOC,能使其表达HSC标志物肌间线蛋白和胶质纤维酸性蛋白,分化为HSC,并上调ECM 相关基因的表达。由此推测,在CCl4诱导的大鼠肝纤维化过程中,CCl4可能通过促进HOC 增殖,激活HSC 分泌大量ECM,从而参与肝纤维化形成。本研究认为HOC的大量增生可能与肝纤维形成有关。
不同学者对HOC在肝脏分布的位置有不同的观点。Faktor 等[23]认为,HOC 来源于Hering 管(又被称为微胆管或终末胆管)和肝门周小胆管;而Burke 等[24]研究认为,HOC 存在于肝门周区和肝实质内。本研究发现,在正常大鼠肝组织窦周隙内偶可见HOC,在肝纤维化组大鼠,HOC 主要位于充满胶原纤维的窦周隙内与肝细胞间,本研究支持HOC位于肝实质即肝小叶内的观点。本课题组前期通过体视学方法结合光镜研究结果表明,大鼠小叶间(包括汇管区)占肝脏总体积的比例仅有0.4%(正常组)和2.7%(肝纤维化组)[3],由此说明,无论是在大鼠正常肝组织还是纤维化肝组织汇管区占整个肝脏的比例非常低,加之尽管透射电镜的高放大倍数能准确分辨出HOC,但由于其视野很小,本实验随机取得的电镜标本制作观察到汇管区的概率极低,而体视学定量研究需要的样本量较大,因此本实验未分析汇管区HOC的增生情况。本实验的另外一个局限性在于未做新生幼稚细胞的免疫组化染色进一步确定其为HOC。在下一步实验中本课题组将在光镜下采用免疫组化标记HOC,并对肝小叶间(包括汇管区)和小叶内的HOC 进行定量研究。
肝纤维化的治疗仍是医学界难题,本研究结果显示肝纤维化过程中HOC 大量增生,随着对HOC 生物学特性以及在肝纤维化进展中作用的深入研究,相信在未来针对HOC 的靶向干预有望成为肝纤维化防治的有效措施。
伦理学声明:本研究方案于2021 年12 月24 日经由川北医学院实验动物伦理委员会审批,批号:2021119。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:彭彬、杨正伟、梅小平负责设计研究方案并提供指导性支持;王川林、刘全明、杨霞负责数据收集、整理与分析;王川林、彭彬负责论文撰写与修改。
