连翘苷调节NLRP3炎性通路对急性胸膜炎大鼠肺损伤的影响
2024-02-18郝建玲信婧婧王靖田红苏海涛
郝建玲 信婧婧 王靖 田红 苏海涛
摘要:目的 探討连翘苷通过调节NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性通路对急性胸膜炎大鼠渗出液和肺损伤的影响。方法 将90只大鼠采用随机数字表法均分为对照组、模型组、连翘苷低剂量(PH-L,5 mg/kg)组、连翘苷中剂量(PH-M,10 mg/kg)组、连翘苷高剂量(PH- H,20 mg/kg)组及NLRP3通路抑制剂(PJ34,10 mg/kg)组。肺功能分析仪检测大鼠用力肺活量(FVC)、第0.1秒用力呼气量(FEV 0.1)、第0.3秒用力呼气量(FEV 0.3);电子天平称量胸腔渗出物质量;瑞氏染色检测渗出物白细胞数;酶联免疫吸附试验检测渗出液中前列腺素E2(PGE2)、单核细胞趋化蛋白-1(MCP-1)、白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)含量;全自动血气分析仪检测大鼠动脉CO2分压[p(CO2)]、动脉氧分压[p(O2)];HE染色观察肺组织病理学变化;免疫组织化学染色检测NOD样受体热蛋白结构域相关蛋白3(NLRP3)、胱天蛋白酶1(Caspase-1)蛋白表达;Western blot检测NLRP3通路蛋白表达。结果 与对照组比较,模型组大鼠胸腔渗出物质量和白细胞数、渗出液PGE2、MCP-1、IL-6、TNF-α含量、p(CO2)、NLRP3通路蛋白表达增加,FVC、FEV 0.1、FEV 0.3、p(O2)降低,肺组织出现明显的病理损伤(P<0.05);与模型组比较,PH各组和PJ34组大鼠胸腔渗出物质量、白细胞数、渗出液PGE2、MCP-1、IL-6、TNF-α含量、p(CO2)、NLRP3通路蛋白表达降低,FVC、FEV 0.1、FEV 0.3、p(O2)增加,肺组织病理损伤好转(P<0.05);与PH-H组比较,PJ34组上述指标差异无统计学意义(P>0.05)。结论 PH可通过抑制NLRP3通路激活,抑制炎症反应,改善急性胸膜炎引起的肺损伤。
关键词:胸膜炎;急性病;连翘苷;肺损伤;NLR家族,热蛋白结构域包含蛋白3
中图分类号:R285.5,R561.1文献标志码:ADOI:10.11958/20230399
Effect of phillyrin regulating NLRP3 inflammatory pathway on exudates and lung injury in rats with acute pleurisy
Abstract: Objective To investigate the impacts of phillyrin on exudates and lung injury in rats with acute pleurisy by regulating the NLRP3 inflammatory pathway. Methods Ninety rats were randomly divided into the control group, the model group, the low-dose phillyrin (PH-L, 5 mg/kg) group, the medium-dose phillyrin (PH-M, 10 mg/kg) group, the high-dose phillyrin (PH-H, 20 mg/kg) group and the NLRP3 pathway inhibitor (PJ34, 10 mg/kg) group. FVC, FEV 0.1 and FEV 0.3 were detected by lung function analyzer. Electronic balance was used to weigh the mass of chest exudate. The number of white blood cells in exudate was detected by Wright staining. Contents of prostaglandin E2 (PGE2), monocyte chemoattractant protein-1 (MCP-1), interleukin (IL) -6 and tumor necrosis factor-α (TNF-α) in exudate were detected by ELISA. Automatic blood gas analyzer was used to detect p (CO2) and p (O2) of rats. HE staining was used to observe pathological changes of lung tissue. The expression levels of NLRP3 and Caspase-1 protein were detected by immunohistochemistry. Western blot assay was used to detect the expression of NLRP3 pathway protein. Results Compared with the control group, the quality of pleural exudate and the number of white blood cells, the contents of PGE2, MCP-1, IL-6, TNF-α, the expression of p (CO2) and NLRP3 pathway proteins in exudate of the model group increased obviously, FVC, FEV 0.1, FEV 0.3 and p (O2) decreased obviously, and the lung tissue showed obvious pathological damage (P<0.05). Compared with the model group, the quality of pleural exudate and the number of white blood cells, the contents of PGE2, MCP-1, IL-6, TNF-α, the expression of p (CO2), NLRP3 pathway proteins in the exudate of rats decreased obviously in the PH group and the PJ34 group, FVC, FEV 0.1, FEV 0.3 and p (O2) increased obviously, the pathological injury of lung tissue was obviously improved (P<0.05). Compared with the PH-H group, there were no significant differences in the above indexes in the PJ34 group (P>0.05). Conclusion PH can improve lung injury induced by acute pleurisy in rats by inhibiting the activation of NLRP3 pathway and inhibiting inflammatory reaction.
Key words: pleurisy; acute disease; phillyrin; lung injury; NLR family, pyrin domain-containing 3 protein
急性胸膜炎是病毒、细菌感染后侵犯胸膜引起的渗出性炎症[1]。该病临床表现为胸闷、呼吸急促、肺音高、呼吸困难,胸腔积液过多等[2]。炎症在胸膜炎发生、发展中起到重要作用,细胞因子是炎症反应过程中的介质,其中肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)和白细胞介素(interleukin,IL)-1β等炎性因子可以激活白细胞和其他细胞类型,放大炎症反应[3]。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)通路激活是炎症细胞因子形成的关键,NLRP3炎症小体是多种蛋白质的复合物,其以胱天蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)依赖性方式激活来促进炎细胞因子IL-1β的分泌,参与炎症调节[4]。连翘苷(phillyrin,PH)是中药连翘的重要活性成分,具有抗病毒、抗炎、抗氧化等活性[5]。研究发现,PH可通过抑制蛋白激酶B(AKT)/核因子-κB(nuclear factor κB,NF-κB)途径来减轻去甲肾上腺素诱导的心脏肥大和炎症反应[6]。NF-κB在受损组织中被激活后,可激活其下游NLRP3炎症小体,加剧组织炎症反应[7]。PH作为舒风节度胶囊中的重要组分,可治疗上呼吸道感染所致肺损伤[8]。本研究以胸膜炎大鼠为研究对象,探讨PH对急性胸膜炎的抗炎机制,为临床治疗胸膜炎相关肺损伤疾病提供理论参考。
1 材料与方法
1.1 材料 SPF级雄性SD大鼠90只,6~7周龄,体质量(220±20)g,购自导科医药技术(广东)有限公司,动物生产许可证号:SCXK(粤)2022-0060。所有大鼠饲养于本院实验动物中心,适应性喂养1周,自由饮食水。连翘苷标准品、L型角叉菜胶、HE染色试剂盒均购自索莱宝生物科技有限公司;前列腺素E2(prostaglandin E2,PGE2)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)、IL-6、TNF-α酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物科技有限公司;磷酸化NF-κB p65(p-NF-κB p65)、NF-kB p65、凋亡斑点样蛋白(apoptotic spot-like protein,ASC)、NLRP3、剪切的Caspase-1(Cleaved-Caspase-1,C-Caspase-1)、Caspase-1、GAPDH抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗購自Abcam公司。全自动生化分析仪、多功能酶标仪均购自赛默飞世尔科技中国有限公司;光学显微镜购自日本奥
林巴斯公司。
1.2 研究方法
1.2.1 造模及分组 大鼠按照随机数字表法分为对照组、模型组,连翘苷低(PH-L,5 mg/kg)、中(PH-M,10 mg/kg)、高(PH-H,20 mg/kg)剂量组[9]以及NLRP3通路抑制剂组(PJ34组,10 mg/kg)[10],每组15只。PH各组鼻腔给予对应剂量药物,PJ34组腹腔注射对应剂量药物,对照组、模型组均在相同部位给予等量生理盐水,连续给药7 d,1次/d。参照文献[11],对照组注射等体积生理盐水,其余组给药结束后2 h建立急性胸膜炎大鼠模型,麻醉大鼠,在大鼠右侧第7肋间注射2%角叉菜胶致炎。造模大鼠胸腔渗出物质量和白细胞升高,表现出典型的急性炎症,表明急性胸膜炎造模成功。
1.2.2 大鼠肺通气功能检测和样本采集 造模成功6 h后,麻醉大鼠,手术切开气管,将大鼠置于体描箱中,连接动物肺功能分析仪,测定用力肺活量(FVC)、第0.1秒用力呼气量(FEV 0.1)、第0.3秒用力呼气量(FEV 0.3)。肺通气功能检测完毕后,腹主动脉取血3 mL备用。采血完毕后,手术打开胸腔,无菌操作吸出渗出液,加入磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤胸腔,将渗出液和洗涤液合并,收集至离心管中,3 000 r/min离心10 min,收集上清液和沉淀物质(渗出物)备用;完成上述操作后,剥离肺组织备用。
1.2.3 胸腔渗出液中渗出物质量和白细胞数 取1.2.2分离的胸腔渗出液的沉淀物,分析天平精密称量沉淀物质量;称定后用PBS稀释、混匀,吸取50 μL细胞悬液于载玻片中,干燥后,进行瑞氏染色,光学显微镜观察并拍照,对白细胞进行计数。
1.2.4 胸腔渗出液炎性因子含量测定和大鼠血气值分析 取1.2.2采集的渗出液上清,根据ELISA试剂盒检测渗出液上清中PGE2、MCP-1、IL-6、TNF-α含量,具体操作严格根据试剂盒说明书进行。取1.2.2采集的动脉血,使用全自动血气分析仪检测大鼠动脉CO2分压[p(CO2)]、动脉氧分压[p(O2)]。
1.2.5 肺组织病理学变化观察 从各组中随机抽取5只大鼠麻醉处死后取右肺中叶,加入4%多聚甲醛固定,梯度乙醇脱水、浸蜡、包埋、连续4 μm切片,根据HE染色试剂盒说明书进行染色,中性树胶封片,光学显微镜观察并拍照。
1.2.6 免疫组织化学法检测肺组织NLRP3、Caspase-1蛋白表达 另从各组中随机取5只大鼠,麻醉处死后取右肺中叶,加入10%多聚甲醛固定,梯度乙醇脱水、O.C.T胶包埋,连续10 μm切片,烤片后,加入3%过氧化氢孵育,10 min后PBS冲洗,加入山羊血清室温封闭,滴加一抗NLRP3(1∶200)、Caspase-1(1∶200),4 ℃过夜,再加入二抗(1∶200),PBS冲洗后,加入DAB显色,苏木素复染。光学显微镜下拍照,肺组织中NLRP3、Caspase-1免疫组化阳性表达成棕黄色。分析NLRP3、Caspase-1蛋白表达量。
1.2.7 Western blot检测肺组织NLRP3通路蛋白表达 将剩余5只大鼠麻醉处死后取右肺中叶,液氮研磨后,加入蛋白裂解液提取蛋白,二辛可宁酸(dicinchonic acid,BCA)法测定蛋白浓度,取适量蛋白上样,电泳、转膜、封闭后,加入p-NF-κB p65、NF-kB p65、ASC、NLRP3、C-Caspase-1、Caspase-1及内参GAPDH(稀释比均为1∶1 000),4 ℃过夜,再加入二抗(1∶2 000),PBS冲洗后,加入ECL显影,根据条带灰度值计算蛋白相对表达量。
1.3 统计学方法 采用SPSS 26.0进行数据分析。符合正态分布的计量资料用[[x] ±s
]表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
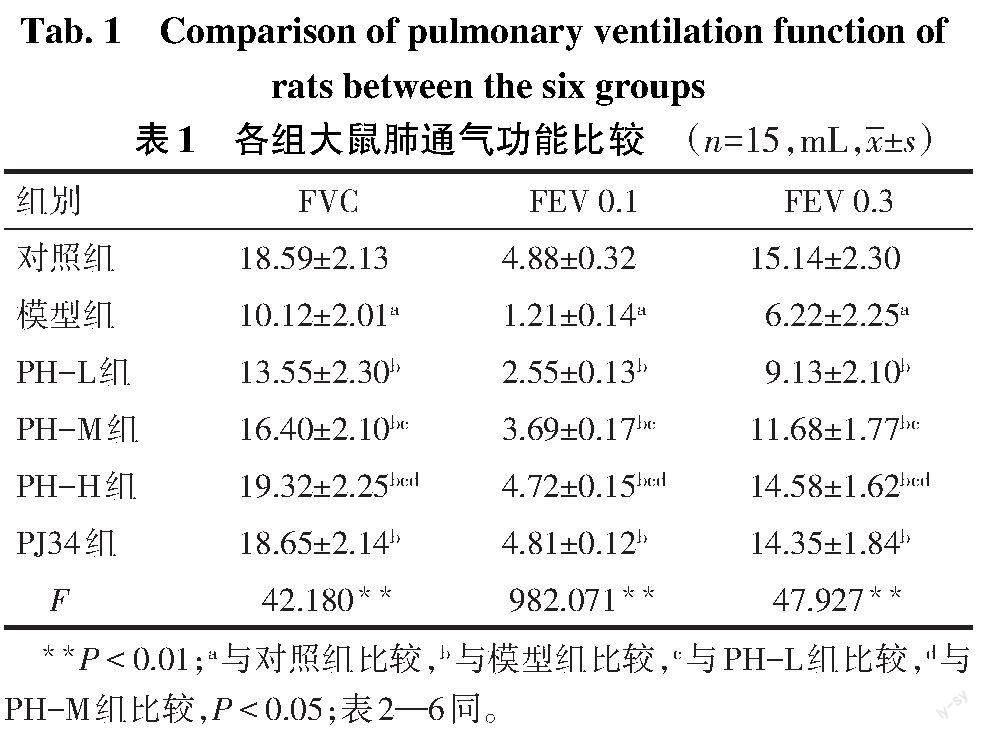
2.1 各组大鼠肺通气功能比较 与对照组比较,模型组大鼠FVC、FEV 0.1、FEV 0.3降低(P<0.05);与模型组比较,PH各组和PJ34组大鼠FVC、FEV 0.1、FEV 0.3增加(P<0.05),且PH-L组、PH-M组、PH-H组上述指标依次增加(P<0.05);与PH-H组比较,PJ34组FVC、FEV 0.1、FEV 0.3差异无统计学意义,见表1。
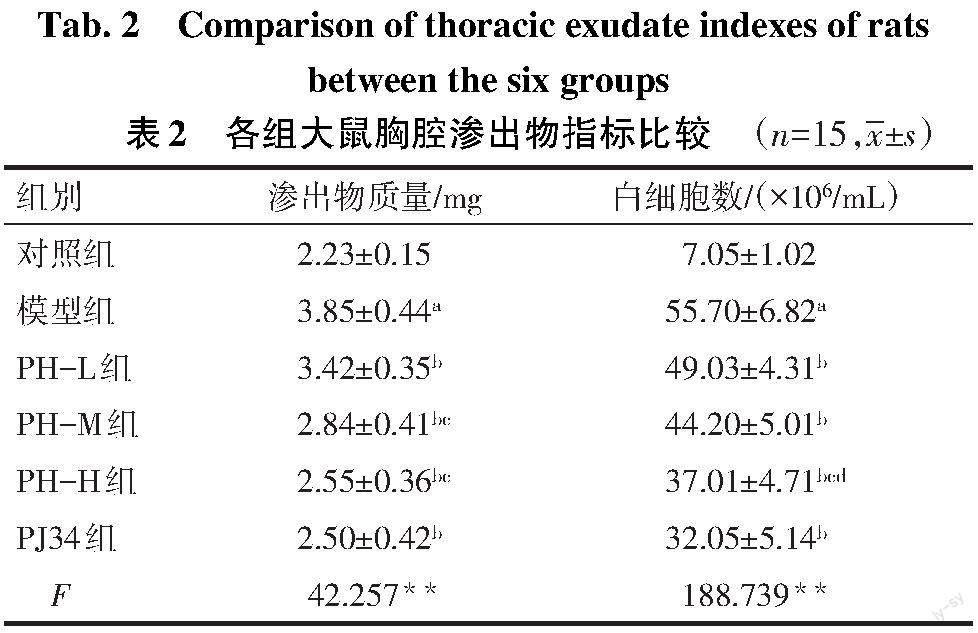
2.2 各组大鼠胸腔渗出物质量和白细胞数比较 与对照组比较,模型组大鼠胸腔渗出物质量和白细胞数增加(P<0.05);与模型组比较,PH各组和PJ34组大鼠胸腔渗出物质量和白细胞数降低(P<0.05);与PH-L组比较,PH-H组胸腔渗出物质量和白细胞数均降低,PH-M组胸腔渗出物质量降低(P<0.05);与PH-M组比较,PH-H组白细胞数降低(P<0.05);与PH-H组比较,PJ34组胸腔渗出物质量和白细胞数差异无统计学意义,见表2。
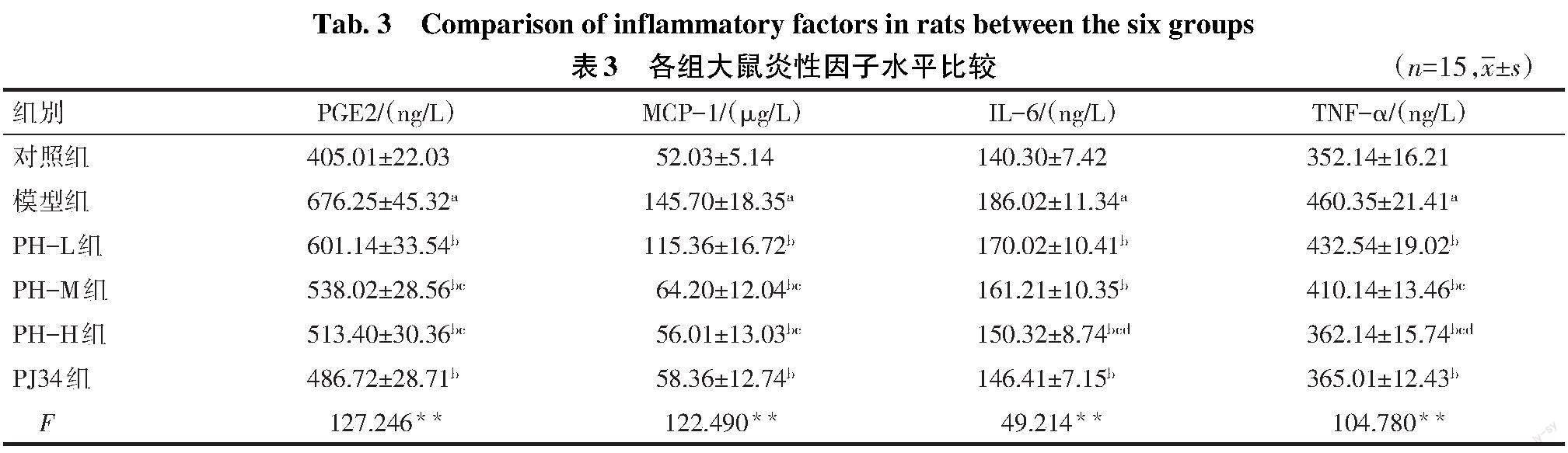
2.3 各组大鼠胸腔渗出液炎性因子水平比较 与对照组比较,模型组大鼠胸腔渗出液中PGE2、MCP-1、IL-6、TNF-α含量增加(P<0.05);与模型组比较,PH各组和PJ34组大鼠胸腔渗出液中PGE2、MCP-1、IL-6、TNF-α含量降低(P<0.05);与PH-L组比较,PH-H组上述指标的含量均降低(P<0.05),PH-M组PGE2、MCP-1、TNF-α含量降低(P<0.05);与PH-M组比较,PH-H组IL-6、TNF-α含量降低(P<0.05);与PH-H组比较,PJ34组胸腔渗出液中PGE2、MCP-1、IL-6、TNF-α含量差异无统计学意义(P>0.05),见表3。
2.4 各组大鼠p(CO2)、p(O2)值比较 与对照组比较,模型组大鼠p(CO2)增加,p(O2)降低(P<0.05);与模型组比较,PH各组和PJ34组大鼠p(CO2)降低,p(O2)增加(P<0.05);与PH-L组比较,PH-H组p(CO2)降低,p(O2)增加,PH-M组p(CO2)降低(P<0.05);与PH-M组比较,PH-H组p(CO2)降低,p(O2)增加(P<0.05);与PH-H组比较,PJ34组p(CO2)、p(O2)差异无统计学意义(P>0.05),见表4。
2.5 各组大鼠肺组织病理变化 对照组大鼠肺组织结构清晰完整,未见炎性细胞浸润;与对照组比较,模型组大鼠肺组织有红细胞渗出,细胞核变形,炎性细胞浸润到支气管,肺泡壁也明显增厚;与模型组比较,PH各组随着药物浓度增大,炎性细胞浸润逐渐减轻,PJ34组炎性细胞浸润减少,肺泡壁增厚现象减轻,见图1。
2.6 各组大鼠肺组织NLRP3、Caspase-1蛋白表达比较 与对照组比较,模型组大鼠肺组织NLRP3、Caspase-1阳性表达增强(P<0.05);与模型组比较,PH各组和PJ34组大鼠肺组织NLRP3、Caspase-1阳性表达降低(P<0.05),且PH-L组、PH-M组、PH-H组上述指标依次降低(P<0.05);与PH-H组比较,PJ34组NLRP3、Caspase-1阳性表达差异无统计学意义(P>0.05),见表5、图2。
2.7 各组大鼠肺组织中NLRP3炎性小体通路相关蛋白表达比较 与对照组比较,模型组大鼠肺组织p-NF-κB p65、ASC、NLRP3和C-Caspase-1表达增加(P<0.05);与模型组比较,PH各组和PJ34组大鼠肺组织p-NF-κB p65、ASC、NLRP3和C-Caspase-1表达降低(P<0.05),且PH-L组、PH-M组、PH-H组上述指标依次降低(P<0.05);与PH-H组比较,PJ34组p-NF-κB p65、ASC、NLRP3和C-Caspase-1表达差异无统计学意义(P>0.05),见图3、表6。
3 讨论
胸膜是覆盖在肺组织表面和胸壁内侧壁上的一层膜状软组织,可调节胸膜腔稳态。胸膜炎属于慢性炎症疾病,而角叉菜胶诱导的大鼠胸膜炎是一种以炎症为特征的模型,是研究胸腔积液的有效模型,会导致胸腔积液外渗和细胞积聚到胸膜腔,引起肺部严重并发症[12]。在本研究中,角叉菜胶诱导后模型大鼠胸腔渗出物质量增加,白细胞数目增多,说明造模成功。胸腔积液外渗和白细胞迁移会导致肺组织病变,引起肺泡壁增厚和炎性细胞浸润等病理损伤[11]。本研究对模型大鼠的肺功能和血气以及病理变化等进行检测后发现,模型大鼠出现明显的肺损伤,主要表现为肺功能降低,肺组织炎性细胞浸润增加,肺泡壁增厚,这与既往研究[11]结果一致,提示急性胸膜炎可导致肺损伤。
PGE2是炎症反应的主要介质,可以促进白细胞向炎症区域聚集,引发组织水肿、充血等病变[13]。MCP-1、TNF-α、IL-6在急性肺損伤患者体内高表达,促进中性粒细胞等白细胞聚集并释放更多炎症介质,加重肺组织炎症[14]。研究显示,在急性胸膜炎大鼠血清和胸腔渗出液中PGE2、TNF-α、IL-6水平均增加[11,15]。此外,MCP-1是胸膜渗出液形成的关键驱动因素,在角叉菜胶诱导的胸膜炎小鼠模型血清和胸腔积液中MCP-1水平增加,使用MCP-1拮抗剂阻断MCP-1活性可减少胸膜炎小鼠炎性胸腔积液的形成[16]。本研究在模型大鼠胸腔渗出液中检测到较高的炎性细胞因子PGE2、MCP-1、IL-6、TNF-α水平,并且白细胞数增多,肺组织发生明显的病理学变化,说明胸腔积液的渗漏引起了肺部严重的并发症。经过PH预处理后,模型大鼠胸腔渗出液炎性介质PGE2、MCP-1、IL-6、TNF-α释放减少,白细胞数减少,肺部病理学改变明显好转,肺功能明显好转,且PH-H组优于PH-L组和PH-M组,表明PH可抑制炎症反应,减轻急性胸膜炎大鼠肺损伤,提示PH具有治疗胸膜炎导致的肺损伤的潜力。
NLRP3是一種胞质多蛋白复合物,由先天免疫受体蛋白NLRP3、适配器蛋白ASC和炎症蛋白pro-Caspase-1组成,其过度激活会促进各种炎症性疾病的发展[17]。有研究发现NLRP3炎症小体活化后,pro-Caspase-1会裂解为具有活性的Cleaved Caspase-1,进而将pro-IL-1β裂解为成熟的IL-1β,促进炎性细胞募集,参与肺部疾病的发生、发展[18-19]。PH改善肺损伤的机制可能与抑制NLRP3炎性通路激活有关。在炎症疾病中,NLRP3受NF-κB调节而激活[20],抑制NLRP3炎性通路的激活可以减轻组织损伤[21]。在本研究中,模型大鼠肺组织中p-NF-κB p65、ASC、NLRP3和C-Caspase-1表达明显增加,表明NLRP3炎性通路被激活;经过PH预处理后,p-NF-κB p65、ASC、NLRP3和C-Caspase-1蛋白表达明显降低,表明NLRP3炎性通路被抑制,推测PH对肺损伤的改善作用可能是通过抑制NLRP3炎性通路实现。为了验证PH的抗炎作用是否与抑制NLRP3炎性通路有关,笔者设置了通路抑制剂组,发现通路抑制剂组与PH-H组呈现相似的治疗效果,再次证实了PH可能通过抑制NLRP3炎性通路激活,从而减轻胸膜炎大鼠的肺损伤。
综上所述,PH可以抑制NLRP3炎性通路激活,减少胸膜炎大鼠炎性介质释放和白细胞聚集,改善肺损伤。然而,炎症反应涉及多种通路协同作用,PH对胸膜炎大鼠肺损伤的治疗作用是否同时涉及其他通路作用,还有待进一步研究。
参考文献
[1] ALIKHANI A,ABBASPOUR KASGARI H,MAJIDI H,et al. Brucella pleurisy:an extremely rare complication of brucellosis[J]. Clin Case Rep,2022,10(9):e6366-e6370. doi:10.1002/ccr3.6366.
[2] BROWN S E,BYCROFT K A,ADAM K,et al. Acute fibrinous pleuropneumonia and septicaemia caused by Bibersteinia trehalosi in neonatal calves in New Zealand[J]. N Z Vet J,2021,69(1):51-57. doi:10.1080/00480169.2020.1792372.
[3] HOU T,YANG M,YAN K,et al. Amentoflavone ameliorates carrageenan-induced pleurisy and lung injury by inhibiting the NF-κB/STAT3 pathways via Nrf2 activation[J]. Front Pharmacol,2022,13:763608. doi:10.3389/fphar.2022.763608.
[4] XU J,N??EZ G. The NLRP3 inflammasome: activation and regulation[J]. Trends Biochem Sci,2023,48(4):331-344. doi:10.1016/j.tibs.2022.10.002.
[5] CHEN S,ZHANG S,WU H,et al. Protective effect of phillyrin against cerebral ischemia/reperfusion injury in rats and oxidative stress-induced cell apoptosis and autophagy in neurons[J]. Bioengineered,2022,13(3):7940-7950. doi:10.1080/21655979.2022.2042142.
[6] TANG K,ZHONG B,LUO Q,et al. Phillyrin attenuates norepinephrine-induced cardiac hypertrophy and inflammatory response by suppressing p38/ERK1/2 MAPK and AKT/NF-kappaB pathways[J]. Eur J Pharmacol,2022,927:175022. doi:10.1016/j.ejphar.2022.175022.
[7] MESSAOUD-NACER Y,CULERIER E,ROSE S,et al. STING agonist diABZI induces PANoptosis and DNA mediated acute respiratory distress syndrome (ARDS)[J]. Cell Death Dis,2022,13(3):269. doi:10.1038/s41419-022-04664-5.
[8] LI Y,CHANG N,HAN Y,et al. Anti-inflammatory effects of Shufengjiedu capsule for upper respiratory infection via the ERK pathway[J]. Biomed Pharmacother,2017,94(1):758-766. doi:10.1016/j.biopha.2017.07.118.
[9] ZHONG W T,WU Y C,XIE X X,et al. Phillyrin attenuates LPS-induced pulmonary inflammation via suppression of MAPK and NF-κB activation in acute lung injury mice[J]. Fitoterapia,2013,90(1):132-139. doi:10.1016/j.fitote.2013.06.003.
[10] 曹乐,唐雅雯,冯平,等. 辛伐他汀对蛛网膜下腔出血早期脑损伤大鼠NLRP3炎性小体的表达及NF-κB信号通路的影响[J]. 脑与神经疾病杂志,2023,31(1):23-28. CAO L,TANG Y W,FENG P,et al. Effect of Simvastatin on the expression of NLRP3 inflammasome and NF-κB signaling pathway in rats with early subarachnoid hemorrhage[J]. Journal of Brain and Neurological Diseases,2023,31(1):23-28.
[11] 赵博,杨馨怡,屈新亮,等. 黄芩茎叶抑制TRPV1通路改善大鼠急性胸膜炎的研究[J]. 中药药理与临床,2022,38(4):112-116. ZHAO B,YANG X Y,QU X L,et al. Effect of stem and leaf of Scutellaria baicalensis on acute pleurisy in rats by inhibiting TRPV1 pathway[J]. Pharmacology and Clinic of Chinese Traditional Medicine,2022,38(4):112-116. doi:10.13412/j.cnki.zyyl.20220418.002.
[12] CAIAZZO E,MORELLO S,CARNUCCIO R,et al. The Ecto-5'-nucleotidase/CD73 inhibitor,α,β-methylene adenosine 5'-diphosphate,exacerbates carrageenan-induced pleurisy in rat[J]. Front Pharmacol,2019,10(1):775-784. doi:10.3389/fphar.2019.
00775.
[13] WANG G,ZHANG Y,HU N,et al. Mesenchymal stem cells attenuate acute lung injury in mice partly by suppressing alveolar macrophage activation in a PGE2-dependent manner[J]. Inflammation,2022,45(5):2000-2015. doi:10.1007/s10753-022-01670-9.
[14] ZHAO H,CHEN H,XIAOYIN M,et al. Autophagy activation improves lung injury and inflammation in sepsis[J]. Inflammation,2019,42(2):426-439. doi:10.1007/s10753-018-00952-5.
[15] 黄媛恒,陈健,黄仁彬,等. 玉郎伞提取物对模型大鼠胸膜炎TNF-α、PGE2、NO的影响[J]. 中国药房,2010,21(3):200-202. HUANG Y H,CHEN J,HUANG R B,et al. Effect of Yulang Parasol extract on TNF-α,PGE2 and NO in pleurisy of model rats[J]. Chinese Pharmacy,2010,21(3):200-202.
[16] LANSLEY S M,CHEAH H M,LEE Y C. Role of MCP-1 in pleural effusion development in a carrageenan-induced murine model of pleurisy[J]. Respirology,2017,22(4):758-763. doi:10.1111/resp.12951.
[17] HUANG Y,XU W,ZHOU R. NLRP3 inflammasome activation and cell death[J]. Cell Mol Immunol,2021,18(9):2114-2127. doi:10.1038/s41423-021-00740-6.
[18] HSU C G,CH?VEZ C L,ZHANG C,et al. The lipid peroxidation product 4-hydroxynonenal inhibits NLRP3 inflammasome activation and macrophage pyroptosis[J]. Cell Death Differ,2022,29(9):1790-1803. doi:10.1038/s41418-022-00966-5.
[19] 卓玉珍,楊磊,鹿燕敏,等. 凉血活血方通过抑制NLRP3炎性小体活化保护脓毒症急性肺损伤小鼠的实验研究[J]. 中国中西医结合外科杂志,2022,28(2):173-178. ZHUO Y Z,YANG L,LU Y M,et al. Experimental study of Liangxue Huoxue Decoction ameliorates sepsis-induced ali in mice by inhibiting NLRP3 inflammasome[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2022,28(2):173-178. doi:10.3969/j.issn.1007-6948.2022.02.005.
[20] CAI B,ZHAO J,ZHANG Y,et al. USP5 attenuates NLRP3 inflammasome activation by promoting autophagic degradation of NLRP3[J]. Autophagy,2022,18(5):990-1004. doi:10.1080/15548627.2021.1965426.
[21] ZHANG C,WANG X,WANG C,et al. Qingwenzhike prescription alleviates acute lung injury induced by LPS via inhibiting TLR4/NF-kB pathway and NLRP3 inflammasome activation[J]. Front Pharmacol,2021,12:790072. doi:10.3389/fphar.2021.790072.
