神经反馈增强积极情绪在抑郁症治疗中的应用
2024-02-18车强燕孙韵琳靳佳朱春燕汪凯叶榕余凤琼
车强燕 孙韵琳 靳佳 朱春燕 汪凯 叶榕 余凤琼


摘 要 积极情绪的增强对抑郁症患者的临床症状改善和社会功能恢复具有重要意义。近年来神经反馈技术的发展为调控抑郁症积极情绪提供了有效的手段。传统积极情绪干预方法主观性强、治疗效果局限、缺乏可量化的客观评价指标, 基于客观生理和影像指标的神经反馈技术在增强抑郁症积极情绪中具有重要的应用价值。神经反馈通过可视化方式将实时的大脑活动反馈给被试, 让其能够使用特定的策略针对性地调控情绪相关脑区, 客观定量地评价积极情绪的改善。现有的研究在实验范式、参数设置和个体疗效上存在较大异质性。通过回顾和总结神经反馈增强积极情绪的实验设计、研究的影响因素和基于神经影像标记物的目标靶点, 强调了神经反馈实验设计和结果报告标准的重要性, 探索性地提出了基于奖赏环路的潜在干预靶点及优化方案。有望为临床抑郁症积极情绪恢复提供可操作性的参考方案, 为未来神经反馈技术在抑郁症临床症状治愈和社会功能康复中的转化应用和普及奠定基础。
关键词 积极情绪, 神经反馈, 抑郁症, 快感缺失, 脑电图, 功能磁共振成像
分类号 B845
1 引言
快感缺失是指兴趣或快乐体验的降低或缺失以及对愉悦刺激缺乏反应(Pizzagalli, 2022)。快感缺失症状与抑郁发作次数、病程和总体症状严重程度呈正相关(Gabbay et al., 2015), 也是预测自杀的风险因子(Ducasse et al., 2021; Sagud et al., 2021)。同时, 快感缺失被证明是抗抑郁药治疗的残留症状(Dunlop et al., 2020)。积极情绪缺失是抑郁症快感缺失的核心临床表现(Treadway & Zald, 2011), 因此以增强积极情绪为目标的干预可以减
少抑郁症快感缺失症状(Werner-Seidler et al., 2013)。其次, 增强抑郁症的积极情绪可以促进患者社会功能的恢复, 并使他们体验到更多的幸福感(Dunn et al., 2019)。美国国家精神卫生研究所(NIMH)研究领域标准(research domain criteria, RDoC)提出的正性效价系统(Positive Valence Systems, PVS)也强调了关注精神疾病人群积极情绪的重要性(Cuthbert & Insel, 2013; Sanislow et al., 2019), 也有研究者呼吁抑郁症创新治疗中对积极情绪缺失的重点干预(Dunn et al., 2019)。因此致力于抑郁症患者积极情绪的恢复对抑郁症治疗具有重要的临床和社会意义。
传统的抑郁症治疗方法聚焦于消极情绪的改善(Vanderlind et al., 2020), 近年来针对积极情绪恢复的治疗仍处于探索阶段。经典抗抑郁药(如: SSRI)在治疗快感缺失方面的效果有限(Nutt et al., 2007) 并可能会加重快感缺失症状(Goodwin et al., 2017); 近年来研究发现临床实验性药物(如致幻剂)对抑郁症快感缺失治疗有效。致幻类药物通过激动5HT-2A受体使人产生欣快感, 从而减缓快感缺失症状并增强积极情绪(Daws et al., 2022)。然而致幻剂的副作用以及药物自身的不可控性将会阻碍该类药物在临床中的转化。经典心理治疗(如认知行为疗法)主要针对消极情绪的改善, 对积极情绪恢复的作用有限(Dunn et al., 2020), 治疗抑郁症快感缺失的效果并不明确(Fernandez et al., 2015)。近年来针对积极情绪缺失的治疗开发了一系列训练方法(Chen et al., 2020; Craske et al., 2016; Taylor et al., 2017), 包括积极情绪治疗(Positive Affect Treatment, PAT)、虚拟现实奖赏训练(Virtual Reality-Reward Training, VR-RT)、正性放大训练(Ampli?cation of Positivity, AMP)等。这些新型心理治疗显示出改善积极情绪的初步效果(Taylor et al., 2017)。然而以上研究的评价指标都是基于患者的自我报告以及治疗师的定性访谈评估, 并没有客观的指标来实时地监测患者积极情绪的改变, 也没有神经生理指标来衡量积极情绪的增强。最后, 除了药物治疗、心理治疗, 非侵入性脑刺激技术也广泛应用于抑郁症辅助治疗。但实际应用中发现重复经颅磁刺激(repetitive transcranial magnetic stimulation, rTMS)和电休克治疗(electroconvulsive therapy, ECT)可导致副反应的发生, 包括患者报告的局部疼痛和记忆障碍等(Cusin & Dougherty, 2012)。rTMS针对不同严重程度抑郁症的治疗效果变异性大(15%~62%), 存在较大个体差异(Janicak & Dokucu, 2015), 可能是刺激靶点的精确性和有效性低影响了rTMS的治疗效应(Klooster et al., 2016)。近期一项三盲、多中心的研究评估了经颅直流电刺激(transcranial direct current stimulation, tDCS) 在重度抑郁症患者中的疗效, 结果表明tDCS的有效性有待進一步研究(Burkhardt et al., 2023)。同时这些脑刺激技术共同的特点是患者是被动的接受者, 无法主动调控自己大脑的神经活动, 根据社会学习理论, 让抑郁症患者学会自己对环境有更多的主动控制感, 对其社会功能恢复有重要意义。综上所述, 目前抑郁症常规治疗不能精准有效地干预积极情绪的恢复, 正在探索的治疗方法仍存争议且治疗效果评价指标未量化, 急需探索更加安全有效精准调控积极情绪的方法, 并能够用更加客观量化可操作性的方式去评估积极情绪改善效果。
近年来研究者关注到了神经反馈增强抑郁症积极情绪的治疗价值。神经反馈(Neurofeedback, NF)是一种非侵入性神经调控技术。该方法利用各种神经成像技术获取大脑活动的实时测量, 并将可视化结果反馈给被试, 被试可以学习大脑活动的特定特征和心理活动的联系, 从而达到自我调节脑功能活动和相关功能的目标(Kim & Birbaumer, 2014; Sitaram et al., 2017)。呈现神经反馈信号的神经成像技术包括电生理学方法和血流动力学成像方法(Sitaram et al., 2017)。电生理技术包括脑电图(electroencephalography, EEG)、脑磁图(magnetoencephalography, MEG)和侵入性皮层脑电图(invasive electrocorticography, ECoG), 检测神经活动的血流动力学成像方法包括功能磁共振成像(functional magnetic resonance imaging, fMRI)和功能近红外光谱成像(functional near-infrared spectroscopy, fNIRS)。相比其他非侵入性神经调控技术, 神经反馈作为一种“内源性”刺激器, 具有更高的安全性、更少的副作用及更精准调控相关脑区。更重要的是, 这种非侵入性的内源性神经调控技术将患者作为主动的调控者, 增加了抑郁症患者对环境的控制感(Linden, 2014), 在神经反馈训练过程中给予被试的正强化能够增强患者的动机和自我效能感(Dimidjian et al., 2011), 可能对患者社会功能恢复具有重要价值。
在抑郁症积极情绪干预中结合神经反馈的神经成像技术主要为EEG和fMRI, 神经反馈技术主要通过让抑郁症患者自主调控“快乐中枢”, 加强情绪调节过程中的监测, 从而改善积极情绪, 为增强抑郁症患者的自我调节能力提供客观可操纵的临床工具(McRae & Gross, 2020; Paret & Hendler, 2020)。早期基于额叶α波偏侧化(frontal alpha asymmetry, FAA)理论开展了一系列抑郁症情绪障碍相关的EEG神经反馈研究, 为我们了解神经反馈在抑郁症积极情绪干预中的应用奠定了一个良好的基石, 近年来, 实时功能磁共振成像神经反馈(real-time functional magnetic resonance imaging neurofeedback, rtfMRI-nf)在抑郁症的情绪障碍干预中得到广泛应用, 进一步积累了神经反馈增强积极情绪的证据。因此总结现有的神经反馈研究对厘清抑郁症积极情绪障碍的神经机制, 促进临床应用研究转化和恢复患者社会功能有重要意义。
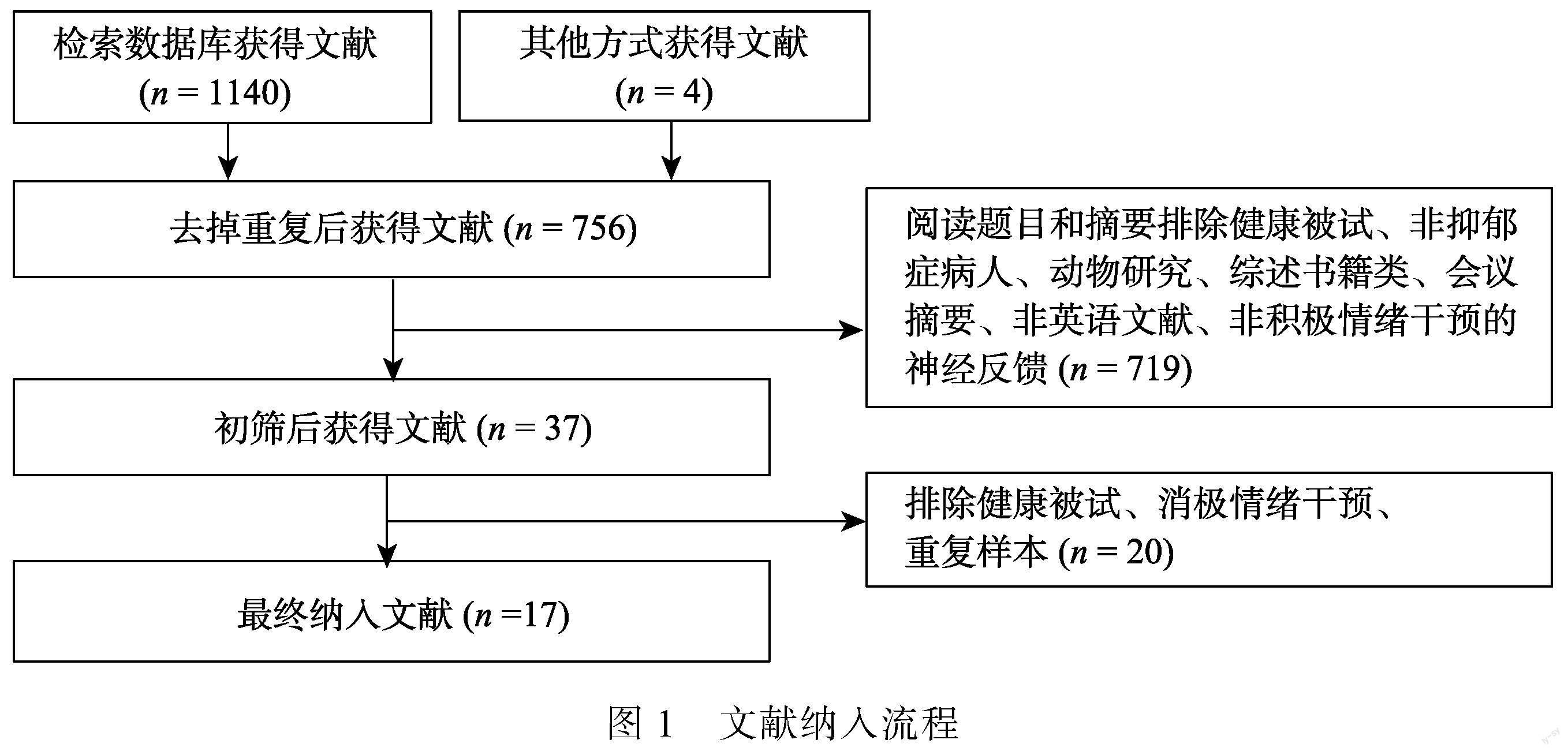
尽管神经反馈具有良好的应用前景, 但其临床疗效尚未得到明确证明, 可能是由于实验方法缺乏统一标准、设计方案可比较性和可重复性差、治疗效果的个体差异大。虽然也有聚焦于抑郁症神经反馈的文献综述(Trambaiolli et al., 2021), 其未探讨神经反馈在抑郁症积极情绪恢复中的重要作用。因此, 本文将以抑郁症积极情绪障碍为切入点论述神经反馈技术调控“快乐中枢”的设计流程以及存在的问题。本文通过多个数据库(PubMed、Web of Science、PsycINFO、Cochrane Library、ScienceDirect)的系统检索和谷歌学术网站等其他来源补充, 截至 2023年9月1日, 使用以下自由词和主题词组合进行搜索:(depress*) AND (neurofeedback OR biofeedback) AND (emot* OR affect*), 初步搜索到1144篇文献, 经过排除与主题无关文献(具体排除标准如图1所示), 最终纳入了17篇神经反馈治疗抑郁症积极情绪障碍的研究, 拟对神经反馈在抑郁症积极情绪干预中的应用进行综述。针对当前这一新兴领域存在的挑战, 通过本文, 我们希望对神经反馈增强抑郁症积极情绪研究的应用现状讨论总结, 定性评估神经反馈对改善抑郁症积极情绪障碍的疗效并相应地提出可能的解决方案, 为将来的神经反馈增强积极情绪的临床试验提供建议和参考, 提出未来研究的可能方向, 为抑郁症积极情绪恢复的干预提供新的视角。
2 诱导积极情绪的范式
目前的神经反馈实验并没有标准化的诱导积极情绪的范式。最主要的策略包括采用自传体记忆(autobiographical memory)、心理意象(mental
imagery)以及使用情绪刺激性材料来诱导被试积极情绪的产生。
自传体记忆受损是抑郁症的一个关键认知特征, 表现为对积极情感记忆的缺失(Dalgleish & Werner-Seidler, 2014), 即抑郁症患者积极记忆缺失抑制对未来积极事件的丰富心理表征, 因此抑郁症自传体记忆受损可能会降低积极情绪体验。基于自传体记忆的情绪诱发策略通常引导被试以一种生动具体的方式去产生与个人相关事件的積极回忆(Arditte Hall et al., 2018), 从而指导患者进行自传体记忆的主动探索。神经反馈训练中通过积极自传体记忆诱导积极情绪的具体步骤为:实验开始前先让被试思考与个人经历相关的积极场景, 写下几个积极自传体记忆, 在练习阶段给被试不同的回忆时间, 指导被试熟悉并加强积极的自传体记忆, 从而诱导其积极情绪的产生, 被试积极情绪量表得分的提高表明了该策略的有效性(Zotev et al., 2020)。
心理意象与情绪加工密切相关(Skottnik & Linden, 2019), 抑郁症患者表现出过度的消极心理意象和缺失的积极心理意象(Holmes et al., 2016)。心理意象策略通过让被试想象积极刺激或积极场景的具体细节, 从而增强积极情绪体验, 改善抑郁症状。有研究评估了积极的心理意象在减少抑郁症快感缺失、调动积极情绪是有效的(Blackwell et al., 2015)。心理意象与神经反馈的结合具有协同潜力, 心理意象是被试在神经反馈技术中能够学习自我调节大脑活动的关键机制之一 (Skottnik & Linden, 2019)。即通过神经反馈界面提供给被试心理意象的大脑神经活动, 同时被试能够基于反馈的大脑信号调动更加有效的心理意象来增加积极情绪, 并且调控大脑活动向目标状态变化。在神经反馈训练中通过积极心理意象诱导积极情绪的具体步骤为:在练习阶段让被试尽可能详细地想象积极刺激或积极场景, 练习调用积极心理意象的最佳策略。在神经反馈训练阶段利用积极心理意象同时调控相应脑区活动。例如有研究表明抑郁症通过主动调动积极心理意象来调节大脑目标区域的活动(Mehler et al., 2018)。
此外, 有些研究使用情绪刺激性材料来诱导被试的情绪, 包括只呈现情绪刺激性材料(Linden et al., 2012)以及情绪刺激性材料结合其他策略:如积极心理想象(Ahrweiler et al., 2022)或积极自传体记忆(Zhu et al., 2019)。只呈现情绪刺激性材料的诱导积极情绪范式为:先给被试在磁共振扫描期间呈现不同效价和唤醒度水平的图片, 在呈现积极图片时定位不同被试所激活的脑区, 这些脑区将作为神经反馈训练的靶点。呈现情绪刺激性材料结合其他策略的具体方法为:被试在观看积极图片的同时产生积极的自传体回忆或心理意象, 然后尝试调控大脑活动, 进而增加被试的积极情绪。总之, 大部分rtfMRI-nf都通过将积极的自传体记忆与神经反馈相结合的方式来干预抑郁症的积极情绪障碍(如表1所示)。以上诱导积极情绪的策略都能有效地诱发出被试的积极情绪, 然而目前对于哪种诱导积极情绪策略更有效尚无定论。
探究最佳的诱导抑郁症积极情绪的范式将会为神经反馈干预抑郁症积极情绪障碍带来更大的治疗潜力。如上所述, 抑郁症患者存在积极自传体记忆和积极心理意象的缺失, 因此相比健康被试, 抑郁症患者很难成功调动积极自传体记忆和积极心理意象来体验积极情绪。这可能是目前使用的诱导积极情绪范式的缺陷。此外, 自传体记忆和心理意象密切相关。心理意象促进了特定记忆的检索, 而特定的检索方式反过来又促进了基于图像的表征(Holmes et al., 2016)。因此未来有必要在实验范式中增加记忆特异性训练, 从而更有效的诱导抑郁症患者的积极情绪, 同时探究有可能与神经反馈相结合的诱导积极情绪的范式的有效性。例如以正性效价系统为目标增加积极情绪的方法包括积极情绪治疗、虚拟现实奖赏训练、正性放大训练等。
3 基于神经影像标记物:增强积极情绪的神经反馈靶点
3.1 脑电前额叶α偏侧化
FAA被认为是一种很有前途的抑郁症脑电图生物标记物以及情绪环路神经调控的靶点(Sun et al., 2017), 也是情绪障碍(Kuusinen et al., 2021)和精神疾病的神经生物标记物(Koller-Schlaud et al., 2020)。FAA的提出源于Davidson的左右半球偏侧化理论(Davidson, 1992)。该理论认为左额半球与行为激活系统(behavioral activation system, BAS)有关, 包括趋近动机和積极情绪(Stewart, Coan, et al., 2011)。右额半球与行为抑制系统(behavioral inhibition system, BIS)有关, 包括退缩或回避动机、负面情绪、抑郁和焦虑共病(Mathersul et al., 2008; Stewart, Towers, et al., 2011; Thibodeau et al., 2006), 同时发现抑郁症患者左额叶的活动水平降低, 右额叶活动水平增加(Davidson, 1992)。既往关于抑郁症的研究发现α波存在明显的前额叶激活偏侧化, 由于α波强度的变化与皮层神经元的激活呈负相关(Cook et al., 1998), 主要表现为左额叶α波强度增加, 右额叶α波强度减少(Segrave et al., 2011)。因此FAA表示左侧额叶和右侧额叶α波(8~13 Hz)活动强度的差异(刘雷, 周仁来, 2015; 张晶, 周仁来, 2010)。从神经反馈的角度可以通过训练患者减少左额叶α活动, 增加右额叶α活动, 或调节这种偏侧化的强度以重新平衡激活水平, 使其有利于大脑左额叶, 从而增加抑郁症的积极情绪。
基于FAA理论, 研究者们也开展了一系列将FAA作为抑郁症神经反馈靶点的研究, 这些研究主要通过神经反馈训练上调FAA活动从而干预抑郁症积极情绪障碍。Baehr等人(1997)提出了前额叶α偏侧化评分(A1)来表示FAA, 开发了前额叶α偏侧化神经反馈方案(Alpha-asymmetry neurofeedback, ALAY)。定义FAA为右侧额叶电极点记录的α波强度的自然对数值和左侧额叶电极点记录的 alpha 波强度的自然对数值的差值, 即FAA表示为ln (P (右侧α)) – ln (P (左侧α)), 其中P表示右侧和左侧对应前额叶EEG通道的α频段脑电功率, 目前以FAA作为抑郁症神经反馈靶点的研究都以Cz为参考电极, 以F4和F3通道的α频段脑电功率作为神经反馈的指标(如表1所示)。A1的计算公式为A1 = ln F4 – ln F3。差值为正的FAA表明左侧前额叶区域的激活相对更强, 前额叶左侧化程度更高。基于Baehr等人的工作, 研究者们也参考该方案开展了抑郁症治疗的研究(具体如表1所示)。然而, 脑电图神经反馈(Electroencephalogram neurofeedback, EEG-nf)中聚焦于FAA的研究结果出现了不一致的情况(Cheon et al., 2016; Hammond, 2008; Peeters et al., 2014)。Hammond刚开始使用ALAY方案治疗一名严重抑郁症患者, 该患者的A1评分难以提高, 同时这位病人感到紧张、焦虑, 并反复思考训练目标失败的问题。Peeters等人发现虽然FAA没有显著变化, 但患者的临床情况有所改善。Cheon等人经过8周的ALAY治疗后, A1评分并没有增加。因此, 关于EEG-nf结果的有效性, 已经出现了激烈的讨论。一些研究者声称EEG-nf的治疗靶点太宽泛, 因此不可能将其从安慰剂效应中分离出来(Thibault et al., 2017; Thibault & Raz, 2016), 治疗抑郁症的EEG-nf方案增强了认知功能(Escolano et al., 2014), 但未能对情绪和情绪特征产生任何影响(Arns et al., 2017)。目前FAA对抑郁、情绪及其认知调节的作用还缺乏稳健的数据(Batail et al., 2019)。因此未来有必要继续探索FAA作为抑郁症增强积极情绪的神经反馈靶点的临床效果, 从而来为EEG-nf对抑郁症积极情绪干预的作用提供有力的证据支持。
3.2 功能磁共振成像神经反馈的靶点脑区
功能磁共振成像神经反馈(functional Magnetic Resonance Imaging neurofeedback, fMRI-nf)具有更高的定位精度和更直接探索情绪相关大脑深部结构的优势(Linden, 2014)。因此fMRI-nf能够直接定位于积极情绪相关的脑区, 从而更精准地干预抑郁症的积极情绪障碍。功能磁共振成像神经反馈目标靶点的选择主要分为两种:基于单个脑区的靶点(如图2所示)和基于脑环路的靶点(Taschereau-Dumouchel et al., 2022)。基于单个脑区靶点的神经反馈指标主要是靶点脑区的血氧水平依赖(blood oxygenation level-dependent, BOLD)信号。
3.2.1 杏仁核
杏仁核(Amygdala, Amy)是人类大脑中情绪加工脑环路的关键区域(Frank et al., 2014)。杏仁核在促进对情绪刺激的注意和感知方面起着关键作用, 这些证据来自对杏仁核受损患者的研究。这些患者无法表现出对情绪刺激的正常注意(Anderson & Phelps, 2001)。此外, 杏仁核也参与采用认知控制的情绪调节。例如有研究发现, 这种对情绪场景的重新评估也会导致杏仁核激活的减少(Ochsner et al., 2002)。同时, 杏仁核作为情绪加工的核心区域与其他参与情绪处理的脑区存在紧密联系。例如杏仁核与控制情感记忆和情绪调节的区域有神经解剖学上的联系, 包括海马体、前扣带回和眶额叶皮质(orbitofrontal cortex, OFC) (Sah et al., 2003), 并且在涉及情绪调节的任务中与这些区域有相互的功能连接(Banks et al., 2007)。
除了在情绪加工中发挥的关键作用, 杏仁核在重度抑郁症患者神经生物学机制中也具有核心作用。健康对照组杏仁核BOLD信号活动在积极和消极的情绪刺激下都会增加(Sergerie et al., 2008), 而重度抑郁症患者杏仁核对积极刺激的反应减弱, 对消极刺激的反应增强(Suslow et al., 2010), 此外, 更严重的抑郁症状与杏仁核对积极刺激的反应减弱有关(Suslow et al., 2010), 在成功的抗抑郁药物治疗后(Victor et al., 2010), 这种反应增强。同时, 重度抑郁症患者的情绪处理偏差在记忆中表现明显, 包括对积极情绪的自传体记忆的回忆缺陷(Young et al., 2016)。杏仁核对积极刺激的反应性较低, 可能表明在编码积极效价刺激时参与动机较低或者对积极刺激的注意偏差(Joormann & Vanderlind, 2014), 这表明神经认知技术增加积极干预可能在重度抑郁症的临床管理中具有治疗潜力。因此, 从神经反馈的角度来看, 增加杏仁核对积极刺激的活性为目标的训练可能通过让这种情绪加工偏差正常化而发挥治疗作用, 进而增加积极情绪。但由于杏仁核的偏侧化理论表明左右杏仁核在时间动力学方面存在功能分离:右侧杏仁核参与快速和自动检测情绪刺激, 而左侧杏仁核参与更详细和复杂的情绪刺激评估(Baas et al., 2004; Sergerie et al., 2008), 此外, 有研究表明当抑郁症患者对积极的刺激做出反应时, 左侧杏仁核的血流动力学活动更为突出(Victor et al., 2010)。故选择左侧杏仁核作为神经反馈靶点更加清晰地体现出积极情绪加工的大脑活动。从表1可以看出, 大部分rt-fMRI的研究将左侧杏仁核作为神经反馈靶点, 通过上调杏仁核的活动增加积极情绪, 从而改善抑郁症积极情绪障碍。Young等人(2018)开展的针对重度抑郁症患者rtfMRI-nf以左侧杏仁核为神经反馈靶点。结果表明杏仁核活动的上调与临床症状改善程度之间存在显著关系, 同时也改善了情绪加工偏差。更重要的是在没有神经反馈的阶段, 抑郁症患者仍然可以持续地上调杏仁核的活动, 促进临床症状改善, 该结果表明在脱离了标准实验室的真实社会环境中患者也能成功地调控特定的脑区来改善积极情绪障碍。神经反馈将杏仁核作为神经反馈积极情绪调节靶点的训练的各种研究结果是令人鼓舞的, 并表明这种方法在缓解重度抑郁症积极情绪缺陷方面的临床应用价值。
3.2.2 海马体
海马体(hippocampus)参与情绪加工和对积极刺激的反应包括积极情绪记忆(Santangelo et al., 2018)。海马体位于内侧颞叶, 与负责情绪记忆回忆和情绪调节的杏仁核相连(Schumacher et al., 2018)。考虑到海马体在积极情绪加工中的作用, 研究者评估了将海马体作为神经反馈训练靶点的有效性(Zhu et al., 2019)。该研究让健康被试通过积极自传体记忆调动积极情绪的同时上调海马体的活动, 结果表明真实神经反馈组被试的海马体活动明显高于假神经反馈对照组。但该研究仅仅评估了神经反馈前后对比的实验效应, 并没有评估不同神经反馈训练阶段被试的表现及去除神经反馈信号的学习迁移(transfer)阶段, 无法评估被试在训练中的学习情况。因此未来需要进一步完善实验设计及分析方法, 在此基础上评估海马体作为抑郁症积极情绪干预有效靶点的可行性。
3.2.3 前额叶皮层
前额叶皮层(prefrontal cortex, PFC)在认知和情绪加工中发挥重要作用。腹外侧前额叶皮层(ventrolateral prefrontal cortex, vlPFC)是神经反馈情绪调节训练的合适目标靶点, 左侧vlPFC在认知重评方面比右侧vlPFC更有优势(Keller et al., 2021)。背外侧前额叶皮层(dorsolateral prefrontal cortex, dlPFC)参与使用认知策略进行情绪调节(Ochsner & Gross, 2005)。研究表明, 与健康对照组相比, 抑郁症患者dlPFC的活性和代谢降低(Opel et al., 2017), 有研究通过呈现积极情绪图片识别出不同抑郁症患者激活的不同情绪相关脑区作为个体化神经反馈的训练靶点, 结果表明积极情绪相关的大脑区域的活动上调(Linden et al., 2012), 例如dlPFC、vlPFC、OFC、脑岛和内侧颞叶等区域。Linden等人(2012)虽已对抑郁病人以PFC为主的多个脑区进行干预并取得了积极效果, 但未评估认知状况是否得到改善。此外, 在健康被试的神经反馈研究中, 试图通过调控PFC脑区以减少消极情绪, 结果证明被试无法有效调控PFC的活动, 但与无神经反馈的对照组相比, 杏仁核的活动明显降低(Sarkheil et al., 2015)。將PFC作为神经反馈靶点的疗效不明确可能是由于其广泛地参与情绪加工过程以及与其他脑区域存在紧密的联系。因此未来的研究可以考虑以前额叶为核心的情绪脑环路或脑网络作为神经反馈靶点, 并且全面的评估对抑郁症患者产生的情绪、认知等方面的改变。
3.2.4 脑岛
脑岛(insula)是情绪产生和情感体验的重要脑区, 但脑岛情绪加工的偏侧化使得我们在选择神经反馈靶点时会有所不同。有元分析显示积极的情绪刺激激活左侧前叶, 而消极的情绪刺激激活双侧前岛叶(Duerden et al., 2013)。众多研究表明抑郁病人在情绪任务中脑岛激活异常。例如有元分析证明了抑郁症患者在处理情绪性刺激时岛叶皮层的激活程度高于健康受试者(Hamilton et al., 2012)。另外有证据表明, 当观看消极图片时, 抑郁症患者右侧脑岛和右侧海马体的活动减弱。相反, 与健康对照组相比, 抑郁患者观看积极图片会导致左脑岛和右侧前扣带回的活动减少(Lee et al., 2007)。总之, 以上结果表明如果要针对抑郁症的积极情绪缺陷, 可能选择左前岛叶比较合适。目前以脑岛为神经反馈靶点的神经反馈积极情绪训练只有健康被试的研究(Lawrence et al., 2014)。该研究指导被试通过正念想象放松来上调右侧前岛叶的活动, 被试能够成功上调该脑区的活动, 但没有发现积极情绪的增加。该结果可能的原因是脑岛的偏侧化导致了对积极和消极情绪加工的不同。因此, 未来的研究应该将脑岛不同子区域作为神经反馈靶点, 从而来对照不同子区域对抑郁症积极情绪干预的作用。
3.2.5 前扣带回皮层
前扣带回皮层(anterior cingulate cortex, ACC)在情感状态的产生中起核心作用(Critchley, 2005)。其中亚属前扣带回皮层(subgenual cingulate cortex, sgACC)作为情绪处理和情绪障碍发病机制的关键大脑区域, sgACC已被证明在抑郁症的默认模式网络功能中过度激活(Greicius et al., 2007)。有研究者在初步定位了每个健康受试者诱导积极情绪后sgACC的激活区域, 选择每个被试个体化激活sgACC区域作为神经反馈靶点, 让被试下调sgACC的活动, 与来自无关脑区的假神经反馈组相比, 真神经反馈组sgACC激活显著减少(Hamilton et al., 2011)。但該研究样本量较少, 真神经反馈组只有8人, 也没有评估被试积极情绪的改善情况。因此未来需要进一步在扩大样本量的基础上继续探索脑岛作为抑郁症积极情绪障碍干预的有效性。
3.2.6 伏隔核
多巴胺能奖赏区域在抑郁症快感缺失和积极情绪缺陷中具有重要意义。伏隔核(nucleus accumbens, NAcc)是奖赏动机的重要脑区(Martz et al., 2016)。NAcc接收来自中脑腹侧被盖区的大量多巴胺神经元的信号传导, 对奖赏刺激的快乐体验和动机寻求有重要作用(Salamone et al., 2016)。在健康受试者中第一次尝试训练上调NAcc的活动取得了积极的结果, 随着NAcc活动的增加, 积极情绪得到改善(Greer et al., 2014)。但该研究未设置对照组, 仅在健康被试中初步探索, 未来可以在进一步考虑优化实验设计的基础上将其应用于抑郁症及其他情绪、动机障碍人群。
总之, 以上研究证明被试可以自主调控来自不同脑区的BOLD信号, 学习控制这些信号导致行为改变和临床症状改善。目前基于功能磁共振成像神经反馈的单个靶点脑区包括杏仁核、前额叶皮层、脑岛、前扣带回皮层及伏隔核, 由于杏仁核在抑郁症情绪加工的核心作用使得其成为干预抑郁症患者积极情绪障碍的“明星脑区”。由于各个研究设计的异质性问题没有定量的证据证明各个靶点的有效性, 但基于不同神经反馈研究设计的质量, 定性评估的证据表明在高质量神经反馈研究中以杏仁核为神经反馈靶点的有效性得到了支持(Barreiros et al., 2019), 而其他脑区作为神经反馈有效靶点的证据尚不明确, 未来需在进一步规范神经反馈实验设计的基础上探究各个脑区作为神经反馈靶点的有效性问题。
3.3 杏仁核与其他情绪加工脑区连接的脑环路靶点
近年来, 研究者们意识到抑郁症不仅仅是单一脑区域的异常导致的, 更是一种“脑网络功能失调或结构紊乱”导致的疾病(Luo et al., 2021)。基于情绪脑网络的连接可以成为神经反馈训练的潜在目标。目前的神经反馈研究方法从单个脑区的训练转变到基于多个脑区连接的神经反馈训练, 未来需要进一步探究脑网络的神经反馈训练。本部分将主要基于杏仁核和其他情绪加工相关脑区连接的神经反馈研究展开论述(如图3所示)。目前抑郁症积极情绪干预中基于连接的神经反馈指标包括脑区间的静息态功能连接和有效连接。
3.3.1 左侧杏仁核与左侧前扣带皮层喙部环路
前扣带皮层喙部(rostral anterior cingulate cortex, rACC)是情绪调节和杏仁核活动调节的关键结点, 左侧rACC与左侧杏仁核脑环路是抑郁症患者积极情绪障碍神经反馈训练的一个有希望的靶点, 该环路神经反馈信号的产生机制为左侧rACC与左侧杏仁核的静息态功能连接。有研究发现健康被试在rtfMRI-nf训练中左侧杏仁核活动的上调伴随着左侧杏仁核与左侧rACC在内的6个前额叶皮层区域之间静息态功能连接的显著增强(Zotev et al., 2011)。这些脑区包括rACC, 双侧背内侧前额叶皮层(bilateral dorsomedial prefrontal cortex ), 双侧额上皮层脑回(bilateral superior frontal gyrus )和右内侧额极皮层(right medial frontopolar cortex)。针对该脑网络的有效连接分析表明, 在rtfMRI-nf训练中左侧rACC在调节左侧杏仁与其他前额叶皮层区域的活动中发挥重要作用(Zotev et al., 2013)。在重度抑郁症患者中, 左侧杏仁核和左侧rACC之间的静息态功能连接与抑郁严重程度呈负相关(Yuan et al., 2014)。在成功上调了左侧杏仁核活动后, 抑郁症患者左侧杏仁核和左侧rACC功能连接增强(Yuan et al., 2014)。Zotev等人(2020)首次通过同步实时的功能磁共振和脑电神经反馈方案(real-time fMRI and EEG neurofeedback, rtfMRI-EEG-nf)证明了杏仁核和rACC环路作为神经反馈靶点的可行性。重度抑郁症患者通过增加左侧杏仁核和左侧rACC功能连接的神经反馈训练使得其积极情绪和抑郁症状的改善, 同时发现该环路功能连接的增强与重度抑郁症患者对奖赏的反应呈正相关。意味着这两个区域之间更强的相互作用应该有利于重度抑郁症患者。因此选择左侧杏仁核和左侧rACC环路可以成为重度抑郁症患者积极情绪调节的一个神经反馈靶点。
3.3.2 杏仁核?海马复合体环路
杏仁核?海马复合体(amygdala-hippocampus, AMY-HIPP)在情绪记忆加工中发挥重要作用(J. Zheng et al., 2017)。AMY-HIPP与腹侧和内侧前额叶皮层、后扣带皮层和楔前叶相互连接, 以实现情绪调节、自我处理和情感自传体记忆(Belzung et al., 2015; Doré et al., 2018)。例如, 在自传体记忆回忆期间, 随着积极情绪增加, 杏仁核?海马中线皮层结构的功能连接增强(Nawa & Ando, 2019)。研究表明在涉及情绪性自我加工时抑郁症患者的杏仁核和海马体活动异常(L. J. Zheng et al., 2017)。与健康对照组相比, 抑郁症患者在识别快乐的自我面孔和识别快乐的他人面孔相比, 杏仁核和海马体激活水平表现得更低(Quevedo et al., 2018)。以上证据表明积极自我相关信息编码和情绪加工的脑环路可能是神经反馈训练的目标靶点。例如近期有一项研究是通过上调AMY-HIPP的血流动力学活动来改善抑郁症状同时改善了积极情绪(Ahrweiler et al., 2022)。AMY-HIPP环路可能是抑郁症积极情绪障碍神经反馈的另外一个目标靶点。
3.3.3 双侧杏仁核与背内侧前额叶皮层环路
前额叶皮层与边缘系统广泛地参与大脑的情绪调节过程。根据情绪调节模型, 成功的调节是通过起源于前额叶皮层自上而下的认知控制对边缘系统自下而上的情绪反应进行调节而实现的(Ochsner et al., 2009; Ochsner et al., 2012)。这一概念在调节积极情绪的过程中也得到了证实(Koush et al., 2017; Koush et al., 2019)。有研究在健康被试中尝试使用多个脑区有效连接的神经反馈信号进行训练, 并将其应用于积极情绪调节(Koush et al., 2017), 目标靶点为背内侧前额叶皮层(dorsomedial prefrontal cortex, dmPFC)到雙侧杏仁核的自上而下的有效连接, 结果表明被试成功地增加了dmPFC和双侧杏仁核自上而下的有效连接, 同时自我报告积极情绪增加。此外, 有研究证明积极社会情绪的上调与前额叶皮层对双侧杏仁核的直接调节有关(Koush et al., 2019)。因此前额叶皮层和双侧杏仁核环路可能是抑郁症积极情绪障碍干预的一个神经反馈有效靶点, 未来有望进一步验证。
综上所述, 选择脑环路及情绪脑网络作为神经反馈的靶点对抑郁症治疗具有更强大的应用价值。如前所述单个脑区作为靶点的神经反馈训练引起了多个脑区的活动改变, 表明最好的神经反馈信号可能不是取决于单个脑区活动的改变, 而是取决于脑区活动在大规模脑网络中的协调程度(Scheinost et al., 2020)。脑连接组学的研究强调了抑郁症中大规模功能和结构脑网络的拓扑组织中断(Gong & He, 2015), 因此在临床疗效方面, 抑郁症患者多个大脑区域连接的反馈信号可能比单一脑区调节方法更强大(Fede et al., 2020)。近期发表于Science的一篇文章也强调了大脑各区域的连接在行为和认知中的重要作用(de Schotten & Forkel., 2022)。以杏仁核为核心的多个脑环路为基于脑区间连接的神经反馈干预积累了证据, 初步证明了以脑环路为神经反馈靶点的有效性。根据脑连接组学的最新进展未来需要开展以情绪脑网络为神经反馈靶点的研究, 利用脑网络连接的研究方法来提供有效的神经反馈信号。
4 神经反馈训练方案
目前神经反馈训练方案没有统一标准的步骤, 该部分本文将总结和归纳现有的神经反馈研究的实验设计内容, 包括指导策略、神经反馈训练时间、神经反馈信号的呈现方式及神经反馈训练流程。
如表1所示, 不同研究实验者提供的指导策略也是不一致的。大部分研究都让被试使用积极自传体回忆的策略, 有些研究指导被试使用积极心理意象的策略, 少数研究告诉被试可以使用自己擅长的任何策略, 不做特定要求, 一些研究指导被试做放松训练。目前并没有证据证明哪一种指导策略更加有利于被试成功调节大脑活动, 但鉴于抑郁症患者更加倾向于主动关注和回忆消极情景及产生负性思维, 因此可能对其特定的指导策略有利于神经反馈训练任务的完成。
成功的神经反馈训练通常需要一定的训练时间, 包括训练时长和训练次数。如表1所示, EEG-nf的训练次数较多, 训练时长为每次一小时左右。fMRI-nf的训练次数较少。有研究者建议fMRI-nf最佳训练次数为1~5次, EEG-nf为30次(Thibault et al., 2016)。因此在未来开展相关研究时要考虑到神经反馈训练时间可能对实验效应的影响。
神经反馈信号呈现方式空间上可以分为视觉、听觉、触觉等形式, 时间上分为连续或间断的形式。连续神经反馈是指反馈贯穿整个任务(或各自的实验条件), 并在每个重复时间后更新信号(Linhartová et al., 2019), 例如一个类似温度计的进度条每次随着神经反馈信号的改变而更新高度。从表1中可以看出, 大部分研究的反馈是以连续的视觉形式呈现; 间歇性神经反馈在每次试验或时间间隔结束后以单个结果形式呈现, 例如在每个试次结束后以视觉呈现(Hamilton et al., 2016)。怎样的呈现方式更有利于训练的效果目前尚无定论, 但考虑到被试认知资源的分配, 如果更复杂的呈现方式会让被试不得不将注意资源分配在关注反馈信号上, 可能会阻碍主要的调控大脑活动的任务。
整个神经反馈流程包括练习阶段、休息阶段、正式训练阶段、分心干扰阶段、学习迁移(transfer)阶段。练习阶段包括告知被试如何调动积极情绪的方法以及如何调控神经反馈的信号; 休息阶段的设置是为了提供一个和神经反馈训练后比较的基线对照; 正式训练阶段会有神经反馈的信号呈现给被试, 通过让被试利用各种心理策略(积极自传体记忆或积极心理意象等)调动积极情绪同时上调相关脑区的活动; 在分心干扰阶段实验者会让被试完成数数或连续减某个数的任务, 目的是排除上个阶段被试心理活动对下个学习迁移(transfer)阶段的干扰; 在学习迁移(transfer)阶段主要是在不提供神经反馈信号的情况下, 让被试自主通过调动积极情绪来上调相应脑活动。学习迁移(transfer)阶段主要是为了探究在去除神经反馈信号的条件下被试自主学习到神经反馈训练的能力, 因此设置学习迁移(transfer)阶段具有重要的生态效度, 能够评估被试离开了标准的实验室环境也能自主调控大脑活动从而改善情绪的学习能力。
总之, 不同神经反馈研究具有不同的具体策略或任务, 要基于研究的目的和主题选择合适的神经反馈训练方案。应用于精神疾病人群的神经反馈方案更加应该考虑到人群的特殊性, 包括研究设计的有效性、可行性以及便携性和可推广性。需要注意的是, 目前的神经反馈训练方案未考虑被试的个体差异。未来需要针对被试的个体差异设计更加个性化的神经反馈方案。
5 神经反馈增强积极情绪的实验设计评价及影响因素
实验设计是整个神经反馈方案得以实施的核心, 鉴于目前的神经反馈研究中实验设计具体方案存在较大差异, 本部分将结合表1中列举的神经反馈研究总结并探讨现有研究的有效性。
首先, 神经反馈的有效性通过实验设计中设置有效的对照组以及盲法原则的实施来评价, 此外还要考虑干预的长期有效性。从表1可知早期的神经反馈研究缺乏对照组和未考虑盲法原则。近年来的神经反馈考虑设置了对照组并实施单盲甚至双盲。但对照组设置存在很大差异。例如研究只有健康对照组(Ahrweiler et al., 2022), 有對照组接受了相同情绪调节策略的训练, 但没有神经反馈训练(Linden et al., 2012), 有研究比较全面地设计了健康对照和假神经反馈的对照(Yuan et al., 2014)。同时盲法原则的实施也不一致。例如在表中列出的17项研究中, 只有6项研究是双盲设计(Compère, Siegle, Lazzaro et al., 2023; Compère, Siegle, Riley et al., 2023; Nazarian, 2005; Young et al., 2014; Young et al., 2017; Yuan et al., 2014), 其他研究都是单盲甚至没有考虑“致盲”。随访在实验设计中能够评估实验干预的长期有效性, 有利于临床应用。从表中可以看出, 大部分研究都没有随访, 无法评估神经反馈给抑郁症患者带来的症状改善的长期性以及成功调节的脑区活动的持久改变, 尽管少量研究证明了随访的积极结果, 然而还需要更多的研究以及更长的随访时间来评估神经反馈带来的长期效果。因此未来的研究有必要标准化对照组的设置以及盲法、随访的设计从而更有效地评估神经反馈的效果。
其次, 神经反馈的实验效应大小受很多实验设计因素的影响, 包括样本量和效应量大小等。据研究统计, 心理学及认知神经科学领域样本量及效应量小的问题一直存在, 导致了实验的可复制性低(Szucs & Ioannidis, 2017)。由表1可知大部分研究的样本量都较小, 部分还有中途退出的情况, 最后纳入数据分析的被试量更少。例如有一项研究的脱落率达到63% (Nazarian, 2005), 需谨慎解释神经反馈真实的实验效应。此外, 效应量也是评估实验效应大小的重要因素, 表中只有5项研究报告了实验的效应量。
最后, 神经反馈研究中被试的个体差异使得神经反馈干预的疗效存在较高的变异度。包括抑郁症患者的疾病严重程度、服药情况以及调节神经反馈信号的能力。服药情况成为影响神经反馈效果变异度高的一个因素。从表1可以看出, 有7项研究的患者是选择未服药的作为被试, 而其他研究则没有考虑服药对实验的影响。此外, 部分研究未区分疾病严重程度, 从轻度到中重度的抑郁症患者均纳入研究。有一项研究大部分患者汉密尔顿抑郁症评定量表 (Hamilton Depression Rating Scale, HDRS)平均分数为12分, 低于治疗试验的常规临界值(Choi et al., 2011)。由于不同严重程度抑郁症患者的情绪障碍表现也不同, 神经反馈治疗效果与疾病严重程度的交互效应尚不清楚。此外, 大部分研究缺乏对被试调节能力成功与否的报告。从表中可以看出, 只有一项研究(Wang et al., 2016)报告了被试的调节能力。尽管利用神经反馈技术增强抑郁症积极情绪的干预效果取得了显著的进展, 但并不是每个接受神经反馈的患者都能成功调节他们的大脑活动信号。这些参与者通常被称为无反应者、无表现者或无调节者, 占30% ~ 50% (Alkoby et al., 2018), 因此量化神经反馈的有效性难度较高。所以在研究中报告出这部分无反应者对于评估实验结果是有重要意义的。
结合表1的效果评价部分, 抑郁症患者能够成功地上调目标脑区的大脑活动, 抑郁症状改善并促进了积极情绪的恢复, 有报告效应量的研究也表明了神经反馈实验效应的积极结果, 初步证明了神经反馈干预的可行性。但目前神经反馈在抑郁症积极情绪干预的研究存在样本量小、缺乏有效对照、未考虑盲法原则、缺乏随访以及被试的个体差异等问题, 对于存在以上问题的神经反馈研究(大部分脑电的神经反馈), 其训练效果还需在完善实验设计的基础上进一步验证。结合以上可能影响神经反馈实验设计的因素, 一个良好的适用于临床患者的神经反馈实验设计建议要在考虑被试个体差异的基础上, 控制可能的混淆变量包括患者的疾病严重程度、服用药物情况, 采用双盲、假神经反馈对照的方法, 招募足够数量的被试, 必要时开展多中心研究, 同时报告能够成功调控神经反馈信号和调控失败的患者, 通过随访追踪神经反馈训练对患者长期的改善效果。神经反馈实验设计的优化有利于神经反馈研究向临床应用转化的进一步推进。
6 总结与展望
本文对神经反馈增加抑郁症积极情绪的实验设计和神经反馈实验设计的影响因素做了回顾和总结, 定性评估了现有研究的有效性, 对未来开展抑郁症积极情绪干预的实验研究提出建议。此外, 基于前人的研究及理论从奖赏加工的角度探索性地提出神经反馈增强积极情绪的潜在靶点以及未来可能的研究方向, 旨在为进一步开展抑郁症神经反馈增强积极情绪的研究提供思路。
fNIRS结合神经反馈将成为未来增强抑郁症积极情绪的有效临床应用工具。如前文所述, 研究者们已经对EEG-nf和rtfMRI-nf开展了大量的研究工作, 该工作使我们更加清晰地了解神经反馈辅助抑郁症积极情绪干预的神经机制, 同时也为开展临床转化研究奠定了实践基础。然而考虑到神经反馈辅助抑郁症积极情绪干预的生态效度和临床转化应用, fMRI的高成本、非便携使得其难以在实际临床干预中推广应用, EEG的低空间分辨率和运动伪迹对EEG信号的影响限制了其发展。相比之下, 具有较高空间分辨率和时间分辨率、低成本、便携及对运动伪迹不敏感的fNIRS在实践性及实用性方面更加适合神经精神疾病人群。有研究结果证明健康被试在fNIRS的神经反馈训练中成功地上调了OFC的活动(Li et al., 2019)。目前fNIRS的神经反馈尚未应用于抑郁症积极情绪干预中。未来结合EEG-nf和rtfMRI-nf的基础研究以及fNIRS的神经反馈的临床应用研究将会为抑郁症治疗开拓新的方向。
诱发积极情绪的范式以及神经反馈方案设计要结合抑郁症奖赏加工和积极情绪记忆可能是治疗抑郁症快感缺失和促进积极情绪恢复的核心方向。奖赏加工异常被认为是抑郁症的一种潜在内表型(Hasler et al., 2004)。快感缺失在认知上表现为奖赏加工异常(Husain & Roiser, 2018)。RDoC也根据奖赏加工将正性效价系统划分为奖赏反应(reward responsiveness)、奖赏学习(reward learning)、奖赏评估(reward valuation)三大部分(Cuthbert & Insel, 2013; Sanislow et al., 2019)。依据强化学习理论, 奖赏编码和奖赏学习是奖赏加工的两个核心环节, 是价值评估、奖赏期待、行为执行等其他成分的基础。二者都与积极记忆密切相关。奖赏线索编码涉及对奖赏线索的编码存储和提取, 即对奖赏线索的认知加工。奖赏记忆经验会直接影响个体对奖赏的期待(Sosa & Giocomo, 2021), 从而影响情绪反应。由于抑郁症患者以消极记忆偏差和缺乏积极记忆为特征(Everaert et al., 2022), 所以积极情绪记忆和奖赏加工是抑郁症积极情绪干预的一个重要机制。因此如果被试存在奖赏加工异常, 则可能会导致在整个神经反馈中不能有效地学习自我调控大脑活动。所以要充分考虑到奖赏加工异常对整个实验过程的影响, 通过增加积极情绪记忆提高对奖赏刺激的编码和奖赏学习, 从而增加奖赏动机和增强积极情绪。研究表明回忆愉快的记忆似乎不足以修复抑郁症患者的积极情绪, 需同时激活与情绪编码有关的大脑区域可能至关重要(Dillon & Pizzagalli, 2018)。所以积极情绪记忆和神经反馈的结合有望成为治疗抑郁症快感缺失和恢复积极情绪的有效手段。未来应该进一步证明该假设同时研究神经反馈对奖赏加工异常的患者积极情绪干预的效果。
鉴于奖赏加工与积极情绪紧密相关, 神经反馈靶点的选择在标准化的基础上需要开发基于奖赏环路的潜在有效靶点。fMRI等神经影像学研究表明社会情绪加工涉及vlPFC、内侧前额叶(medial Prefrontal Cortex, mPFC)、NAcc等脑区。vlPFC是社会情绪管理的重要脑区(Morawetz et al., 2016)。mPFC是自我相关信息处理的关键节点(Roy et al., 2012)。在加工社交信息时, mPFC会被激活(Kumar et al., 2019)。NAcc参与奖赏等积极信息的加工(Sherman et al., 2016)。社会性奖赏行为可以促使NAcc释放更多的多巴胺(Hu et al., 2021)。Liu等人通过动物实验发现, mPFC-NAcc环路与亲密行为紧密相关(Amadei et al., 2017)。此外, 青少年抑郁症在处理自我相关的社会线索时表现出mPFC的活动减弱(Silk et al., 2017)。在加工积极的社会线索时, NAcc活动减少(Brush et al., 2021), mPFC和NAcc的功能连接越强抑郁症状越弱(Tashjian & Galván, 2018)。因此, 基于以上研究, vlPFC-mPFC-NAcc環路可以成为增强抑郁症积极情绪的一个神经反馈潜在靶点(如图3所示)。
未来训练情绪脑网络的神经反馈将会成为抑郁症中促进积极情绪恢复的一个重点方向。多模态神经反馈的出现使多变量模式的脑网络指标可以成为神经反馈的训练指标。如前文所述, 目前在抑郁症积极情绪干预的神经反馈研究中神经反馈的指标包括单一成分的脑电指标(例如α频段)、单个脑区活动的BOLD信号、两个脑区连接的指标(磁共振成像的静息态功能连接和有效连接)。传统的脑电神经反馈主要提取单一且固定频率的脑电成分进行反馈训练(例如α频段), 而且这些患者在这些脑电指标上存在较大的个体差异。抑郁症积极情绪缺乏涉及多个脑电指标同时存在脑网络活动异常。因此多变量模式分析法 (Multivariate Pattern Analysis, MVPA)可以将特定心理状态下的多个脑活动时空特征信号融合形成多变量的模式(Ritchie et al., 2019)。目前已经有结合 MVPA 的EEG-nf研究发现, 新式的EEG-nf训练可有效治疗冰毒、尼古丁等物质成瘾(Bu et al., 2019), 因此未来可以探究以MVPA 为神经反馈指标在抑郁症积极情绪障碍中的应用, 促进脑网络训练的神经反馈的发展。
结合机器学习开发个性化神经反馈方案可以解决由于个体差异导致的治疗效果的异质性。近年来机器学习技术有助于神经反馈的个性化。机器学习(Bandit算法)已被用于帮助被试在脑机交互训练中选择最适合被试能力的任务(Fruitet et al., 2013)。因此在神经反馈任务中, 如果被试不能调节要求的EEG模式或fMRI模式, 可以通过自适应的方式依据被试在神经反馈训练中的学习速度和能力实时地调整模式。通过未来对能够成功调节者和调节失败者之间的个体差异的研究可以为不同的抑郁症患者提供个性化的神经反馈方案带来证据。最近有研究表明, 多巴胺能中脑的神经反馈控制依赖于认知控制网络, 并且通过强化学习信号索引即将到来的反馈的可预测性有助于成功的神经反馈训练(Hellrung et al., 2022)。该研究为了解被试神经反馈的调节能力的个体差异提供了一个证据, 因此未来的研究需要进一步探索能成功自我调节者和不能成功自我调节者的个体差异及神经机制, 不能成功调节者可能与奖赏加工异常相关, 需要未来的研究进一步明确该假设。
鉴于目前神经反馈领域实验设计较大的异质性, 需要优化神经反馈的操作范式, 建议实验设计中考虑被试的个体差异、随访时间、神经反馈训练次数及时间。建议在未来的研究中要评估并报告有反应者和无反应者的数量, 从而更好的评估神经反馈的效果。同时结合2020年提出的关于临床和认知行为神经反馈研究报告和实验设计的共识(Ros et al., 2020)中列举的检查清单来优化并评价自己的实验方案, 以推动整个神经反馈领域的进一步发展。
7 结论
由于神经反馈技术的无创性、调动患者的主动性以及能够可视化并客观定量地评价情绪改善情况, 并特异性地调控情绪相关的大脑活动从而增加抑郁症患者的积极情绪。神经反馈有望成为一种安全、有效的抑郁症积极情绪干预方法, 具有广泛的应用前景。未来需要结合新的研究技术如机器学习等给患者提供个性化的神经反馈, 有效的解决个体差异带来的问题。同时也应继续探索不同的脑成像技术与神经反馈结合的生态学效度, 开发便携式的神经反馈干预方案从而促进临床转化应用。将更高效、更具个性化、更精准调控靶点的神经反馈技术应用于各种精神疾病和心理问题及整个医学领域的研究中。
参考文献
刘雷, 周仁来. (2015). 一个测量抑郁症的重要神经指标:静息额叶脑电活动的不对称性. 心理科学进展, 23(6), 1000?1008.
张晶, 周仁来. (2010). 额叶EEG偏侧化: 情绪调节能力的指标. 心理科学进展, 18(11), 1679?1683.
Ahrweiler, N., Santana-Gonzalez, C., Zhang, N., Quandt, G., Ashtiani, N., Liu, G. M., ... Quevedo, K. (2022). Neural activity associated with symptoms change in depressed adolescents following self-processing neurofeedback. Brain Sciences, 12(9), 1128. doi: 10.3390/brainsci12091128
Alkoby, O., Abu-Rmileh, A., Shriki, O., & Todder, D. (2018). Can we predict who will respond to neurofeedback? A review of the inefficacy problem and existing predictors for successful eeg neurofeedback learning. Neuroscience, 378, 155?164. doi: 10.1016/j.neuroscience.2016.12.050
Amadei, E. A., Johnson, Z. V., Kwon, Y. J., Shpiner, A. C., Saravanan, V., Mays, W. D., ... Liu, R. C. (2017). Dynamic corticostriatal activity biases social bonding in monogamous female prairie voles. Nature, 546(7657), 297?301. doi: 10.1038/nature22381
Anderson, A. K., & Phelps, E. A. (2001). Lesions of the human amygdala impair enhanced perception of emotionally salient events. Nature, 411(6835), 305?309. doi: 10.1038/35077083
Arditte Hall, K. A., de Raedt, R., Timpano, K. R., & Joormann, J. (2018). Positive memory enhancement training for individuals with major depressive disorder. Cognitive Behaviour Therapy, 47(2), 155?168. doi: 10. 1080/16506073.2017.1364291
Arns, M., Batail, J. M., Bioulac, S., Congedo, M., Daudet, C., Drapier, D., ... Vialatte, F. (2017). Neurofeedback: One of today's techniques in psychiatry? Neurofeedback en psychiatrie: Une technique du présent? LEncéphale, 43(2), 135?145. doi: 10.1016/j.encep.2016.11.003
Baas, D., Aleman, A., & Kahn, R. S. (2004). Lateralization of amygdala activation: A systematic review of functional neuroimaging studies. Brain Research Reviews, 45(2), 96?103. doi: 10.1016/j.brainresrev.2004.02.004
Baehr, E., Rosenfeld, J. P., & Baehr, R. (1997). The clinical use of an alpha asymmetry protocol in the neurofeedback treatment of depression. Journal of Neurotherapy, 2(3), 10?23. doi: 10.1300/J184v02n03_02
Banks, S. J., Eddy, K. T., Angstadt, M., Nathan, P. J., & Phan, K. L. (2007). Amygdala - frontal connectivity during emotion regulation. Social Cognitive and Affective Neuroscience, 2(4), 303?312. doi: 10.1093/scan/nsm029
Barreiros, A. R., Almeida, I., Baía, B. C., & Castelo-Branco, M. (2019). Amygdala modulation during emotion regulation training with fMRI-based neurofeedback. Frontiers in Human Neuroscience, 13, 24. doi: 10.3389/fnhum.2019. 00089
Batail, J. M., Bioulac, S., Cabestaing, F., Daudet, C., Drapier, D., Fouillen, M., ... Vialatte, F. (2019). EEG neurofeedback research: A fertile ground for psychiatry? LEncephale, 45(3), 245?255. doi: 10.1016/j.encep.2019.02.001
Belzung, C., Willner, P., & Philippot, P. (2015). Depression: From psychopathology to pathophysiology. Current Opinion in Neurobiology, 30, 24?30. doi: 10.1016/j.conb.2014. 08.013
Blackwell, S. E., Browning, M., Mathews, A., Pictet, A., Welch, J., Davies, J., ... Holmes, E. A. (2015). Positive imagery-based cognitive bias modification as a web-based treatment tool for depressed adults: A randomized controlled trial. Clinical Psychological Science, 3(1), 91?111. doi: 10.1177/2167702614560746
Brush, C. J., Burani, K., Schmidt, K. M., Santopetro, N. J., & Hajcak, G. (2021). The impact of a single session of aerobic exercise on positive emotional reactivity in depression: Insight into individual differences from the late positive potential. Behaviour Research and Therapy, 144, 103914. doi: 10.1016/j.brat.2021.103914
Bu, J. J., Young, K. D., Hong, W., Ma, R., Song, H. W., Wang, Y., ... Zhang, X. C. (2019). Effect of deactivation of activity patterns related to smoking cue reactivity on nicotine addiction. Brain, 142(6), 1827?1841. doi: 10.1093/brain/awz114
Burkhardt, G., Kumpf, U., Crispin, A., Goerigk, S., Andre, E., Plewnia, C., ... Padberg, F. (2023). Transcranial direct current stimulation as an additional treatment to selective serotonin reuptake inhibitors in adults with major depressive disorder in Germany (DepressionDC): A triple-blind, randomised, sham-controlled, multicentre trial. The Lancet, 402(10401), 545?554. https://doi.org/10.1016/S0140-6736(23) 00640-2
Chen, K., Barnes-Horowitz, N., Treanor, M., Sun, M., Young, K. S., & Craske, M. G. (2020). Virtual reality reward training for anhedonia: A pilot study. Frontiers in Psychology, 11, 613617. doi: 10.3389/fpsyg.2020.613617
Cheon, E.-J., Koo, B.-H., & Choi, J.-H. (2016). The efficacy of neurofeedback in patients with major depressive disorder: An open labeled prospective study. Applied Psychophysiology and Biofeedback, 41(1), 103?110. doi: 10.1007/s10484-015-9315-8
Choi, S. W., Chi, S. E., Chung, S. Y., Kim, J. W., Ahn, C. Y., & Kim, H. T. (2011). Is alpha wave neurofeedback effective with randomized clinical trials in depression? A pilot study. Neuropsychobiology, 63(1), 43?51. doi: 10.1159/000322290
Compère, L., Siegle, G. J., Lazzaro, S., Strege, M., Canovali, G., Barb, S., ... Young, K. (2023). Real-time functional magnetic resonance imaging neurofeedback training of amygdala upregulation increases affective flexibility in depression. Journal of Psychiatry Neuroscience, 48(3), E232?E239. doi: 10.1503/jpn.220208
Compère, L., Siegle, G. J., Riley, E., Lazzaro, S., Strege, M., Pacoe, E., ... Young, K. (2023). Enhanced efficacy of CBT following augmentation with amygdala rtfMRI neurofeedback in depression. Journal of Affective Disorders, 339, 495? 501. doi: 10.1016/j.jad.2023.07.063
Cook, I. A., O'Hara, R., Uijtdehaage, S. H., Mandelkern, M., & Leuchter, A. F. (1998). Assessing the accuracy of topographic EEG mapping for determining local brain function. Electroencephalography and Clinical Neurophysiology, 107(6), 408?414. doi: 10.1016/s0013-4694(98)00092-3
Craske, M. G., Meuret, A. E., Ritz, T., Treanor, M., & Dour, H. J. (2016). Treatment for anhedonia: A neuroscience driven approach. Depression and Anxiety, 33(10), 927? 938. doi: 10.1002/da.22490
Critchley, H. D. (2005). Neural mechanisms of autonomic, affective, and cognitive integration. Journal of Comparative Neurology, 493(1), 154?166. doi: 10.1002/cne.20749
Cusin, C., & Dougherty, D. D. (2012). Somatic therapies for treatment-resistant depression: ECT, TMS, VNS, DBS. Biology of Mood & Anxiety Disorders, 2, 14. doi: 10.1 186/2045-5380-2-14
Cuthbert, B. N., & Insel, T. R. (2013). Toward the future of psychiatric diagnosis: The seven pillars of RDoC. BMC Medicine, 11, 126. doi: 10.1186/1741-7015-11-126
Dalgleish, T., & Werner-Seidler, A. (2014). Disruptions in autobiographical memory processing in depression and the emergence of memory therapeutics. Trends in Cognitive Sciences, 18(11), 596?604. doi:10.1016/j.tics.2014.06.010
Davidson, R. J. (1992). Anterior cerebral asymmetry and the nature of emotion. Brain and Cognition, 20(1), 125?151. doi: 10.1016/0278-2626(92)90065-t
Daws, R. E., Timmermann, C., Giribaldi, B., Sexton, J. D., Wall, M. B., Erritzoe, D., ... Carhart-Harris, R. (2022). Increased global integration in the brain after psilocybin therapy for depression. Nature Medicine, 28(4), 844?851. doi: 10.1038/s41591-022-01744-z
de Schotten, M. T., & Forkel, S. J. (2022). The emergent properties of the connected brain. Science, 378(6619), 505?510. doi: 10.1126/science.abq2591
Dillon, D. G., & Pizzagalli, D. A. (2018). Mechanisms of memory disruption in depression. Trends in Neurosciences, 41(3), 137?149. doi: 10.1016/j.tins.2017.12.006
Dimidjian, S., Barrera, M., Martell, C., Mu?oz, R. F., & Lewinsohn, P. M. (2011). The origins and current status of behavioral activation treatments for depression. Annual Review of Clinical Psychology, 7, 1?38. doi: 10.1146/ annurev-clinpsy-032210-104535
Doré, B. P., Rodrik, O., Boccagno, C., Hubbard, A., Weber, J., Stanley, B., ... Ochsner, K. N. (2018). Negative autobiographical memory in depression reflects elevated amygdala-hippocampal reactivity and hippocampally associated emotion regulation. Biological Psychiatry- Cognitive Neuroscience and Neuroimaging, 3(4), 358?366. doi: 10.1016/j.bpsc.2018.01.002
Ducasse, D., Dubois, J., Jaussent, I., Azorin, J. M., Etain, B., Gard, S., ... Courtet, P. (2021). Association between anhedonia and suicidal events in patients with mood disorders: A 3-year prospective study. Depression and Anxiety, 38(1), 17?27. doi: 10.1002/da.23072
Duerden, E. G., Arsalidou, M., Lee, M., & Taylor, M. J. (2013). Lateralization of affective processing in the insula. Neuroimage, 78, 159?175. doi: 10.1016/j.neuroimage. 2013.04.014
Dunlop, K., Rizvi, S. J., Kennedy, S. H., Hassel, S., Strother, S. C., Harris, J. K., ... Downar, J. (2020). Clinical, behavioral, and neural measures of reward processing correlate with escitalopram response in depression: A canadian biomarker integration network in depression (CAN-BIND-1) report. Neuropsychopharmacology, 45(8), 1390?1397. doi: 10.1038/s41386-020-0688-x
Dunn, B. D., German, R. E., Khazanov, G., Xu, C. L., Hollon, S. D., & DeRubeis, R. J. (2020). Changes in positive and negative affect during pharmacological treatment and cognitive therapy for major depressive disorder: A secondary analysis of two randomized controlled trials. Clinical Psychological Science, 8(1), 36?51. doi: 10.1177/2167702619863427
Dunn, B. D., Widnall, E., Reed, N., Owens, C., Campbell, J., & Kuyken, W. (2019). Bringing light into darkness: A multiple baseline mixed methods case series evaluation of Augmented Depression Therapy (ADepT). Behaviour Research and Therapy, 120, 103418. doi: 10.1016/j.brat. 2019.103418
Earnest, C. (1999). Single case study of EEG asymmetry biofeedback for depression. Journal of Neurotherapy, 3(2), 28?35. doi: 10.1300/J184v03n02_04
Escolano, C., Navarro-Gil, M., Garcia-Campayo, J., Congedo, M., de Ridder, D., & Minguez, J. (2014). A controlled study on the cognitive effect of alpha neurofeedback training in patients with major depressive disorder. Frontiers in Behavioral Neuroscience, 8, 12. doi: 10.3389/fnbeh. 2014.00296
Everaert, J., Vrijsen, J. N., Martin-Willett, R., van de Kraats, L., & Joormann, J. (2022). A meta-analytic review of the relationship between explicit memory bias and depression: Depression features an explicit memory bias that persists beyond a depressive episode. Psychological Bulletin, 148(5-6), 435?463. doi: 10.1037/bul0000367
Fede, S. J., Dean, S. F., Manuweera, T., & Momenan, R. (2020). A guide to literature informed decisions in the design of real time fMRI neurofeedback studies: A systematic review. Frontiers in Human Neuroscience, 14, 17. doi: 10.3389/fnhum.2020.00060
Fernandez, E., Salem, D., Swift, J. K., & Ramtahal, N. (2015). Meta-analysis of dropout from cognitive behavioral therapy: Magnitude, timing, and moderators. Journal of Consulting and Clinical Psychology, 83(6), 1108?1122. doi: 10.1037/ccp0000044
Frank, D. W., Dewitt, M., Hudgens-Haney, M., Schaeffer, D. J., Ball, B. H., Schwarz, N. F., ... Sabatinelli, D. (2014). Emotion regulation: Quantitative meta-analysis of functional activation and deactivation. Neuroscience and Biobehavioral Reviews, 45, 202?211. doi: 10.1016/j.neubiorev.2014.06. 010
Fruitet, J., Carpentier, A., Munos, R., & Clerc, M. (2013). Automatic motor task selection via a bandit algorithm for a brain-controlled button. Journal of Neural Engineering, 10(1), 8. doi: 10.1088/1741-2560/10/1/016012
Gabbay, V., Johnson, A. R., Alonso, C. M., Evans, L. K., Babb, J. S., & Klein, R. G. (2015). Anhedonia, but not irritability, is associated with illness severity outcomes in adolescent major depression. Journal of Child and Adolescent Psychopharmacology, 25(3), 194?200. doi: 10. 1089/cap.2014.0105
Gong, Q. Y., & He, Y. (2015). Depression, neuroimaging and connectomics: A selective overview. Biological Psychiatry, 77(3), 223?235. doi: 10.1016/j.biopsych.2014.08.009
Goodwin, G. M., Price, J., de Bodinat, C., & Laredo, J. (2017). Emotional blunting with antidepressant treatments: A survey among depressed patients. Journal of Affective Disorders, 221, 31?35. doi: 10.1016/j.jad.2017.05.048
Greer, S. M., Trujillo, A. J., Glover, G. H., & Knutson, B. (2014). Control of nucleus accumbens activity with neurofeedback. Neuroimage, 96, 237?244. doi: 10.1016/j. neuroimage.2014.03.073
Greicius, M. D., Flores, B. H., Menon, V., Glover, G. H., Solvason, H. B., Kenna, H., ... Schatzberg, A. F. (2007). Resting-state functional connectivity in major depression: Abnormally increased contributions from subgenual cingulate cortex and thalamus. Biological Psychiatry, 62(5), 429?437. doi: 10.1016/j.biopsych.2006.09.020
Hamilton, J. P., Etkin, A., Furman, D. J., Lemus, M. G., Johnson, R. F., & Gotlib, I. H. (2012). Functional neuroimaging of major depressive disorder: A meta- analysis and new integration of baseline activation and neural response data. American Journal of Psychiatry, 169(7), 693?703. doi: 10.1176/appi.ajp.2012.11071105
Hamilton, J. P., Glover, G. H., Bagarinao, E., Chang, C., Mackey, S., Sacchet, M. D., & Gotlib, I. H. (2016). Effects of salience-network-node neurofeedback training on affective biases in major depressive disorder. Psychiatry Research- Neuroimaging, 249, 91?96. doi: 10.1016/j.pscychresns. 2016.01.016
Hamilton, J. P., Glover, G. H., Hsu, J. J., Johnson, R. F., & Gotlib, I. H. (2011). Modulation of subgenual anterior cingulate cortex activity with real-time neurofeedback. Human Brain Mapping, 32(1), 22?31. doi:10.1002/hbm. 20997
Hammond, D. C. (2008). Neurofeedback treatment of depression with the roshi. Journal of Neurotherapy, 4(2), 45?56. doi: 10.1300/J184v04n02_06
Hasler, G., Drevets, W. C., Manji, H. K., & Charney, D. S. (2004). Discovering endophenotypes for major depression. Neuropsychopharmacology, 29(10), 1765?1781. doi: 10. 1038/sj.npp.1300506
Hellrung, L., Kirschner, M., Sulzer, J., Sladky, R., Scharnowski, F., Herdener, M., & Tobler, P. N. (2022). Analysis of individual differences in neurofeedback training illuminates successful self-regulation of the dopaminergic midbrain. Communications Biology, 5(1), 845. doi: 10. 1038/s42003-022-03756-4
Holmes, E. A., Blackwell, S. E., Burnett Heyes, S., Renner, F., & Raes, F. (2016). Mental imagery in depression: Phenomenology, potential mechanisms, and treatment implications. Annual Review of Clinical Psychology, 12, 249?280. doi: 10.1146/annurev-clinpsy-021815-092925
Hu, R. K., Zuo, Y. N., Ly, T., Wang, J., Meera, P., Wu, Y. E., & Hong, W. Z. (2021). An amygdala-to-hypothalamus circuit for social reward. Nature Neuroscience, 24(6), 831?842. doi: 10.1038/s41593-021-00828-2
Husain, M., & Roiser, J. P. (2018). Neuroscience of apathy and anhedonia: A transdiagnostic approach. Nature Reviews Neuroscience, 19(8), 470?484. doi: 10.1038/s41583-018- 0029-9
Janicak, P. G., & Dokucu, M. E. (2015). Transcranial magnetic stimulation for the treatment of major depression. Neuropsychiatric Disease and Treatment, 11, 1549?1560. doi: 10.2147/ndt.S67477
Joormann, J., & Vanderlind, W. M. (2014). Emotion regulation in depression: The role of biased cognition and reduced cognitive control. Clinical Psychological Science, 2(4), 402?421. doi: 10.1177/2167702614536163
Keller, M., Zweerings, J., Klasen, M., Zvyagintsev, M., Iglesias, J., Mendoza Qui?ones, R., & Mathiak, K. (2021). fMRI neurofeedback-enhanced cognitive reappraisal training in depression: A double-blind comparison of left and right vlPFC regulation. Frontiers in Psychiatry, 12, 715898. doi: 10.3389/fpsyt.2021.715898
Kim, S., & Birbaumer, N. (2014). Real-time functional MRI neurofeedback: A tool for psychiatry. Current Opinion in Psychiatry, 27(5), 332?336. doi: 10.1097/yco.000000000 0000087
Klooster, D. C. W., de Louw, A. J. A., Aldenkamp, A. P., Besseling, R. M. H., Mestrom, R. M. C., Carrette, S., ... Boon, P. (2016). Technical aspects of neurostimulation: Focus on equipment, electric field modeling, and stimulation protocols. Neuroscience and Biobehavioral Reviews, 65, 113?141. doi: 10.1016/j.neubiorev.2016.02.016
Koller-Schlaud, K., Querbach, J., Behr, J., Str?hle, A., & Rentzsch, J. (2020). Test-retest reliability of frontal and parietal alpha asymmetry during presentation of emotional face stimuli in healthy subjects. Neuropsychobiology, 79(6), 428?436. doi: 10.1159/000505783
Koush, Y., Meskaldji, D. E., Pichon, S., Rey, G., Rieger, S. W., Linden, D. E. J., ... Scharnowski, F. (2017). Learning control over emotion networks through connectivity-based neurofeedback. Cerebral Cortex, 27(2), 1193?1202. doi: 10.1093/cercor/bhv311
Koush, Y., Pichon, S., Eickhoff, S. B., van de Ville, D., Vuilleumier, P., & Scharnowski, F. (2019). Brain networks for engaging oneself in positive-social emotion regulation. Neuroimage, 189, 106?115. doi: 10.1016/j.neuroimage. 2018.12.049
Kumar, P., Pisoni, A., Bondy, E., Kremens, R., Singleton, P., Pizzagalli, D., & Auerbach, R. P. (2019). Delineating the social valuation network in adolescents. Social Cognitive and Affective Neuroscience, 14(11), 1159?1166. doi: 10. 1093/scan/nsz086
Kuusinen, V., Per?kyl?, J., Sun, L. H., Ogawa, K. H., & Hartikainen, K. M. (2021). Emotional modulation of frontal alpha asymmetry - a novel biomarker of mild traumatic brain injury. Frontiers in Human Neuroscience, 15, 13. doi: 10.3389/fnhum.2021.699947
Lawrence, E. J., Su, L., Barker, G. J., Medford, N., Dalton, J., Williams, S. C. R., ... David, A. S. (2014). Self-regulation of the anterior insula: Reinforcement learning using real-time fMRI neurofeedback. Neuroimage, 88, 113?124. doi: 10.1016/j.neuroimage.2013.10.069
Lee, B. T., Cho, S. W., Khang, H. S., Lee, B. C., Choi, I. G., Lyoo, I. K., & Ham, B. J. (2007). The neural substrates of affective processing toward positive and negative affective pictures in patients with major depressive disorder. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 31(7), 1487?1492. doi: 10.1016/j.pnpbp.2007. 06.030
Li, K. S., Jiang, Y. H., Gong, Y. L., Zhao, W. H., Zhao, Z. Y., Liu, X. L., ... Becker, B. (2019). Functional near-infrared spectroscopy-informed neurofeedback: Regional-specific modulation of lateral orbitofrontal activation and cognitive flexibility. Neurophotonics, 6(2), 025011. doi: 10.1117/ 1.NPh.6.2.025011
Linden, D. E. J. (2014). Neurofeedback and networks of depression. Dialogues in Clinical Neuroscience, 16(1), 103?112.
Linden, D. E. J., Habes, I., Johnston, S. J., Linden, S., Tatineni, R., Subramanian, L., ... Goebel, R. (2012). Real-time self-regulation of emotion networks in patients with depression. Plos One, 7(6), e38115. doi: 10.1371/ journal.pone.0038115
Linhartová, P., Látalová, A., Kó?a, B., Ka?párek, T., Schmahl, C., & Paret, C. (2019). fMRI neurofeedback in emotion regulation: A literature review. Neuroimage, 193, 75?92. doi: 10.1016/j.neuroimage.2019.03.011
Luo, L., Wu, H. W., Xu, J. P., Chen, F. F., Wu, F. C., Wang, C., & Wang, J. J. (2021). Abnormal large-scale resting- state functional networks in drug-free major depressive disorder. Brain Imaging and Behavior, 15(1), 96?106. doi: 10.1007/s11682-019-00236-y
Martz, M. E., Trucco, E. M., Cope, L. M., Hardee, J. E., Jester, J. M., Zucker, R. A., & Heitzeg, M. M. (2016). Association of marijuana use with blunted nucleus accumbens response to reward anticipation. JAMA Psychiatry, 73(8), 838?844. doi: 10.1001/jamapsychiatry.2016.1161
Mathersul, D., Williams, L. M., Hopkinson, P. J., & Kemp, A. H. (2008). Investigating models of affect: Relationships among EEG alpha asymmetry, depression, and anxiety. Emotion, 8(4), 560?572. doi: 10.1037/a0012811
McRae, K., & Gross, J. J. (2020). Emotion regulation. Emotion, 20(1), 1?9. doi: 10.1037/emo0000703
Mehler, D. M. A., Sokunbi, M. O., Habes, I., Barawi, K., Subramanian, L., Range, M., ... Linden, D. E. J. (2018). Targeting the affective brain-a randomized controlled trial of real-time fMRI neurofeedback in patients with depression. Neuropsychopharmacology, 43(13), 2578?2585. doi: 10. 1038/s41386-018-0126-5
Morawetz, C., Bode, S., Baudewig, J., Kirilina, E., & Heekeren, H. R. (2016). Changes in effective connectivity between dorsal and ventral prefrontal regions moderate emotion regulation. Cerebral Cortex, 26(5), 1923?1937. doi: 10.1093/cercor/bhv005
Nawa, N. E., & Ando, H. (2019). Effective connectivity within the ventromedial prefrontal cortex-hippocampus- amygdala network during the elaboration of emotional autobiographical memories. Neuroimage, 189, 316?328. doi: 10.1016/j.neuroimage.2019.01.042
Nazarian, M. (2005). An alternative treatment for depression using EEG biofeedback to alter frontal alpha asymmetry and improve mood (Unpublished doctorial dissertation). The University of Arizona, United States.
Nutt, D., Demyttenaere, K., Janka, Z., Aarre, T., Bourin, M., Canonico, P. L., ... Stahl, S. (2007). The other face of depression, reduced positive affect: The role of catecholamines in causation and cure. Journal of Psychopharmacology, 21(5), 461?471. doi: 10.1177/ 0269881106069938
Ochsner, K. N., Bunge, S. A., Gross, J. J., & Gabrieli, J. D. E. (2002). Rethinking feelings: An fMRI study of the cognitive regulation of emotion. Journal of Cognitive Neuroscience, 14(8), 1215?1229. doi: 10.1162/08989290 2760807212
Ochsner, K. N., & Gross, J. J. (2005). The cognitive control of emotion. Trends in Cognitive Sciences, 9(5), 242?249. doi: 10.1016/j.tics.2005.03.010
Ochsner, K. N., Ray, R. R., Hughes, B., McRae, K., Cooper, J. C., Weber, J., ... Gross, J. J. (2009). Bottom-up and top-down processes in emotion generation: Common and distinct neural mechanisms. Psychological Science, 20(11), 1322?1331. doi: 10.1111/j.1467-9280.2009.02459.x
Ochsner, K. N., Silvers, J. A., & Buhle, J. T. (2012). Functional imaging studies of emotion regulation: A synthetic review and evolving model of the cognitive control of emotion. In A. Kingstone & M. B. Miller (Eds.), Year in Cognitive Neuroscience (Vol. 1251, pp. E1?E24). Oxford: Blackwell Science Publ.
Opel, N., Redlich, R., Grotegerd, D., Dohm, K., Zaremba, D., Meinert, S., ... Dannlowski, U. (2017). Prefrontal brain responsiveness to negative stimuli distinguishes familial risk for major depression from acute disorder. Journal of Psychiatry & Neuroscience, 42(5), 343?352. doi: 10.1503/ jpn.160198
Paret, C., & Hendler, T. (2020). Live from the "regulating brain": Harnessing the brain to change emotion. Emotion , 20(1), 126?131. doi: 10.1037/emo0000674
Peeters, F., Oehlen, M., Ronner, J., van Os, J., & Lousberg, R. (2014). Neurofeedback as a treatment for major depressive disorder-A pilot study. Plos One, 9(3), e91837. doi:10.1371/journal.pone.0091837
Pizzagalli, D. A. (2022). Toward a better understanding of the mechanisms and pathophysiology of anhedonia: Are we ready for translation? American Journal of Psychiatry, 179(7), 458?469. doi: 10.1176/appi.ajp.20220423
Quevedo, K., Harms, M., Sauder, M., Scott, H., Mohamed, S., Thomas, K. M., ... Smyda, G. (2018). The neurobiology of self face recognition among depressed adolescents. Journal of Affective Disorders, 229, 22?31. doi: 10. 1016/j.jad.2017.12.023
Ritchie, J. B., Kaplan, D. M., & Klein, C. (2019). Decoding the brain: Neural representation and the limits of multivariate pattern analysis in cognitive neuroscience. The British Journal for the Philosophy of Science, 70(2), 581?607. doi: 10.1093/bjps/axx023
Ros, T., Enriquez-Geppert, S., Zotev, V., Young, K. D., Wood, G., Whitfield-Gabrieli, S., ... Thibault, R. T. (2020). Consensus on the reporting and experimental design of clinical and cognitive-behavioural neurofeedback studies (CRED-nf checklist). Brain, 143(6), 1674?1685. doi: 10. 1093/brain/awaa009
Rosenfeld, J. P., Baehr, E., Baehr, R., Gotlib, I. H., & Ranganath, C. (1996). Preliminary evidence that daily changes in frontal alpha asymmetry correlate with changes in affect in therapy sessions. International Journal of Psychophysiology, 23(1-2), 137?141. doi: 10.1016/0167- 8760(96)00037-2
Roy, M., Shohamy, D., & Wager, T. D. (2012). Ventromedial prefrontal-subcortical systems and the generation of affective meaning. Trends in Cognitive Sciences, 16(3), 147?156. doi: 10.1016/j.tics.2012.01.005
Sagud, M., Tudor, L., ?imunic, L., Jezernik, D., Mad?arac, Z., Jak?i?, N., ... Pivac, N. (2021). Physical and social anhedonia are associated with suicidality in major depression, but not in schizophrenia. Suicide & Life-Threatening Behavior, 51(3), 446?454. doi: 10.1111/sltb.12724
Sah, P., Faber, E. S. L., Lopez De Armentia, M., & Power, J. (2003). The amygdaloid complex: Anatomy and physiology. Physiological Reviews, 83(3), 803?834.
Salamone, J. D., Yohn, S. E., López-Cruz, L., Miguel, N. S., & Correa, M. (2016). Activational and effort-related aspects of motivation: Neural mechanisms and implications for psychopathology. Brain, 139(5), 1325?1347. doi: 10.1093/brain/aww050
Sanislow, C. A., Ferrante, M., Pacheco, J., Rudorfer, M. V., & Morris, S. E. (2019). Advancing translational research using NIMH research domain criteria and computational methods. Neuron, 101(5), 779?782. doi: 10.1016/j.neuron. 2019.02.024
Santangelo, V., Cavallina, C., Colucci, P., Santori, A., Macri, S., McGaugh, J. L., & Campolongo, P. (2018). Enhanced brain activity associated with memory access in highly superior autobiographical memory. Proceedings of the National Academy of Sciences of the United States of America, 115(30), 7795?7800. doi: 10.1073/pnas.1802730115
Sarkheil, P., Zilverstand, A., Kilian-Hütten, N., Schneider, F., Goebel, R., & Mathiak, K. (2015). fMRI feedback enhances emotion regulation as evidenced by a reduced amygdala response. Behavioural Brain Research, 281, 326?332. https://doi.org/10.1016/j.bbr.2014.11.027
Scheinost, D., Hsu, T. W., Avery, E. W., Hampson, M., Constable, R. T., Chun, M. M., & Rosenberg, M. D. (2020). Connectome-based neurofeedback: A pilot study to improve sustained attention. Neuroimage, 212, 116684. doi: 10.1016/j.neuroimage.2020.116684
Schumacher, A., Villaruel, F. R., Ussling, A., Riaz, S., Lee, A. C. H., & Ito, R. (2018). Ventral hippocampal CA1 and CA3 differentially mediate learned approach-avoidance conflict processing. Current Biology, 28(8), 1318?1324. E4. doi: 10.1016/j.cub.2018.03.012
Segrave, R. A., Cooper, N. R., Thomson, R. H., Croft, R. J., Sheppard, D. M., & Fitzgerald, P. B. (2011). Individualized alpha activity and frontal asymmetry in major depression. Clinical EEG and Neuroscience, 42(1), 45?52. doi: 10. 1177/155005941104200110
Sergerie, K., Chochol, C., & Armony, J. L. (2008). The role of the amygdala in emotional processing: A quantitative meta-analysis of functional neuroimaging studies. Neuroscience and Biobehavioral Reviews, 32(4), 811?830. doi: 10.1016/j.neubiorev.2007.12.002
Sherman, L. E., Payton, A. A., Hernandez, L. M., Greenfield, P. M., & Dapretto, M. (2016). The power of the like in adolescence: Effects of peer influence on neural and behavioral responses to social media. Psychological Science, 27(7), 1027?1035. doi: 10.1177/0956797616645673
Silk, J. S., Lee, K. H., Kerestes, R., Griffith, J. M., Dahl, R. E., & Ladouceur, C. D. (2017). "Loser" or "Popular"?: Neural response to social status words in adolescents with major depressive disorder. Developmental Cognitive Neuroscience, 28, 1?11. doi: 10.1016/j.dcn.2017.09.005
Sitaram, R., Ros, T., Stoeckel, L., Haller, S., Scharnowski, F., Lewis-Peacock, J., ... Sulzer, J. (2017). Closed-loop brain training: The science of neurofeedback. Nature Reviews Neuroscience, 18(2), 86?100. doi: 10.1038/nrn.2016.164
Skottnik, L., & Linden, D. E. J. (2019). Mental imagery and brain regulation-new links between psychotherapy and neuroscience. Frontiers in Psychiatry, 10, 14. doi: 10. 3389/fpsyt.2019.00779
Sosa, M., & Giocomo, L. M. (2021). Navigating for reward. Nature Reviews Neuroscience, 22(8), 472?487. doi: 10. 1038/s41583-021-00479-z
Stewart, J. L., Coan, J. A., Towers, D. N., & Allen, J. J. B. (2011). Frontal EEG asymmetry during emotional challenge differentiates individuals with and without lifetime major depressive disorder. Journal of Affective Disorders, 129(1-3), 167?174. doi:10.1016/j.jad.2010.08.029
Stewart, J. L., Towers, D. N., Coan, J. A., & Allen, J. J. B. (2011). The oft-neglected role of parietal EEG asymmetry and risk for major depressive disorder. Psychophysiology, 48(1), 82?95. doi: 10.1111/j.1469-8986.2010.01035.x
Sun, L. H., Perakyla, J., & Hartikainen, K. M. (2017). Frontal alpha asymmetry, a potential biomarker for the effect of neuromodulation on brain's affective circuitry- preliminary evidence from a deep brain stimulation study. Frontiers in Human Neuroscience, 11, 9. doi: 10.3389/ fnhum.2017.00584
Suslow, T., Konrad, C., Kugel, H., Rumstadt, D., Zwitserlood, P., Sch?ning, S., ... Dannlowski, U. (2010). Automatic mood-congruent amygdala responses to masked facial expressions in major depression. Biological Psychiatry, 67(2), 155?160. doi: 10.1016/j.biopsych.2009. 07.023
Szucs, D., & Ioannidis, J. P. A. (2017). Empirical assessment of published effect sizes and power in the recent cognitive neuroscience and psychology literature. Plos Biology, 15(3), e3001151. doi: 10.1371/journal.pbio.2000797
Taschereau-Dumouchel, V., Cushing, C. A., & Lau, H. (2022). Real-time functional MRI in the treatment of mental health disorders. Annual Review of Clinical Psychology, 18, 125?154. doi: 10.1146/annurev-clinpsy- 072220-014550
Tashjian, S. M., & Galván, A. (2018). The role of mesolimbic circuitry in buffering election-related distress. Journal of Neuroscience, 38(11), 2887?2898. doi: 10.1523/jneurosci.2470-17.2018
Taylor, C. T., Lyubomirsky, S., & Stein, M. B. (2017). Upregulating the positive affect system in anxiety and depression: Outcomes of a positive activity intervention. Depression and Anxiety, 34(3), 267?280. doi: 10.1002/da.22593
Thibault, R. T., Lifshitz, M., & Raz, A. (2016). The self- regulating brain and neurofeedback: Experimental science and clinical promise. Cortex, 74, 247?261. doi: 10.1016/ j.cortex.2015.10.024
Thibault, R. T., Lifshitz, M., & Raz, A. (2017). Neurofeedback or neuroplacebo? Brain, 140(4), 862?864. doi: 10.1093/brain/awx033
Thibault, R. T., & Raz, A. (2016). Neurofeedback: The power of psychosocial therapeutics. Lancet Psychiatry, 3(11), E18?E18. doi: 10.1016/s2215-0366(16)30326-1
Thibodeau, R., Jorgensen, R. S., & Kim, S. (2006). Depression, anxiety, and resting frontal EEG asymmetry: A meta-analytic review. Journal of Abnormal Psychology, 115(4), 715?729. doi: 10.1037/0021-843x.115.4.715
Trambaiolli, L. R., Kohl, S. H., Linden, D. E. J., & Mehler, D. M. A. (2021). Neurofeedback training in major depressive disorder: A systematic review of clinical efficacy, study quality and reporting practices. Neuroscience and Biobehavioral Reviews, 125, 33?56. doi: 10.1016/j.neubiorev.2021.02.015
Treadway, M. T., & Zald, D. H. (2011). Reconsidering anhedonia in depression: Lessons from translational neuroscience. Neuroscience and Biobehavioral Reviews, 35(3), 537?555. doi: 10.1016/j.neubiorev.2010.06.006
Vanderlind, W. M., Millgram, Y., Baskin-Sommers, A. R., Clark, M. S., & Joormann, J. (2020). Understanding positive emotion deficits in depression: From emotion preferences to emotion regulation. Clinical Psychology Review, 76, 101826. doi: 10.1016/j.cpr.2020.101826
Victor, T. A., Furey, M. L., Fromm, S. J., Ohman, A., & Drevets, W. C. (2010). Relationship between amygdala responses to masked faces and mood state and treatment in major depressive disorder. Archives of General Psychiatry, 67(11), 1128?1138. doi: 10.1001/archgenpsychiatry.2010.144
Wang, S.-Y., Lin, I. M., Peper, E., Chen, Y.-T., Tang, T.-C., Yeh, Y.-C., ... Chu, C.-C. (2016). The efficacy of neurofeedback among patients with major depressive disorder: Preliminary study. NeuroRegulation, 3(3), 127? 134. doi: 10.15540/nr.3.3.127
Werner-Seidler, A., Banks, R., Dunn, B. D., & Moulds, M. L. (2013). An investigation of the relationship between positive affect regulation and depression. Behaviour Research and Therapy, 51(1), 46?56. doi: 10.1016/j.brat. 2012.11.001
Young, K. D., Siegle, G. J., Bodurka, J., & Drevets, W. C. (2016). Amygdala activity during autobiographical memory recall in depressed and vulnerable individuals: Association with symptom severity and autobiographical overgenerality. American Journal of Psychiatry, 173(1), 78?89. doi: 10.1176/appi.ajp.2015.15010119
Young, K. D., Siegle, G. J., Zotev, V., Phillips, R., Misaki, M., Yuan, H., ... Bodurka, J. (2017). Randomized clinical trial of real-time fMRI amygdala neurofeedback for major depressive disorder: Effects on symptoms and autobiographical memory recall. American Journal of Psychiatry, 174(8), 748?755. doi: 10.1176/appi.ajp.2017. 16060637
Young, K. D., Zotev, V., Phillips, R., Misaki, M., Drevets, W. C., & Bodurka, J. (2018). Amygdala real-time functional magnetic resonance imaging neurofeedback for major depressive disorder: A review. Psychiatry and Clinical Neurosciences, 72(7), 466?481. doi: 10.1111/pcn.12665
Young, K. D., Zotev, V., Phillips, R., Misaki, M., Yuan, H., Drevets, W. C., & Bodurka, J. (2014). Real-time fMRI neurofeedback training of amygdala activity in patients with major depressive disorder. Plos One, 9(2), e88785. doi: 10.1371/journal.pone.0088785
Yuan, H., Young, K. D., Phillips, R., Zotev, V., Misaki, M., & Bodurka, J. (2014). Resting-state functional connectivity modulation and sustained changes after real-time functional magnetic resonance imaging neurofeedback training in depression. Brain Connectivity, 4(9), 690?701. doi: 10. 1089/brain.2014.0262
Zheng, J., Anderson, K. L., Leal, S. L., Shestyuk, A., Gulsen, G., Mnatsakanyan, L., ... Lin, J. J. (2017). Amygdala- hippocampal dynamics during salient information processing. Nature Communications, 8, 14413. doi: 10.1038/ncomms 14413
Zheng, L. J., Yang, G. F., Zhang, X. Y., Wang, Y. F., Liu, Y., Zheng, G., ... Han, Y. (2017). Altered amygdala and hippocampus effective connectivity in mild cognitive impairment patients with depression: A resting-state functional MR imaging study with granger causality analysis. Oncotarget, 8(15), 25021?25031. doi: 10.18632/ oncotarget.15335
Zhu, Y. S., Gao, H., Tong, L., Li, Z. L., Wang, L. Y., Zhang, C., ... Yan, B. (2019). Emotion regulation of hippocampus using real-time fMRI neurofeedback in healthy human. Frontiers in Human Neuroscience, 13, 14. doi: 10.3389/ fnhum.2019.00242
Zotev, V., Krueger, F., Phillips, R., Alvarez, R. P., Simmons, W. K., Bellgowan, P., ... Bodurka, J. (2011). Self- regulation of amygdala activation using real-time fMRI neurofeedback. Plos One, 6(9), e24522. doi: 10.1371/ journal.pone.0024522
Zotev, V., Mayeli, A., Misaki, M., & Bodurka, J. (2020). Emotion self-regulation training in major depressive disorder using simultaneous real-time fMRI and EEG neurofeedback. Neuroimage-Clinical, 27, 102331. doi: 10.1016/j.nicl. 2020.102331
Zotev, V., Phillips, R., Young, K. D., Drevets, W. C., & Bodurka, J. (2013). Prefrontal control of the amygdala during real-time fMRI neurofeedback training of emotion regulation. Plos One, 8(11), e79184. doi: 10.1371/journal. pone.0079184
Zotev, V., Yuan, H., Misaki, M., Phillips, R., Young, K. D., Feldner, M. T., & Bodurka, J. (2016). Correlation between amygdala BOLD activity and frontal EEG asymmetry during real-time fMRI neurofeedback training in patients with depression. Neuroimage-Clinical, 11, 224?238. doi: 10.1016/j.nicl.2016.02.003
The application of neurofeedback for positive emotion enhancementin depression treatment
Abstract: Positive emotion plays an important role in the improvement of clinical symptoms and the recovery of social function in patients with depression. In recent years, the development of neurofeedback technology provides an effective approach to enhance the positive emotion of depression. The traditional treatments that target the positive affect are subjective, have a relatively limited impact and lack of objective outcome measures. In contrast, neurofeedback technology based on objective physiological and image indicators has important clinical application value in enhancing positive emotions in depression. Neurofeedback, as a non-invasive technology, uses various electrophysiological methods and neuroimaging technologies to obtain real-time measurements of brain activity and provide feedback signals to subjects, so that the subjects can learn self-control over the activity in a brain area related to emotions through certain strategies. Crucially, it can evaluate objectively and quantitatively the improvement of positive emotions as well as provide more targeted treatments. However, the existing studies have great heterogeneity in experimental paradigms, parameter settings and individual efficacy. In this review, training protocols, the influencing factors of the protocols of neurofeedback and target brain regions of neurofeedback training based on imaging biomarkers will be discussed and summarized, the importance of standardization of experimental design and result reporting will be emphasized, and the potential treatment targets based on reward circuits and optimization schemes of neurofeedback will be recommended. It is expected to provide an operable reference scheme for positive emotion recovery in clinical depression. It lays a foundation for the clinical translation and popularization of neurofeedback technology in the treatment of clinical symptoms and social function rehabilitation of depression in the future.
Keywords: positive affect, neurofeedback, depression, anhedonia, electroencephalography, functional magnetic resonance imaging
