活性污泥萃取液施用对水稻根际土壤微生物群落结构的影响
2024-02-16童彤纪荣婷许秋瑾王建国李小鸥张悦
童彤,纪荣婷,许秋瑾*,王建国,李小鸥,张悦
1.湖泊水污染治理与生态修复技术国家工程实验室,中国环境科学研究院
2.生态环境部南京环境科学研究所
3.中农国盛(北京)环境生态工程科技有限公司
4.中国土木工程学会水工业分会
随着我国城市化的发展,城市生活污水产生量不断增长。活性污泥法是当前应用最广泛的生活污水处理技术之一,我国现有城镇污水处理厂80%以上采用该工艺进行污水处理[1]。污水处理过程中,微生物利用自身活性通过转化和降解,降低污水中污染物浓度,同步产生副产物活性污泥[2]。未经良好处置的污泥直接进入自然环境中,会对环境造成二次污染[3]。为了保证污水处理厂正常运行和防止产生二次污染,必须对污泥进行处理处置。因此,如何经济有效地利用生活污水处理过程中产生的高回收价值的活性污泥受到广泛关注[4]。活性污泥是由多种好氧微生物、兼性厌氧微生物(少量厌氧微生物)与废水中的有机、无机固体物混合在一起形成的絮状体,具有较高的生物多样性和微生物活性。据统计,活性污泥中的细菌数量为1010~1012个/L[5]。自然界中,大部分微生物均以凝聚体的形式存在,并通过胞外聚合物聚集在一起。胞外聚合物由细胞代谢产生,成分与微生物的胞内成分相似,主要由高分子物质组成,如多糖、蛋白质、核酸等聚合物,占活性污泥总有机物的80%[6]。同时,活性污泥中还包含丰富的有机碳源,如蛋白质、多糖、核酸、脂类、腐殖酸等,有着巨大的资源回收价值[7]。利用碱性热水解法从活性污泥中制备农业上可利用的养分是活性污泥农用资源化的一种方式,已有研究显示碱热水解法可从活性污泥中制备出高活性植物生长促进物质[8],其中植物激励素(吲哚-3-乙酸和羟基苯基乙酸)和化感化学物质(吲哚啉衍生物和芳香族羧酸)等能促进植株生长,改良土壤环境,前期研究通过活性污泥萃取液的重金属测定与种子萌发和根伸长试验发现,适宜浓度的活性污泥萃取液可安全农用,同时促进水稻种子萌发和苗期生长[9]。
根土界面是土壤微生物和作物根系发育最活跃的区域,不同的养分物质输入首先会影响作物根际土壤中生态系统组成成分的功能,进而影响作物地上部的生长发育[10]。根际作为植物-土壤-微生物相互作用的微区域,既是养分从土壤进入植物体内参与物质循环的重要门户,又是土壤微生物活跃的关键场所,也是养分生物有效性研究关注的焦点[11]。根土界面微生物广泛分布在根际和非根际土壤中,其多样性和丰富度在调节有机质分解和养分循环等生态系统功能中发挥着关键作用[12],其中土壤根际微生物更是参与作物生长发育必不可少的碳氮等元素的循环、有机化合物的分解以及能量传输等多个过程[13]。根际微生物群落多样性与土壤生态系统的结构、功能密切相关,在维持土壤肥力和土壤生态平衡中发挥着重要作用[14]。根际微生物易受土壤理化性质影响,同时也是评价植物根际土壤质量的重要生物学指标[15]。前期试验过程中发现施用活性污泥萃取液可以促进作物种子萌发和苗期生长、提高土壤质量,但根际微生物对萃取液施用下水稻植株生长和土壤质量的影响机理尚待进一步研究。笔者研究活性污泥萃取液施用对水稻苗期生长和土壤的影响,以及根土界面中微生物群落结构的变化特征,旨在从根际微生物角度阐释萃取液对作物生长和土壤性质的调控机理。
1 材料与方法
1.1 供试材料
供试水稻品种为粳稻“南粳9108”。供试土壤采自生态环境部南京环境科学研究所黄山野外试验基地,土壤类型为水稻土。土壤基本理化性质:pH,5.7;可溶性有机碳含量,2.7 mg/kg;电导率,105 μS/cm;硝态氮含量,3.58 mg/kg;铵态氮含量,14.52 mg/kg。活性污泥萃取液由中农国盛(北京)环境生态工程科技有限公司提供,前期研究[8]已通过种子发芽试验证实适宜浓度的萃取液能促进水稻种子萌发。萃取液重金属浓度均远低于NY 1429—2010《含氨基酸水溶肥料》标准限值,符合相关农用标准。本试验中活性污泥萃取液在30 倍稀释状态下施用。氮、磷、钾肥分别采用尿素、磷酸二氢钾和氯化钾。
1.2 试验设计
试验采用多区室的定制根箱,根箱由聚氯乙烯灰色塑料板制成,大小为17 cm×15 cm×20 cm。每个分区间以尼龙网相隔成多区室种植环境,尼龙网可以避免根系组织生长时进入相邻区域,还可确保根系分泌物、微生物、水分、营养等物质的无障碍迁移。根系生长室和距离根室0~5、5~70 mm 的区域分别为根际(rhizosphere,简称R)、近根际(nearrhizosphere,简称NR)和远根际(far-rhizosphere,简称FR)的土壤取样区域,每个根箱用土为5 kg 风干土。根箱试验于2021 年夏季进行,设置5 个试验组,包括空白对照(T1,不施用任何肥料),常规施肥对照(T2,仅施用化肥处理,施用量参考当地习惯),低量活性污泥萃取液(T3,化肥减氮30%配施0.2 mg/kg 萃取液),高量活性污泥萃取液(T4,化肥减氮30%配施0.4 mg/kg 萃取液),全量活性污泥萃取液(T5,无化肥氮施用,8 mg/kg 萃取液提供25%氮肥施用量,即减氮75%)。每个试验组设置4 个平行,各处理的磷、钾肥养分施用量一致,分别为0.13 g/kg P2O5和0.19 g/kg K2O。水稻育苗至三叶一心后,选取长势一致的幼苗移栽至根箱中(每箱4 株),生长30 d 后进行植株和多区域(根际、近根际和远根际区域)土壤样品采集。各区室分别随机选取3 个采样点,去除其中的石块、细根等杂质,采集50.0 g 土壤样品。样品一部分于−80 ℃储存,用于土壤微生物DNA 的提取;一部分于4 ℃储存,用于土壤硝态氮和铵态氮的测定;剩余土壤风干后用于测定基本理化性质。
1.3 测定方法
植株叶面积采用直接测量法测定;植株生物量(地上、地下)采用烘干称重法测定;植株叶绿素含量采用无水乙醇浸提法测定。
土壤pH 采用电位法(土水比为1∶2.5)测定;土壤电导率采用的饱和泥浆法(土水比为1∶1)测定;土壤可溶性有机碳(DOC)用蒸馏水提取后利用TOC 仪(德国,耶拿Multi N/C2100)测定其含量;土壤全氮含量采用H2SO4-混合催化剂消煮-凯氏定氮法测定,硝态氮含量采用KCl 浸提-紫外分光光度法测定,铵态氮含量采用KCl 浸提-靛酚蓝比色法测定。
采用DNA 提取试剂盒(FastDNA SPIN Kit for Soil,MP)进行土壤DNA 的提取。采用2%琼脂糖凝胶电泳检测DNA 提取质量,鉴定DNA 的浓度和纯度。扩增程序:预变性(95 ℃,3 min),变性(95 ℃,30 s),退火(55 ℃,30 s),延伸(72 ℃,30 s),延伸(72℃,10 min)。土壤细菌采用具有特征性引物F341(5′-CCT ACG GGN GGC WGC AG-3′)和R806(5′-GGA CTA CHV GGG TAT CTA AT-3′)扩 增16S rRNA V3+V4 区,在每个样品的上游引物5′端添加Barcode 序列区分样品。使用AMPure XP Beads 对第二轮扩增产物进行纯化,采用ABI StepOnePlus RealTime PCR System(Life Technologies,美国)进行定量,根据Novaseq 6000 的PE250 模式pooling 上机测序,测序服务委托广州基迪奥生物科技公司完成。
1.4 数据分析
采用Excel 2019 软件进行数据整理,利用DPS 软件的LSD 法(P<0.05)进行处理间差异性分析,结果以平均值±标准差表示。选择97%相似度的OTU 进行α多样性分析,采用LEfSe 软件根据分类学组成对样本按照不同的分组条件进行线性判别分析(LDA),Qiime 软件计算β多样性距离矩阵,利用R 语言工具进行统计分析和作图。
2 结果与讨论
2.1 萃取液对水稻植株生长的影响
水稻叶面积和叶绿素含量的增加有利于提高叶片光合作用,可有效反映作物生长状况。地上部生物量与地下部生物量的积累可以反映水稻生长的发育情况。由图1 可知,与T1 相比,施用萃取液后,T3、T4、T5 处理的叶面积显著增加13.67%、20.70%、21.12%(P<0.05);地上部生物量显著增加15.49%、33.80%、46.48%(P<0.05),地下部生物量显著增加25.53%、34.04%、57.45%(P<0.05);叶绿素含量显著增加18.07%、24.10%、30.12%(P<0.05)。与T2 相比,T3、T4、T5 处理的叶面积显著增加11.91%、18.84%、19.25%(P<0.05),地上部生物量显著增加10.81%、28.38%、40.54%(P<0.05),地下部生物量显著增加18%、26%、48%(P<0.05);叶绿素含量显著增加16.67%、22.62%、28.57%(P<0.05)。
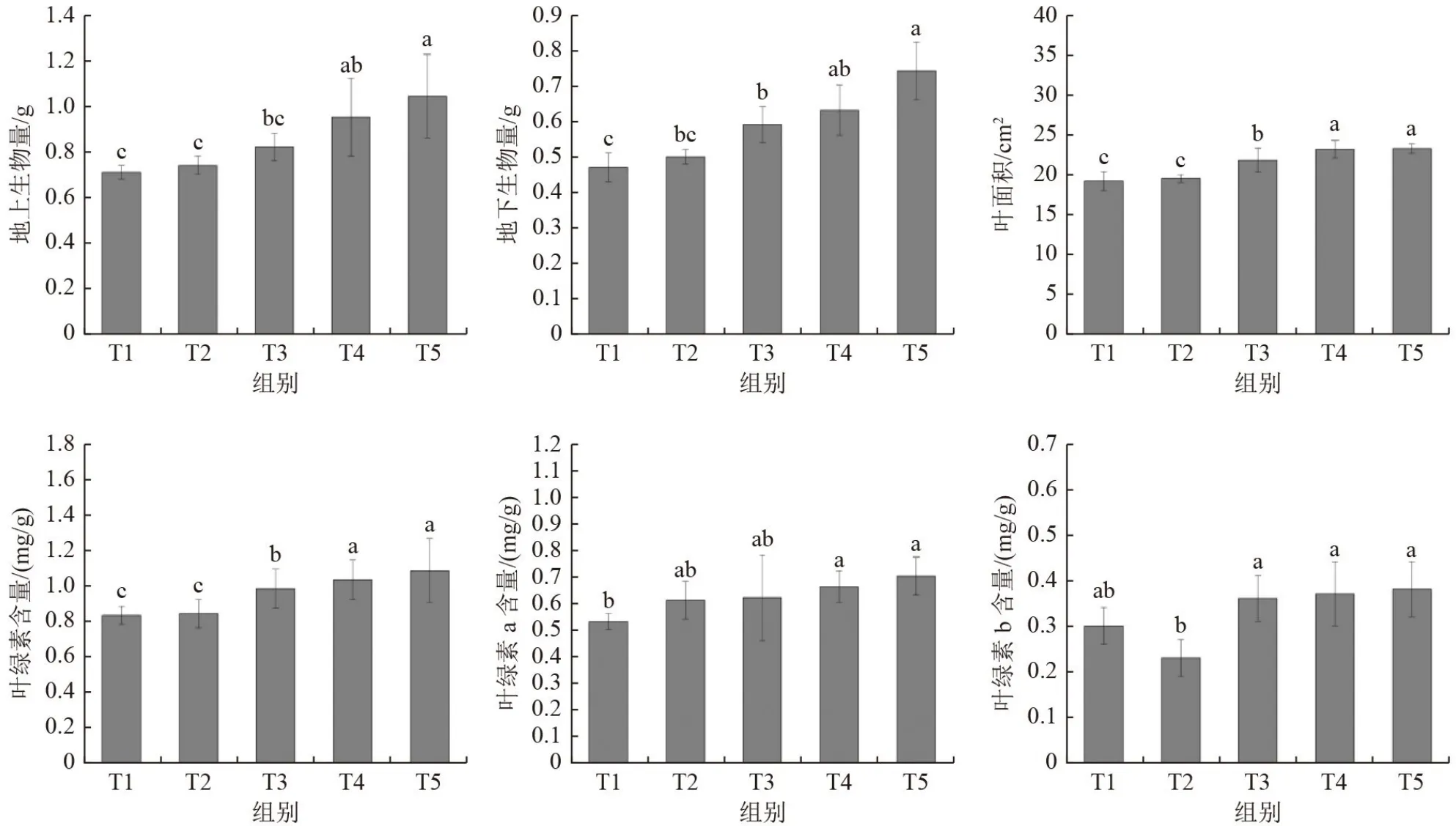
图1 活性污泥萃取液对水稻幼苗生长性状的影响Fig.1 Effect of activated sludge extracts on growth traits of rice seedlings
施用萃取液能显著促进水稻幼苗叶面积、叶绿素含量、地上部生物量和地下部生物量的增长,可见,萃取液对水稻苗期生长具有显著促进作用。原因可能是萃取液中包含丰富的有机碳源,如蛋白质、多糖、核酸、脂类、腐殖酸等,这些丰富的有机碳源能够为水稻幼苗的生长提供充分的营养物质[7-8]。与已有研究相比,萃取液促进水稻生长的效果和烟秆生物炭、秸秆还田等施用效果相似。如烟秆生物炭施用能够显著促进烟草株高、茎围、叶片生长和生物量增加[16];秸秆还田后玉米的株高、茎围、生物量等指标均有增加[17],萃取液作用效果与上述物质相比类似或更加显著,表明萃取液可作为一种潜在的植物生长促进物质。
2.2 萃取液对水稻土壤理化性质的影响
由图2 可知,与T2 相比,无论是根际、近根际还是远根际,T3、T4、T5 处理的pH 显著增加,增加幅度为0.54%~14.97%(P<0.05)。与T2 相比,T3、T4、T5 处理各根区电导率显著降低,降幅为28.77%~66.27%(P<0.05)。与T2 相比,各根区土壤中,T3、T4、T5 处理组DOC 含量均显著增加(P<0.05),增幅为8.29%~68.03%。可见,萃取液施用可显著影响土壤理化性质,且根际和近根际区域土壤DOC 含量、降低土壤含量和质子的净产量,增加土壤pH[18]。与常规施肥相比,萃取液配施后土壤电导率pH 及电导率变化较远根际区域更为显著。经过碱性稳定化手段后的萃取液呈碱性,因此施入土壤后会使土壤pH 略增加,但和空白对照相比没有显著性差异,这可能是由于化肥氮肥添加后土壤中尿素的氨化和硝化均会释放大量质子,降低土壤pH,而配施萃取液后,一方面其本身的碱性可以提高土壤pH,另一方面萃取液添加可提高氮素的利用率,从而显著下降,这是由于萃取液的施用降低了速效养分的投入,同时提高了植物对养分离子的利用率,该结果与其他有机水溶肥施用的效果[19]相似,表明萃取液配施可降低土壤盐分,减少盐渍化可能。土壤DOC 含量的提高对碳水化合物、氨基酸和多聚化合物等物质的利用能力具有一定的促进作用[20],因此,萃取液的施用既可以充当土壤DOC 的来源,也可以促进土壤有机质的溶解,使土壤DOC 含量显著增加。
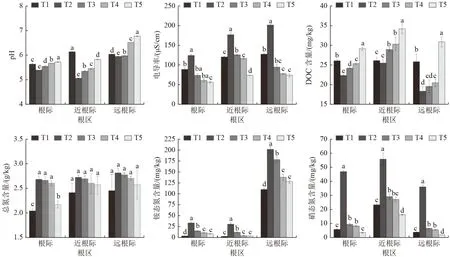
图2 活性污泥萃取液对土壤理化性质的影响Fig.2 Effect of activated sludge extracts on soil physicochemical properties
由图2 可知,与T2 相比,T3、T4、T5 处理各根区铵态氮含量均显著减少,且T4、T5 处理组减少更明显,最多减少了88.22%(P<0.05);T3、T4、T5 处理各根区硝态氮含量均显著减少,最多减少了94.54%(P<0.05),但总氮含量仅根际土壤中T5 处理显著减少19.03%(P<0.05)。上述研究结果显,示施用萃取液后土壤总氮含量基本无明显变化,铵态氮和硝态氮含量显著降低,说明萃取液施用可以促进土壤氮素转化为有机氮,有利于土壤中氮元素的积累。原始活性污泥中存在大量和氮代谢有关的菌群,故而萃取液中会含有大量和氮元素形态转化相关的微生物代谢产物[4]。在萃取液施用过程中,这些代谢产物可能会传递化学和生物信息,起到促进氮的转化利用功能,这和一些微生物菌剂的作用效果类似。微生物菌剂可有效提高土壤有机碳含量,提高氮肥农学效率和氮素吸收效率[21]。近根际土壤可溶性有机碳、全氮含量均显著高于根际和远根际土壤。根际效应会促使微生物菌群向近根际区域靠近,植物根产生的分泌物和脱落物为近根际区土壤微生物提供有效碳和氮源[22]。远根际区域铵态氮含量远高于根际和近根际区域,可能由于pH 由酸性向碱性过渡时,土壤有机质由螺旋态转变为线性态的过程会为铵态氮提供了大量吸附点位[23],这与远根际区域pH 高于根际及近根际区域的试验结果吻合。在本研究中硝态氮含量显著高于铵态氮含量,这可能是由于相对硝态氮,水稻更喜欢吸收利用铵态氮,进而导致根际和近根际土壤中铵态氮含量减少[24]。
2.3 萃取液对土壤微生物群落多样性的影响
2.3.1α多样性分析
由表1 可知,根际区域内,与对照组T1、T2 相比,各处理组土壤细菌群落结构的多样性和丰富度无显著性差异。在近根际区域,Sobs、Chao、Ace 指数显示,T5 的α多样性指数显著大于T1、T2(P<0.05);Shannon 指数显示,T4 和T5 的α多样性指数分别较T1 显著提高10.34%、8.05%(P<0.05);T4、T5 的Simpson 指数显著大于T1(P<0.05)。远根际区域内,Sobs、Chao、Ace 指数显示,T4 的α多样性指数较T1 显著提高8.41%~10.19%(P<0.05)。研究结果显示,在活性污泥萃取液配施化肥处理中,随着萃取液施用量的增加,总体上菌群丰富度和均匀度均会逐渐提高,但全量萃取液组有所下降。不同种类或基因型植物的根系均会在土壤中招募大量特定种属的微生物,调节根际微生物群落的多样性和群落结构,以促进自身的生长并增强抗逆性[25]。有研究表明,氮肥减施不仅能促进水稻优良生长,还能增加根际分泌物,为微生物生长繁殖提供更为适宜的生长条件[26]。本研究处理组不仅减氮,而且还配施了萃取液,萃取液本身含有腐殖酸、氨基酸、糖类、蛋白质等物质,可为微生物提供大量的碳源,以促进细菌α多样性指数的提高[8]。

表1 各处理不同根区土壤微生物α 多样性指数Table 1 α diversity index of soil microorganisms in different rhizosphere regions for each treatment
2.3.2β多样性分析
PCoA 主成分分析可将不同组样品的微生物多样性差异反映在二维坐标图上,主成分轴用来解释差异。图3 显示,施用萃取液对水稻根际、近根际和远根际微生物的影响存在差异。对根际微生物而言〔图3(a)〕,第1 主成分(PCo1)和第2 主成分(PCo2)分别解释差异的31.78%和22.17%,合计贡献率为53.95%;对近根际微生物而言〔图3(b)〕,PCo1 和PCo2 分别解释差异的58.67%和11.19%,合计贡献率为69.86%;对远根际微生物而言〔图3(c)〕,PCo1 和PCo2 分别解释差异的31.21%和16.96%,合计贡献率为48.17%。Anosim 检验结果显示(图4),在根际、近根际和远根际土壤区域内R的范围为[0,1],P分别为0.001、0.001 和0.002,说明组间差异大于组内差异,且差异显著(P<0.05)。远根际细菌变异解释率和P均低于根际、近根际,表明萃取液的施用使得根际与近根际细菌群落结构变异更大。有研究表明土壤pH、电导率和有机质均是影响土壤微生物群落结构变化的主要因素[27]。本研究证实施用萃取液后,根际和近根际区域土壤DOC 含量、pH 及电导率变化较远根际区域更为显著,这可能是远根际区域菌群结构变化较小的原因。
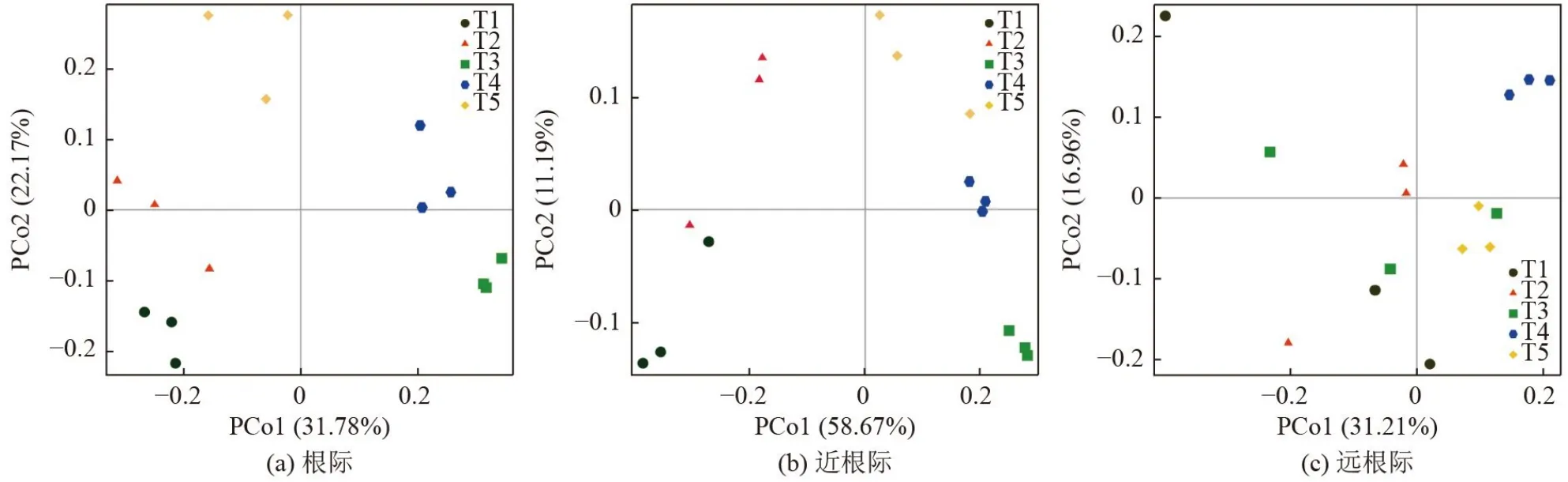
图3 各处理不同根际区域细菌群落结构主坐标分析Fig.3 Principal coordinate analysis of bacterial community structure in different rhizosphere regions for each treatment

图4 各处理不同根际区域组间细菌群落结构Anosim 检验箱线图Fig.4 Anosim test box plots of bacterial community structure in different rhizosphere regions for each treatment
β多样性结果表明,在根际与近根际土壤中,组间距离显著大于组内距离,不同处理组与对照组之间微生物群落结构具有显著差异,说明不同处理组与对照组间的物种多样性存在显著差异(P<0.05),外源养分添加后土壤原有的生态平衡会被打破,土壤微生物丰度及群落结构也会随之改变。该结果与Paz-Ferreiro 等[28]的研究结果相似,即在土壤中添加污泥生物炭后,土壤微生物群落结构会发生显著改变。
2.4 土壤根际微生物属水平群落分析
由图5 可知,相比较远根际,施用萃取液对水稻根际、近根际土壤微生物群落结构产生了显著的影响,尤其以近根际效果最为明显。属水平差异分析显示:施用活性污泥萃取液配合氮肥减施,在根际和近根际富集的主要菌群为黄色土源菌(Flavisolibacter)、Candidatus_Udaeobacter、鞘氨醇单胞菌属(Sphingomonas)。与T2 相比,T3、T4、T5各处理组根际区域黄色土源菌相对丰度分别增加了319%、217%、138%,Candidatus_Udaeobacter相对丰度分别增加了232%、320%、93%,鞘氨醇单胞菌属相对丰度分别增加了181%、115%、55%;近根际区域黄色土源菌相对丰度分别增加了541%、336%、151%,Candidatus_Udaeobacter相对丰度分别增加了151%、181%和26%,鞘氨醇单胞菌属相对丰度分别增加了266%、364%、105%。其中黄色土源菌是一种植物根际促生菌,能高密度定殖在植物根际,兼有抑制植物病原菌、根际有害微生物的作用,可有效增强作物对非生物胁迫的耐受性和防御反应以及促进植物生长并增加作物产量。Candidatus_Udaeobacter属于厌氧异养微生物,拥有丰富的种群、相对较小基因组的和多个假定的营养缺陷型,擅长使用替代策略牺牲代谢多功能性以提高在土壤环境中的主导地位,该菌群可以利用有限的碳源如葡萄糖、丙酮酸、壳二糖等进行代谢活动[29],同时可使其他释放出抗生素的菌群裂解,避免抗生素的有害影响。鞘氨醇单胞菌属是一类丰富的新型微生物,对多环芳烃、除草剂、农药等有害大分子物质有生物降解作用。研究显示植物根际的选择性招募会导致土壤中的功能微生物含量发生改变[30],本研究结果显示,萃取液配施化肥的处理中根际和近根际黄色土源菌、Candidatus_Udaeobacter、鞘氨醇单胞菌群丰度显著增加,说明施用萃取液对土壤微生物也有一定的选择性招募作用,可促使植物根际促生菌和具有降解污染物功能的微生物含量增多。
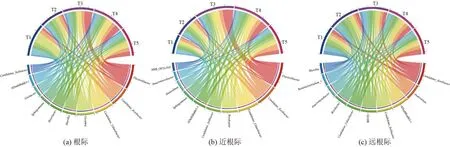
图5 各处理间不同根际区域土壤属水平菌群落结构组成分析Fig.5 Structural composition analysis of genus level bacteria in different rhizosphere regions for each treatment
2.5 土壤微生物群落结构与理化因子耦合分析
土壤理化因子可影响土壤内的微生物组成。土壤的pH、电导率、氮、磷、有机质等物理特性会对土壤中的微生物群落产生一定作用[31]。运用Pearson相关性分析,可解释环境因子对土壤微生物群落结构影响。由于萃取液施用对近根际土壤中的微生物影响最显著,因此聚焦分析土壤理化因子对近根际土壤中生物群落的影响。由图6 可知,pH 与HSB_OF53-F07 和Candidatus_Solibacter菌群丰度呈显著负相关(P<0.05)。电导率与Candidatus_Koribacter菌群丰度呈极显著负相关(P<0.01)。DOC 含量与Candidatus_Koribacter菌群丰度呈极显著正相关(P<0.001)。铵态氮、硝态氮含量均与Candidatus_Solibacter菌群丰度呈极显著正相关(P<0.01)。总氮含量与HSB_OF53-F07 和Candidatus_Solibacter菌群丰度呈显著正相关(P<0.05),与Anaeromyxobacterr菌群丰度呈显著负相关(P<0.05)。以上结果和Yuan 等[32]得出的土壤理化因子差异使靠近植物根部的土壤微生物趋于多样性和差异分布的结论相似。
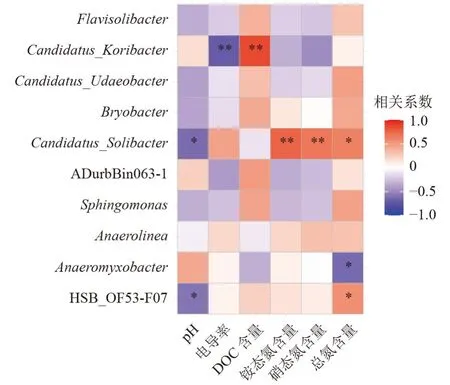
图6 土壤理化因子与土壤微生物耦合分析热图Fig.6 Heat map of coupled soil physicochemical factors and soil microbial analysis
2.6 土壤微生物功能预测
采用FAPROTAX 微生物功能预测软件对根际、近根际和远根际土壤细菌群落分别进行功能注释。由图7 可见,土壤细菌功能种群丰度较高的主要有化能异养(chemoheterotrophy)、有氧化能异养(aerobic chemoheterotrophy)、发酵作用(fermentation)、铁呼吸(iron_respiration)、芳香化合物降解(aromatic_compound_degradation)、细菌掠夺性或外寄生(predatory_or_exoparasitic)等。其中,与空白和常规施肥对照相比,近根际菌群功能变化最为显著。与T2 相比,施用萃取液的T3、T4、T5 处理组,化能异养功能分别显著增加32.90%、54.28%、37.92%,有氧化能异养功能分别显著增加57.11%、89.95%、51.72%,芳香化合物降解功能分别显著增加115.38%、273.08%、219.23%。
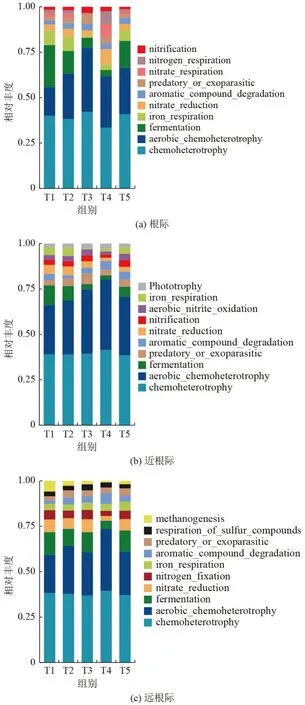
图7 基于FAPROTAX 的各处理间不同区域土壤微生物功能预测Fig.7 Prediction of soil microbial functions in different areas between treatments based on FAPROTAX
化能异养、有氧化能异养与碳循环相关,被认为是最广泛的生态系统功能,并由大多数微生物执行[33],如酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)等。化能异养型和好氧化能异养微生物所需能源来自有机物的氧化分解,萃取液中含有大量的有机碳以及微生物活性物质,这和一些有机肥类似,不仅能提供大量的有机物,而且有利于促进土壤原有有机质的溶解和利用[34]。芳香化合物是环境中广泛分布、结构复杂的难降解污染物,施用萃取液后显著增加的鞘氨醇单胞菌属菌株是降解芳香化合物的主要菌株。芳香化合物降解菌功能表达的增强有利于污染土壤修复。施用萃取液后,土壤中菌群固氮作用、硝化作用等与氮循环相关的功能表达增强,据此可以推测,生长在降水充沛、酸性土壤上的水稻植株,可通过根内和根际菌群的硝化作用、固氮作用,促进氮素的吸收和利用,降低硝态氮的淋溶,这可能和T3、T4、T5 处理下土壤铵态氮、硝态氮含量降低有关。虽然通过功能预测分析能部分反映萃取液施用对土壤根际微生物功能表达的改变,但土壤中大量细菌功能仍未知,因此,还需对该变化机理开展深入研究。
3 结论
(1)施用活性污泥萃取液可显著促进水稻苗期叶面积的增长、地上和地下部生物量的积累及叶绿素含量的增加。
(2)施用萃取液能够显著提高土壤pH,减少过量施用氮肥导致的土壤酸化。此外,可增加土壤DOC 含量,降低土壤硝态氮和铵态氮含量,促进土壤碳氮循环。
(3)施用萃取液可使根际与近根际土壤的菌群多样性显著增加。土壤pH、电导率、DOC 含量和氮含量与土壤微生物群落结构的变化存在密切关系。
(4)近根际土壤中全量萃取液配施磷钾肥组α多样性各指数显著高于空白对照与常规施肥对照组,远根际土壤中高量萃取液组α多样性各指数较空白对照组显著提高8.41%~10.19%。β多样性结果显示,萃取液对土壤微生物性质的影响主要作用在根际及近根际土壤中,不同萃取液处理组与空白及常规施肥对照组间细菌群落结构及多样性存在显著差异。属水平细菌群落结构分析结果显示,施用萃取液后,根际与近根际土壤中与碳代谢及植物根际促生菌相关的黄色土源菌、Candidatus_Udaeobacter、鞘氨醇单胞菌属菌群相对丰度分别增加151%~541%、26%~320%和55%~364%。功能预测分析显示土壤微生物群落与碳循环相关的化能异养、有氧化能异养、发酵作用功能表达加强,与氮循环相关的固氮作用、反硝化作用等功能表达加强,与降解有机污染物有关的芳香化合物降解作用功能表达加强。
