烟草疫霉拮抗细菌M10-4的筛选及其生防和促生效果
2024-02-14梅斯钇滕凯肖志鹏周向平肖艳松蔡海林李玲玲唐前君刘天波












摘要:为获得防治烟草黑胫病的生防资源,采用稀释涂布法及室内平板对峙法从烟草根际分离筛选烟草疫霉Phytophthora nicotianae)生防菌株。通过形态学、生理生化特性和16S rDNA 序列分析进行鉴定,并明确其抑菌广谱性及促生特性。筛选获得一株对烟草疫霉拮抗效果较好的生防细菌M10-4,抑菌率为73.97%,鉴定为吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia),它对辣椒疫霉病菌、烟草赤星病菌、烟草镰刀菌根腐病菌、柑橘炭疽病菌、烟草靶斑病菌都有一定抑制效果,对烟草黑胫病的田间防效为60.7%。该生防菌株具有产IAA能力,产IAA达6.754 mg/L,具有溶钾、溶磷、产蛋白酶的能力,对烟草的株高、最大叶长、总鲜重、总干重、地上部干重等促生效果明显。吡咯伯克霍尔德氏菌M10-4在病害防控和促生作用上效果明显,可作为PGPR进行研究,具有较好的应用前景。
关键词:烟草;疫霉;吡咯伯克霍尔德氏菌;生物防治;促生作用
中图分类号:S435.72" 文献标志码:A
文章编号:1002-1302(2024)24-0133-08
收稿日期:2023-12-13
基金项目:湖南省重点研发项目(编号:2023NK2019);中国烟草总公司项目[编号:110202101050(LS-10)、110202201019(LS-03)]。
作者简介:梅斯钇(1998—),女,江西九江人,硕士,主要从事植物病害生物防治研究。E-mail:453516175@qq.com。
通信作者:唐前君,博士,教授,主要从事植物病害生物防治研究,E-mail:Tangqianjun@126.com;刘天波,高级农艺师,主要从事植物病害生物防治研究,E-mail:tianboliu@126.com。
由烟草疫霉(Phytophthora nicotianae)引起的烟草黑胫病是烟草上一种重要土传病害,在世界烟区普遍发生[1],给我国烟草种植业造成重大损失[2]。目前,控制烟草黑胫病的主要方法有品种遗传改良、物理防治、化学防治和生物防治等。化学防治具有简便性、高效性,是烟草黑胫病首选的防治方法[3],但过于依赖化学杀菌剂,不仅使病原菌产生抗药性,还会破坏生态环境,造成农药残留、土壤板结、影响非靶标生物生存等问题[4]。
近年来,为了减少化学杀菌剂的使用,环境安全友好、无毒无残留的生物防治手段越来越受到研究者们的关注[5]。张蒙蒙等在病株根际分离的贝莱斯芽孢杆菌YCYM-09菌株对烟草黑胫病的室内防效为61.5%[6]。李苗苗等研究发现,3种芽孢杆菌GY1、GY10、GY12混合施用对烟草疫霉的平板抑菌率为86.9%,盆栽防效为74.53%[7]。章舸从根际土壤中筛选得到的放线菌H-3对烟草疫霉的抑菌率达81.90%[8]。生防菌除了可以防治病害,还能促进植物生长发育,可以作为微生物肥料使用[9]。吴风光等发现,用芽孢杆菌A03制成的菌肥对烟草角斑病、赤星病有较好拮抗作用,能提高土壤中的矿质元素含量,从而使烤烟增产[10]。王典等发现,哈茨木霉CGMCC23294在田间对烟草黑胫病防治效果最高达83.6%,同时促进烟株根系发育和茎叶生长,上等烟比例提高[11]。目前对防治烟草黑胫病的生防菌筛选主要集中在芽孢杆菌、放线菌等,但由于烟叶种植制度和土壤生态环境的差异,需要不断挖掘和发现新的本地土著生防菌。目前,对伯克霍尔德氏菌(Burkholderia sp.)作为烟草黑胫病生防菌的研究鲜有报道,研究其防效及促生作用,对丰富烟草病害生防菌株种类和开发生物菌剂具有重要意义。
本研究从烟草根际土壤中分离筛选出1株对烟草黑胫病有拮抗作用的生防细菌,开展了形态学、生理生化特征和分子生物学鉴定,测定抑菌谱以及促生特性,以期为丰富生防资源及烟草黑胫病的生物防治提供理论支撑。
1 材料和方法
1.1 供试材料
1.1.1 供试菌株 烟草疫霉及抑菌谱测定用的辣椒疫霉病菌(Phytophthora capsici)、烟草赤星病菌(Alternaria alternata)、烟草镰刀菌根腐病菌(Fusarium falciforme)、柑橘炭疽病菌(Gloeosporium frucrigenum)、烟草靶斑病菌(Rhizoctonia solani)均保存于湖南农业大学植物保护学院农业微生物基因组学研究室。
1.1.2 培养基 LB液体培养基(1 L):胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g(固体LB培养基只需在液体LB的基础上加入15 g琼脂粉)。马铃薯琼脂固体培养基PDA(1 L):去皮新鲜马铃薯 200 g,葡萄糖20 g,琼脂粉15 g。燕麦培养基(1 L):燕麦片30 g,琼脂粉15 g。Salkowski比色液[12]:15 mL浓硫酸中加入25 mL超纯水,加入0.75 mL的0.5 mol/L FeCl3·6H2O。
1.2 烟草黑胫病生防菌的分离筛选
采用稀释涂布法分离菌株[13]。取黑胫病发生严重的烟田中健康植株的根际土壤,将取得的烟草根际土壤除杂过筛,称取10 g于250 mL锥形瓶中,无菌水定容至90 mL,置于30" ℃、180 r/min的摇床中充分振荡混匀20~30 min。将土壤悬浮液稀释成10-2~10-6 5个稀释倍数的菌悬液。在超净台中用移液器吸取各梯度的土壤溶液0.1 mL至LB平板上涂布,各稀释设置3个重复,28 ℃恒温培养。2 d后观察菌落生长情况,挑取菌落特征不同的单菌落多次平板划线纯化,甘油保存备用。
采用平板对峙法筛选生防菌株[14]。将培养5 d的烟草疫霉PDA平板用打孔器(直径5 mm)打取菌饼,作为靶标菌放置在新的PDA平板中央,用无菌吸头将分离的菌株发酵液对称点接在距烟草疫霉菌饼2 cm处,以未接菌株的为空白对照,每个处理3次重复。置于28 ℃恒温培养箱倒置暗培养5~7 d,待对照黑胫病菌丝长满平板,测量处理菌落直径,并计算抑菌率。按以下公式计算抑菌率[15]:
抑菌率=对照组菌落生长直径-处理组菌落生长直径对照组菌落生长直径-菌饼直径×100%。
1.3 菌株M10-4鉴定
1.3.1 形态学鉴定 将菌株M10-4划线于固体LB平板,置于30 ℃恒温培养箱中培养1~2 d,观察菌落大小、形态、颜色、光滑程度等特征。挑取单菌落进行革兰氏染色,在光学显微镜下观察颜色,电镜观察芽孢、荚膜、鞭毛等菌体特征。用购于北京奥莱博科技有限公司的芽孢染色液(Moeller法)试剂盒、荚膜染色液(Hiss法)试剂盒、鞭毛染色液(Leifson法)试剂盒进行染色验证。
1.3.2 生理生化鉴定 参照《常见细菌系统鉴定手册》[16]和《伯杰细菌鉴定手册》[17]进行生理生化特性测定。
1.3.3 分子鉴定 挑取菌株M10-4单菌落到 10 μL 无菌水中,重悬混匀,利用细菌扩增通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行扩增。PCR扩增体系(20 μL)为Mix 10 μL、ddH2O 8.2 μL、引物1492R 0.4 μL、引物27F 0.4 μL、模板DNA" 1 μL。反应条件为:94 ℃预变性5 min;94 ℃变性 30 s,55 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃ 延伸5 min,4 ℃保存。PCR产物送至生工生物工程(上海)股份有限公司进行基因序列测定,将所测得的序列在NCBI上进行BLAST比对。以大肠杆菌为外群,利用MAGAX软件,采用Neighbor-Joining法构建拮抗菌株的系统发育树。
1.4 菌株M10-4抑菌谱测定
采用平板对峙法分别将辣椒疫霉病菌(Phytophthora capsici)、烟草赤星病菌(Alternaria alternata)、烟草镰刀菌根腐病菌(Fusarium falciforme)、柑橘炭疽病菌(Gloeosporium frucrigenum)、烟草靶斑病菌(Rhizoctonia solani)与M10-4对峙培养,操作及抑菌率计算方法同“1.2”节。
1.5 菌株M10-4发酵滤液对烟草疫霉的抑制效果
将生防菌接入液体LB中发酵48 h后分装到50 mL离心管中,7 000 r/min离心15 min,用 0.22 μm 的过滤器过滤后加入55 ℃左右的燕麦培养基中,摇匀后倒板。配成滤液浓度为10%、30%的平板,以不加滤液的平板为空白对照,每组3个重复。在平板中央接入5 mm烟草疫霉菌饼,28 ℃恒温培养5~7 d,待空白对照长满后,采用十字交叉法测量处理组菌落直径,挑取菌丝在光学显微镜下观察形态[18]。
1.6 菌株M10-4对烟草黑胫病的田间防效
2022年3月,选取湖南省湘西自治州烟草黑胫病往年发生较重的烟田进行防效试验。以菌株M10-4发酵液(1×108 CFU/mL)为试验组,化学对照药剂为68%精甲霜灵·锰锌可湿性粉剂1 000倍液,50%烯酰吗啉可湿性粉剂1 000倍液,生物对照药剂为10亿CFU/g 枯草芽孢杆菌粉剂,空白对照为清水。每个处理50株,设置3个重复,随机区组排列,四周设保护行3行,各处理的其他条件都与当地保持一致。分别在移栽时,移栽后7、14、21 d进行灌根。按照《烟草病虫害分级及调查方法》(GB/T 23222—2008)中的分级标准及调查方法,在最后一次灌根30 d后进行病害调查,记录小区中的总株数及各级病株数,计算发病率、病情指数、防治效果,公式如下:
发病率=发病株数调查总株数×100%;
病情指数=∑(各级病叶数×各级代表值)调查总叶数×最高级代表值×100;
防治效果=对照病情指数-处理病情指数对照病情指数×100%。
1.7 菌株M10-4的促生作用
1.7.1 产IAA能力测定 在100 mL的LB液体培养基中加入10 mg L-色氨酸,待完全溶解后接种菌株M10-4,放入30 ℃、180 r/min的摇床中培养 48 h。定性观察[19]:将培养48 h后的菌液分装至 2 mL 离心管中,离心取上清,加入等量Salkowski比色液,避光静置30 min,观察颜色变化。定量测定[20]:LB液体培养基加入吲哚乙酸,配置成含吲哚乙酸0、10、20、30 mg/L的标准溶液,各取1 mL至 2 mL 离心管,加入等量Salkowski比色液,严格避光静置30 min,分别测定D530 nm,制作标准曲线。测定加入Salkowski比色液的无菌发酵液D530 nm,代入标准曲线计算菌株M10-4的产IAA量[21]。
1.7.2 溶钾、溶磷能力测定 将溶钾钾长石培养基[22]、溶磷无机磷培养基[23]倒平板,用9 mm打孔器在中央打孔后,用移液器在孔内加入50 μL(D600 nm=2.0)菌液,置于30 ℃恒温培养箱中培养 6~7 d后观察有无溶钾、溶磷圈产生[24]。
1.7.3 产胞外蛋白酶、纤维素酶、噬铁素能力测定 将脱脂奶粉培养基[25]、CMC-Na培养基[26]、CAS培养基[27]分别倒平板,用9 mm打孔器在中央打孔后,用移液枪在孔内加入50 μL(D600 nm=2.0)菌液,置于 30 ℃ 恒温培养箱中培养3 d后观察有无透明圈产生。纤维素酶试验用刚果红染色10 min后,再用 1 mol/L NaCl洗脱,观察有无透明圈产生。
1.7.4 盆栽促生试验 待烟草(云烟87)长出3~4张真叶时,挑选大小相近的烟苗移栽至盆中,用M10-4发酵液(浓度1×108 CUF/mL)灌根,以LB液体培养基作为对照,每个处理3次重复,每个重复5株烟。每隔7 d灌根1次,共灌根3次,30 d后测量根、茎、叶的各项指标[28]。
1.8 数据处理
使用Excel 2019进行数据处理、结果计算及标准曲线的绘制,利用SPSS Statistics 25对各组数据进行差异显著性分析。
2 结果与分析
2.1 菌株对烟草疫霉的拮抗效果
从烟草根际土壤中共分离得到66株细菌,对烟草疫霉有拮抗作用的有M10-4、MX-4、YFZ-8、DL-3、MCL-11、LJH-11等6株菌株(表1),其中以M10-4对烟草疫霉的拮抗效果最好,抑菌率为73.97%(图1)。
2.2 菌株M10-4鉴定
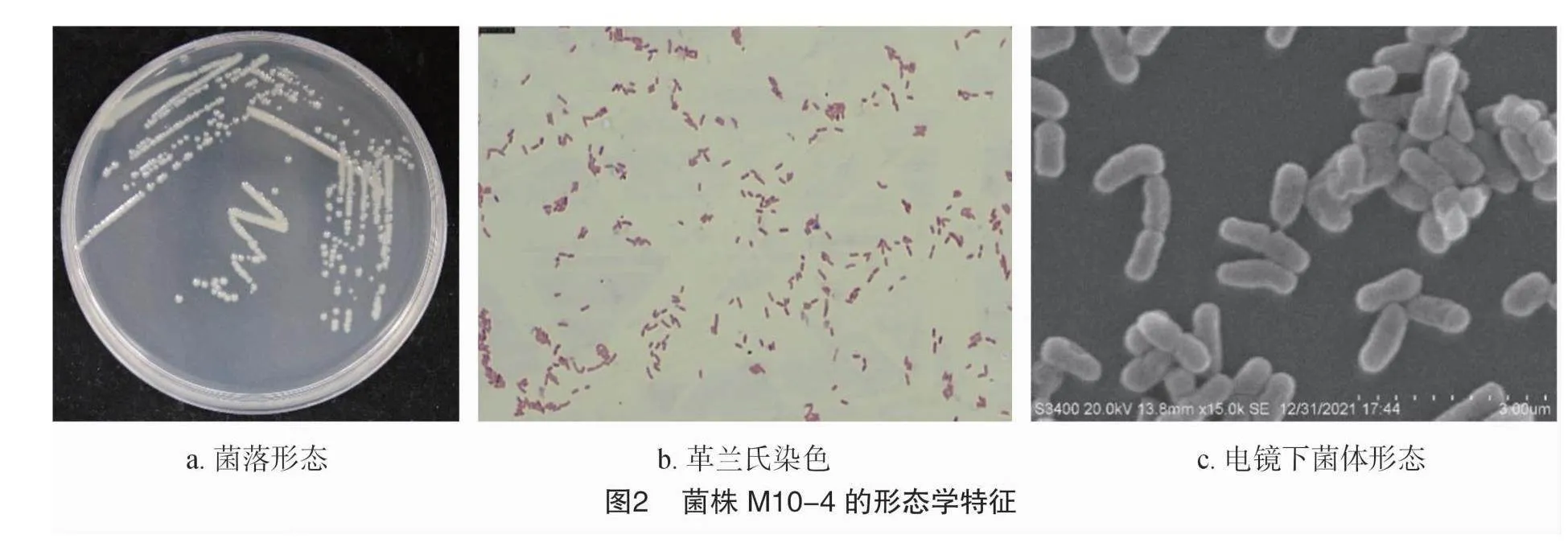
2.2.1 形态学特征 菌株M10-4在LB平板上 30 ℃ 培养48 h后菌落呈不透明乳白色,圆形,黏稠状,表面光滑湿润,边缘平滑(图2-a)。革兰氏染色红色,为阴性(图2-b),菌体大小为(0.3~0.5) μm×(0.6~1.2) μm,短杆状,无荚膜,无芽孢,无鞭毛(图2-c)。
2.2.2 生理生化特性 菌株M10-4不能水解淀粉,V-P反应、甲基红反应、吲哚反应均为阴性,不具有运动性;明胶液化、接触酶反应、氧化酶反应、硝酸盐还原为阳性,可利用柠檬酸盐(表2)。
2.2.3 16S rDNA基因序列分析 对菌株M10-4 16S rDNA序列进行PCR扩增,得到长度1 500 bp左右的PCR产物条带。将序列在NCBI数据库进行BLAST检索比对,结果显示,与吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia)同源性最高,达到99.86%。利用MEGAX软件构建系统发育树,菌株M10-4与吡咯伯克霍尔德氏菌(登录号为CP094459.1)处于同一分支簇(图3)。结合形态学和生理生化特性鉴定结果,将菌株M10-4鉴定为吡咯伯克霍尔德氏菌。同时将序列提交至NCBI GenBank获得登录号OR835659。
2.3 菌株M10-4抑菌谱
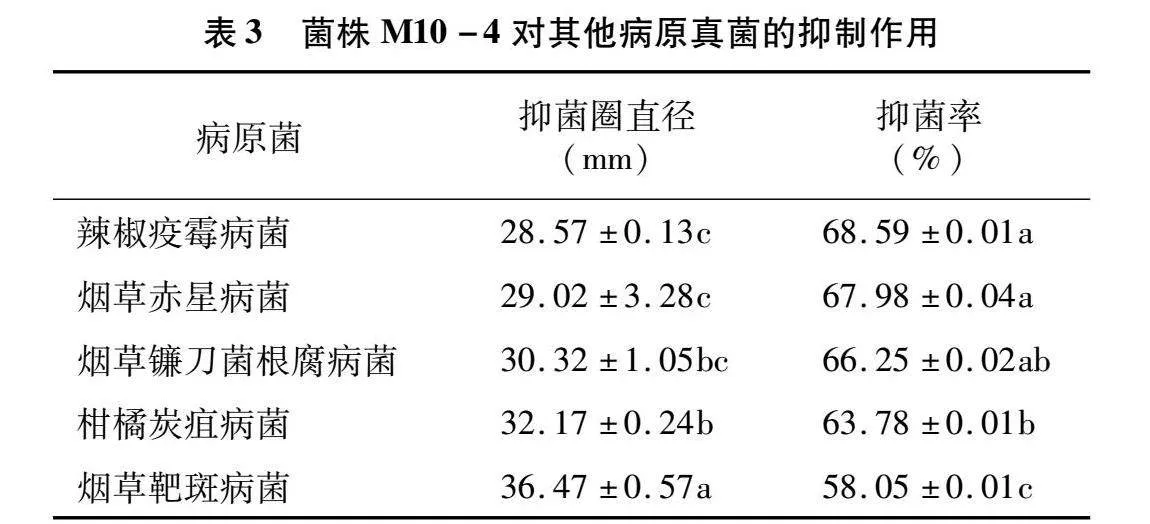
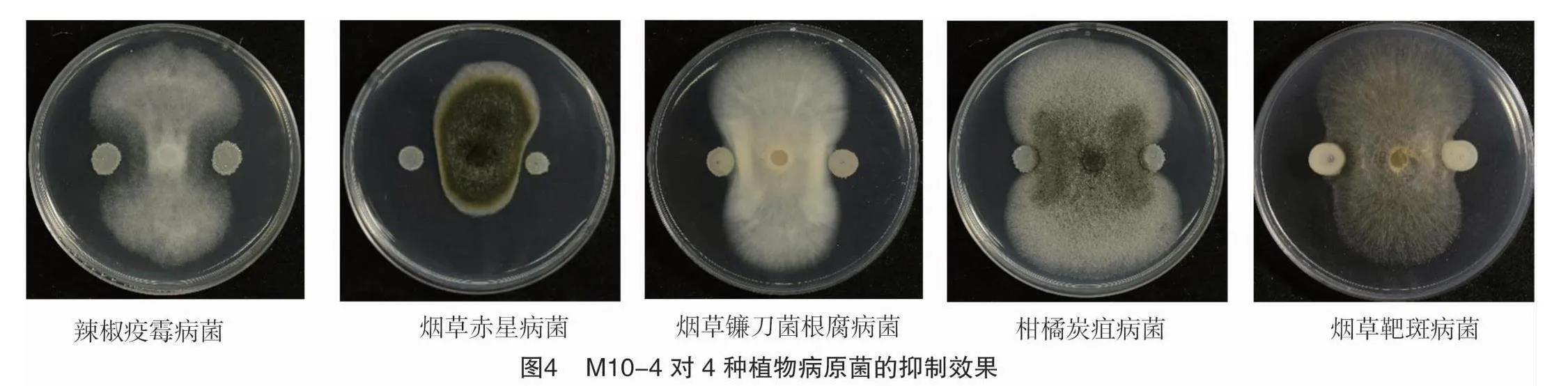
菌株M10-4对辣椒疫霉病菌、烟草赤星病菌、烟草镰刀菌根腐病菌、柑橘炭疽病、烟草靶斑病菌菌均有拮抗作用,抑菌率分别为68.59%、67.98%、66.25%、63.78%、58.05%(表3、图4)。
2.4 菌株M10-4发酵滤液对烟草疫霉的抑制效果
菌株M10-4的发酵滤液对烟草疫霉有明显抑制作用,浓度越高,抑制效果越好,浓度为30%时黑胫病菌生长明显受抑制(图5),抑菌率达72.75%。浓度为10%的菌株M10-4发酵滤液抑制烟草疫霉菌丝生长,菌丝肿大、畸形,粗细不一,原生质分布不均(图6)。
2.5 菌株M10-4对烟草黑胫病的田间防效
在最后一次灌根30 d后,记录田间烟苗患烟草黑胫病的病情等级,计算其发病率、病情指数及防治效果。使用M10-4发酵液处理的发病率为26.67%,病情指数为9.92,均显著低于化学药剂、生物药剂及清水处理组;防治效果达60.70%,显著高于化学药剂、生物药剂及清水处理组(表4)。
2.6 菌株M10-4促生特性
2.6.1 产IAA能力 加入Salkowski比色液避光静置30 min后,肉眼可见颜色由淡黄色变成浅粉色,证明菌株M10-4可以产生长素IAA(图7)。用紫外分光光度计测得比色后的发酵滤液D530 nm值为0.058,用4个梯度的吲哚乙酸标准溶液的D530 nm制作成标准曲线(y=0.006 1x+0.016 8,r2=0.978 4),由此计算出IAA产量为6.754 mg/L。
2.6.2 溶磷、溶钾及产蛋白酶能力 菌株M10-4培养6~7 d后,在溶钾、溶磷、脱脂奶粉培养基平板上可以明显观察到透明圈(图8) CMC-Na培养基、CAS培养基平板无变化,表明菌株M10-4具有溶钾、溶磷、产蛋白酶能力,无纤维素酶、噬铁素的产出。
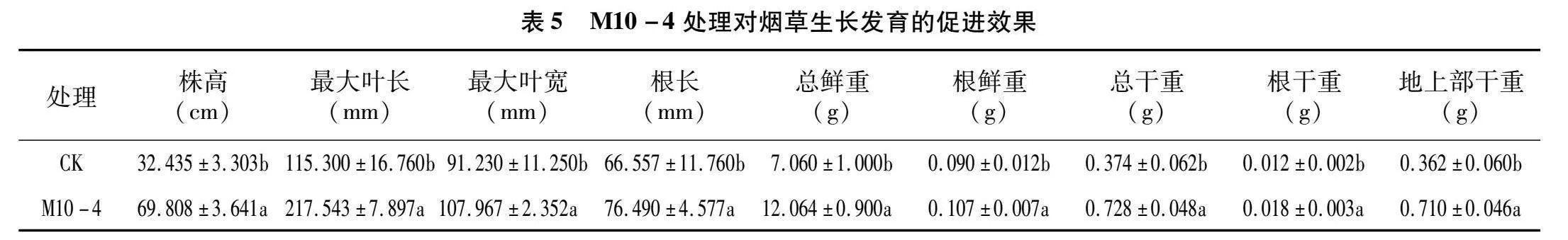
2.6.3 对烟株的促生作用 与对照组相比,经 M10-4 灌根处理过的烟株长势更好(图9)。处理组的株高、最大叶长、总鲜重、总干重、地上部干重均有显著提升,增长率分别为115.22%、88.68%、70.88%、94.65%、96.13%。最大叶宽、根长、根鲜重、根干重也有一定的增加,增长率分别为18.35%、14.92%、18.89%、50.00%(表5)。
3 结论与讨论
生防菌是生物防治的重要方法之一,分离和筛选优质生防菌株是丰富烟草生防资源的重要手段。烟草根际土壤中有很多可以用作生防的微生物,其中包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、链霉菌属(Streptomyces)等具有相对优势的菌属[29]。本研究从烟草根际土壤中分离得到有拮抗效果的菌株M10-4,经形态学、生理生化及分子鉴定其为吡咯伯克霍尔德氏菌(Burkholderia pyrrocinia)。
目前已有报道伯克霍尔德氏菌作为生防菌防治植物病害。解星丽等研究发现,多噬伯克霍尔德氏菌(Burkholderia multivorans)WS-FJ9对林木病原菌物具有很好的生防潜力[30]。许萌杏等分离得到洋葱伯克霍尔德氏菌(Burkholderia cepacia)JX-1,其温室防治番茄青枯病的防效达80.89%[31]。任嘉红等研究发现,吡咯伯克霍尔德氏菌JK-SH007对杨树溃疡病具有防治及促生作用[32-33]。刘璐等报道的吡咯伯克霍尔德氏菌S377对棉花黄萎病具有良好的生防潜力[34]。于晓庆等从烟草根际分离得到吡咯伯克霍尔德氏菌Lyc2,对棉苗立枯病的温室防效达48.8%[35]。Wang等的研究表明,occidiofungin是菌株Lyc2抗真菌活性的重要成分[36]。本研究发现,M10-4的无菌发酵液对烟草黑胫病病原菌有很好的抑制作用,使菌丝无法正常生长,发生畸形、肿大等变化,对烟草赤星病菌、辣椒疫霉病菌、烟草靶斑病菌、烟草镰刀菌根腐病菌、柑橘炭疽病菌均有抑制作用。同时,M10-4在田间对烟草黑胫病表现出较好的防治效果。
植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是指对作物具有促生、防治、增产作用的微生物[37],可以增强植物对土壤中矿物质的吸收,比如一些不易被吸收的磷和钾会被转化为可吸收的形式,从而减少对化肥的依赖;能够分泌铁载体,充分利用环境中含量较低的铁元素,具备产生植物激素、固氮、产生抗生素等功能[38-39]。伯克霍尔德氏菌可以作为PGPR菌种,在NCBI数据库中查询到全基因组序列的吡咯伯克霍尔德氏菌有15种,其中对植物有益处的菌株为DSM 10685、mHSR5、Hargis、Lyc2、CH-67[38]。韩超等研究发现,吡咯伯克霍尔德氏菌A12对烟草根的生长、叶绿素含量、光合及蒸腾速率均有促进作用[40]。Li等分离得到了2株具有良好溶磷、固氮、产IAA和铁载体的吡咯伯克霍尔德氏菌ZJ9和ZJ174[41]。Han等的研究表明,在盐胁迫条件下接种吡咯伯克霍尔德氏菌P10能促进花生幼苗的生长[42]。本研究发现菌株M10-4具有产IAA、溶磷、溶钾以及产蛋白酶的能力,对温室内盆栽烟草具有促生作用,能显著提升株高、最大叶长、总鲜重、总干重、地上部干重,有作为PGPR研究的潜力。
以上结果表明,吡咯伯克霍尔德氏菌M10-4在病害防控、促生方面均表现较好,具有较大的研究意义及应用前景。由于田间的环境较为复杂,存在许多不可控因素,因此在下一步的研究中,应着重于田间促生的效果,除此之外还需评估其生物安全性,研究其是否会产生污染环境的及影响土壤微生物的物质。考虑到实际生产需要,还要更深入地研究生防菌株的发酵条件及其抑菌、促生物质。
本研究中分离的伯克霍尔德氏菌(Burkholderia pyrrocinia)M10-4对烟草疫霉在平板和大田试验中有较好的抑制作用,无菌发酵液可以破坏烟草疫霉菌丝的正常生长,对辣椒疫霉病菌、烟草赤星病菌、烟草镰刀菌根腐病菌、柑橘炭疽病、烟草靶斑病菌均有抑制作用。此外,M10-4能够产IAA、溶磷、溶钾、产蛋白酶,对盆栽烟株的生长有明显促进作用,有作为PGPR研究的潜力。
参考文献:
[1]Kamoun S,Furzer O,Jones J D G,et al. The Top 10 oomycete pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2015,16(4):413-434.
[2]王 岩. 烟草黑胫病菌、青枯病菌拮抗放线菌的筛选及控病研究[D]. 重庆:西南大学,2009:1.
[3]赵 辉,王喜英,刘国权,等. 烟草黑胫病发生因素及综合防治研究进展[J]. 湖南农业科学,2020(11):99-103.
[4]汪汉成,李文红,冯勇刚,等. 烟草黑胫病化学防治的历史与现状[J]. 中国烟草学报,2011,17(5):96-102.
[5]彭海莹. 烟草黑胫病和根黑腐病的生物防治技术研究[D]. 泰安:山东农业大学,2020:2-3.
[6]张蒙蒙,梁俊阳,王清福,等. 烟草黑胫病生防细菌的鉴定和防效测定[J]. 河南农业大学学报,2022,56(2):219-227.
[7]李苗苗,王晓强,王东坤,等. 生防菌复配对烟草黑胫病的防治效果研究[J]. 中国烟草科学,2020,41(2):32-38.
[8]章 舸. 烟草疫霉拮抗放线菌的筛选及在烟草根际定殖研究[D]. 合肥:安徽农业大学,2021:36.
[9]Gouda S,Kerry" R G,Das G,et al. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture[J]. Microbiological Research,2018,206:131-140.
[10]吴风光,王豹祥,汪 健,等. 抗生菌肥对植烟土壤和烤烟生产的影响[J]. 土壤,2010,42(1):53-58.
[11]王 典,匡志豪,孙晓伟,等. 哈茨木霉对烟草生长/产质量及黑胫病防效的影响[J]. 贵州农业科学,2023,51(3):27-35.
[12]肖志鹏,李玲玲,母婷婷,等. 烟草赤星病菌拮抗菌解淀粉芽孢杆菌YW-2-6鉴定及生防效果[J]. 中国生物防治学报,2022,38(6):1598-1607.
[13]黄婉媛,李彩斌,彭 宇,等." 烟草根黑腐病拮抗菌的分离鉴定和生防作用特性研究[J]. 浙江农业学报,2023,35(4):873-883.
[14]Schwyn B,Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,1987,160(1):47-56.
[15]吴丽娟,韩 聪,王惠梅,等. 伯克霍尔德氏菌JP2-270抗水稻纹枯病菌机理的初步研究[J]. 中国生物防治学报,2022,38(1):230-241.
[16]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:349-399.
[17]布坎南,吉本斯. 伯杰细菌鉴定手册[M]. 8版. 中国科学院微生物研究所,译. 北京:科学出版社,1984:729-758.
[18]王亚娇,栗秋生,纪莉景,等. 一株西瓜枯萎病生防菌的鉴定与田间防效[J]. 微生物学通报,2021,48(6):1976-1984.
[19]Eike L,Renate M,Edda S. Interactions between plants and epiphytic bacteria regarding their auxin metabolism[J]. Physiologia Plantarum,1970,23(4):93-98.
[20]Glickmann E,Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,1995,61(2):793-796.
[21]赵玳琳,何海永,吴石平,等. 棘孢木霉GYSW-6m1对草莓炭疽病的生防机制及其防病促生作用研究[J]. 中国生物防治学报,2020,36(4):587-595.
[22]孙金凤,翟景琳,钱 坤,等. 解钾菌的分离筛选及其解钾能力测定[J]. 淮阴工学院学报,2017,26(5):52-56.
[23]杜 雷,王素萍,陈 钢,等. 一株高效解磷细菌的筛选、鉴定及其溶磷能力的研究[J]. 中国土壤与肥料,2017(3):136-141.
[24]王海霞,郑成忠,东保柱,等. 燕麦内生细菌YN-J3的分离鉴定及防病促生作用研究[J]. 中国生物防治学报,2022,38(2):447-457.
[25]方 园,彭勇政,廖长贵,等. 一株具有防病促生功能的贝莱斯芽孢杆菌SF327[J]. 微生物学报,2022,62(10):4071-4088.
[26]马玲玲. 纤维素降解细菌B. subtilis 1AJ3的纤维素酶的克隆表达、协同作用及其应用研究[D]. 杨凌:西北农林科技大学,2020:15.
[27]王 欢,薛林贵,常思静,等. 七株耐重金属菌株的促生特性研究[J]. 兰州交通大学学报,2023,42(1):92-99,117.
[28]罗志威,林元山. 一株烟草疫霉菌拮抗菌的筛选及应用潜力初探[J]. 湖南农业科学,2021(4):74-77.
[29]秦艳秋,史晓艺,谷子谦,等. 不同植物根际土壤有益细菌种类及其功能鉴定[J]. 北京农学院学报,2023,38(2):31-37.
[30]解星丽,吴小芹. 多噬伯克霍尔德氏菌WS-FJ9对林木病原菌物的拮抗作用及代谢产物的稳定性[J]. 微生物学通报,2021,48(6):1985-1996.
[31]许萌杏,李凤芳,袁高庆,等. 洋葱伯克霍尔德氏菌JX-1防治番茄青枯病机理的初步分析[J]. 中国生物防治学报,2021,37(2):304-314.
[32]任嘉红,班虎栋,叶建仁,等. 吡咯伯克霍尔德氏菌JK-SH007的发酵条件及其对杨树溃疡病的防治效果[J]. 中国生物防治,2010,26(3):300-306.
[33]闵莉静,郭 璐,叶建仁. 基于嗜铁素介导的吡咯伯克霍尔德氏菌JK-SH007促生作用机制研究[J]. 南京林业大学学报(自然科学版),2019,43(6):165-172.
[34]刘 璐,万伟杰,郑通文,等. 根际细菌吡咯伯克霍尔德氏菌YZU-S377对棉花黄萎病的防效及其促生作用研究[J]. 河南农业科学,2021,50(3):91-96.
[35]于晓庆,郗丽君,刘永光,等. 洋葱伯克霍尔德氏菌株Lyc2的鉴定及对棉苗的防病促生作用[J]. 植物病理学报,2007,37(4):426-432.
[36]Wang X Q,Liu A X,Guerrero A,et al. Occidiofungin is an important component responsible for the antifungal activity of Burkholderia pyrrocinia strain Lyc2[J]. Journal of Applied Microbiology,2016,120(3):607-618.
[37]张昊鑫,王中华,牛 兵,等. 产IAA兼具溶磷解钾高效促生菌的筛选、鉴定及其广谱性应用[J]. 生物技术通报,2022,38(5):100-111.
[38]晋婷婷,曹永清,李云玲,等. 一株连香树根际促生细菌LWK2的分离鉴定及其全基因组序列分析[J]. 微生物学通报,2023,50(5):1917-1940.
[39]陈多菲,徐 畅,刘文佳,等. 3株水稻根际促生菌的筛选鉴定及促生作用研究[J]. 江苏农业科学,2023,51(24):196-202.
[40]韩 超,武贵元,刘爱新,等. 吡咯伯克霍尔德氏菌A12筛选鉴定及其对烟草幼苗的促生作用[J]. 浙江农业学报,2012,24(5):880-885.
[41]Li X Q,Yan J L,Li D Y,et al. Isolation and molecular characterization of plant-growth-promoting bacteria and their effect on eggplant (Solanum melongena) growth[J]. Agriculture,2021,11(12):1258.
[42]Han L Z,Zhang H,Xu Y,et al. Biological characteristics and salt-tolerant plant growth-promoting effects of an ACC deaminase-producing Burkholderia pyrrocinia strain isolated from the tea rhizosphere[J]. Archives of Microbiology,2021,203(5):2279-2290.
