抗生素溶杆菌13-6次生代谢物Myxin对水稻条斑病菌活体转录组的影响
2024-02-14孟涵魏方俊王博袁加升彭梦林刘学瑞姬广海







摘要:近年来,水稻细菌性条斑病已成为影响我国水稻产量的重要病害之一。探究抗生素溶杆菌13-6次生代谢物对水稻条斑病菌的影响,明确抗生素溶杆菌13-6次生代谢物对水稻细菌性条斑病的防病机制,对于实际生产具有重要意义。在水稻感病品种日本晴(4叶期)上接种条斑病菌YM15,48 h后用抗生素溶杆菌13-6次生代谢物(480 μg/mL)处理,然后进行活体转录组测序分析、生物信息分析并进行qRT-PCR验证。结果表明,经抗生素溶杆菌13-6次生代谢物处理后,将处理组和对照组与参考基因组基因进行对比,共得到203个差异显著基因,上调基因125个,下调基因78个。随机挑选10个基因(上调6个,下调4个)进行qRT-PCR验证,qRT-PCR结果与RNA-Seq结果一致,证实转录组测序结果可靠。在GO功能富集中,差异基因主要集中在相应刺激和生物调控等过程;在KEGG功能富集中,差异基因主要集中在双组分系统等代谢通路。本研究发现,抗生素溶杆菌13-6次生代谢物可显著影响病原菌中与致病性相关的基因,如鞭毛合成相关基因和趋化性相关基因。此外,抗生素溶杆菌13-6次生代谢物还可影响KEGG代谢通路中与鞭毛组装相关的基因、双组分系统以及氨基酸代谢过程相关基因表达,为进一步阐明Myxin对水稻细菌性条斑病的作用靶点奠定了基础。
关键词:水稻;细菌性条斑病;抗生素溶杆菌;次生代谢物;基因表达差异;活体转录组
中图分类号:S435.111.4+9" 文献标志码:A
文章编号:1002-1302(2024)24-0117-10
收稿日期:2023-11-13
基金项目:国家自然科学基金地区科学基金(编号:32060601);云南省“万人计划”中国工业技术领军人才项目(编号:YNWR-CYJS-2019-046)。
作者简介:孟 涵(1997—),女,山东潍坊人,硕士研究生,主要从事植物分子生物学研究。E-mail:1964391536@qq.com。
通信作者:姬广海,博士,教授,主要从事植物病理学研究。E-mail:550356818@qq.com。
水稻是世界上最重要的粮食作物,全球有一半以上的人口以水稻为主食。但水稻的生产受到多种病害的影响,报道显示,真菌、细菌、病毒和线虫均可侵染水稻,导致稻瘟病、水稻根结线虫病、南方水稻黑条矮缩病、水稻白叶枯病和水稻细菌性条斑病的发生[1-5]。
由稻黄单胞菌(Xanthomonas oryzae pv. oryzicola,简称Xoc)侵染引起的水稻细菌性条斑病(bacterial leaf streak,简称BLS)是我国乃至世界水稻生产上的第二大细菌性病害。该病害于1918年在菲律宾首次发现[6],而后在亚洲热带、亚热带地区、澳大利亚北部和非洲西部被相继报道[7];1957年,国内首次报告水稻条斑病,此后,水稻条斑病被列为一种检疫性病害[8]。近年来,该病害在云南的大部分稻区普遍发生,严重危害水稻产量,造成水稻减产15%~25%,严重时可达40%~60%[9]。
溶杆菌属于γ变形菌亚门黄单胞菌科[10-11],在自然界中广泛分布并存在,具有高滑动性和高 G+C 含量的特征,对多种病原真菌、细菌和线虫具有溶菌活性[12-13]。目前,已发现的溶杆菌种类有抗生素溶杆菌(Lysobacter antibioticus)、产酶溶杆菌(L. enzymogenes)和辣椒溶杆菌(L. capsici)等。抗生素溶杆菌13-6可产生具有广谱抗菌活性的吩嗪类化合物,如Myxin[14]、对氨基苯甲酸等,已有研究表明此类活性物质对水稻细菌性条斑病菌具有较高的抑菌活性[11]。本研究对抗生素溶杆菌13-6次生代谢产物进行浓缩抽提和分离纯化得到Myxin,用其处理接种病原菌YM15的水稻叶片,后续通过活体转录组测序来探寻Myxin对水稻细菌性条斑病菌基因表达的影响,并通过qRT-PCR加以验证。以寻找Myxin作用于Xoc YM15的作用靶点,挑选经Myxin处理前后差异表达明显的基因进行基因突变并验证其功能。
1 材料与方法
1.1 水稻选材
选用感病品种日本晴作为水稻试验材料,试验于云南农业大学试验基地温室开展。水稻种植于温室水稻池中,5行×6株,整个生育期管理按常规栽培管理进行。
1.2 试验地点及时间
本试验于云南农业大学细菌实验室和云南农业大学温室完成。试验时间为2022年6—7月。
1.3 菌株和培养条件
水稻细菌性条斑病菌YM15(NCBI基因组序列登录号:CP007810)、抗生素溶杆菌13-6(简称 13-6),均由笔者所在实验室提供。
营养琼脂(nutrient agar,简称NA)培养基:葡萄糖10 g,细菌学蛋白胨5 g,牛肉浸膏3 g,酵母浸膏 1 g,琼脂20 g,加蒸馏水定容至1 L,pH值调至7.0,121 ℃高压灭菌后备用[15]。
NB培养基:不添加琼脂的NA培养基。
KB培养基:蛋白胨20 g,MgSO4·7H2O 1.5 g,K2HPO4 1.5 g,甘油10 mL,琼脂20 g(液体不添加琼脂),加蒸馏水定容至1 L,pH值调整至7.0,121 ℃ 高压灭菌后备用。
1.4 抗生素溶杆菌13-6次生代谢物Myxin分离纯化
抗生素溶杆菌13-6(简称13-6)在KB固体培养基进行活化,28 ℃培养24 h,活化后的13-6于KB液体培养基中过夜摇培,再以1%的接种量转接至500 mL KB液体培养基中,28 ℃、160 r/min摇培72 h得到 13-6 发酵液。发酵液与乙酸乙酯 1 ∶1 混合萃取3次,取上层有机相经无水硫酸钠除水后经旋转蒸发浓缩得到粗提物。
粗提物按照甲醇 ∶三氯甲烷=7 ∶3的体积比分别在硅胶板上利用薄层色谱法(TLC),根据比移值(Rf)选取合适的洗脱体系。用通用显色剂(浓硫酸 ∶乙醇=1 ∶1)和5%重铬酸钾显色剂(需要 150 ℃ 烤制后显色)进行显色。
根据TLC检测结果,最终确定洗脱体系及不同梯度设置。利用硅胶柱和凝胶柱根据洗脱体系对粗提物进行分离,结合TLC检测合并相同Rf值的组分。以Xoc YM15为指示菌,利用活性追踪确定最终活性组分。
HPLC纯化:将经过硅胶柱和凝胶柱纯化得到的组分采用RP-C18柱进行分离纯化。制备条件:40%乙腈,60%超纯水,流速4 mL/min,半制备柱(RP-C18,9.4 mm×250 mm×5 μm),吸收波长 274 nm。检测条件:10 μL样品进样,流动相A为水(含0.1%甲酸),流动相B为乙腈,流速 1 mL/min,检测波长274 nm。HPLC检测洗脱体系:0 min 20%B,5 min 35%B,19 min 50%B,20 min 60%B,23 min 100%B,27 min 100%B,28 min 20%B,30 min 20%B。
1.5 水稻接种
将Xoc YM15在NA培养基上活化后连续培养2代以恢复菌株毒性,再于NA培养基上划线,28 ℃培养36 h;活化后的Xoc YM15接种于NB培养基中过夜培养,再以1%的接种量接种在500 mL NB培养基中摇培至D600 nm≈0.3备用。
在日本晴4叶期采用针刺法接种病原菌YM15,并在接种后48 h用13-6次生代谢物Myxin(480 μg/mL)进行叶面喷雾处理。
1.6 转录组测序与分析
1.6.1 RNA提取
采取接种后的水稻叶片按照TRNzol Universal总RNA提取试剂参照说明书,进行叶片总RNA提取。利用紫外分光光度计对提取的RNA纯度和浓度进行检测,并通过1.2%琼脂糖凝胶电泳验证其完整性。
1.6.2 cDNA文库构建
用于RNA-seq的RNA样品,每个样品取1 μg RNA用于cDNA文库构建,总RNA送至北京诺禾致源生物科技有限公司进行cDNA文库构建,cDNA文库由Genedenovo公司(中国广州)在Illumina测序平台上进行测序。
1.6.3 cDNA合成
提取的RNA反转录为cDNA,用于qRT-PCR。通过cDNA第1链合成试剂盒:FastKing RT Kit(With gDNase)合成cDNA,具体方法参照FastKing RT Kit(With gDNase)试剂盒说明书进行。
1.6.4 RNA-seq测序数据分析
测序的原始数据(raw data)通过fastQC软件(v0.11.2版本)进行评估,采用paired-end测序方式,两端接头插入片段长度,其中使用Trimmomatic(0.36.5)软件低质量的和带接头的raw data过滤得到高质量的clean read。为保证后续分析结果的准确性,后续分析都基于clean reads。为明确抗生素溶杆菌13-6次生代谢物Myxin处理后处理组与对照组间的差异表达基因(DEGs),利用EdgeR进行DEGs分析。为明确差异表达基因的功能,分别通过Goatools (http://github.com/tanghaibao/Goatools)和KOBAS(http://kobas.cbi.pku.edu.cn/home.do)对GO功能和KEGG功能进行分析。将DEGs注释到GO、KEGG数据库中,获得差异表达基因的GO功能注释和代谢途径通路信息。
1.7 qRT-PCR验证差异基因
为了评估RNA-seq数据的准确性和有效性,用测序返还的样品RNA,随机挑选显著差异基因富集中的10个差异表达基因(6个上调基因和4个下调基因)进行验证。qPCR引物设计见表4,内参基因为gyrB,所选择的差异表达基因的相对表达水平采用2-ΔΔCT的方法进行计算[11]。
2 结果与分析
2.1 转录组测序数据分析
4个水稻叶片样本总共得到1 566 508 200 bp raw reads,过滤后得到1 129 974 206 bp clean reads,clean reads占raw reads的比值均在92.00%以上。Q20为97.01%~97.50%,Q30为 92.60%~93.73%,GC平均含量约为52.84%。表明整体测序质量好,数据可以用于后续生物信息学分析,并能满足后续做基因表达定量及差异基因表达分析基本要求。
2.2 基因表达定量
为了确定13-6次生代谢物处理Xoc YM15后基因的表达差异,本研究将Xoc YM15接种4叶期水稻,在第48 h用13-6次生代谢物Myxin(480 μg/mL)处理后进行转录组测序,然后将处理组和对照组与参考基因组所有基因进行对比,共得到3 582个基因,对其按差异显著性标准 |log2(fold change)|≥1(Plt;0.05)进行筛选,统计基因表达差异情况,共有203个差异显著基因,其中有125个基因显著上调,78个基因下调。
2.3 差异表达基因GO功能注释
通过GO功能富集分析可以初步了解水稻接种Xoc YM15并经Myxin处理前后,YM15差异表达基因(DEG)情况及其主要生物学功能。通过注释,将DEG归为三大类,分别为细胞组分(cellular component,简称CC)、分子功能(molecular function,简称MF)和生物过程(biological process,简称BP)。其中147个基因属于生物过程,68个基因为细胞组分,50个基因被GO归类到分子功能。
在BP中,有121个基因上调表达,26个基因下调表达,主要分布在代谢过程、细胞过程、单组分过程、响应刺激、生物调控和生物过程调控等功能;而在CC中,有56个基因上调表达,12个基因下调表达,主要分布于细胞部分、细胞和膜等功能。此外,在MF中,有38个基因上调表达,12个基因下调表达,主要分布在催化活性和结合等功能(图1)。
通过对差异基因GO富集显著性分析,受13-6次生代谢物Myxin影响的GO terms共有30个,差异富集最显著的5个GO功能terms都和响应与调节相关,分别为响应化学物质、响应刺激、调控细胞过程、调控生物过程和生物调控(图2)。其中响应化学物质中8个基因全部上调,功能聚集在细胞运动和信号转导;响应刺激中10个基因上调,1个基因下调,功能聚集在信号转导和环境适应;调控细胞过程中8个基因上调,2个基因下调;调控生物过程和生物调控中均有10个基因上调,2个基因下调,且基因相同。
2.4 差异表达基因KEGG功能注释
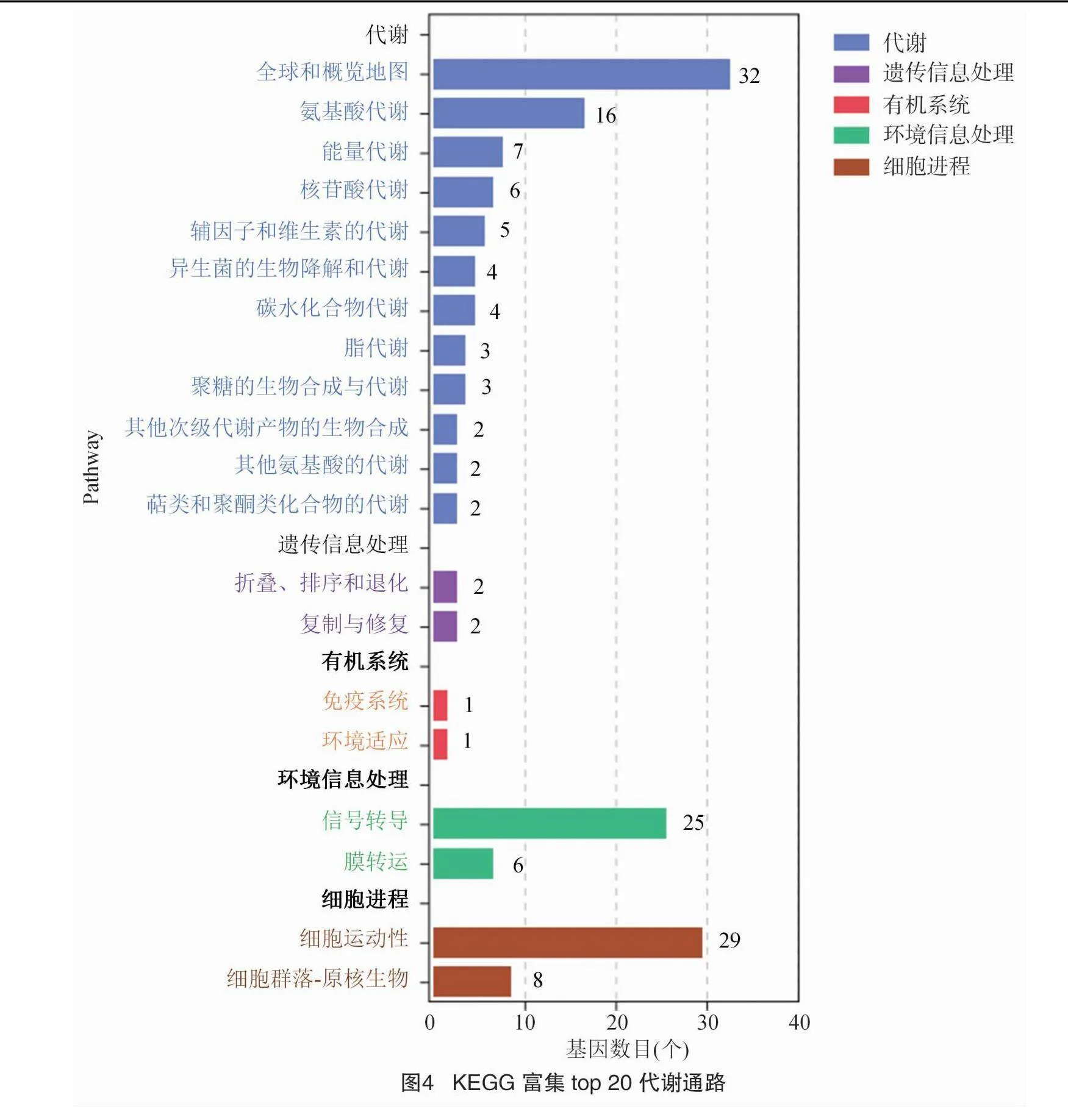
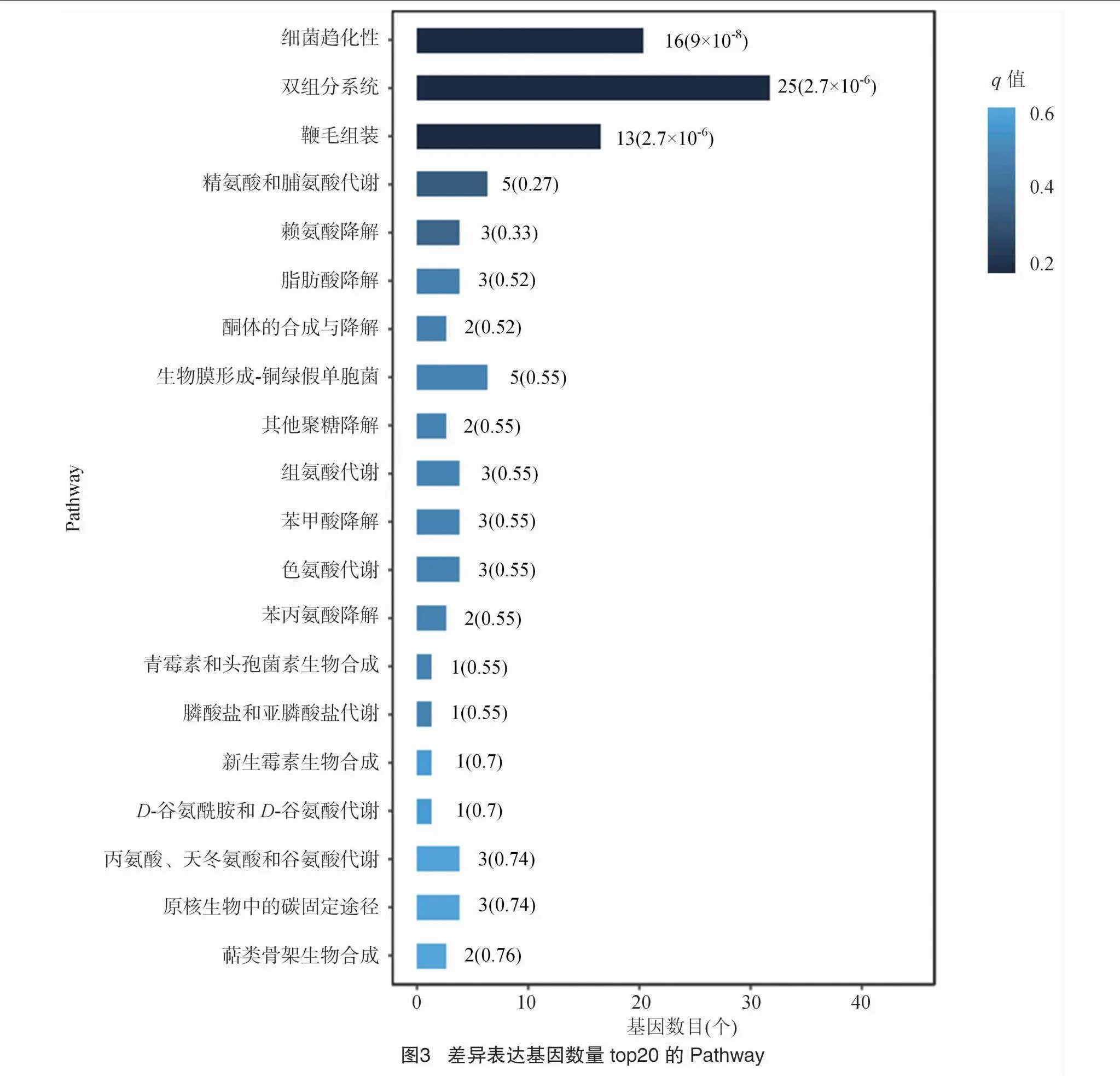
为进一步明确Myxin对Xoc YM15代谢途径的影响,将Xoc YM15 DEGs与KEGG数据库进行比较。结果显示,差异表达基因通过KEGG的富集分析被富集到63条通路,其中差异基因数前20的通路如图3所示。主要富集通路(Plt;0.05)为ko02020双组分系统、ko02030细菌趋化性和ko02040鞭毛组装,分别属于环境信息处理和细胞进程2个类别。
2.5 差异表达基因KEGG通路分析
将Xoc YM15 DEG与KEGG数据库进行比较,结果显示,KEGG富集的前20条代谢通路可分为5个类别,分别为代谢、遗传信息处理、环境信息处理、细胞进程和有机系统。其中,主要富集代谢通路为全局和概览地图、氨基酸代谢、信号转导和细胞运动(图4)。另外,差异基因数大于10的通路为细菌趋化性、双组分系统和鞭毛组装通路(图3),其中双组分系统差异基因涉及鞭毛合成、趋化运动、生物膜合成、氧化磷酸化和电子转运等多种功能,包含部分细菌趋化性和鞭毛组装通路基因。
2.5.1 Myxin对双组分系统的影响
双组分系统(two-component system,简称TCS)包括组氨酸激酶(histidine kinase,简称HK)和应答调节蛋白(response regulator,简称RR)2个部分,可控制细菌包括趋化性、营养利用、细胞分化和毒力等在内的多种生理通路。细菌感应到周围环境的刺激信号后,组氨酸激酶通过磷酸化机制激活应答调节蛋白进而调控下游基因的表达或细胞机制触发适应性反应[16-19]。在该途径中,共富集到25个差异基因,24个上调基因,1个下调基因。双组分系统包含多个代谢通路,现对以下通路进行分析:
2.5.1.1 Myxin对细菌趋化性和鞭毛组装的影响
细菌运动代谢途径的通路包括细菌趋化性和鞭毛组装。在该代谢途径中共富集到21个差异基因,且全部上调(表1、表2)。鞭毛作为细菌的运动器官可以帮助细菌逃离有害物质。在鞭毛组装代谢途径中,共富集到13个差异基因且全部上调。由此说明13-6次生代谢物Myxin处理Xoc YM15后,使Xoc YM15的鞭毛组装和细菌趋避性增强,从而对Myxin产生趋避作用。
2.5.1.2 Myxin对氧化磷酸化的影响
氧化磷酸化是主要的ATP产生方式,可在呼吸链电子传递过程中偶联ATP的生成。在该过程中共富集到3个差异基因,分别为cyoD(ACU12_RS15685)、ctaC(ACU12_RS18735)和cydB(ACU12_RS18210),其中cydB(ACU12_RS18210)和ctaC(ACU12_RS18735)为下调基因,而cyoD(ACU12_RS15685)则呈现明显的上调趋势。在复合物Ⅳ上O2在细胞色素C氧化酶的作用下发生氧化反应生成H2O,在这一过程中可形成跨膜的质子电化学势能差,而这一势能差可以被三磷酸腺苷合酶用于制造生物体中的能量分子ATP。本研究猜测,由于该过程中基因下调使势能差降低或Myxin影响复合物Ⅳ上细胞色素C氧化酶中血红素的活性,从而使病原菌合成ATP的数量减少。由此推测,Myxin可影响病原菌ATP的合成。
2.5.2 Myxin对信号转导的影响
信号转导途径在所有调控途径中共富集到25个差异基因,其中有24个上调基因、1个下调基因。主要代谢通路为双组分系统,涉及鞭毛组装、细菌趋化性、生物膜合成、氧化磷酸化、膜转运、细胞生长与死亡和电子转运等多种功能。说明Myxin可能通过影响双组分系统来增强病原菌对外界刺激信号的感知,从而使信号转导增强。
2.5.3 Myxin对氨基酸代谢的影响
氨基酸代谢除与蛋白质合成相关外,还与激素和次生代谢、能量和碳水化合物代谢、碳氮收支以及应激反应等密切相关[20]。在本研究中,氨基酸代谢途径在所有调控途径中共富集到26个差异基因,其中有22个上调基因和4个下调基因,所属代谢途径见表3。根据Myxin处理后对氨基酸代谢途径的影响推测Myxin可能使病原菌处于胁迫状态,从而使氨基酸呈上调或下调趋势以减弱Myxin对其的影响。
2.6 致病性相关差异表达基因分析
在与分泌系统相关的基因中,共富集到20个差异显著基因(图5-A),其中有9个为上调基因,主要归属于Ⅲ型分泌系统和Ⅳ型分泌系统;11个下调基因,主要归属于Ⅵ型分泌系统和Ⅱ型分泌系统。Ⅱ型分泌系统分泌有关基因下调,说明经该系统分泌的水解酶减少,病原菌降解植物屏障的能力减弱,侵染宿主植物能力下降,即Myxin可影响病原菌水解酶的外泌,导致其致病性降低。
在本研究中,与鞭毛合成相关基因fliR(ACU12_RS10635)呈下调趋势,且该基因与Ⅲ型分泌系统相关;而其他与鞭毛相关基因均上调(图5-B),说明Myxin可使病原菌对其产生趋避作用。
与趋化性相关基因中,共富集到20个差异显著基因,且全部上调(图5-C)。包括双组分系统趋化蛋白/趋化性响应调节器cheA/cheY、趋化反应调节蛋白谷氨酸甲基酯酶和甲基趋化性受体蛋白(MCP)等。由此推测,Myxin可使病原菌对其产生负趋化性。
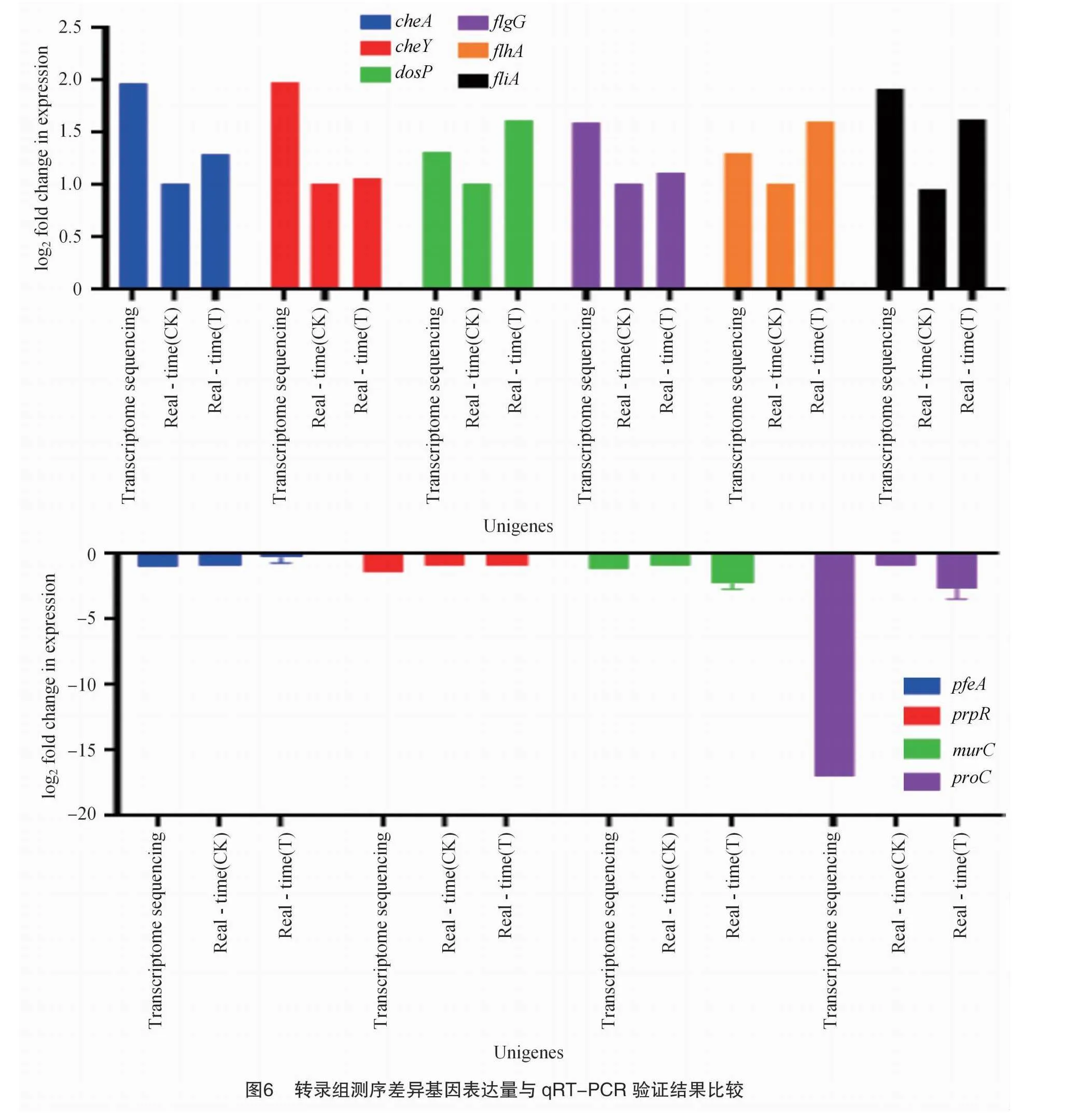
2.7 qRT-PCR验证
通过随机挑选显著差异基因富集中的10个差异表达基因,4个下调基因murC(UDP-N-acetylmuramate-L-alanine ligase),proC(pyrroline-5-carboxylate reductase),prpR(propionate catabolism operon regulatory protein),pfeA(TonB-dependent receptor),6个上调基因cheY(chemotaxis response regulator),cheA(chemotaxis protein),flhA(flagellar biosynthesis protein FlhA),fliA(RNA polymerase sigma factor),flgG(flagellar biosynthesis cell-distal portion of basal-body rod),dosP(c-di-GMP phosphodiesterase),设计荧光定量PCR引物(表4),以活体条件下经Myxin处理和未经Myxin处理的条斑病菌YM15 RNA为样品,gyrB为内参,利用 qRT-PCR测定以上10个基因的表达量并与转录组测序结果进行比对。结果显示,10个基因的 qRT-PCR 测定结果与转录组测序结果基本一致(图6),表明测序结果可靠。
3 讨论与结论
在本研究中,与分泌系统相关基因共富集到10个上调基因,主要归属于Ⅲ型分泌系统和Ⅳ型分泌系统;11个下调基因,主要归属于Ⅵ型分泌系统和Ⅱ型分泌系统。
已有研究表明,T3SS是革兰氏阴性病原菌中关键的致病因子[21-22],可通过筛选T3SS抑制剂或突变其关键致病基因来降低T3SS的致病性。目前,已筛选到多种对T3SS有作用的抑制剂,如CZ-1、CZ-4和CZ-9等[23-24]。植物病原细菌的致病力和引发HR的能力由hrp基因决定[25-26]。hrp基因簇包括hrc(hypersensitive response and conseverd)基因、hpa(hrp associated protein)基因或hop(hrp outer protein)基因以及一部分非保守的hrp基因。将hrp基因簇(如hrpE、hrpG及hrc)突变后,可使致病性大部分或完全丧失。而在本研究中,接种YM15后的水稻经抗生素溶杆菌13-6次生代谢物Myxin处理后,与Ⅲ型分泌系统相关基因明显上调,由此推测Myxin可能使病原菌处于胁迫状态,从而使基因上调表达。而Myxin对病原菌YM15的作用时间规律有待进一步探究。
与鞭毛相关基因共富集到29个上调基因,包括基因fliC、fliQ、flgG和flhB等。已有研究表明,在植物病原菌黄单胞菌中,同源调控因子RopN1和RopN2在毒力性状、鞭毛生物合成等方面发挥不同的调控作用。在野油菜黄单胞菌中,RopN2可以直接通过fliC和fliQ来调控鞭毛的合成,进而影响病原菌的运动性[27]。此外,将RopN2基因突变后,会使基因flgG、fliC和flhB的表达显著下调[28]。由此推测接种病原菌后再用Myxin处理,可使病原菌对Myxin产生趋避作用。
在本研究中,与细菌趋化性相关的上调基因主要为cheA、cheY、tsr和MCP等。MCP即甲基趋化性受体蛋白(methyl-accepting chemotaxis protein),作为一种跨膜细菌传感器蛋白,可控制细菌趋化性[29]。MCP能够使细菌感受到外界环境的刺激,从而使细菌定向运动,趋向有利于细菌生长的物质,避开对细菌生长有害的物质,从而达到趋利避害的目的[30]。此病原菌受外界刺激时,MCP相关基因的缺失导致其运动性几乎全部丧失[29]。由此说明,MCP在细菌趋化性方面有着至关重要的作用。
氨基酸是蛋白质、能量和氮代谢的核心成分,它们还是在植物-微生物相互作用中具有特定功能的各种活性化合物的前体。氨基酸代谢对植物内建立系统免疫反应的免疫信号传递有至关重要的作用,可提供信号分子、防御化合物和营养物质,以形成与微生物的相互作用[31]。已有研究表明,伤寒沙门氏菌的芳香族氨基酸的合成可促进其增殖[32]。此外,有研究显示Xoo可能在低氧条件下通过促进芳香族氨基酸的合成促进其致病基因的表达和增殖进而促进感染[33]。而在本研究中,芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)生物合成途径显著上调,说明抗生素溶杆菌13-6次生代谢物Myxin可能使病原菌YM15处于胁迫状态从而使与芳香族氨基酸合成相关基因上调表达。芳香族氨基酸生物合成上调是否有利于增强病原菌YM15的致病性及其在水稻内的生存能力有待进一步探究。
基于转录组测序结果,以未经吩嗪化合物处理为对照,挑选经吩嗪化合物处理后上下调明显的基因进行基因突变并验证其功能,并明确Myxin作用于Xoc YM15的作用靶点。
参考文献:
[1]Jain P,Sharma V,Dubey H,et al. Identification of long non-coding RNA in rice lines resistant to Rice blast pathogen Maganaporthe oryzae[J]. Bioinformation,2017,13(8):249-255.
[2]Zhu Y,Chen H,Fan J,et al. Genetic diversity and disease control in rice[J]. Nature,2000,406(6797):718-722.
[3]Dutta T K. Global status of rice root-knot nematode,Meloidogyne graminicola[J]. African Journal of Microbiology Research,2012,6(32):6016-6021.
[4]He Y Q,Zhang H H,Sun Z T,et al. Jasmonic acid-mediated defense suppresses brassinosteroid-mediated susceptibility to rice black streaked dwarf virus infection in rice[J]. The New Phytologist,2017,214(1):388-399.
[5]Oliva R,Ji C H,Atienza-Grande G,et al. Broad-spectrum resistance to bacterial blight in rice using genome editing[J]. Nature Biotechnology,2019,37(11):1344-1350.
[6]周丽洪. 水稻品种与条斑病菌、溶杆菌代谢物巴马汀的互作研究[D]. 昆明:云南农业大学.
[7]Laha G S,Singh R,Ladhalakshmi D,et al. Importance and management of rice diseases:a global perspective[M]//Chauhan B,Jabran K,Mahajan G. Rice production worldwide. Cham:Springer,2017:303-360.
[8]Xu M R,Xia Z H,Zhai W X,et al. Construction of double right-border binary vector carrying non-host gene Rxo1 resistant to bacterial leaf streak of rice[J]. Rice Science,2008,15(3):243-246.
[9]Nio-Liu D O,Ronald P C,Bogdanove A J. Xanthomonas oryzae pathovars:model pathogens of a model crop[J]. Molecular Plant Pathology,2006,7(5):303-324.
[10]Christensen P,Cook F D. Lysobacter,a new genus of nonfruiting,gliding bacteria with a high base ratio[J]. International Journal of Systematic Bacteriology,1978,28(3):367-393.
[11]Liu Q,Yang J,Wang X,et al. Effect of culture medium optimization on the secondary metabolites activity of Lysobacter antibioticus 13-6[J]. Preparative Biochemistry amp; Biotechnology,2021,51(10):1008-1017.
[12]Ying-hua J,Bai-Shi H U,Feng-quan L. Selection and identification of antagonistic bacteria against soil-borne plant pathogens[J]. Chinese Journal of Biological Control,2005,21(4):260.
[13]Lou L L,Chen H T,Cerny R L,et al. Unusual activities of the thioesterase domain for the biosynthesis of the polycyclic tetramate macrolactam HSAF in Lysobacter enzymogenes C3[J]. Biochemistry,2012,51(1):4-6.
[14]Zhao Y Y,Liu J Y,Jiang T P,et al. Resistance-nodulation-division efflux pump,LexABC,contributes to self-resistance of the phenazine di- N-oxide natural product myxin in Lysobacter antibioticus[J]. Frontiers in Microbiology,2021,12:618513.
[15]Parandhaman T,Pentela N,Ramalingam B,et al. Metal nanoparticle loaded magnetic-chitosan microsphere:water dispersible and easily separable hybrid metal nano-biomaterial for catalytic applications[J]. ACS Sustainable Chemistry amp; Engineering,2017,5(1):489-501.
[16]赵延存,刘春晖,钱国良,等. 水稻细菌性条斑病菌RpfCxoc/RpfGxoc双组分系统的功能[J]. 微生物学报,2012,52(4):449-456.
[17]Charles T C,Jin S,Nester E W. Two-component sensory transduction systems in phytobacteria[J]. Annual Review of Phytopathology,1992,30:463-484.
[18]He Y W,Xu M,Lin K,et al. Genome scale analysis of diffusible signal factor regulon in Xanthomonas campestris pv.campestris:identification of novel cell-cell communication-dependent genes and functions[J]. Molecular Microbiology,2006,59(2):610-622.
[19]Ryan R P,Dow J M. Communication with a growing family:diffusible signal factor (DSF) signaling in bacteria[J]. Trends in Microbiology,2011,19(3):145-152.
[20]Yang Q Q,Zhao D S,Liu Q Q. Connections between amino acid metabolisms in plants:lysine as an example[J]. Frontiers in Plant Science,2020,11:928.
[21]Moraes T F,Spreter T,Strynadka N C. Piecing together the type Ⅲ injectisome of bacterial pathogens[J]. Current Opinion in Structural Biology,2008,18(2):258-266.
[22]Mota L J,Cornelis G R.The bacterial injection kit:type Ⅲ secretion systems[J]. Annals of Medicine,2005,37(4):234-249.
[23]Fan S S,Tian F,Li J Y,et al. Identification of phenolic compounds that suppress the virulence of Xanthomonas oryzae on rice via the type Ⅲ secretion system[J]. Molecular Plant Pathology,2017,18(4):555-568.
[24]Tao H,Fan S S,Jiang S,et al. Small molecule inhibitors specifically targeting the type Ⅲ secretion system of Xanthomonas oryzae on rice[J]. International Journal of Molecular Sciences,2019,20(4):971.
[25]Alfano J R,Collmer A. Bacterial pathogens in plants:life up against the wall[J]. The Plant Cell,1996,8(10):1683-1698.
[26]姜伯乐. 野油菜黄单胞菌hrp基因簇的功能鉴定和表达调控分析[D]. 南宁:广西大学,2004.
[27]Li K H,Wu G C,Liao Y L,et al. RpoN1 and RpoN2 play different regulatory roles in virulence traits,flagellar biosynthesis,and basal metabolism in Xanthomonas campestris[J]. Molecular Plant Pathology,2020,21(7):907-922.
[28]Tian F,Yu C,Li H Y,et al. Alternative sigma factor RpoN2 is required for flagellar motility and full virulence of Xanthomonas oryzae pv.oryzae[J]. Microbiological Research,2015,170:177-183.
[29]曾 晨. 水稻白叶枯病菌PXO99~A菌株MCP-free突变体的构建和趋化受体基因研究[D]. 南宁:广西大学,2019.
[30]Derr P,Boder E,Goulian M. Changing the specificity of a bacterial chemoreceptor[J]. Journal of Molecular Biology,2006,355(5):923-932.
[31]Moormann J,Heinemann B,Hildebrandt T M. News about amino acid metabolism in plant-microbe interactions[J]. Trends in Biochemical Sciences,2022,47(10):839-850.
[32]Hlzer S U,Hensel M. Divergent roles of Salmonella pathogenicity island 2 and metabolic traits during interaction of S.enterica serovar Typhimurium with host cells[J]. PLoS One,2012,7(3):e33220.
[33]王建良. 水稻黄单胞菌PXO99~A抗低氧压力研究以及三型效应蛋白的发掘[D]. 武汉:华中农业大学,2017.
