低温和赤霉素对蚕豆开花、内源激素、基因表达的调控
2024-02-14刘陈玮徐仁超卞晓春王凡陆红臣王玉娟吴春芳








摘要:蚕豆是长三角地区重要的越冬作物之一,但其产量低、成熟慢和采摘期短,让鲜食蚕豆销售遭遇很大障碍。人工低温春化技术的研发推广,实现蚕豆鲜荚提前上市,采摘期大幅延长。赤霉素是一类非常重要的植物激素,参与植物生长发育等多个生物学过程。为了探究赤霉素和低温联合应用对蚕豆花期及生理特性的影响,并为进一步调控蚕豆花期提供理论支撑和实践依据,以蚕豆品种通鲜1号、通鲜2号、通鲜3号、启豆2号、南通三白为材料,对蚕豆芽苗进行低温处理、赤霉素喷施处理、低温+赤霉素喷施处理,统计始花时间、单株开花数量、株高、分枝数、主茎节数等开花和生长特性,并检测不同发育阶段叶片内源激素和开花相关基因的表达情况。结果表明,低温处理可以使蚕豆开花提早16~22 d,喷施赤霉素处理可以促进开花提早2~10 d,低温+100 mg/L赤霉素处理提早开花效果最佳,最早可提前26 d。低温和100 mg/L 赤霉素均可以促进蚕豆分枝数和主茎节数的增加,低温会抑制蚕豆株高,但赤霉素处理会显著增加株高。以促进开花效果最好的通鲜3号为材料,发现ABA、IAA、GA3含量在蚕豆苗期、蕾期、花期均呈先增后降的趋势,低温处理会降低蚕豆叶片中ABA的含量,提高IAA、GA3的含量,适宜的赤霉素处理可以提高叶片中的ABA、IAA、GA3含量。通过实时荧光定量PCR研究发现,低温、赤霉素、低温+赤霉素处理均可以诱导GA20ox、GID1、FT、SOC1、VRN1的表达,抑制GAI的表达,VIN3只响应低温的调控。蚕豆芽苗低温处理后,叶面喷施100 mg/L赤霉素可以有效提早开花期,并提高分枝数、主茎节数、株高,可在鲜食蚕豆生产上进行应用。
关键词:蚕豆;低温;赤霉素;开花;内源激素;关键基因
中图分类号:S643.601" 文献标志码:A
文章编号:1002-1302(2024)24-0105-08
收稿日期:2023-11-24
基金项目:江苏省种业振兴“揭榜挂帅”项目(编号:JBGS〔2021〕058);江苏现代农业产业技术体系建设项目(编号:JATS[2022]169);江苏省重点研发计划(现代农业)(编号:BE2021389);沿江所青年科技基金[编号:YJ(2021)007]。
作者简介:刘陈玮(1993—),男,江苏南通人,硕士,助理研究员,主要从事蚕豆春化及病虫害防控研究。E-mail:20192001@jaas.ac.cn。
通信作者:吴春芳,硕士,研究员,主要从事春化蚕豆育种及栽培技术等研究。E-mail:jsyias@163.com。
蚕豆属于豆科野豌豆属,是一年生或二年生草本植物。蚕豆作为重要的食用豆作物,广泛分布于世界各地,我国一直是世界上蚕豆栽培面积最大、总产量和消费量最高的国家。长三角地区喜食鲜食蚕豆,传统露地栽培鲜食蚕豆集中在4月下旬至5月上旬上市,且产量较低,无法满足市场需求。
近年来,春化蚕豆因其上市早、产量高、采收期长、品质优等优势,在江浙沪等地的应用面积逐步扩大[1]。不同春化处理促进蚕豆开花结荚的研究已经较为成熟。研究发现,以蚕豆品种大朋一寸为材料,0 ℃春化处理20 d效果最好,青荚采收期缩短60 d[2]。ZB 系列蚕豆苗在5~6 ℃春化处理20 d后,始花期提前至11月,上市期提前至3月[3]。研究发现,慈蚕1号在萌动露白时,4 ℃春化处理9~12 d后,可显著缩短始花期[4]。研究发现,以通鲜2号蚕豆为材料,10 ℃/5 ℃日夜春化处理35 d,对始花期、鲜荚始收期促进效果最明显[5]。
除了低温春化外,植物的成花还受植物生长调节剂的影响。赤霉素处理能促进大白菜茎的伸长,并提早开花和抽薹[6]。外源赤霉素处理后,莲花的株高增加90%左右,开花数增加40%左右,开花提前4 d[7]。300 mg/L赤霉素促进切花月季卡罗拉增高和早花,赤霉素途径相关基因RhGA2ox、RhGA20ox、RhGA3ox、 RhGID1表达上调,开花相关基因RhAP1、RhKSN 、RhSOC1的表达先上升后下降[8]。
目前,有关低温和外源赤霉素对蚕豆开花相关生理指标及基因表达量的研究尚不多见。本研究利用低温和赤霉素处理蚕豆芽苗,通过测定各项生理指标,明确最佳调控浓度,并探索低温和赤霉素对内源激素及相关基因的影响,以期为蚕豆促早技术的完善和开花机理的研究提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为南通地区的蚕豆品种通鲜1号、通鲜2号、通鲜3号、启豆2号、南通三白,选取无病虫害、长势良好一致的蚕豆芽苗进行处理。
1.2 试验方法
1.2.1 赤霉素和低温春化处理
试验设置对照、低温处理、赤霉素处理、低温+赤霉素处理,10月上旬同时移栽至大棚内。大棚位于江苏沿江地区农业科学研究所薛窑基地内。对照:未进行低温和赤霉素处理;低温处理:4 ℃低温处理30 d;赤霉素处理、低温+赤霉素处理:将4 ℃低温处理30 d后和常温处理的蚕豆芽苗移栽至大棚,分别使用赤霉素处理。使用上海同瑞生物科技有限公司的农用赤霉素(有效成分含量75%),共设置5个浓度梯度,分别为50、100、200、400、800 mg/L。赤霉素在芽苗移栽后30 d内进行叶面喷施,每个处理50株,重复3次。
1.2.2 蚕豆开花特性指标测定
从定植开始,观察和记录植株的生长状况和开花情况。开花特性指标统计始花时间和单株开花数量,生长特性指标统计株高、分枝数、主茎节数。
1.2.3 蚕豆内源激素水平测定
在植株苗期、现蕾期、花期,采集顶端第2节的叶片,用液氮速冻,放入-80 ℃冰箱保存,用于后续试验。
样品提取后,采用超高效液相色谱(Vanquish,UPLC,Thermo,美国)检测内源激素含量,色谱条件为:柱温40 ℃,进样量2 μL,流速0.3 mL/min,流动相为超纯水(含0.1%乙酸)、乙腈(含0.1%乙酸),整个分析过程中样品置于4 ℃自动进样器中。采用美国Thermo公司的Q Exactive高分辨质谱检测系统进行采集。
1.2.4 蚕豆开花关键基因的定量分析
采用TRIZOL法提取样品叶片的RNA,用Takara反转录试剂盒进行反转录,放入-20 ℃保存。
设计实时荧光定量引物(表1)。荧光定量PCR反应体系为20 μL,包含cDNA 2 μL,UltraSYBRMixture 10 μL,正向引物0.5 μL,反向引物0.5 μL,RNase-freeWater 7 μL。反应条件为:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 31 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。
1.2.5 数据分析
利用Excel和SPSS等软件对试验数据进行统计分析。
2 结果与分析
2.1 低温和赤霉素对蚕豆生长和开花的影响
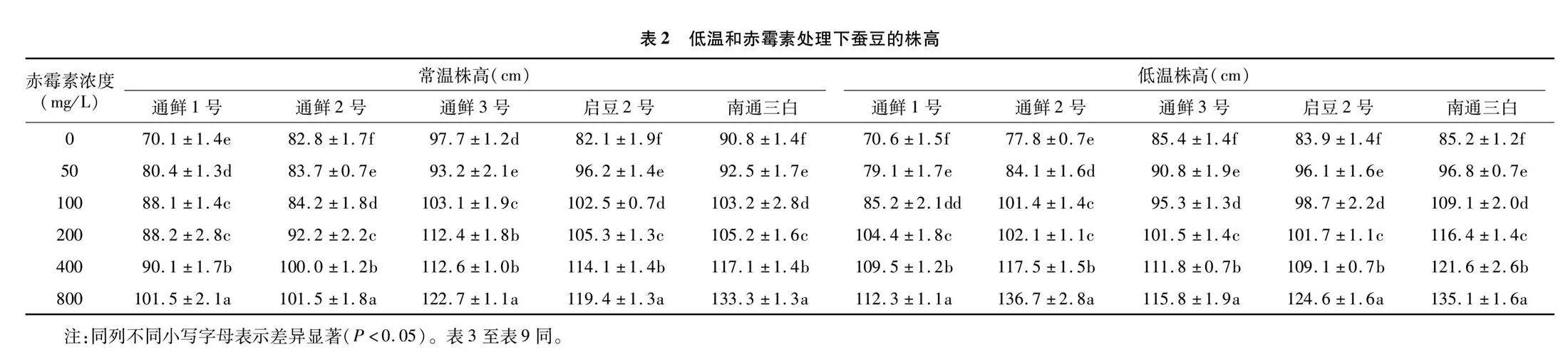
由表2可知,单一低温处理下,通鲜1号、启豆2号的株高增长,而其余3个品种的株高变低。低温处理后施用赤霉素较常温处理直接施用赤霉素处理,通鲜1、2号和南通三白在赤霉素浓度≥200 mg/L 时株高更高,而通鲜3号在所有处理浓度下株高均更低。
在相同温度处理条件下,随着赤霉素施用浓度的升高,所有品种的株高总体呈逐步上升的趋势。常温处理条件下,除了通鲜3号在浓度为50 mg/L时株高低于对照组,其他品种的株高在不同浓度处理下均高于对照组。低温处理后,所有品种的株高在不同赤霉素浓度处理下均高于单一低温处理,且除了通鲜3号在浓度为50~100 mg/L时株高低于对照组,其他品种的株高在不同浓度处理下均高于对照组。
在所有处理中,通鲜2号在低温处理后施用800 mg/L赤霉素较对照组株高增长率最高,达65.1%。
由表3可知,单一低温处理下,通鲜系列的分枝数均比对照增加,而启豆2号、南通三白的分枝数变少。低温处理后施用赤霉素较常温处理直接施用赤霉素处理,通鲜1、2号在不同浓度下分枝数均更多,而南通三白在所有处理浓度下分枝数均更少。
在相同温度处理条件下,随着赤霉素施用浓度的升高,所有品种的分枝数均呈先升后降的趋势。常温处理条件下,除通鲜3号以外,其余品种均在浓度为100 mg/L时分枝数最多,所有品种在 100 mg/L 时分枝数均高于对照组。低温处理之后,通鲜1号、南通三白在200 mg/L时分枝数最多,通鲜2、3号和启豆2号在100 mg/L时分枝数最多。
低温和赤霉素共同处理时,所有品种在赤霉素浓度50~200 mg/L时分枝数高于单一低温处理。
在所有处理中,通鲜2号在低温处理后施用 100 mg/L 赤霉素较对照组分枝数增长率最高,达54.2%。
由表4可知,相同赤霉素浓度条件下,低温处理下,除启豆2号主茎节数减少以外,其余品种的主茎节数整体增多。
在相同温度处理条件下,随着赤霉素施用浓度的升高,不同品种主茎节数的变化趋势各不相同。在常温处理条件下,通鲜1、2号的主茎节数随着赤霉素浓度的升高逐渐下降,但在50 mg/L时节数高于对照组;其余品种的主茎节数随着赤霉素浓度的升高均呈先升后降的趋势,通鲜3号在100 mg/L时主茎节数最多,启豆2号、南通三白在200 mg/L时主茎节数最多,3个品种在50~400 mg/L时主茎节数均高于对照组。低温处理之后,通鲜1、2号和南通三白的主茎节数随着赤霉素浓度的升高呈逐渐下降的趋势,且均低于单一低温处理的节数;通鲜2号在低温后喷施不同浓度赤霉素情况下主茎节数均低于对照组,但通鲜1号在50~200 mg/L时主茎节数高于对照组。通鲜3号、启豆2号的主茎节数随着赤霉素浓度的升高呈先增后降的趋势,通鲜3号在100 mg/L时主茎节数最多,并高于单一低温处理,且在低温后喷施不同浓度赤霉素情况下节数均高于对照组;启豆2号在200 mg/L时主茎节数最多,在低温后喷施不同浓度赤霉素情况下主茎节数基本不低于单一低温处理,但仅在低温后赤霉素浓度为100~200 mg/L时主茎节数高于对照。
在所有处理中,通鲜1号在单一低温处理下较对照组的主茎节数增长率最高,达51.5%。
由表5可知,低温和赤霉素处理后整体可以促进蚕豆提早开花,低温促进早花的效应更明显。与对照相比,适宜浓度的赤霉素处理对不同品种的始花天数最多提早2~10 d,单一低温处理对不同品种的始花天数提早14~22 d,低温+赤霉素处理提早开花天数最多,为16~27 d。
在相同温度处理条件下,随着赤霉素施用浓度的升高,不同品种始花天数的变化趋势各不相同。通鲜1号在常温、低温处理后喷施赤霉素,始花天数随着浓度的升高基本呈逐渐增加的趋势,且在常温处理下喷施400~800 mg/L赤霉素比对照组延迟开花。通鲜2、3号在常温、低温处理后喷施赤霉素,始花天数随着浓度的升高呈先降后升的趋势;通鲜3号在常温处理下喷施800 mg/L赤霉素比对照组延迟开花。启豆2号在常温处理后喷施赤霉素,始花天数随着浓度的升高呈先降后升的趋势,但在低温处理后喷施赤霉素,始花天数随着浓度升高呈逐渐增加的趋势,且赤霉素浓度为 800 mg/L 时比单一低温处理延迟开花。南通三白在常温、低温处理后喷施赤霉素,始花天数随着浓度的升高分别呈逐渐降低、逐渐增加的趋势,且在低温处理后施用400~800 mg/L赤霉素比单一低温处理延迟开花。
在所有处理中,通鲜3号在低温+200 mg/L赤霉素混合处理下较对照组开花提前天数最多,可达27 d。
由表6可知,低温处理可明显增加蚕豆的单株花数。相同温度条件下,赤霉素对不同品种单株花数的影响各不相同。除启豆2号外,赤霉素处理在适宜浓度时均可增加单株花数,最多可以增加单株花数3.6%。
在所有处理中,通鲜2号在低温处理后施用200 mg/L赤霉素较对照组单株花数增加最多,可达69.4%。
2.2 低温和赤霉素对蚕豆内源激素的影响
选取促早花效果最显著的通鲜3号作为试验材料,对其不同发育时期内源激素进行检测发现,ABA含量在蚕豆不同发育时期呈先增后降的趋势;除单一低温处理外,所有试验组苗期叶片的ABA含量均高于开花期叶片内的含量(表7)。喷施同一浓度赤霉素条件下,低温处理植株不同时期的ABA含量较常温处理的更低,低温处理后喷施浓度≥200 mg/L 赤霉素的植株花期除外。
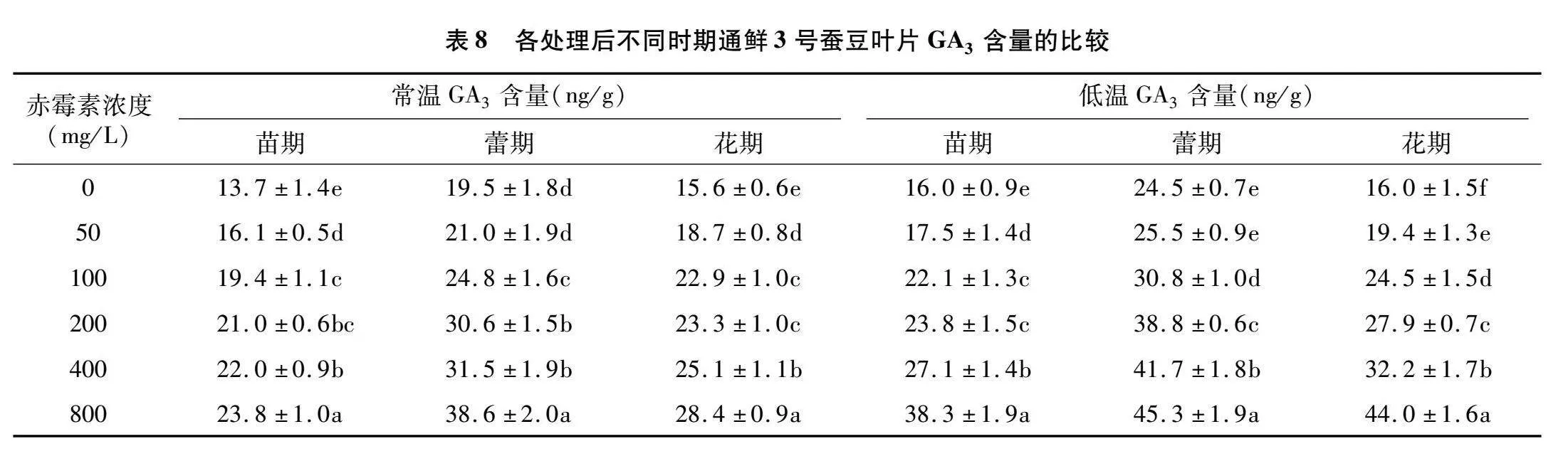
GA3含量在蚕豆不同发育时期呈先增后降的趋势,苗期叶片的GA3含量低于开花期叶片内的含量;随着赤霉素处理浓度的升高,GA3含量逐步增加(表8)。低温处理下的GA3含量较常温处理整体较高。
IAA含量在蚕豆不同发育时期呈先增后降的趋势。0~200 mg/L赤霉素处理下,苗期叶片的IAA含量均低于开花期含量;而赤霉素浓度400~800 mg/L 处理下,花期IAA含量低于苗期(表9)。随着赤霉素处理浓度的升高,IAA含量逐步增加。低温处理下的IAA含量较常温处理总体均较高。
2.3 低温和赤霉素对蚕豆开花关键基因表达的影响
GA20ox是影响赤霉素合成的关键酶,低温、赤霉素处理后GA20ox基因表达均上调,赤霉素处理的诱导效果相对低温更强;低温+赤霉素处理后,GA20ox基因表达显著上升(图1)。DELLA蛋白GAI是赤霉素调控途径的重要因子,是感知GA信号转导的关键。低温、赤霉素、低温+赤霉素处理均抑制GAI基因的表达,低温处理的抑制效果较赤霉素处理更强。赤霉素受体GID1是赤霉素信号传导途径的重要因子,低温、赤霉素、低温+赤霉素处理均可诱导GID1基因的表达,赤霉素比低温处理的诱导效果更强。
FT基因不仅受春化途径中FLC基因的影响,又是光周期中关键基因CO的靶基因,自主途径、春化途径、光周期途径信号传导共同作用于FT基因来促进植物开花。SOC1属于MADS-box转录因子,它不仅受赤霉素途径控制,同时也受到春化途径、光周期途径、自主途径的调节。低温、赤霉素、低温+赤霉素处理下,SOC1、FT基因表达均上升,赤霉素对2种基因的促进效果相对更明显,低温+赤霉素处理较单一处理促进效果更强。
VRN1、VIN3基因通过改变FLC染色质的空间结构抑制FLC的表达,从而促进开花。与对照相比,低温、赤霉素、低温+赤霉素处理下,VRN1基因表达均显著上升;低温对VRN1基因的促进效果相对更强。低温可以促进VIN3基因的上调,而赤霉素处理下VIN3基因表达无显著变化。
3 讨论
蚕豆作为长三角地区重要的越冬作物,低温春化是开花结荚必不可少的环节。本研究结果表明,低温处理可以显著提早开花,并增加单株开花总数,抑制株高增长,促进分枝数、总茎节数的增加。邵奇等对50份蚕豆资源春化后的生长发育形态进行分析,发现低温春化后植株开花时间可提前10~60 d,大多数品种的株高、有效分枝数在生长初期相对较低,生长后期逐渐持平,也有少部分品种在低温春化后,其株高、分枝数有所增加[9]。本研究中,低温春化处理后,通鲜1号、启豆2号的株高略有增加,南通三白、启豆2号分枝数显著下降,启豆2号的主茎节数也略有减少,这可能也是不同品种间的差异导致。赤霉素在植物生长调控中扮演着重要角色,可以促进植物开花并延长开花时间,并促进植株茎秆的伸长。早期研究表明,赤霉素可以促进蚕豆株高、节间长度的增加,还能显著增加主茎节数[10-11]。本研究中,蚕豆喷施赤霉素后始花期最多提前2~10 d,植株株高随着处理浓度的升高逐渐增加,分枝数和主茎节数随着处理浓度的升高先增后降,与已有报道结果[12-14]一致。黄家总等研究发现,温度联合赤霉素喷雾处理后,紫罗兰主茎节数比对照少[15]。低温处理的蚕豆喷施赤霉素后,通鲜1号、通鲜2号、南通三白的主茎节数也随着浓度的增加而逐渐下降,其相关机制还需要进一步研究。
植物内源激素在植株生长发育的各类生理反应中发挥重要作用,参与调控植物萌发与休眠、组织生长与分化、开花与结实、成熟与衰老等各项功能。本研究中,低温处理会降低蚕豆叶片中ABA的含量,提高IAA、GA3的含量;适宜的赤霉素处理可以提高叶片中ABA、IAA、GA3的含量。研究发现,大
白菜低温处理后,从抽薹期到开花期茎尖中IAA、GA、ABA的含量均高于对照[6]。喷施赤霉素会促进甘蔗和油茶内源GA、IAA的水平升高,并导致ABA水平降低[16-17]。高山低温+植物生长调节剂处理,可以促进春石斛品种Carmen花芽分化期间内源激素GA3、IAA的积累,而对ABA的含量无明显影响[18]。可见在低温及喷施赤霉素条件下,植株内GA3、IAA的含量均会增加,而ABA含量的变化趋势各不相同[19-20]。关于ABA信号如何参加花芽分化还有待研究。
植物从营养生长到生殖生长需要经历复杂的调控网络,根据其对不同信号的感知,大致分为光周期途径、春化途径、赤霉素途径、自主成花途径[21]。春化途径是蚕豆成花的必要途径,VRN1、VIN3作为FLC的负调控因子,通过抑制其表达促进开花[22]。实时荧光定量PCR结果表明,低温处理后蚕豆内VRN1、VIN3基因表达量显著上升,赤霉素处理后VRN1基因表达量有所上升,而VIN3基因表达量无明显变化,说明VIN3只有在感受低温的情况下表达,赤霉素可能参与促进VRN1的调控。赤霉素是调控植物开花重要的植物激素之一。GA20ox是赤霉素合成的关键基因,赤霉素可以诱导GA20ox基因的表达,促进植株增高[23-24],低温也可以诱导GA20ox基因的表达,从而促进花芽解除休眠[19]。本研究中,低温和赤霉素处理均显著诱导蚕豆内GA20ox基因的表达,低温的诱导效果相对较弱,与已有研究结果一致。DELLA蛋白是感知赤霉素信号的重要因子,包括GAI、RGA、RGL等,其会阻碍植物的生长发育,而赤霉素受体GID1通过与赤霉素结合发挥其功能,从而促进DELLA蛋白的降解,促进成花[25]。本研究中,低温和赤霉素处理均抑制GAI基因的表达,低温处理的抑制效果更显著;低温和赤霉素处理均可诱导GID1基因的表达,赤霉素比低温处理的诱导效果更强,与已有报道[26-27]一致。FT、SOC1基因会受到春化途径和赤霉素途径等信号传导共同作用而促进成花[28-29],在低温和赤霉素处理后,蚕豆内FT、SOC1基因均被诱导表达,两者共同处理后相对表达量更高,促进开花效果也更加显著。
4 结论
低温和赤霉素在蚕豆成花和生长发育中发挥不同的作用,低温+100 mg/L赤霉素可以促进蚕豆花期进一步提早,并增加株高、分枝数和主茎节数,对促进开花相关的内源激素和基因均有显著诱导作用。蚕豆的生长期较长,针对不同的栽培方式,如何选用合理的赤霉素施用时期、次数和浓度,以及构建多样化的激素组合以保障上市期和产量的双赢,还有待进一步的研究。
参考文献:
[1]卞晓春,王 凡,吴春芳. 春化蚕豆产业现状及发展建议[J]. 现代农业科技,2021,17 (17):245-247.
[2]徐兵划,祁 婷,曹玉杰,等. 蚕豆人工春化诱导技术研究[J]. 湖北农业科学,2015,54(19):4673-4675,4681.
[3]戚自荣,崔萌萌,王旭强,等. 鲜食蚕豆不同人工春化处理及栽培技术试验[J]. 中国园艺文摘,2017,33(7):31-33.
[4]陈江辉,王旭强,王双千,等. 春化处理对蚕豆性状表达的影响[J]. 浙江农业科学,2018,59(1):6-8.
[5]赵 薇,王爱花,陆 慢,等. 不同春化处理对蚕豆开花结荚时间和产量的影响[J]. 江苏农业科学,2018,46(16):102-105.
[6]Song S W,Lei Y L,Huang X M,et al. Crosstalk of cold and gibberellin effects on bolting and flowering in flowering Chinese cabbage[J]. Journal of Integrative Agriculture,2019,18(5):992-1000.
[7]Sheng J Y,Li X,Zhang D. Gibberellins,brassinolide,and ethylene signaling were involved in flower differentiation and development in Nelumbo nucifera[J]. Horticultural Plant Journal,2022,8(2):243-250.
[8]李茂福,杨 媛,王 华,等. 赤霉素对露地栽培月季卡罗拉生长发育的影响[J]. 园艺学报,2019,46(4):749-760.
[9]邵 奇,袁星星,于龙龙,等. 人工春化对不同基因型蚕豆生长表型及发育形态的影响[J]. 江苏农业科学,2016,44(9):218-221.
[10]中国科学院植物生理研究所生长素工作组. 赤霉酸对蚕豆生长的影响[J]. 实验生物学报,1959,6(3):211-216.
[11]夏明忠. 赤霉素和其他生长调节剂对蚕豆生长的协同效应[J].植物生理学通讯,1990(4):20-23.
[12]Hiroko Y,Nobutaka S,Akihiro I,et al. Involvement of gibberellins in the regulation of tillering in Welsh onion (Allium fistulosum L.)[J]. The Horticulture Journal,2015,84(4):334-341.
[13]Mujadidi A,Kumar M,Malik S,et al. Effect of time and concentrations of gibberellic acid application on growth and flowering of African marigold (Tagetes erecta L.) CV. Pusa Narangi[J]. Progressive Agriculture,2019,19(2):293-297.
[14]Sharma A,Dilta B S,Sharma C L,et al. Effect of foliar application of gibberellic acid on plant growth,flowering and yield attributes in pansy (Viola×wittrockiana Gams.)[J]. International Journal of Plant amp; Soil Science,2023,35(17):403-410.
[15]黄家总,颜 艳,冈田芳明,等. 温度与赤霉素对紫罗兰生育及其开花的影响[J]. 广州大学学报(自然科学版),2004,3(1):27-30.
[16]Wen Y,Su S C,Ma L Y,et al. Effects of gibberellic acid on photosynthesis and endogenous hormones of Camellia oleifera Abel. in 1st and 6th leaves[J]. Journal of Forest Research,2018,23(5):309-317.
[17]Qiu L H,Chen R F,Luo H M,et al. Effects of exogenous GA3 and DPC treatments on levels of endogenous hormone and expression of key gibberellin biosynthesis pathway genes during stem elongation in sugarcane[J]. Sugar Tech,2019,21(6):936-948.
[18]章金辉,王再花,李 杰,等. 低温和植物生长调节剂诱导春石斛‘Carmen’开花及其生理变化[J]. 北方园艺,2020(18):64-70.
[19]Zhou L P,Pan C,Wang M X,et al. Progress on the mechanism of hormones regulating plant flower formation[J]. Hereditas,2020,42(8):739-751.
[20]赵文武,黄莉娟,赵丽丽,等. 低温胁迫对葛藤幼苗生长发育及生理特性的影响[J]. 南方农业学报,2022,53(11):3068-3078.
[21]周 琴,张思思,包满珠,等. 高等植物成花诱导的分子机理研究进展[J]. 分子植物育种,2018,16(11):3681-3692.
[22]Neha S,Koen G,Shekhar B G,et al. The molecular mechanism of vernalization in Arabidopsis and cereals:role of flowering locus C and its homologs[J]. Physiologia Plantarum,2020,170(3):373-383.
[23]杨艳华,张亚东,朱 镇,等. 赤霉素(GA3)和脱落酸(ABA)对不同水稻品种生长和生理特性及GA20ox2、GA3ox2基因表达的影响[J]. 中国水稻科学,2010,24(4):433-437.
[24]Yue J H,Zhang D,Chen G Q,et al. ApGA20ox1,a key gibberellin biosynthesis gene,regulates somatic embryogenesis and plant height in Agapanthus praecox[J]. Scientia Horticulturae,2023,312:111846.
[25]张玉喜,张文超,李玉娥,等. 赤霉素氧化酶PsGA20ox基因参与低温诱导的牡丹内休眠解除[J]. 华北农学报,2014,29(3):22-26.
[26]王春生. 大豆GmGAI基因参与赤霉素调控开花时间的功能研究[D]. 哈尔滨:东北农业大学,2021.
[27]李 鹏. GA对扁桃花药发育的影响及调控网络构建[D]. 乌鲁木齐:新疆农业大学,2019.
[28]范树国. 高等植物成花分子机理研究进展[J]. 楚雄师范学院学报,2014,29(6):58-69.
[29]Yong W J,Areum L,Sun J M,et al. Genome-wide identification of flowering time genes associated with vernalization and the regulatory flowering networks in Chinese cabbage[J]. Plant Biotechnology Reports,2018,12(5):347-363.
