番茄GEF基因家族鉴定及青枯菌胁迫响应分析
2024-02-14骆少丹王琼







摘要:鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)广泛存在于植物细胞中,它通过调控小G蛋白的活性来参与植物生长发育和胁迫响应等多种胞内信号传导过程。目前GEF已经在拟南芥、水稻等物种中被发现,但番茄中GEF家族基因的研究尚未报道。本研究从番茄基因组数据库中共筛选鉴定出了13个植物特有的GEF基因家族成员,并将其分别命名为SlRopGEF1~SlRopGEF13。利用生物信息学手段对其理化性质、进化关系、基因结构、染色体分布、共线性等进行分析,并基于番茄功能基因组数据库中的转录组数据对其组织特异性表达和青枯菌胁迫下的诱导表达模式进行分析。结果表明,13个番茄GEF基因分别定位在9条染色体,各染色体上平均分布1~3个基因;氨基酸序列比对和结构域分析结果显示,SlRopGEF都具有由多个保守基序组成的典型PRONE (plant-specific ROP nucleotide exchanger)结构域;亚细胞定位预测结果显示所有的SlRopGEF都定位于细胞核,SlRopGEF2和SlRopGEF11还部分分别定位于细胞膜和叶绿体中;根据物种间进化关系分析将GEF家族成员分为3个亚族;番茄物种内共线性分析检测到6对共线性关系;物种间共线性分析结果显示多个番茄SlRopGEF与拟南芥和水稻中GEF家族同源基因存在共线性关系;除SlRopGEF1和SlRopGEF7在根部组织中表达水平较高,其余SlRopGEF更倾向于在花和果实组织中积累;青枯菌侵染处理下,番茄抗病和感病品种中一些SlRopGEF的表达水平显著性变化,表明部分GEF家族蛋白在调控番茄抗青枯病过程中发挥着一定的作用。本研究结果为接下来探究番茄GEF家族蛋白的免疫功能并解析其通过调控小G蛋白活性以参与番茄抗青枯病提供了基础科学依据。
关键词:番茄;GEF基因家族;生物信息学;基因表达;青枯菌
中图分类号:S436.412.1+5" 文献标志码:A
文章编号:1002-1302(2024)24-0034-10
收稿日期:2023-12-26
基金项目:中国博士后科学基金(编号:2023M733004);江苏省科协青年科技人才托举工程(编号:JSTJ-2023-007)。
作者简介:骆少丹(1996—),女,贵州安顺人,硕士研究生,主要从事番茄青枯病抗性相关基因挖掘与功能分析方面的研究。E-mail:211211801105@stu.just.edu.cn。
通信作者:王 琼,博士,讲师,主要从事植物病理学、植物免疫学方面的教学与研究。E-mail:wangqiong@yzu.edu.cn。
番茄(Solanum lycopersicum)是世界范围内一种重要且备受喜爱的蔬菜和经济作物,也是研究果实发育与成熟的理想模式植物。成熟的番茄果实富含维生素C、番茄红素、有机酸等营养物质[1]。在我国,番茄栽培面积和产量逐年增加,是种植面积最广、经济价值最高的蔬菜作物之一[2]。但番茄在生长发育过程中经常受到真菌、病毒、细菌等生物胁迫,严重危害其产量与品质,造成巨大的经济损失。
青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)在茄科作物上引起的一种土传性细菌病害,在我国番茄主产区发病日趋严重。青枯菌在入侵植物根部或茎基部的导管系统后,可堵塞或破坏寄主维管束输导组织,导致植株失水枯萎但仍保持青绿[3]。在防治番茄青枯病的众多措施中,培育并种植抗病品种是最为绿色环保且高效的途径之一,而发掘抗病相关基因则可为育种工作提供新的遗传资源和理论指导。
鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)是小G蛋白从GDP结合的非活性形式转换为GTP结合的活性形式关键调控因子[4-5]。GEF蛋白可刺激GDP从小G蛋白上释放,使细胞内高浓度水平的GTP自发地结合到无核苷酸结合形式的小G蛋白上,从而将小G蛋白激活[6-7]。PRONE (plant-specific ROP nucleotide exchanger)类型的 GEF是植物所特有的一类GEF蛋白,最初是通过酵母双杂交技术在拟南芥中发现的,并被命名为RopGEF[8]。RopGEF具有一个可变的N端和C端以及中央保守的PRONE结构域。PRONE结构域具有催化功能并且直接与下游小G蛋白结合,而C端可变区则具有抑制GEF活性的作用[9-10]。
GEF在植物生长发育和抗逆过程中都发挥着重要作用。拟南芥GEF家族蛋白AtRopGEF1和AtRopGEF4与AtROP11互作并特异性地调控脱落酸(ABA)介导的气孔关闭过程[11]。AtRopGEF7激活AtRAC1,并通过调控关键转录因子表达水平从而维持根部干细胞生态位[12]。OsRopGEF7B调节水稻花器官的发育,影响水稻结实率[13]。蓝莓基因组共编码32个GEF蛋白,其中VcGEF3参与根毛和表皮毛发育调控[14]。进一步研究发现,一些GEF蛋白的活性还受其上游类受体激酶(receptor-like kinase,RLK)的调控,比如拟南芥花粉特异性类受体激酶AtPRK2和AtPRK6直接磷酸化RopGEF的C端,从而逐级激活RopGEFs-ROPs介导的花粉管极性生长途径[15-16]。类似地,长春花类受体激酶家族蛋白FERONIA与RopGEF互作并将其激活,进而参与ROS介导的根毛发育、花粉管信号感知以及白粉病感染等多种胞内活动[17-19]。此外,水稻类受体激酶OsCERK1被几丁质信号激活后可磷酸化OsRacGEF1的C末端第549位丝氨酸,从而将OsRacGEF1激活。被激活的OsRacGEF1可通过与小G蛋白OsRac1互作将其激活,随后诱导一系列免疫反应以防御稻瘟病菌的入侵[20]。越来越多的证据表明RLK-GEF-Rop/Rac是调控植物生长、发育以及胁迫响应的关键信号通路,且在不同物种中具有一定的保守性。近期笔者所在课题组对番茄ROP家族9个小G蛋白(SlRop1-9)的亚细胞定位、免疫功能以及是否参与调控抗青枯病进行了系统性分析,发现在本氏烟草中瞬时过表达激活状态的SlRop3和SlRop4可抑制青枯菌的增殖[21]。鉴于SlRop3和SlRop4极有可能具有正调控番茄青枯病抗性的能力,而GEF蛋白是细胞内小G蛋白的激活者,那么番茄中必然存在可以调节SlRop3和SlRop4活性状态的GEF蛋白。但是,至今尚未见任何有关于番茄中GEF蛋白的系统性分析以及其参与调控青枯病抗性功能的报道。
本研究采用生物信息学技术对番茄GEF家族进行了全基因组鉴定,对鉴定到的13个GEF基因折理化性质、基因结构、共线性关系和进化关系等进行了分析,并利用番茄转录组数据对其组织特异性表达和青枯菌侵染胁迫下的表达模式进行了初步分析,为进一步探究番茄GEF家族蛋白的抗青枯病功能以及揭示GEF-ROP模块调控番茄青枯病抗性的分子机制奠定了理论基础。
1 材料与方法
1.1 试验时间和地点
试验于2023年3—8月在扬州大学植物保护学院植物病理系实验室完成。
1.2 试验材料
本研究选用番茄Ailsa Craig品种作为试验材料,培养于28 ℃、75%湿度、12 h光周期的人工气候室10 d,然后收集番茄幼苗的新鲜根、茎、叶,液氮速冻并保存于-80 ℃。
1.3 番茄GEF基因家族的检索和理化性质预测
将水稻OsRacGEF1(Os09g0544800)编码的氨基酸序列导入番茄基因组数据库(https://solgenomics.net/)进行BLAST搜索,下载番茄GEF基因组序列、编码序列(coding sequence,CDS)和蛋白序列。在拟南芥基因组网站TAIR(https://www.arabidopsis.org/)和水稻基因组数据库RAP-DB(https://rapdb.dna.affrc.go.jp/)中分别下载拟南芥和水稻的GEF基因家族蛋白序列。
使用Expasy网站在线工具ProtParam(https://web.expasy.org/protparam/)分析SlRopGEF基因的理化性质。利用Cell-PLoc 2.0网站中的Plant-mPLoc服务器(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测番茄GEF家族蛋白的亚细胞定位。
1.4 序列比对与系统进化树构建
分别利用在线软件MUSCLE(https://www.ebi.ac.uk/Tools/msa/muscle/)和GeneDoc(http://www.nrbsc.org/gfx/genedoc/index.html)对番茄13个GEF家族蛋白氨基酸序列进行多重比对及将比对结果可视化。
将番茄、水稻和拟南芥GEF基因家族成员的氨基酸序列按上述方法进行多序列比对,使用trimAI软件对比对结果进行修整以排除不需要的区域,然后使用IQ-TREE软件(设置bootstrap重复次数为 1 000)构建系统发育树。
1.5 染色体分布、保守基序、基因结构与共线性分析
使用MEME软件鉴定番茄GEF家族蛋白序列中的保守基序,设置保守基序最小长度为6,最大长度为50,最大发现数目为15个。在茄科数据库下载番茄SlRopGEF基因组注释文件,利用TBtools提取基因起始位置、ID及Chrom等信息,并绘制染色体定位图并进行物种内共线性分析。采用GSDS在线软件(http://gsds.cbi.pku.edu.cn)绘制番茄GEF基因家族成员的基因结构图。利用MCScanX软件分别绘制番茄与水稻、番茄与拟南芥之间的共线性关系图。
1.6 RNA提取与反转录
使用南京诺唯赞公司的FastPure Universal Plant Total RNA Isolation Kit和HiScript II Q Select RT SuperMix for qPCR(+gDNA wiper)试剂盒分别进行番茄幼苗根、茎、叶总RNA的提取和反转录。
1.7 实时荧光定量PCR
使用南京诺唯赞公司的ChamQ Universal SYBR qPCR Master Mix试剂盒和美国伯乐CFX96 Touch Real-Time PCR 仪进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试验。利用qPrimerDB在线数据库(https://qprimerdb.biodb.org/)搜索SlRopGEF1~SlRopGEF13基因的特异性实时定量扩增引物序列(表1),并在生工生物工程(上海)股份有限公司合成。以番茄根、茎、叶的cDNA为模板,通过qRT-PCR检测GEF家族基因在番茄不同器官中的表达水平。扩增体系总体积12 μL,包括cDNA 2 μL、2×SYBR Master Mix 6 μL、10 μmol/L 正反向引物各0.5 μL和去离子水3 μL。使用SlUbiquitin7基因作为定量分析内参基因,qPCR引物序列见表1。试验共进行3次生物学重复。
1.8 表达模式分析
利用Tomato Functional Genomics数据库(http://ted.bti.cornell.edu/cgi-bin/-TFGD/digital/h-ome.cgi)搜索并下载SlRopGEF基因在番茄Heinz品种的不同器官组织以及不同成熟度果实中的表达水平(RPKM),并使用TBtools绘制基因相对表达热图。在线下载青枯菌侵染番茄抗病品种(Hawaii 7996)和感病品种(M82)的转录组测序数据(https://onlinelibrary.wiley.com/doi/10.1111/tpj.14175),利用GraphPad Prism 9.5软件对SlRopGEF基因在青枯菌胁迫后的表达水平进行统计分析。
2 结果与分析
2.1 番茄GEF基因家族鉴定及理化性质分析
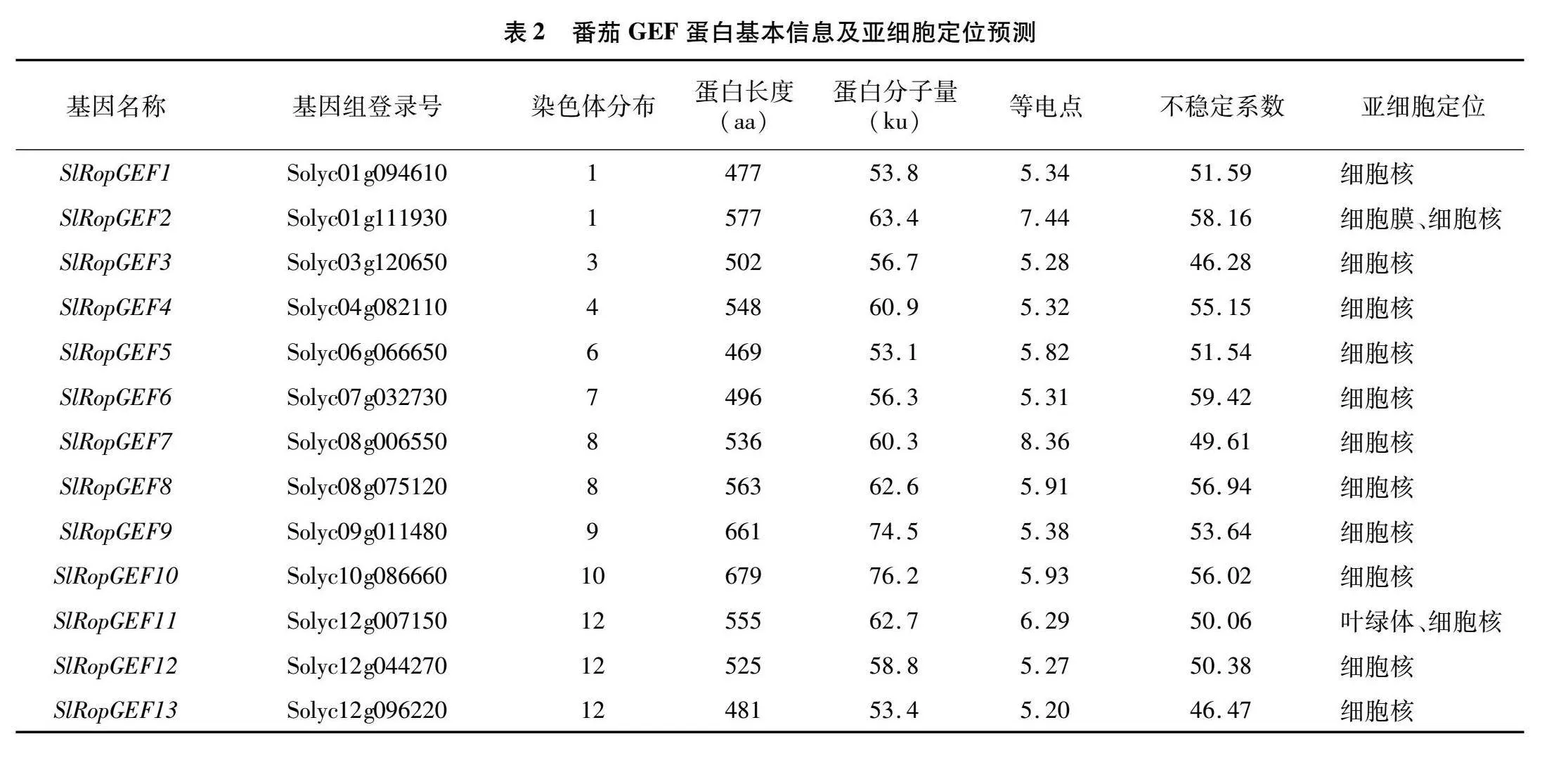
基于水稻OsRacGEF1的序列在番茄基因组数据库中共搜索到13个番茄GEF基因,根据各基因染色体位置及与水稻GEF基因家族的同源关系依次将其命名为SlRopGEF1~SlRopGEF13。由图1可知,番茄GEF家族基因分布在9条染色体上,其中12号染色体上分布最多,有3个GEF基因;1号和8号染色体上各分布2个GEF基因;3号、4号、6号、7号、9号和10号染色体上各分布1个GEF基因。接下来对13个SlRopGEF的理化性质和亚细胞定位情况进行预测,结果(表2)显示,番茄GEF蛋白长度在469~679个氨基酸之间,蛋白分子量大小在53.1~76.2 ku之间,理论等电点在 5.20~8.36之间。SlRopGEF蛋白不稳定系数在46.28~59.42之间,表示全部处于不稳定形态。亚细胞定位预测分析发现,番茄GEF基因家族成员都定位于细胞核中;SlRopGEF2和SlRopGEF11除定位在细胞核外,还分别定位于细胞膜和叶绿体中。
2.2 番茄GEF家族系统进化、基因结构与保守结构域分析
根据报道可知,拟南芥和水稻基因组分别共编码14、11个PRONE类型的GEF蛋白[9,22]。为了揭示番茄GEF基因在进化过程中与其他物种中该家族基因的同源关系,将番茄、水稻和拟南芥中所有GEF基因家族蛋白的氨基酸序列进行比对并构建系统进化树,结果(图2)显示,所有的GEF基因可根据其亲缘关系远近分为3个亚族(Ⅰ、Ⅱ、Ⅲ),同一亚族成员之间具有较高的同源性以及较近的亲缘关系,可能发挥相似的功能。亚族Ⅰ由6个AtRopGEF、4个OsRopGEF和5个SlRopGEF组成;亚族Ⅱ有1个AtRopGEF、1个OsRopGEF和2个SlRopGEF;亚族Ⅲ包括7个AtRopGEF、6个OsRopGEF和6个SlRopGEF。其中SlRopGEF1、SlRopGEF2、SlRopGEF4、SlRopGEF7、SlRopGEF9、SlRopGEF10与水稻中调控稻瘟病抗性的关键免疫因子OsRacGEF1(即OsRopGEF7)处于同一亚族中,暗示着这些SlRopGEF也有参与番茄的免疫信号通路的可能。
基因结构分析结果(图3)显示除SlRopGEF13有13个外显子外,其余12个GEF基因外显子数都在5~7个之间。保守基序预测结果表明,番茄GEF家族蛋白序列中存在10个保守基序,依次将其命名为motif1~motif10。进一步分析发现除SlRopGEF4和SlRopGEF13只含有8个保守基序外,其余SlRopGEF都含有9个保守基序;同一亚族GEF同源蛋白的保守基序组成几乎一致;亚族Ⅰ特异性含有motif 8但不含motif 10,而亚族Ⅱ特异性含有motif 10却不含motif 8;13个SlRopGEF的所有保守基序都处于GEF蛋白的PRONE结构域内且序列相似度较高(图3和图4)。
2.3 GEF基因家族共线性分析
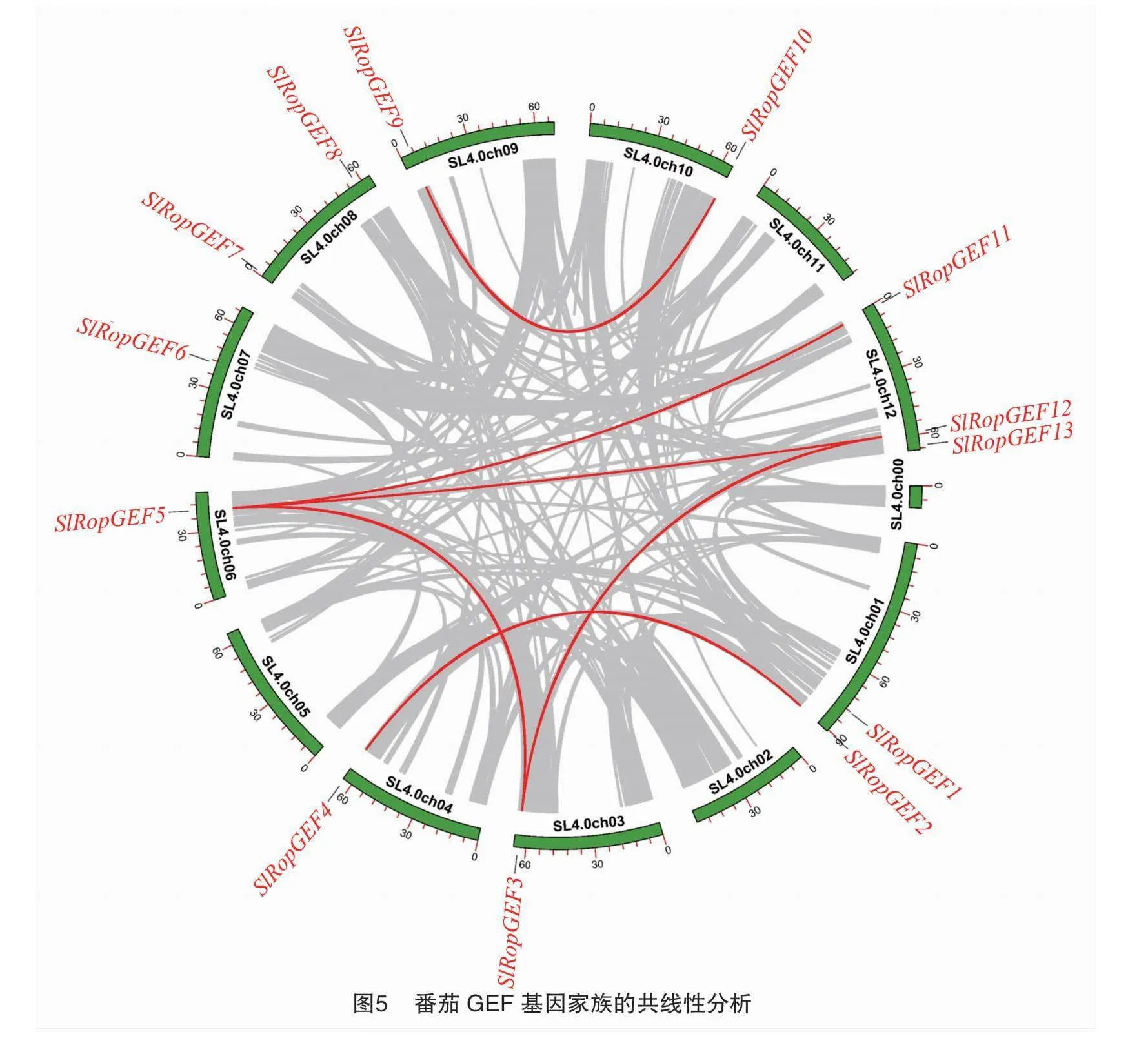
番茄基因组内GEF基因共线性分析结果显示存在6个旁系同源基因对,分别为SlRopGEF2/SlRopGEF4、SlRopGEF3/SlRopGEF5、SlRopGEF3/SlRopGEF12、SlRopGEF5/SlRopGEF11、SlRopGEF5/SlRopGEF12和SlRopGEF9/SlRopGEF10(图5)。每组旁系同源基因对之间存在大片段同源现象,且同源片段内部基因排序保守,这意味着功能上可能也是保守的。
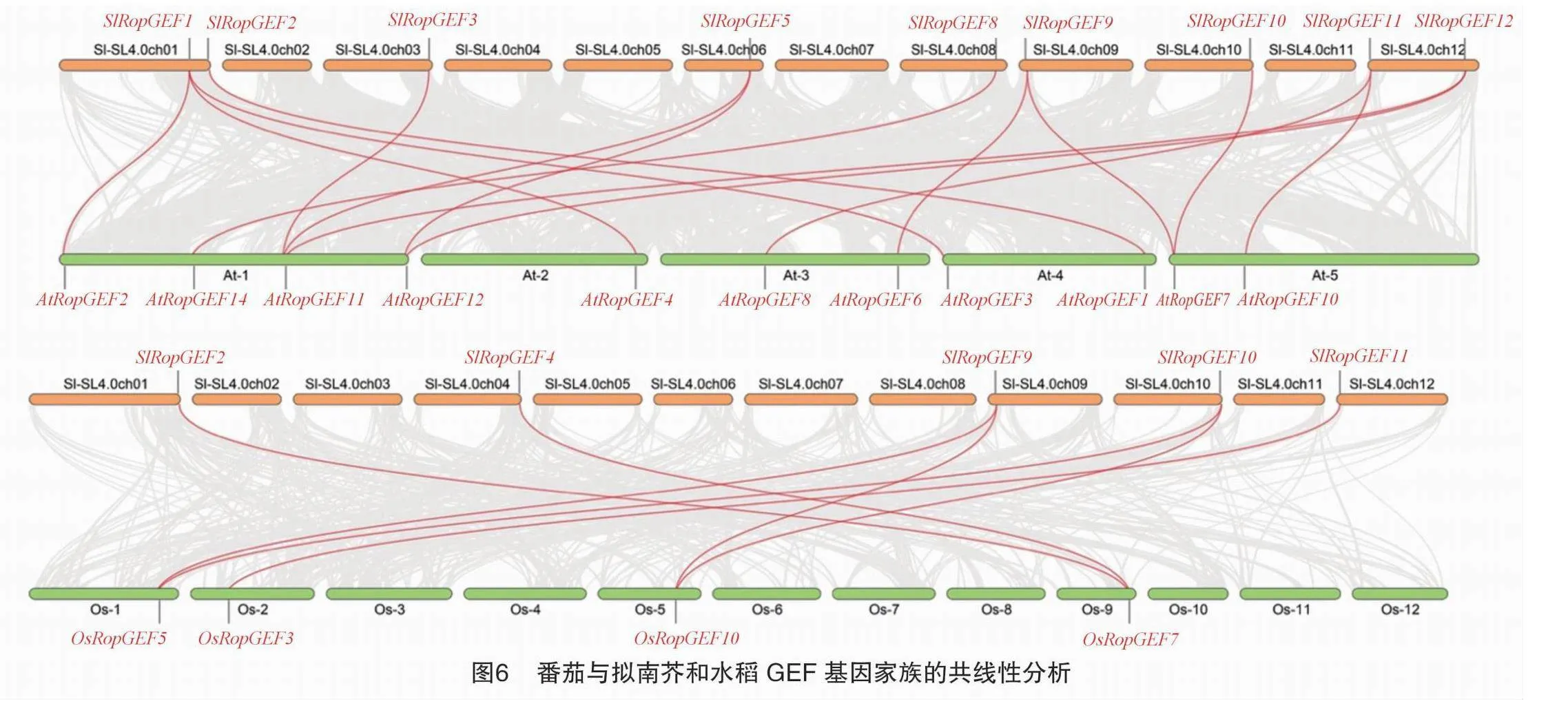
番茄与拟南芥和水稻基因组中GEF基因家族的物种间共线性分析结果(图6)表明,SlRopGEF中有9个基因与AtRopGEF为直系同源基因,其中SlRopGEF3、SlRopGEF5和SlRopGEF12都与AtRopGEF11有共线性,SlRopGEF5和SlRopGEF12都与AtRopGEF12有共线性,SlRopGEF9和SlRopGEF10都与AtRopGEF7有共线性,暗示这3组基因可能发挥相似的功能。此外,SlRopGEF中有5个基因与OsRopGEF为直系同源基因,其中SlRopGEF9和SlRopGEF10都与OsRopGEF5和OsRopGEF10有共线性,SlRopGEF2和SlRopGEF4都与OsRopGEF7(即OsRacGEF1)有共线性,进一步提高了SlRopGEF2和SlRopGEF4在番茄中发挥抗病功能的可能性。相较于拟南芥,水稻中SlRopGEF的直系同源基因数目较少,表明番茄中该基因家族与拟南芥亲缘关系更近。番茄SlRopGEF6、SlRopGEF7和SlRopGEF13与拟南芥和水稻基因组GEF基因家族中成员均无共线性关系,这可能是由于进化过程中这些基因发生变异从而获得了新的特异性功能。
2.4 番茄GEF家族基因在不同组织中的表达分析
为了深入了解GEF基因在番茄生长和发育过程中的表达模式,本研究利用番茄功能基因组数据库中Heinz番茄品种的转录组数据对其转录水平进行了分析,结果表明SlRopGEF具有不同的表达谱。由图7可知,SlRopGEF13在所有组织中的转录水平都是最高的,SlRopGEF7的整体表达水平较低;SlRopGEF1和SlRopGEF7在根部组织中表达较多,暗示这2个基因可能参与调控根部某些细胞通路,例如根毛发育、响应土壤环境胁迫等;SlRopGEF3、SlRopGEF4、SlRopGEF5、SlRopGEF6、SlRopGEF8、SlRopGEF11和SlRopGEF12在花器官中显著表达,它们极有可能在花器官生长、发育或其他信号通路中发挥着重要的作用;SlRopGEF2、SlRopGEF9、SlRopGEF10和SlRopGEF13则倾向于在果实中表达,表明这些基因有调控果实成熟、颜色、形状、大小或其他果实发育指标的可能。
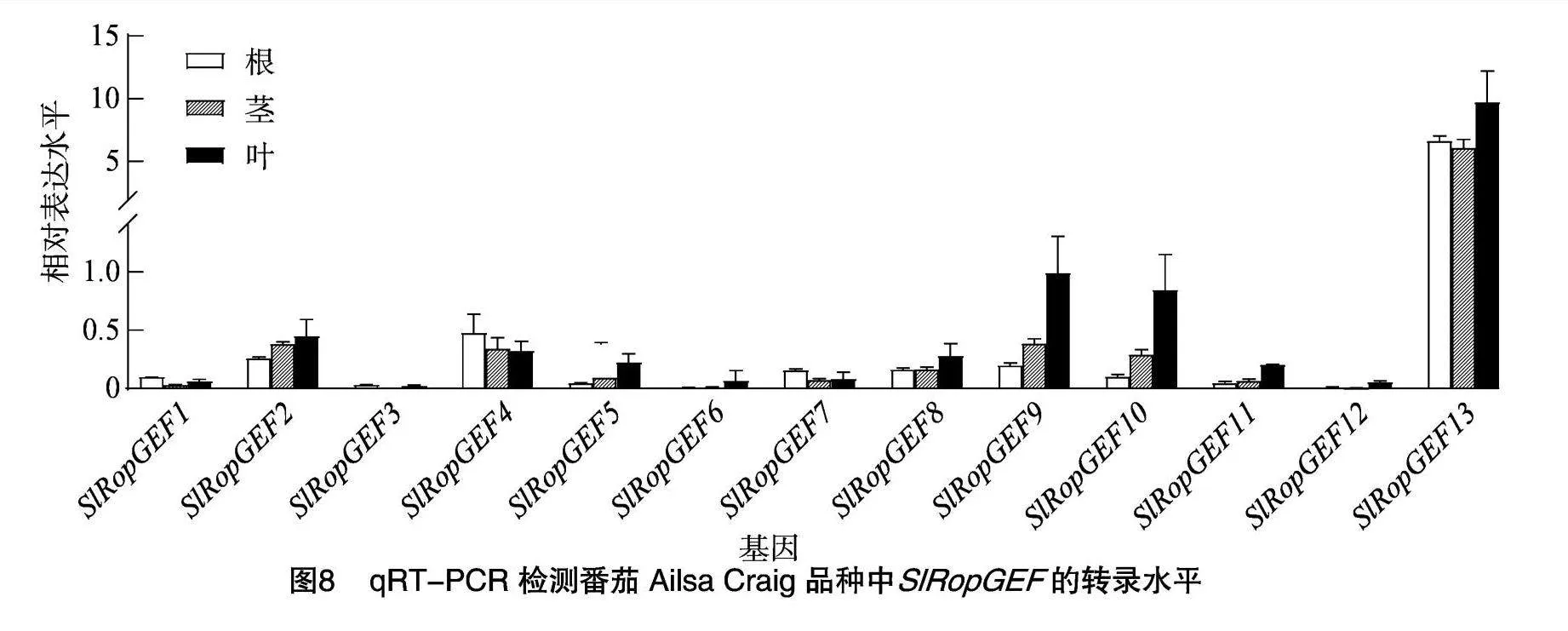
由于本研究重点关注GEF家族基因响应青枯菌入侵胁迫的情况,而根—茎—叶是青枯菌从土壤向番茄入侵的途径,因此接下来利用qRT-PCR方法对番茄Ailsa Craig品种幼苗的根、茎、叶组织中的SlRopGEF基因表达水平进行检测。试验结果(图8)与转录组数据基本一致。
2.5 番茄GEF家族基因受青枯菌诱导表达分析
为了初步探究番茄GEF家族基因在抗青枯病过程中的作用,利用转录组数据分别对青枯菌侵染处理(0、3、5 d)后番茄抗病和感病品种中SlRopGEF在根、茎部组织中的表达水平进行分析。结果(图9)显示,青枯菌处理后5 d,SlRopGEF1、SlRopGEF4、SlRopGEF7、SlRopGEF9、SlRopGEF10、SlRopGEF11和SlRopGEF13的表达水平在感病或抗病品种的根或茎中受到显著下调;而抗病品种根部SlRopGEF6和SlRopGEF8的表达水平在青枯菌侵染3 d时受到显著上调; SlRopGEF2、 SlRopGEF3和SlRopGEF5的转录水平并不受青枯菌胁迫的影响;SlRopGEF12由于转录水平过低,在各品种组织中都未被检测到。综上而言,除SlRopGEF2、SlRopGEF3、SlRopGEF5和SlRopGEF12外,其余SlRopGEF均有可能在调控番茄青枯病抗性中发挥一定的作用。
3 讨论与结论
迄今为止,GEF家族基因已在多个物种中被鉴定出来,其中水稻中有11个、拟南芥中有14个、蓝莓中有32个,但尚无番茄中GEF家族基因的相关报道[9,14]。本研究基于番茄基因组数据库共鉴定到13个GEF基因,分布在9条染色体上,并将其命名为SlRopGEF1~SlRopGEF13。理化性质分析结果显示,SlRopGEF蛋白的等电点介于5.20~8.36之间,其中酸性蛋白占85%左右,说明大部分SlRopGEF可能会定位于酸性细胞环境中。番茄、水稻和拟南芥3个物种中GEF基因家族的进化关系分析结果揭示番茄GEF家族基因可分为3个聚类组,这与蓝莓中报道的研究结果[14]相同。值得注意的是,SlRopGEF1、SlRopGEF2、SlRopGEF4、SlRopGEF7、SlRopGEF9、SlRopGEF10与水稻中OsRopGEF7(也叫OsRacGEF1)处于同一分组中,而OsRacGEF1是正调控稻瘟病抗性的关键因子,推测番茄中同组GEF基因可能也具有响应病原菌入侵的相似功能[20]。保守结构域组成与进化关系分析结果基本一致,即具有相似保守基序的SlRopGEF聚类在同一分组中。组织特异性表达和青枯菌诱导表达分析结果显示,SlRopGEF1和SlRopGEF7倾向于在番茄根部表达且其表达水平受青枯菌侵染抑制,暗示这2个基因很有可能在番茄根部中参与响应青枯菌
入侵的免疫信号途径。
根据报道可知,GEF蛋白最典型的功能是在受到上游信号分子刺激后调控小G蛋白的活性:几乎所有的GEF蛋白都是通过与小G蛋白互作以占据小G蛋白上的镁离子和磷酸基结合位点以促进GDP的解离,催化小G蛋白从与GDP结合的非活性状态转变成与GTP结合的活性状态[23]。被激活的小G蛋白通过与不同的下游蛋白互作,从而调控不同的胞内信号通路。比如,水稻OsRacGEF1与小G蛋白OsRac1互作并将其激活,被激活的OsRac1与包括支架蛋白OsRACK1A、OsMPK3/6、NADPH氧化酶、木质素生物合成酶OsCCR1等15个组分互作,调控ROS产生及抗病相关基因的表达以实现对病原菌入侵的防御[24-27]。笔者所在课题组前期发现番茄中的小G蛋白SlRop3和SlRop4可能正调控番茄青枯病抗性,但是调控其活性的上游GEF蛋白尚未见相关报道[21]。本研究鉴定出了2个可能响应青枯病胁迫的GEF蛋白——SlRopGEF1和SlRopGEF7,这为进一步探究番茄GEF-ROP模块参与抗青枯病过程的分子机制提供了一定的研究方向和理论基础。
参考文献:
[1]Li N,Wu X T,Zhuang W,et al. Tomato and lycopene and multiple health outcomes:umbrella review[J]. Food Chemistry,2021,343:128396.
[2]李君明,项朝阳,王孝宣,等. “十三五”我国番茄产业现状及展望[J].中国蔬菜,2021(2):13-20.
[3]姚文武,张晓丽,秦双林,等. 番茄青枯病发生机制及主要防治技术研究进展[J]. 长江蔬菜,2022(20):30-34.
[4]Cherfils J,Zeghouf M. Regulation of small GTPases by GEFs,GAPs,and GDIs[J]. Physiological Reviews,2013,93(1):269-309.
[5]Feiguelman G,Fu Y,Yalovsky S. ROP GTPases structure-function and signaling pathways[J]. Plant Physiology,2018,176(1):57-79.
[6]Bos J L,Rehmann H,Wittinghofer A. GEFs and GAPs:critical elements in the control of small G proteins[J]. Cell,2007,129(5):865-877.
[7]Berken A,Wittinghofer A. Structure and function of Rho-type molecular switches in plants[J]. Plant Physiology and Biochemistry,2008,46(3):380-393.
[8]Berken A,Thomas C,Wittinghofer A. A new family of RhoGEFs activates the Rop molecular switch in plants[J]. Nature,2005,436(7054):1176-1180.
[9]Gu Y,Li S D,Lord E M,et al. Members of a novel class of Arabidopsis rho guanine nucleotide exchange factors control rho GTPase-dependent polar growth[J]. The Plant Cell,2006,18(2):366-381.
[10]Zhang Y,McCormick S. A distinct mechanism regulating a pollen-specific guanine nucleotide exchange factor for the small GTPase Rop in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(47):18830-18835.
[11]Li Z X,Liu D. ROPGEF1 and ROPGEF4 are functional regulators of ROP11 GTPase in ABA-mediated stomatal closure in Arabidopsis[J]. FEBS Letters,2012,586(9):1253-1258.
[12]Chen M,Liu H L,Kong J X,et al. RopGEF7 regulates PLETHORA-dependent maintenance of the root stem cell niche in Arabidopsis[J]. The Plant Cell,2011,23(8):2880-2894.
[13]Huang J Q,Liu H L,Berberich T,et al. Guanine Nucleotide Exchange Factor 7B (RopGEF7B) is involved in floral organ development in Oryza sativa[J]. Rice,2018,11(1):42.
[14]尹亚红,马 芮,李 可,等. 蓝莓GEF家族基因鉴定与功能分析[J]. 植物生理学报,2023,59(3):515-526.
[15]Chang F,Gu Y,Ma H,et al. AtPRK2 promotes ROP1 activation via RopGEFs in the control of polarized pollen tube growth[J]. Molecular Plant,2013,6(4):1187-1201.
[16]Yu Y X,Song J L,Tian X H,et al. Arabidopsis PRK6 interacts specifically with AtRopGEF8/12 and induces depolarized growth of pollen tubes when overexpressed[J]. Science China(Life Sciences),2018,61(1):100-112.
[17]Duan Q H,Kita D,Li C,et al. FERONIA receptor-like kinase regulates RHO GTPase signaling of root hair development[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(41):17821-17826.
[18]Kessler S A,Shimosato-Asano H,Keinath N F,et al. Conserved molecular components for pollen tube reception and fungal invasion[J]. Science,2010,330(6006):968-971.
[19]Nibau C,Cheung A Y. New insights into the functional roles of CrRLKs in the control of plant cell growth and development[J]. Plant Signaling amp; Behavior,2011,6(5):655-659.
[20]Akamatsu A,Wong H L,Fujiwara M,et al. An OsCEBiP/OsCERK1-OsRacGEF1-OsRac1 module is an essential early component of chitin-induced rice immunity[J]. Cell Host amp; Microbe,2013,13(4):465-476.
[21]Wang Q,Zhang D,Liu C C,et al. Comprehensive analysis of subcellular localization,immune function and role in bacterial wilt disease resistance of Solanum lycopersicum Linn. ROP family small GTPases[J]. International Journal of Molecular Sciences,2022,23(17):9727.
[22]Kim E J,Park S W,Hong W J,et al. Genome-wide analysis of RopGEF gene family to identify genes contributing to pollen tube growth in rice (Oryza sativa)[J]. BMC Plant Biology,2020,20(1):95.
[23]Thomas C,Fricke I,Scrima A,et al. Structural evidence for a common intermediate in small G protein-GEF reactions[J]. Molecular Cell,2007,25(1):141-149.
[24]Nakashima A,Chen L T,Thao N P,et al. RACK1 functions in rice innate immunity by interacting with the Rac1 immune complex[J]. The Plant Cell,2008,20(8):2265-2279.
[25]Kim S H,Oikawa T,Kyozuka J,et al. The bHLH rac Immunity1 (RAI1) is activated by OsRac1 via OsMAPK3 and OsMAPK6 in rice immunity[J]. Plant and Cell Physiology,2012,53(4):740-754.
[26]Wong H L,Pinontoan R,Hayashi K,et al. Regulation of rice NADPH oxidase by binding of rac GTPase to its N-terminal extension[J]. The Plant Cell,2007,19(12):4022-4034.
[27]Kawasaki T,Koita H,Nakatsubo T,et al. Cinnamoyl-CoA reductase,a key enzyme in lignin biosynthesis,is an effector of small GTPase Rac in defense signaling in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(1):230-235.
