TasHSP16.9参与茉莉酸信号传导介导的小麦白粉病抗性
2024-02-14李静婷杨玉霞魏泽昶李彦庆





摘要:小分子热激蛋白(sHSP)是一类结构保守且受逆境胁迫诱导合成的应激蛋白。笔者所在课题组前期发现TasHSP16.9受非生物胁迫诱导表达,为明确该基因对病原物的应答反应。本研究利用荧光定量RT-PCR分析小麦TasHSP16.9基因对茉莉酸甲酯(MeJA)和白粉菌的应答响应,利用病毒诱导的基因沉默(VIGS)技术分析白粉菌侵染后TasHSP16.9基因沉默对小麦白粉病抗性的影响。结果发现,MeJA和白粉菌均可诱导TasHSP16.9基因表达;TasHSP16.9基因沉默促进了白粉菌菌丝生长,表明TasHSP16.9基因可能参与了JA信号传导途径介导的小麦白粉病抗性防御。
关键词:小麦;sHSP16.9;茉莉酸;病毒诱导的基因沉默(VIGS);白粉病抗性
中图分类号:S435.121.4+6" 文献标志码:A
文章编号:1002-1302(2024)24-0030-04
收稿日期:2023-12-19
基金项目:国家自然科学基金(编号:32360484);河南省高等学校重点科研项目(编号:22B210008);兰州交通大学大学生创新创业训练计划项目(编号:CXXL20220035)。
作者简介:李静婷(1983—),女,内蒙古包头人,博士,副教授,主要从事小麦遗传育种学研究。E-mail:jingting_lee@163.com。
小麦是我国主要粮食作物,小麦产量和品质的提升关乎国民经济发展和人们生活质量。环境胁迫(高温及干热风、低温冷害及霜冻、干旱)和生物胁迫(赤霉病、条锈病、白粉病等病害)严重影响小麦的产量和品质。2023年全国小麦白粉病预计发生面积高达600万hm2(https://www.natesc.org.cn)。虽然,已在小麦及其近缘种属中近66个位点定位了100多个抗白粉病基因,但是大多数未进行深入的功能研究[1]。因此,解析小麦白粉病抗性遗传机制对于抗病育种具有重要意义。
病毒诱导基因沉默(VIGS)已经被广泛应用于各种模式植物和农作物基因功能研究中,这项技术在小麦抗条锈病、白粉病、纹枯病等抗病相关基因功能研究方面取得重要研究成果[2]。利用BSMV-VIGS技术沉默蛋白激酶基因TaPiPK1、TaPK3A来研究其功能,发现沉默TaPiPK1、TaPK3A基因降低了小麦对条锈菌、禾谷丝核菌的抗性,推测其参与小麦条锈病、纹枯病抗性防御[3-4]。随着测序技术的发展和基因克隆新技术新方法的不断涌现,抗病相关的候选基因挖掘会越来越多,候选基因功能验证将是未来研究重点,VIGS技术将会在禾本科植物的基因功能研究中发挥更大的作用。
小分子热激蛋白(sHSP)在正常条件下不表达或表达量很低,高温、盐胁迫、干旱等非生物胁迫均会诱导sHSP表达[5-7]。此外,sHSP也可被茉莉酸甲酯(MeJA)和水杨酸(SA)诱导表达,参与植物的抗病防御反应,如草莓HSP17.4介导水杨酸与茉莉酸互作调控草莓炭疽病抗性[8]。研究发现,茉莉酸(JA)可诱导小麦、水稻提高对赤霉病、白粉病、纹枯病的抗性,JA 是病原物诱导小麦防御基因表达的信号分子[9-11]。本研究发现,TasHSP16.9启动子含有MeJA响应元件(CGTCA-motif、TGACG-motif)和真菌诱导响应元件(Box-W1),推测TasHSP16.9参与了小麦抗病防御响应。本研究利用荧光定量RT-PCR分析小麦TasHSP16.9基因对MeJA和白粉菌的应答响应,利用VIGS技术分析白粉菌侵染后TasHSP16.9基因沉默对小麦白粉病抗性的影响。
1 材料与方法
1.1 试验材料
小麦品种复壮30(携带抗白粉病基因Pm5e)[12]由中国科学院遗传与发育生物学研究所刘志勇研究员惠赠。烟草采用本生烟品种。经过修饰的大麦条纹花叶病毒(BSMV)的VIGS系统、农杆菌菌株EHA105由中国农业大学生物学院李大伟教授惠赠。小麦白粉菌E09菌株由中国农业科学院作物科学研究所李洪杰研究员惠赠。试验中所需引物由北京赛百盛生物工程有限责任公司合成,Trizol试剂、TIANScript Ⅱ RT Kit等试剂盒从天根生化科技(北京)有限公司购得,MeJA购自Sigma公司。所有试验于2023年3—9月在兰州交通大学生物与制药工程学院实验室进行。
1.2 试验方法
1.2.1 白粉菌侵染生物胁迫
选取籽粒饱满的复壮30种子种植于盛有营养土的小钵中,置于光照培养箱中生长,光照16 h,温度22 ℃,黑暗8 h,温度18 ℃,相对湿度60%。待小麦长至2叶期时,利用白粉菌E09菌株接种2叶期小麦,并于接种后1、3、6、12、24 h时取样。同时,接种14 d后,按照0~4级标准调查植株的抗病性,以感白粉病小麦品种农大015为感病对照[13]。
1.2.2 茉莉酸甲酯处理
利用1.0 mmol/L的MeJA溶液(用含0.2%Tween的蒸馏水配成浓度10 mmol/L的溶液)喷洒于2叶期小麦复壮30第1张叶,并在MeJA处理后0、1、3、6、12、24 h时取第1张叶。
1.2.3 TasHSP16.9基因表达谱分析
利用Trizol试剂法提取小麦叶片的总RNA并反转录合成cDNA第一链作为模版,利用荧光定量RT-PCR检测TasHSP16.9基因表达,并进行3次生物学重复。反应程序:95 ℃ 5 min;95 ℃ 10 s,56 ℃ 10 s,72 ℃ 20 s,38个循环。参见李静婷等的方法[14]进行数据处理和分析。
1.2.4 VIGS侵染烟草和小麦
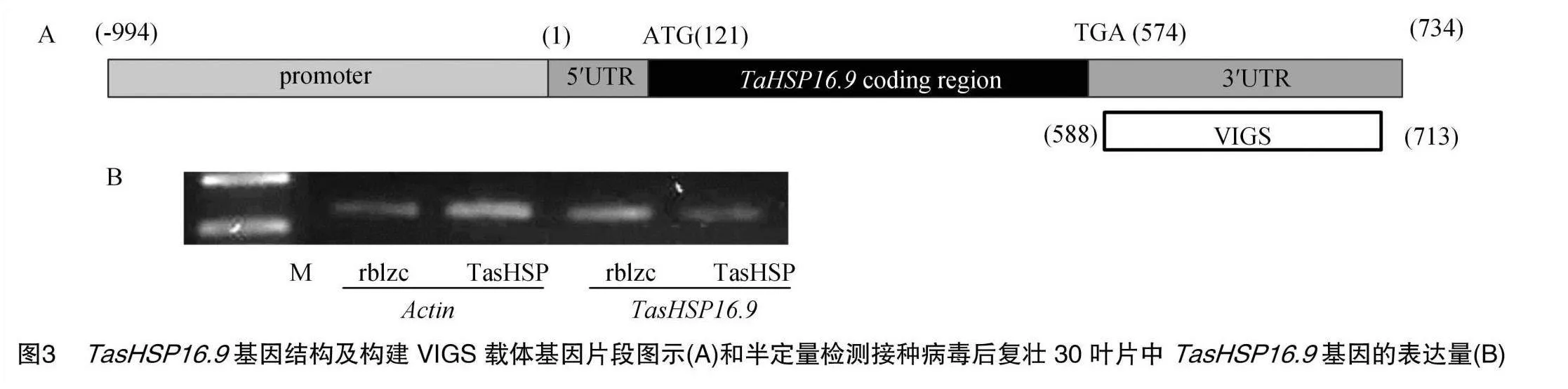
利用PCR扩增克隆TasHSP16.9基因的3′UTR区域特异性片段插入到大麦条纹花叶病毒(BSMV)的γ亚基γb序列后构建重组病毒沉默载体BMSV:TasHSP。用BSMV:α、BSMV:β、BMSV:rblzc(空载体为对照)、BMSV:PDS、BMSV:TasHSP分别接种含有Kan、Rif 的LB液体培养基(50 mmol/L MES、0.1 mmol/L 乙酰丁香酮),28 ℃培养至吸光度D600 nm为0.5~1.0。将BSMV:α、BSMV:β分别与BMSV:rblzc、BMSV:PDS(沉默小麦内源八氢番茄红素脱氢酶基因Pds,作为VIGS体系的指示基因)、BMSV: TasHSP等体积混合,离心后将沉淀重悬于50 mL侵染缓冲液(10 mmol/L MgCl2、10 mmol/L MES、10 mmol/L 乙酰丁香酮)。然后分别接种6株长势一致的烟草,用注射器将侵染液注射于幼嫩叶片繁殖病毒,7 d后取有病毒表型的烟草叶片,研磨成汁液,涂擦于生长8 d的2叶期小麦复壮30的叶片表面,10 d后观察第3张叶的病毒感染表型,以转染BMSV:PDS病毒的小麦第3张叶叶基部白化作为病毒沉默系统转染效率的指示。
1.2.5 内源基因沉默检测
取转染空病毒BMSV:rblzc和BMSV: TasHSP的小麦复壮30且出现黄化病状的叶片,进而提取RNA并反转录合成cDNA第一链。利用半定量RT-PCR法检测内源TasHSP16.9基因表达(表1),检测内源基因是否沉默。
1.2.6 离体观察
取转染空病毒BMSV:rblzc和BMSV: TasHSP的小麦复壮30出现黄化病状的叶片叶尖和叶中部,置于0.8%琼脂培养基(加保绿剂苯胼咪唑0.6%),接白粉菌后3 d开始显微镜(40×)观察离体叶片白粉菌菌丝生长情况。利用脱色剂(75%乙醇、25%三氯甲烷和0.3%三氯乙酸)65 ℃处理过夜,再利用染色液(0.6%考马斯亮蓝与015%三氯乙酸等体积混合)染色5~10 min,置于保存液(75%水、20%甘油和5%乙酸)中备用。
2 结果与分析
2.1 MeJA与白粉菌侵染后复壮30中TasHSP16.9基因的表达模式
本研究前期已克隆了TasHSP16.9基因,对其启动子进行顺式作用调控元件分析发现,TasHSP16.9启动子含有MeJA响应元件(CGTCA-motif、TGACG-motif)和真菌诱导响应元件(Box-W1)(表2),推测TasHSP16.9参与了植物抗病防御响应。为明确TasHSP16.9对白粉菌诱导的应答反应,采用荧光定量 RT-PCR方法分析MeJA处理及白粉菌E09侵染后复壮30幼苗中TasHSP16.9的表达。
利用白粉菌E09菌株苗期接种复壮30、农大015鉴定其白粉病抗性水平,发现复壮30表现为高抗或免疫,叶尖表现为过敏性坏死(IT=0),农大015表现高感(IT=4)(图1)。
由图2可知,MeJA处理后1~6 h TasHSP16.9表达量逐渐升高,6 h时表达量达到最高,随着时间的延长,外源MeJA在叶片内的浓度逐渐下降,该基因表达水平也逐渐下降。白粉菌接种后1~6 h TasHSP16.9表达量很低,没有明显变化,12 h时表达量达到最高。表明MeJA和白粉菌均可以诱导TasHSP16.9的表达。推测TasHSP16.9是茉莉酸(JA)信号途径下游的防御基因,外源喷施MeJA激活其表达。而JA是小麦抗白粉病的信号分子,白粉菌侵染小麦后诱导内源JA水平升高,激活下游TasHSP16.9表达。所以该基因对白粉菌的响应较外源MeJA缓慢。进而推测TasHSP16.9参与了JA信号传导途径介导的小麦白粉病抗性防御。
2.2 内源基因沉默效果
由于小麦复壮30对白粉菌E09表现高抗或免疫,所以选取小麦复壮30为试验材料进行病毒侵染。克隆TasHSP16.9基因的3′UTR区域特异性片段插入到大麦条纹花叶病毒(BSMV)的γ亚基γb序列后构建重组病毒沉默载体BMSV:TasHSP(图 3-A)。病毒接种10 d后,取有病毒表型的小麦叶片对内源基因相对表达量进行半定量分析。与空载体BMSV:rblzc相比,BMSV:TasHSP转染的小麦叶片TasHSP16.9基因表达量下调,表明接种病毒后,复壮30叶片中TasHSP16.9基因被瞬时沉默(图3-B)。
2.3 接种病毒后复壮30对白粉病菌的抗性
小麦复壮30接种病毒10 d后,取有病毒表型的小麦叶片接种白粉菌E09进行离体观察。结果显示,在白粉菌E09侵染后7 d,转染病毒BMSV:TasHSP较空病毒BMSV:rblzc叶片中菌丝形成更大更密集的网状,表明沉默TasHSP16.9基因促进了白粉菌菌丝生长(图4)。TasHSP16.9可能参与了小麦白粉病抗性防御。
3 讨论与结论
橡树HbHSP90.8-1基因受白粉菌、外源MeJA和SA的诱导表达,表明其参与了橡树白粉病抗病防御及抗病相关激素信号转导途径[15]。Hsp90是一类受腺嘌呤核苷三磷酸(ATP)调节的同源二聚体热激蛋白。热激蛋白是一类可被环境胁迫诱导并参与植物生长发育和逆境响应过程的蛋白家族,其中含量最丰富的是小分子热激蛋白sHSP。
很多研究表明,非生物胁迫可诱导sHSP的产生,本研究前期结果表明,TasHSP16.9受高温、低温、干旱和高盐等非生物胁迫诱导表达,表明TasHSP16.9基因可能在小麦抵抗非生物胁迫方面发挥重要作用[5-7,14]。而且TasHSP16.9启动子含有MeJA响应元件(CGTCA-motif、TGACG-motif)和真菌诱导响应元件(Box-W1),所以TasHSP16.9也可能参与了植物抗病防御反应。本研究发现外源MeJA和白粉菌E09均可诱导TasHSP16.9基因表达。已有研究表明,MeJA可诱导提高小麦对白粉病的抗性,JA是诱导小麦抗白粉病的信号分子,所以推测TasHSP16.9参与了JA信号传导途径介导的小麦白粉病抗性防御[11]。
VIGS是一种转录后基因沉默技术,具有快速、简单和高效的特点,而小麦品种复壮30对我国流行的白粉病生理小种表现为高抗或免疫,所以本研究以复壮30为材料利用VIGS技术分析白粉菌侵染后TasHSP16.9基因沉默对小麦白粉病抗性的影响[12]。利用VIGS技术介导TasHSP16.9沉默促进了白粉菌菌丝生长,表明TasHSP16.9可能参与了小麦抗白粉病防御。后续将通过转录组分析及利用酵母双杂交筛选TasHSP16.9的互作蛋白,以明确该基因在小麦抗病信号通路中的调控功能,为小麦抗病育种提供理论参考。
参考文献:
[1]Zou S H,Xu Y,Li Q Q,et al. Wheat powdery mildew resistance:from gene identification to immunity deployment[J]. Frontiers in Plant Science,2023,14:1269498.
[2]李 姣,于宗霞,冯宝民. 植物中病毒诱导基因沉默技术的研究与应用进展[J]. 分子植物育种,2019,17(5): 1537-1542.
[3]冯柃杰,张玲玉,王晓东,等. 蛋白激酶TaPiPK1在小麦抗条锈病反应中的功能分析[J]. 植物保护,2023,49(3):32-38,84.
[4]苏 强,荣 玮,张增艳.小麦类受体蛋白激酶基因TaPK3A的克隆与抗纹枯病功能初步分析[J]. 作物学报,2019,45(8):1158-1165.
[5]王世威,屈仁军,彭佳铭,等. 丹参小分子热激蛋白SmHSP21.8基因克隆、诱导模式和原核表达[J]. 药学学报,2022,57(6):1909-1917.
[6]奚玉培,张志忠,王景荣,等. 马铃薯HSP17.7基因的克隆及其对高温逆境的响应[J]. 西北植物学报,2019,39(11): 1952-1960.
[7]Waters E R,Vierling E. Plant small heat shock proteins-evolutionary and functional diversity[J]. The New Phytologist,2020,227(1):24-37.
[8]Fang X P,Chai W G,Li S G,et al. HSP17.4 mediates salicylic acid and jasmonic acid pathways in the regulation of resistance to Colletotrichum gloeosporioides in strawberry[J]. Molecular Plant Pathology,2021,22(7):817-828.
[9]牛 皓,姜玉梅,牛吉山. 小麦抗赤霉病遗传育种研究进展[J]. 农业生物技术学报,2020,28(3):530-542.
[10]黄俊宝,陈立才,曹中盛,等. 茉莉酸甲酯对水稻纹枯病的诱导抗性及防御酶活性影响的研究[J]. 江西农业学报,2023,35(8):82-87.
[11]牛吉山,倪永静,刘 靖,等. 茉莉酸甲酯对小麦白粉病抗性的诱导作用[J]. 中国农学通报,2010,26(4):254-257.
[12]Xie J Z,Guo G H,Wang Y,et al. A rare single nucleotide variant in Pm5e confers powdery mildew resistance in common wheat[J]. The New Phytologist,2020,228(3):1011-1026.
[13]Liu Z,Sun Q,Ni Z,et al. Development of SCAR markers linked to the Pm21 gene conferring resistance to powdery mildew in common wheat[J]. Plant Breeding,1999,118(3):215-219.
[14]李静婷,刘子记,赵旭耀,等. 小麦小分子热激蛋白 TasHSP16.9基因在逆境应答中的表达分析[J]. 江苏农业科学,2016,44(7):39-41.
[15]Liu M Y,Xiao H Y,Wang L F,et al. Cloning and functional analysis of heat shock protein HbHSP90.8-1 from Hevea brasiliensis Müll.arg[J]. Bulletin of Botanical Research,2022,42(5): 811-820.
