配位交联的DOX纳米颗粒的制备与质量评价
2024-02-13李西建营双亦李飘史菁颖刘宁何玉静
*李西建 营双亦 李飘 史菁颖 刘宁 何玉静,2*
(1.山东第一医科大学(山东省医学科学院)药学院 山东 250117 2.先进药物递释系统全国重点实验室 山东 250117)
引言
肿瘤是当前威胁人类健康的主要疾病之一,其临床治疗面临着许多困难[1-3]。目前肿瘤治疗的常规疗法是化疗,但会引起严重的副作用,并且许多药物在肿瘤治疗中只起一定作用,在单独使用时往往疗效较差。本文所设计的纳米药物递送系统有许多独特优势,包括高载药量、增加难溶性药物溶解度、提高肿瘤靶向性等,使化疗药物发挥更好的抗肿瘤效果[4-6]。
阿霉素(doxorubicin,DOX)是一种蒽环类化疗药物,广泛应用于实体肿瘤的治疗,该药物进入细胞核与DNA嵌合,导致癌细胞凋亡[7]。单宁酸(tannic acid,TA)具有良好的生物相容性、高载药性能且副作用很低[8]。DOX能与三价铁离子如FeCl3形成配合物降低DOX的心脏毒性[9]。同时,FeCl3也可与TA配位,其配合物可在肿瘤部位实现药物的pH响应性释放,从而降低毒副作用。因此,我们利用小分子材料TA、FeCl3和DOX配位自组装制备简便、绿色、高效的纳米颗粒。
1.试验部分
(1)试验试剂
盐酸阿霉素(分析纯,AR),购于上海阿拉丁生化科技有限公司;单宁酸(分析纯,AR),购于上海阿拉丁生化科技有限公司;六水合三氯化铁(分析纯,AR),购于国药集团化学试剂有限公司;4T1细胞,购于中科院上海细胞库。
(2)试验仪器
UV-8000紫外可见分光光度计,上海元析仪器有限公司;BT25S型电子天平,赛多利斯科学仪器有限公司;UPT-1-10T实验室超纯水机,上海杲森仪器设备有限公司;KQ-100DE数控超声波清洗机,昆山市超声仪器有限公司;BCD-239WTGM美的冰箱,合肥美的冰箱有限公司;SW-CJ-IF双人双面超净台,AIRTECH;5804R离心机,Eppendorf;Nano-S90粒度分析仪,英国马尔文仪器有限公司;Reference移液枪,Eppendorf;EP管,上海沪试实验室器材股份有限公司;一次性无菌注射器,常州悦康医疗仪器有限公司;0.22μm孔径滤膜,津隆公司;细胞培养板,Theremo Fisher Scient。
(3)纳米颗粒的制备
称取DOX 6.82mg、TA 19.28mg、FeCl343.51mg,分别置于50mL的EP管中,依次加入1.1759mL和1.1333mL、16.0970mL去离子水配制成10mM的母液。另取EP管加入3mL去离子水,置于水浴锅中加热至42℃,在超声处理条件下缓慢依次加入TA、FeCl3、DOX母液各60μL,该过程应边加母液边振摇,最终得到TA-Fe-DOX纳米颗粒。
(4)阿霉素标准曲线的建立
精密称取9.58mg DOX于10mL EP管中,加1.652mL蒸馏水配制成10mM的溶液,取1.6mL母液再加158.4mL蒸馏水配制成100μM的溶液,从100μM的溶液中分别精密量取7.5mL、10mL、15mL、20mL、25mL、30mL置于50mL容量瓶中,定容至刻度线,摇匀,得到浓度为15μM、20μM、30μM、40μM、50μM、60μM的标准溶液,在480nm波长处分别测定吸光度,以浓度c为横坐标,吸光度A为纵坐标,将浓度c与吸光度A作线性回归,得线性回归方程:y=0.0119x+0.0216,R2=0.9999。
(5)处方筛选
①处方筛选一
本轮筛选以3种母液加入顺序为筛选对象,制成纳米颗粒的丁达尔现象为标准进行筛选,母液加入顺序如图1所示。
用激光笔照射EP管,观察丁达尔效应,丁达尔效应最明显的加入顺序为单宁酸、三氯化铁、阿霉素,因此选择该顺序制备纳米颗粒。
②处方筛选二
本轮筛选变量是纳米颗粒中DOX的含量,以制备得纳米颗粒的稳定性及DOX的包封率为筛选标准进行筛选。纳米颗粒中三种药物TA、FeCl3、DOX的摩尔比例分别为①1:1:1②1:1:2③1:1:3④1:1:4⑤1:1:5⑥1:1:6⑦1:1:7⑧1:1:8。
本轮筛选率先进行稳定性实验。将制备的各组纳米颗粒进行为期一周的粒径检测,以粒径为稳定性标准进行筛选。结果显示①②③组稳定性极差,故不进行后续包封率检测,④⑤⑥⑦⑧组进行包封率检测。
包封率检测中,以间接测量法测定包封率,即纳米颗粒中DOX投药总量减去游离DOX量。各组DOX投药总量的检测步骤:④⑤组各取400μL于EP管中,并加入800μL的1mol/L盐酸破坏纳米颗粒,15min后再加水至3mL,得检测液;⑥⑦⑧组重复上述步骤,但加水分别至3.2mL、3.4mL、4mL,得到检测液。将检测液在480nm波长下用紫外可见分光光度计测定吸光度。
各组游离DOX检测步骤:各组分别取2.5mL原溶液于超滤管中,在转速4000rpm条件下离心14min,得到含有游离DOX的下滤液,④⑤⑥组下滤液各加入1mol/L盐酸2.4mL,再分别加水至3mL、3mL、6mL;⑦组下滤液加入800μL盐酸,再加水至6mL;⑧组下滤液加入2mL盐酸,再加水至6mL。将各组检测液在波长480nm下用紫外可见分光光度计测定其吸光度。
计算原溶液DOX含量和下滤液DOX量,计算包封率。包封率公式(1)所示。
式中,W总表示纳米颗粒投入总药量;W游表示下滤液中DOX的量,即未装载的DOX量。
分析稳定性实验与包封率检测的结果可得最优处方是TA:FeCl3:DOX=1:1:5,如图2所示。
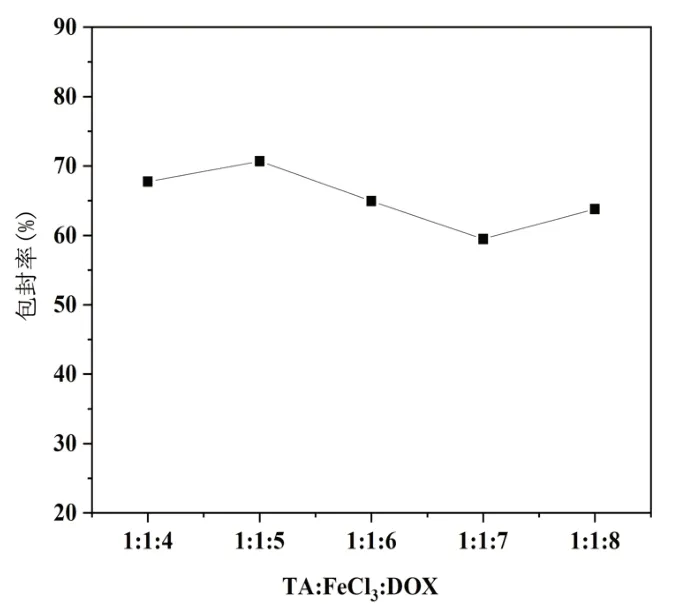
图2 不同比例的TA-Fe-DOX所得纳米颗粒的包封率
(6)纳米颗粒表征
将经过处方筛选制备的TA-Fe载体和最优处方TA-Fe-DOX纳米颗粒进行粒径检测得到粒径分布图,并对TA-Fe-DOX纳米颗粒进行电镜检测,观察电镜图。根据此方案制备出的纳米颗粒粒径分布如图3所示,空白载体的粒径为135nm,TA-Fe-DOX纳米颗粒的粒径为190nm。
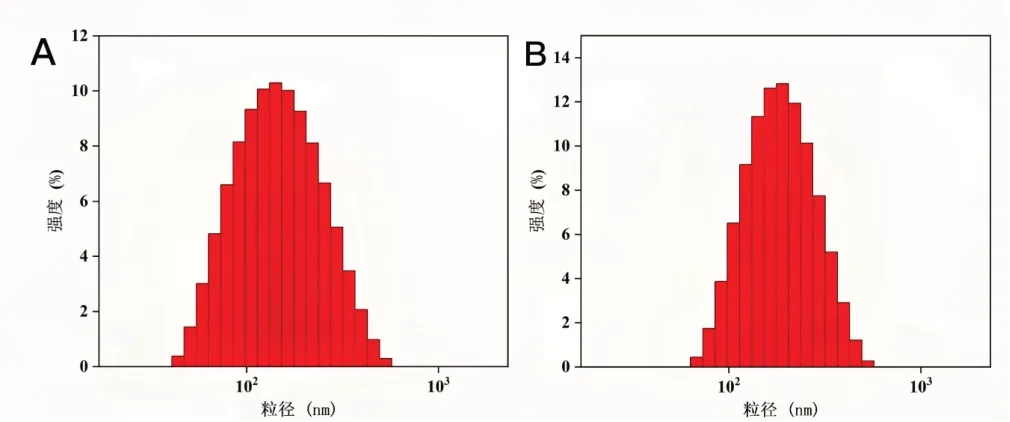
图3 (A)TA-Fe空白载体与(B)TA-Fe-DOX纳米颗粒的粒径分布图
电镜图4所示,制备的纳米颗粒粒径均匀,电镜下呈类球形,表面光滑,直径在50nm以内。

图4 TA-Fe-DOX纳米颗粒的形貌图
(7)稳定性实验
最优处方制得的纳米颗粒在一天和一周的粒径及PDI变化作为考察其稳定性的依据。一天中粒径和PDI检测时间:0h、0.5h、2h、4h、8h、24h。一周中检测时间:1d、2d、3d、4d、5d、6d、7d。制备的纳米颗粒在一天和一周的粒径及PDI变化结果,如图5所示。
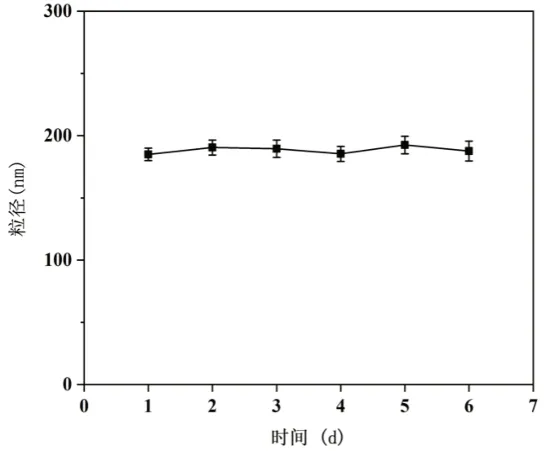
图5 TA-Fe-DOX纳米颗粒在一周的粒径变化
由上述结果可知,以1:1:5比例制备所得的TA-Fe-DOX纳米颗粒粒径在一周内稳定性良好。
(8)体外释放实验
取2mL最优处方制得的纳米颗粒于透析袋中,放入以pH为4.5、5.0和7.4的80mL的PBS磷酸盐缓冲溶液为体外释放介质的100mL磨砂口带塞锥形瓶中,在37℃恒温空气浴振荡器中进行24h体外释放实验,0.5h、1h、2h、4h、6h、8h、12h、24h时在锥形瓶中取样3mL并及时补充3mL新制对应pH的PBS磷酸盐水溶液使其体积保持80mL。取得的样品液在480nm波长下用紫外可见分光光度计定量检测药物释放量,绘制DOX的累积释放曲线。体外释放结果如图6所示。
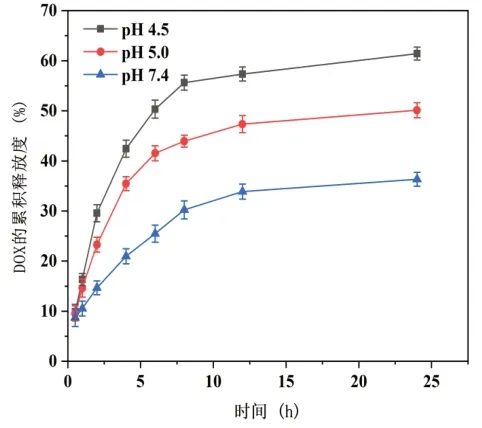
图6 纳米颗粒在不同释放介质中的释放曲线
由图6可见,在药物释放初期,纳米颗粒药物释放速率较大;但在8h之后,药物释放速率逐渐降低。在不同的释放介质中,通过对最终累计pH释放率的比较,可见TA-Fe-DOX纳米颗粒在pH=4.5的磷酸盐缓冲溶液PBS释放介质环境下释放的药物最多,在pH为7.4的介质中释放率最低。pH为4.5释放介质中的释放量一直高于pH为7.4和pH为5.0介质中的纳米颗粒释放量,所以纳米颗粒在肿瘤细胞的酸性环境内释放速率快,而在体循环中释放速率较慢,因此可降低对正常组织的毒性。
(9)TA-Fe-DOX纳米颗粒对4T1细胞的毒性作用
①纳米颗粒的制备。精密称取25g DOX于EP管中,加入25mL去离子水,得浓度为1.724mM的DOX溶液。再精密称取TA 14.63mg和FeCl32.3245mg,分别将TA和FeCl3用12.5mL去离子水溶解,将两者按TA、FeCl3的顺序在43℃超声波条件下进行混合,得到1.725mM的TAFeCl3混合液。再称取DOX 25mg,TA 14.63mg,FeCl32.3245mg,分别用833μL的去离子水溶解,在43℃超声波条件下按TA、FeCl3、DOX顺序进行混合,得浓度为1.724mM的纳米颗粒制剂组。
②细胞给药。细胞给药时分为三大组,即游离DOX组、TA-FeCl3混合液组、TA-Fe-DOX纳米颗粒制剂组,并根据含量在三组之内分出不同浓度,即浓度为4.31μM、8.62μM、12.93μM、17.24μM、21.55μM的稀释液。
给药时将培养好的细胞板拿出,用注射器吸干培养液后,按预定浓度顺序在每个孔中依次加入稀释液100μL,并在每个细胞板上设置空白对照组。将细胞继续培养48h。
③细胞毒性检测。采用MTT法检测4T1细胞中TAFe、游离DOX和纳米颗粒TA-Fe-DOX的体外毒性作用。以TA-Fe为阴性对照组、游离DOX为阳性对照组来评价TA-Fe-DOX纳米颗粒的抗肿瘤活性。
显色实验时,首先使用pH7.4的磷酸盐缓冲液将MTT溶解成5mg/mL的溶液。将给药的96孔板从二氧化碳培养箱中取出后,每孔加入20μL MTT溶液。加好后再将96孔板放回二氧化碳培养箱,等待4h。4h后取出,用一次性注射器将染色液吸出,加入150μL的二甲基亚砜,再放回二氧化碳培养箱,等待15min。15min后,用酶标仪在490nm波长下进行测定,得出吸光度,由式(2)算出细胞存活率。
式中,OD实验组代表实验组吸光度;OD对照组代表对照组吸光度。
由图7可得,在浓度范围4.31~21.55μM内,空白载体组的细胞存活率均在90%以上,高达98%,说明空白载体TA-Fe在浓度低于21.55μM时,对4T1肿瘤细胞是几乎没有毒性作用的。
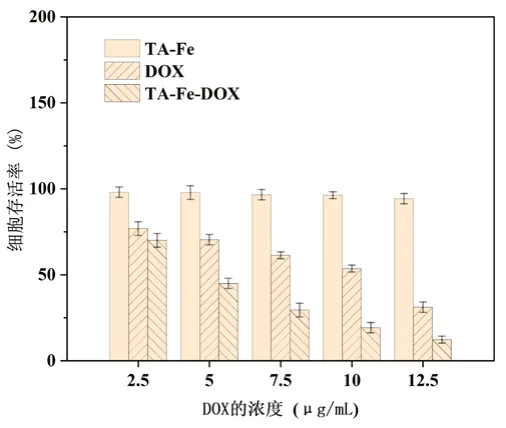
图7 不同浓度TA-Fe-DOX纳米颗粒的的细胞存活率
由此可以得出TA-Fe-DOX纳米颗粒和游离DOX对肿瘤细胞都有较强的杀伤作用。当游离DOX组即阳性对照组和制剂组TA-Fe-DOX的浓度为4.31μM时,他们对肿瘤细胞的毒性作用差别不大,细胞存活率比较高。但是随着制剂组TA-Fe-DOX纳米颗粒的浓度变大,4T1肿瘤细胞的相对存活率大幅下降,而阳性DOX组的细胞存活率下降缓慢。TA-Fe-DOX纳米颗粒对肿瘤细胞的抑制率高达88%,表明TA-Fe-DOX纳米颗粒的毒性大于游离DOX,有良好的抗肿瘤作用。
2.结果与讨论
以TA-Fe为载体,通过配位自组装制备了DOX纳米颗粒。TA:FeCl3:DOX三者摩尔比1:1:5制备所得纳米颗粒稳定性较好,包封率相对较高。纳米颗粒呈类球形,表面光滑,颗粒大小均一,直径约为190nm。制得的纳米颗粒比游离DOX毒性作用好,有pH响应性释药的优势,随着给药浓度的增加,其对4T1肿瘤细胞的毒性作用明显强于游离DOX,且载体TA-Fe几乎没有毒性。
实验中以TA-Fe为载体制备DOX的纳米颗粒,DOX和Fe3+可以配位,Fe3+和TA可以配位,三者通过配位自组装形成纳米颗粒,制备简便且绿色,没有添加任何有机试剂。DOX对心脏、肾脏和肝脏有一定的毒性,而且能引起重度脱发。通过物理包裹可以实现DOX的肿瘤靶向,并在保留其抗肿瘤活性的同时降低对心脏的毒性。TA具有较高的药物装载能力,实现了药物的弱酸性pH响应释放。Fe用于纳米递送系统后,展现了良好的生物组织相容性,低毒副作用、稳定的化学结构等一系列重要优势。
3.结论
本实验通过简便且绿色的配位交联法制备了粒径均匀、表面光滑的TA-Fe-DOX纳米颗粒,经过处方筛选实验得到该纳米颗粒的最优配比为1:1:5,并以TA:FeCl3:DOX加入顺序制得的纳米颗粒稳定性最好,包封率最高,在一周内稳定性良好。经实验证明所制得的纳米颗粒无毒,在具有pH响应性释药性能的同时也增强了DOX的抗肿瘤活性,为肿瘤治疗提供新的思路和实际参考意义。
