HPLC-柱后衍生荧光法测定水产品中河豚毒素含量结果的不确定度评定
2024-02-13袁巧杰
*袁巧杰
(谱尼测试集团上海有限公司 上海 201613)
河豚毒素是自然界中所发现的毒性最大的神经毒素之一,高效液相色谱-柱后衍生荧光法灵敏度高,检测限可达50μg/kg[1]。
不确定度是科学评价检测结果的参数之一[2],日常检测中,除了给出测量值,还应同时给出不确定度。本实验采用液相色谱(HPLC),并依据GB 5009.206—2016第三法[1]对水产品中河豚毒素进行分析检测。参照CNAS-GL06:2006[2],JJF 1059—2012[3]《测量不确定度评定与表示》中的计算方式,计算水产品中河豚毒素测定过程中各分量的标准不确定度和扩展不确定度[4-5],并对各分量进行比较,以最大可能降低检测过程中的不确定度,保障检测结果的准确性。
1.材料与方法
(1)材料与试剂。鱼;河豚毒素标准溶液,浓度100μg/mL;甲醇;乙腈;甲酸;冰乙酸;乙酸铵;十二水合磷酸氢二钠;二水合磷酸二氢钠;氯化钠;氢氧化钠;庚烷磺酸钠;碳酸钠。
(2)仪器与设备。岛津LC-20AT高效液相色谱仪,配柱后衍生装置;密理博A10纯水机系统;固相萃取仪;色谱柱:Agilent SB C18(4.6×250mm,5μm);KQ500B超声波振荡器;循环水真空泵;氮吹仪;河豚毒素免疫亲和柱,柱规格3mL,最大柱容量1000ng。
(3)方法。参照GB 5009.206—2016第三法液相色谱-荧光检测法进行[1]:
①色谱条件。A.色谱柱:Agilent SB C18(4.6×250mm,5μm);B.流动相:乙腈-乙酸铵缓冲液(5+95,体积比);C.流速:1.0mL/min;D.激发波长:385nm;发射波长:505nm;E.柱温:40℃;F.进样量:40μL;G.柱后衍生溶液:氢氧化钠(4mol/L);流速:0.5mL/min;温度:110℃。
②标准溶液配制。A.河豚毒素标准储备液:准确移取1mL河豚毒素液标于10mL容量瓶中,用甲醇稀释至刻度,即得标准储备液,浓度为10μg/mL。B.河豚毒素标准工作液:以河豚毒素标准储备液为原液,用移液器移取适当体积至10mL容量瓶,用1%乙酸溶液定容,即得浓度为0.1μg/mL、0.2μg/mL、0.5μg/mL、1μg/mL、2μg/mL系列标准工作液。
③实验步骤。称取2g试样,加入乙酸-甲醇溶液提取,旋蒸浓缩,用2mL乙酸溶液复溶后,加入8mL PBS缓冲液稀释,氢氧化钠溶液调节pH至7~8,上免疫亲和柱净化,洗脱,氮吹干后用1%的乙酸溶液定容至1.00mL,过0.22μm的水相滤膜,上HPLC检测。
④定量方法。将河豚毒素标准系列工作液和检测试样溶液上液相色谱仪检测,测定其峰面积,以河豚毒素的浓度为横坐标,峰面积为纵坐标做标准曲线,以保留时间定性,峰面积定量,根据标准曲线可得试样中河豚毒素的浓度,并根据计算公式得到样品中河豚毒素的含量。
⑤试样中河豚毒素的含量式(1)计算:
式中,X—试样中河豚毒素的含量,μg/kg;C—试样待测液中河豚毒素的浓度,μg/L;C0—空白待测液中河豚毒素的浓度,μg/L;V—定容体积,mL;f—稀释倍数;m—试样的称样量,g。
2.结果与讨论
(1)不确定度来源分析
河豚毒素检测结果的不确定度主要来源于标准品的校准过程、样品称量、实验过程移取及定容体积、样品重复实验产生的误差、前处理过程中的回收率不同等[3,5]。
(2)不确定度分量
①校准过程产生不确定度Urel(cal)A.标准溶液配制过程产生的不确定度
a.标准品纯度的不确定度Urel(C1)。根据供应商目录所给纯度,河豚毒素标准溶液浓度为100μg/mL,扩展不确定度为5%,包含因子k=2,标准不确定度为相对标准不确定度为
b.配制标准储备液的不确定度Urel(C2)。
第一,根据JJG 646—2006移液器检定规程[6],使用标称容量为1mL的移液器,移取1mL液体时,容量允许误差为±1%,移液器移取所产生的不确定度为
第二,使用A级10mL单标线容量瓶定容,根据JJG 196—2006常用玻璃量器规定[7],容量允许差为±0.020mL,配制标准储备液定容产生的不确定为
第三,根据实验室对环境的要求,温度严格控制在20±5℃,20℃下,甲醇的体积膨胀系数约为0.00119,1%乙酸水的体积膨胀系数约为0.00207[8],体积膨胀带来的相对不确定度为:
综上,标准储备液配制过程引入的不确定度为:
c.配制标准工作液的不确定度Urel(C3)。
式中,Urel()—移液器移取的不确定度,见表1;Urel()—容量瓶定容至10mL的不确定度;Urel()—1%乙酸水体积膨胀带来的不确定度。
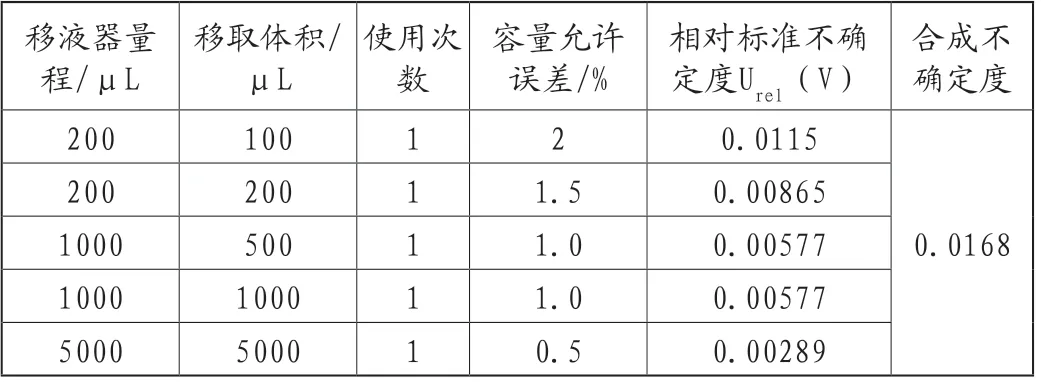
表1 标准工作液移取过程中产生的不确定度
综上,标准溶液配制过程产生的不确定度为:
B.校准曲线拟合产生的不确定度Urel(A)
根据高效液相色谱仪的软件分析,得到标准曲线为f(x)=11299.9×x+0,其中x为河豚毒素标准系列工作液的浓度,f(x)为河豚毒素的峰面积,5个标准工作液浓度点对应的响应值峰面积Ai分别为921、2286、5033、10952、22947,理论响应值峰面积A分别为1130、2260、5650、11300、22600。
对阴性样品加标,进行6次平行实验,得到的浓度分别为188.015ng/mL、180.289ng/mL、189.302ng/mL、186.614ng/mL、184.071ng/mL、186.787ng/mL,平均值为185.846ng/mL,由标准曲线拟合产生的不确定度由式(2)计算。
式中,Urel(C4)—标准曲线拟合产生的不确定度;S(A)—标准溶液待测物质信号残差的标准差;p—样品测定次数(6次);n—标准系列工作液的点数(5次);b—标准曲线的斜率;c0—待测样品中河豚毒素浓度的平均值,ng/mL;ci—标准曲线各点河豚毒素浓度理论值,ng/mL;—标准曲线各点河豚毒素浓度平均值,ng/mL。其中,S(A)的计算如式(3)。
式中,n—标准曲线的点数;Ai—标准溶液各浓度点的峰面积;A—根据标准曲线算出的理论峰面积。
由公式(3)可得,S(A)=471.4,由公式(2)可得,校准曲线产生的峰面积标准不确定度为U(A)=3.27,相对标准不确定度为:
综上,校准曲线拟合产生的不确定度为:
②样品称量产生的不确定度Urel(m)
使用电子分析天平称取2g样品,按上海市计量测试技术研究院校准证书给出的示值误差为0.1mg,样品称量产生的不确定度为:
③样品定容的产生的不确定度Urel(V)
样品定容体积为1mL,根据JJG 646—2006移液器检定规程规定[6]:1mL移液器移取1ml的允许误差为±1.0%,即0.01mL,按均匀分布[8]计算,样品定容产生的不确定度为:
④样品重复性实验的不确定度Urel(R)
取阴性样品进行加标实验,加标量为100μg/kg,实际测定值分别为90.3μg/kg、89.6μg/kg、90.1μg/kg、92.1μg/kg、91.4μg/kg、90.3μg/kg,平均值R=90.6μg/kg,标准偏差SR=0.0936μg/kg,计算样品重复性引入的不确定度为:
⑤回收率的不确定度Urel(P)
取阴性样品进行加标实验,加标量为100μg/kg,回收率分别为94.0%、90.1%、 94.7%、93.3%、92.0%、93.4%,平均值P=92.9%,标准偏差SP=1.61%,计算回收率引入的不确定度为:
(3)相对合成标准不确定度
(4)主要不确定度分量对合成不确定度的贡献
综上所述,标准溶液配制、校准曲线拟合、样品称量、样品定容、样品重复性实验、回收率的不确定度分别为:0.0311、0.0176、0.0000289、0.00577、0.000422、0.00725,对合成不确定度的相对贡献[u(y1)/u(y)]2分别为71.03%、22.75%、0.00006%、2.45%、0.013%、3.86%。
(5)合成不确定度
在95%置信概率下,扩展因子k=2,本实验中河豚毒素的测定值为90.6μg/kg,扩展不确定度为:
Up(X)=k×Urel(X)×-X=2×90.6μg/kg×0.0369=6.69μg/kg。因此,样品中河豚毒素的结果表示为:X=(90.6±6.7)μg/kg,k=2。
3.结论
本实验通过量化分析水产品中河豚毒素测定结果的不确定度分量,并对各分量相对贡献进行比较,得出如下结论:河豚毒素测量结果的不确定度主要来源于标准溶液的配制过程,其次是标准曲线拟合、回收率、样品定容、样品重复性实验和样品称量的影响最小。
