沉默NAC-1基因对人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤化疗敏感的影响
2024-02-06李冬冬凌晨祁
李冬冬,王 莉,钟 洁,凌晨祁,韩 英
(上海理工大学附属市东医院妇科,上海 200438)
卵巢癌是严重威胁女性健康的妇科肿瘤,是致死率最高的女性生殖系统恶性肿瘤。在全球范围内,每年约有20万人被诊断为卵巢癌,12.5万人死于此病[1-2]。卵巢癌发病隐匿,早期症状不明显,且发病率呈逐年上升趋势,大多数卵巢癌患者确诊时已属晚期,患者5年存活率仅为32%[3]。由于多数卵巢癌患者发现时即为晚期,严重制约着手术治疗的疗效。因此,辅助化疗成为卵巢癌治疗最主要的辅助治疗手段,其中顺铂(Cisplatin)是目前治疗卵巢上皮癌最有效的首选药,有效率达29%~35%,但长期临床应用暴露出顺铂的诸多问题,如易产生耐药,导致肿瘤化疗失败。化疗后顺铂耐药是造成卵巢癌患者5年生存率较低(仅30%左右)的重要原因[4-5]。目前顺铂耐药的机制尚不清楚,其受到多方面因素的影响。深入研究卵巢癌顺铂耐药机制对提高卵巢癌的治疗效果,改善卵巢癌患者生存质量具有重要意义。
核转录因子NAC-1(nucleus accumbens 1,又称伏隔核因子1)是BTB/POZ转录因子家族成员,其二聚体复合物可参与多种生物功能调控,如基因转录、细胞增殖和凋亡、蛋白泛素化降解、维持干细胞多能性等[6]。近年来随着NAC-1研究的不断深入,越来越多的证据表明NAC-1与卵巢癌密切相关,其对肿瘤细胞的增殖发挥重要作用,同时NAC-1可能参与肿瘤的化疗抵抗。有研究显示,NAC-1表达上调与原发性卵巢癌接受顺铂等化疗后的复发密切相关,复发卵巢癌化疗后组织中NAC-1表达水平显著高于未化疗的原发性卵巢癌[7-8]。本课题组前期采用siRNA-NAC-1抑制NAC-1表达后,卵巢癌耐药株(SKOV-3/DDP)细胞凋亡率显著提高,细胞生存率下降,表明抑制NAC-1能有效提高SKOV-3/DDP细胞顺铂敏感性[9]。因此,通过控制NAC-1信号通路促进肿瘤细胞衰老的发生,可能成为增强肿瘤化疗疗效的新手段。本研究采用LV4-LUC-GFP慢病毒转染建立NAC-1基因沉默SKOV3/DDP细胞株,然后建立人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤模型,研究了NAC-1基因对裸鼠移植瘤的影响。
1 材料与方法
1.1 材料 BALB/c Nude小鼠购自北京维通利华,RPMI 1640培养基及新生小牛血清购自美国Gibco公司; gene expresso转染试剂购自南京迈极;注射用顺铂购自齐鲁制药;其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞处理 使用LV4-LUC-GFP慢病毒转染建立NAC-1基因沉默SKOV3/DDP细胞株,用SKOV3/DDP-459(Sh1)、SKOV3/DDP-522(Sh2)、SKOV3/DDP-1431(Sh3)三条ShRNA进行干预,ShRNA序列见表1。干预后收集细胞沉淀进行RT-PCR检测,GAPDH引物序列:上游为GGAAGCTTGTCATCAATGGAAATC,下游为TGATGACCCTTTTGGCTCCC;NAC1引物序列:上游为CTCCTGGCCTCCTTCTTTGA,下游为CTCGATCTTGCCCGTTTCAC。SKOV3/DDP细胞株培养于含10%胎牛血清的McCoy's 5 A培养液。收集指数生长期细胞,无血清McCoy's 5 A重悬至密度1×108/mL,再按1∶1体积与基质胶混合均匀用于接种。

表1 NAC-1基因沉默ShRNA序列
1.2.2 动物实验分组 待肿瘤生长至约100mm3时,剔除肿瘤体积过大或过小的老鼠,最终挑选24只荷瘤鼠。将小鼠随机分成4组(每组6只):对照组、对照+顺铂(2mg/kg)组、实验组、实验+顺铂(2mg/kg)组。于小鼠右侧腋下(前肢)皮下注射接种密度为5×107细胞,注射体积0.2mL,注射后缓慢拔针,注射后观察小鼠状态无异常后放入原笼位饲养,2h后再次观察小鼠无异常。常规监测包括肿瘤细胞对小鼠正常活动的影响,肿瘤细胞对小鼠体重的影响等,包括实验动物的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。每2天测量并记录1次肿瘤长短径。
1.2.3 顺铂对裸鼠移植瘤模型治疗效果观察 待肿瘤生长至100mm3左右时,各组治疗后测量并记录移植瘤长径、宽径。计算移植瘤体积,移植瘤体积=1/2×长径×宽径2,记录并观察不同组肿瘤的体积变化,并绘制肿瘤生长曲线。进行顺铂给药处理20d后将裸鼠脱臼处死,称瘤体重量。
1.2.4 转录组测序分析 选取对照组+顺铂组和实验组+顺铂小鼠各2个瘤体标本,采用RNA提取试剂盒提取瘤体总RNA,经质量控制检测合格后开始构建测序文库。文库构建及转录组测序由武汉赛维尔生物科技有限公司Illumina测序平台完成。
1.2.5 差异表达基因分析 使用R语言limma包分析两组样品间的差异表达,筛选出DEGs,标准为P<0.05,|log2FC|>1。基于筛选出的差异基因,使用Gene Ontology数据库和KEGG(Kyoto encyclopedia of genes and genomes)数据库进行差异表达基因富集分析,分析可能生物学过程及信号通路。
1.2.6 关键基因筛选及分析 使用STRING数据库(https://string-db.org/)构建DEGs编码蛋白互作网络,结合Cytoscape(3.9.1版)中CytoHubba插件(0.1版)的MCC算法、Degree 算法、Closeness算法依次筛选节点中心度前20位的基因;韦恩图筛选3种算法共有的基因作为关键基因;使用Metascape网站(https://metascape.org/)在线分析这些共同基因的基因功能。
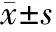
2 结 果
2.1 NAC-1基因沉默SKOV3/DDP细胞株的构建 慢病毒表达载体经构建、包装、纯化后,进一步验证感染效果和干扰效果,采用LV4-LUC-GFP慢病毒进行转染测试,结果显示MOI 为200时转染效果较好(图1A),RT-PCR结果显示.SKOV3/DDP-522(Sh2)沉默效果最好(P<0.05),可用于后续实验(图1B)。
图1 NAC-1慢病毒表达载体效果评价
2.2 抑制NAC-1基因卵巢癌荷瘤裸鼠治疗效果 在实验周期内,24只裸鼠均存活,皮下均有肿瘤形成,各组接种部位未出现红肿、破溃等表征。对照组小鼠肿瘤体积由(116.23±7.25)mm3增长到(1271.52±261.93)mm3,顺铂化疗后肿瘤体积显著缩小,第20天时肿瘤体积为(560.11±113.17)mm3,而抑制NAC-1基因同时给予顺铂化疗组肿瘤体积为(363.40±120.40) mm3。与顺铂化疗组相比,抑制NAC-1基因后裸鼠皮下肿瘤的体积变小(图2A、C)。第20天时检测四组瘤体重量分别为对照组(1.20±0.25)g,对照+顺铂组(0.57±0.12)g,实验组(1.13±0.23)g,实验+顺铂组(0.31±0.13)g,实验+顺铂组瘤体重量最轻,与对照组+顺铂组瘤体存在显著性差异(图2B、D),表明抑制NAC-1基因能够显著提高顺铂对裸鼠卵巢癌荷瘤的治疗效果。

图2 抑制NAC-1基因后裸鼠皮下肿瘤生长情况
2.3 两组瘤体组织差异表达基因(DEGs)筛选 对照+顺铂组和实验+顺铂组两组的转录组结果进行表达量差异统计分析(P<0.05,|log2FC|>1),筛选出抑制NAC-1基因后顺铂化疗瘤体中差异表达的基因共1028个(图3A和B),其中抑制NAC-1基因后发生显著下调的基因有460个,显著上调的基因有568个。
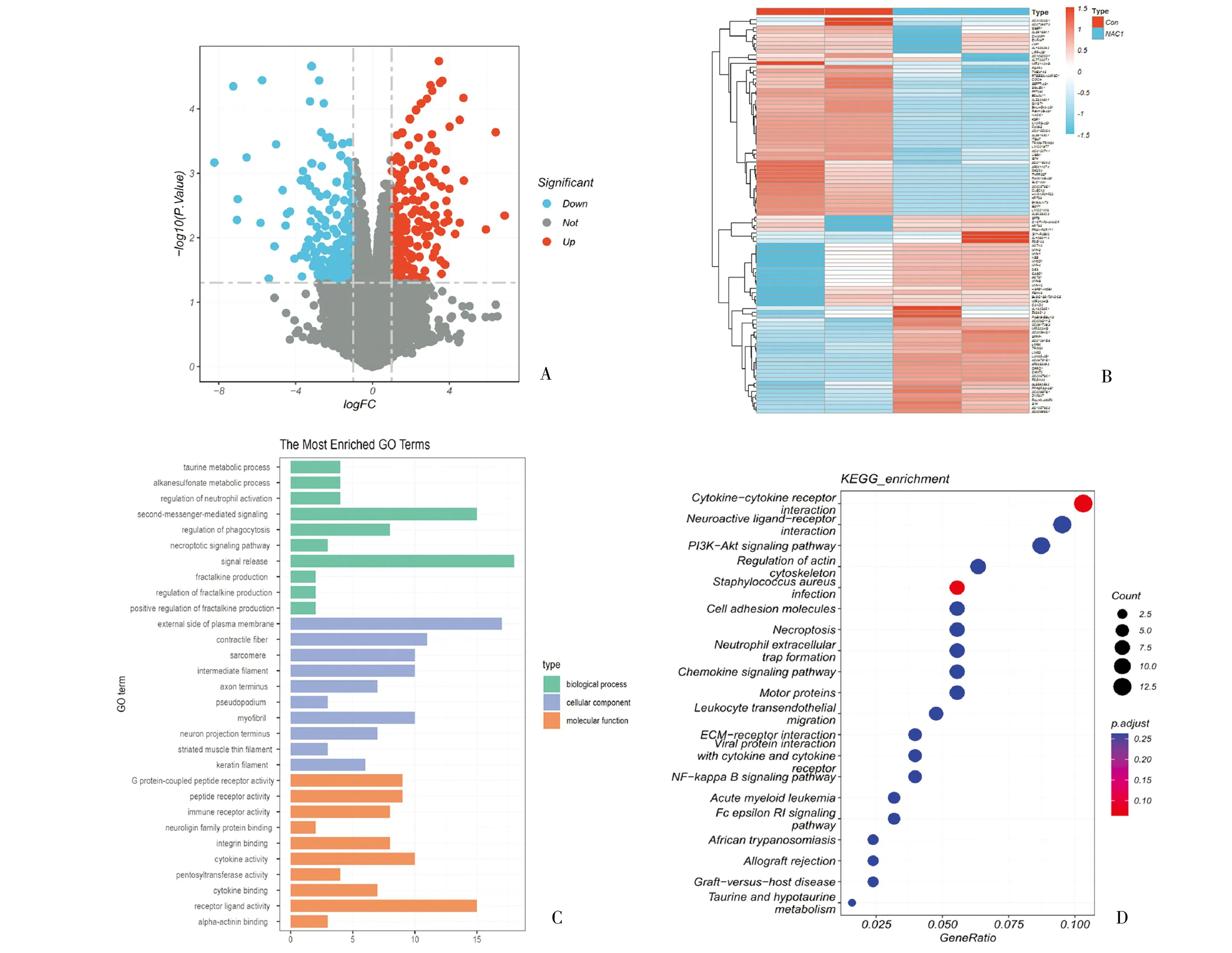
图3 差异基因筛选与分析结果
2.4 GO富集分析 为了揭示所筛选的DEGs的生物学功能,对这些DEGs进行GO富集分析,共富集到736个显著差异的条目,其中生物过程类(BP)569个,主要对代谢、黏附、吞噬、坏死、趋化等条目造成影响;细胞组分类(CC)62个条目,主要对收缩纤维、中间丝、肌原纤维、轴突等细胞微结构造成影响;分子功能(MF)105个条目,主要与G蛋白偶联肽受体活性、肽受体活性、免疫受体活性、细胞因子活性、受体配体活性等有关,各选取BP、CC、MF排名前10的GO条目绘制柱状图 (图3C)。由此可见,这些DEGs多与生物学过程中的细胞代谢、有丝分裂、坏死、炎症、信号传递等相关。
2.5 KEGG富集分析 筛选得到的差异表达基因用KEGG 数据库进行通路注释,结果显示这些DEGs主要分布在62条通路中,取KEGG前20条目绘制气泡图(图3D)。主要与NAC-1基因相关的信号转导途径有细胞因子-细胞因子受体相互作用、白细胞跨内皮迁移、神经活性配体-受体相互作用、细胞黏附分子、坏死、ECM受体相互作用、PI3K-Akt信号通路、NF-κB信号通路等。
2.6 蛋白相互作用网络(PPI)和关键基因的筛选 在PPI网络图中共有 191个节点和319条边,使用Cytoscape中CytoHubba插件的MCC算法、Degree 算法、Closeness 算法依次筛选节点中心度前20位的基因(图4A~C),使用韦恩图筛选3种算法共有的基因12个,分别为ITGAM、STAT5B、STAT5A、TNF、SYK、BTK、KLRG1、OSM、ACTN3、CCR1、NCF4、RYR1,通过Metascape在线软件分析发现这些基因显著富集在白细胞介素的信号传导、粒细胞-巨噬细胞集落刺激因子(GM-CSF)通路、炎症反应等通路(图4D~E)。

图4 蛋白相互作用网络(PPI)和关键基因的筛选与分析
3 讨 论
卵巢癌是致死率最高的女性生殖系统恶性肿瘤,严重威胁着妇女健康。基于卵巢癌的高度危害性,美国国立卫生研究院(NIH)将卵巢癌纳入肿瘤基因组图谱计划(TCGA),成为继肺癌之后第二个被纳入该计划的肿瘤。导致卵巢癌死亡率和发病率居高不下的因素主要为晚期诊断和治疗耐药。其中,化疗后顺铂耐药是造成卵巢癌患者5年生存率较低的重要原因[4-5]。近年来针对卵巢癌化疗耐药的靶向干预研究已取得了很多的进展,但卵巢癌顺铂耐药机制十分复杂,对卵巢癌顺铂耐药的干预手段仍较局限,急需探寻新的参与卵巢癌顺铂耐药的作用靶点,探索更有效的抑制卵巢癌化疗抵抗产生的干预策略。
NAC-1基因在多种类型的肿瘤中呈过表达状态,如乳腺癌、肝癌、卵巢癌等,可能影响肿瘤的发生发展、转移复发或化疗耐药等。本课题组前期使用siRNA-NAC-1抑制NAC-1基因表达后发现卵巢癌耐药株(SKOV-3/DDP)细胞凋亡率显著提高,同时细胞生存率下降,这表明抑制NAC-1能有效提高SKOV-3/DDP细胞顺铂敏感性[9]。本研究中,进一步采用LV4-LUC-GFP慢病毒转染建立NAC-1基因沉默SKOV3/DDP细胞株,然后将细胞接种到免疫缺陷小鼠皮下,建立人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤模型,分别给予顺铂化疗,结果显示抑制NAC-1基因能抑制皮下肿瘤生长,证明NAC-1在卵巢癌耐药株抵抗顺铂化疗过程中发挥重要作用。通过调控NAC-1信号通路促进化疗耐受肿瘤细胞的化疗敏感性,可能成为增强肿瘤化疗疗效新的治疗手段。
NAC-1作为维持干细胞多潜能性的关键因子,参与机体的多种生理功能[10]。本研究检测发现,抑制NAC-1基因后顺铂化疗瘤体中存在 1028个差异表达基因,其中下调基因460个,上调基因568个。这些DEGs的GO富集分析显示其主要影响了细胞代谢、有丝分裂、坏死、炎症、信号传递等生物学过程,提示NAC-1转录因子在细胞生长、分化、代谢、免疫应答等多种生理过程中发挥功能。如Rahman等[11-12]研究显示,抑制NAC-1表达能影响脂肪酸和磷脂合成等代谢过程。KEGG分析显示,NAC-1基因相关的信号转导途径有细胞因子-细胞因子受体相互作用、白细胞跨内皮迁移、神经活性配体-受体相互作用、细胞黏附分子、坏死、ECM受体相互作用、PI3K-Akt信号通路、NF-κB信号通路等。其中,在肿瘤耐受研究中,PI3K/Akt、NF-κB等信号通路是顺铂、吉西他滨等抗肿瘤药物产生耐药的重要调控通路,这些通路的激活可能减轻化疗药物对肿瘤细胞的杀伤作用,从而导致卵巢癌化疗耐受[13-14]。因此,NAC-1基因可能通过调控PI3K/Akt、NF-κB等信号通路影响人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤化疗敏感性。
肿瘤微环境介导的卵巢癌耐药是当前化疗耐药的研究热点,肿瘤细胞或基质细胞能分泌多种炎症因子、趋化因子、生长因子等可溶性因子,这些因子与基质细胞均有助于卵巢癌耐药性的发生[15-16]。本研究对蛋白相互作用网络中筛选获得的12个关键基因进行分析显示,NAC-1基因可能影响到白细胞介素、粒细胞-巨噬细胞集落刺激因子等炎症反应相关的信号通路,提示NAC-1基因可能通过调控炎症微环境实现对肿瘤细胞化疗耐受的影响。目前对NAC-1基因功能的研究主要集中在肿瘤细胞生长增殖、细胞衰老、转移及侵袭和干细胞分化等领域。最新研究显示,NAC-1基因可能还参与机体的炎症反应。Xia等[17]研究证实,NAC-1基因可调节RLR介导的I型IFN的表达,过表达或敲低NAC-1基因能分别增强或降低TBK1和IRF3的活化,影响IFN-β表达。Yang等[18]研究发现,NAC-1可能是调节Treg细胞介导的免疫抑制的关键因子,敲除NAC-1基因后免疫细胞分泌的TGF-β、IL-10等炎症因子水平显著升高。
综上所述,本研究借助人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤模型,证实了沉默NAC-1基因可有效提高人卵巢癌耐药细胞株SKOV3/DDP裸鼠移植瘤化疗敏感性, 靶向干预NAC-1通路是抑制卵巢癌化疗抵抗的有效手段。通过比较分析NAC-1基因干预的卵巢癌耐药株 mRNA 的表达谱,揭示了NAC-1参与卵巢癌化疗抵抗的信号通路,筛选获得的关键基因生物信息学分析提示抑制NAC-1基因能改变肿瘤的炎症微环境调控肿瘤细胞的化疗耐受。
