荻草谷网蚜ABCG1基因的克隆及表达模式分析
2024-02-06于苗苗张思宇宋国锋陈巨莲解海翠范佳
于苗苗 张思宇 宋国锋 陈巨莲 解海翠 范佳

摘要
荻草谷網蚜Sitobion miscanthi是严重威胁我国小麦生产安全的迁飞性害虫。蜕皮激素是参与蚜虫翅型分化调控的内激素,在有翅成蚜体内保持高滴度,且诱导后代产生更高比例的无翅蚜,其进出靶细胞需要经过细胞膜上特定蛋白的转运。ATP结合盒转运蛋白家族G亚家族(ATPbinding cassette transporter G, ABCG)中的ABCG1是通过跨膜转运昆虫类固醇、对蜕皮激素信号进行负调控的功能蛋白之一,在蚜虫中尚未见报道。本文克隆了荻草谷网蚜ABCG1(SmisABCG1)基因,并进行了序列比对、系统进化分析以及不同组织部位和发育时期表达模式分析。结果显示,SmisABCG1基因的开放阅读框全长为1 851 bp,编码616个氨基酸,含7个跨膜结构域,符合ABCG蛋白家族典型结构特性,基因登录ID:OP626323。昆虫间ABCG1较保守,该蛋白系统进化关系与各自物种间亲缘关系的远近保持一致。其中,SmisABCG1与来自豌豆蚜、禾谷缢管蚜、棉蚜、花生蚜和雪松长足大蚜等的ABCG1氨基酸序列高度一致(>87%),以上蚜虫聚为一支。与SmisABCG1亲缘关系最近的是豌豆蚜的ABCG1,其次是半翅目的褐飞虱、白背飞虱和灰飞虱,与膜翅目的新疆菜叶蜂、阿里山潜蝇茧蜂以及鞘翅目的赤拟谷盗、蜂箱小甲虫亲缘关系较远。该基因在伪胚胎和成蚜阶段高表达。包含伪胚胎的有翅、无翅成蚜整蚜SmisABCG1的转录水平无显著差异,但其在来自有翅成蚜的伪胚胎中的转录水平高于无翅成蚜伪胚胎,证实无翅成蚜自身的转录水平较高,而有翅成蚜较低。进一步分析显示这一差异主要是无翅蚜胸部显著高表达所导致。基于该蛋白对蜕皮激素负调控,与有翅成蚜转录水平低,但蜕皮激素水平更高相符合。
关键词
荻草谷网蚜; ABC转运蛋白; 蜕皮激素; 基因克隆; 表达谱
中图分类号:
S 433.3
文献标识码: A
DOI: 10.16688/j.zwbh.2022648
Cloning and expression profiling of ATPbinding cassette transporter G1 gene in grain aphid Sitobion miscanthi
YU Miaomiao1,2, ZHANG Siyu2, SONG Guofeng2, CHEN Julian2, XIE Haicui1*, FAN Jia2*
(1. Hebei Key Laboratory of Crop Stress Biology (in Preparation), Hebei Normal University of Science and
Technology, Qinhuangdao 066600, China; 2. State Key Laboratory for Biology of Plant Diseases and
Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Grain aphid Sitobion miscanthi is a migratory pest as well as the dominant pest on wheat in China. Molting hormone, ecdysone (20E), as one of the internal hormone, involved in the regulation of wing differentiation of aphids, which induces a higher proportion of wingless aphid in the offspring and maintains a high titer in winged adults. To enter and exit the target cells, 20E requires the transport of specific membrane transporters. ABCG1, as one of 20E membrane transporters in insects, negatively regulates ecdysone signaling by transmembrane transport of insect ecdysone, which has not been reported in aphids yet. In the present study, SmisABCG1 was cloned and aligned with its orthologs, and their phylogenetic relationship was analyzed among insects. Expression patterns among organs or tissues of both winged and wingless adults,pseudo embryos, first to fourth instar nymphs were also analyzed. The results showed that the complete open reading frame of SmisABCG1 was 1 851 bp, encoding 616 amino acids, with seven transmembrane regions, which was consistent with the traits of ABCG protein family member. The gene accession ID was OP626323. ABCG1 is conserved among insects, and the phylogenetic relationship of this protein confirmed that there is a close genetic relationship among species. SmisABCG1 shared high consistency (>87%) of sequence with ABCG1s in other insects such as Acyrthosiphon pisum, Rhopalosiphum padi, Aphis gossypii, A.craccivora, Cinara cedri, and these aphids clustered into a branch.
The closest neighbor of SmisABCG1 is ApisABCG1 in A.pisum, followed by whitebacked planthopper (Sogatella furcifera), plant hopper (Nilaparvata lugens), small brown planthopper (Laodelphax striatellus), sawfly (Athalia rosae), alishan dive fly cocoon bee (Fopius arisanus), red flour beetle (Tribolium castaneum) and Aethina tumida. RTqPCR results showed that SmisABCG1 is mainly expressed in pseudo embryo as well as adults. Significantly high level of pseudo embryo in winged adult and equal level of winged and wingless adults with embryo indicated that wingless aphid expressed higher ABCG1 than winged aphid. Subsequent analysis found that this was due to a significantly higher expression in the thorax of wingless adult. All other organs or tissues showed no significant differences between winged and wingless phenotype.
Based on the negative regulation of ecdysone by this ;protein, it consistent with low transcript levels but high ecdysone levels in winged adult aphids.
Key words
Sitobion miscanthi; ATPbinding cassette transporter; ecdysone (20E); gene cloning; expression profile
荻草谷網蚜Sitobion miscanthi是严重威胁我国小麦生产安全的迁飞性害虫[14],国内又称麦长管蚜 [56]。其为害主要通过刺吸小麦叶片、茎秆甚至麦穗来汲取作物营养、阻碍植株正常生长发育;其次,荻草谷网蚜还是传播小麦黄矮病毒的重要介体;再次,麦蚜排泄物蜜露可污染作物、引起霉污病,降低小麦品质的同时,蜜露阻碍光合作用、影响小麦营养积累,从而降低农作物产量[7]。按农业农村部2020年公布数据,麦蚜属于我国“一类农作物病虫害”。因此,有效防控麦蚜为害是我国小麦增产保收面临的重大挑战。
翅二型是蚜虫对不良生态环境的适应策略,有翅蚜的分化有助于蚜虫逃离逆境、重新定殖,实现种群延续和蓄势暴发。因此,防控有翅蚜的发生扩散是蚜害防控的关键和难点之一[89]。研究发现荻草谷网蚜在我国1月0℃等温线以北地区无法完成越冬[10],包括河北、山东、宁夏、内蒙古、北京、天津市郊、山西省大部以及河南北部在内的广大北方麦区的麦蚜均来自南方迁入虫源[3,1113]。在不良环境因子及生物因子刺激下,种群有翅迁飞蚜比例开始上升[1415]。有翅蚜可短距离自主迁飞甚至借助气流长距离迁飞寻找合适生境再次定殖,实现种群扩张[8]。影响蚜虫种群翅型比例的因素包括内部因素和外部因素。除温度、拥挤度、寄主适合度、天敌等外部因素外,内部因素例如昆虫激素源(蜕皮激素、保幼激素等)的调节发挥了决定性作用[1619]。昆虫蜕皮激素具有调节控制昆虫的生理机能、代谢、生长发育、滞育、变态、生殖等的重要功能,蜕皮激素的缺乏或过多都会导致昆虫发育异常[2022]。并且,蜕皮激素是典型的参与昆虫翅发生和翅分化的内激素[18,23]。蜕皮激素受体(ecdysone receptor,ECR)沉默会导致灰飞虱Laodelphax striatellus翅发育缺陷,前后翅无法正常伸展[24]。而母蚜蜕皮激素滴度与后代无翅蚜比例正相关。豌豆蚜Acyrthosiphon pisum无翅成蚜额外摄入蜕皮激素时,会导致其后代的无翅蚜比例上升[21]。在荻草谷网蚜中发现有翅成蚜蜕皮激素滴度显著高于无翅成蚜,并且有翅成蚜后代发育为无翅蚜的比例也更高[25]。
ATP结合盒转运蛋白G1(ATPbinding cassette transporter G1,ABCG1)是已知参与昆虫蜕皮激素跨膜转导的功能蛋白之一,相关工作在模式昆虫黑腹果蝇Drosophila melanogaster中已获得详细的阐释。最初,ABCG1是作为果蝇蜕皮激素直接诱导表达的3个转录因子之一被发现的。之后证实蜕皮激素的内分泌释放是通过可调节的囊泡运输机制介导的,而该蛋白即位于分泌囊泡,与蜕皮激素滴度负相关,是调节果蝇类固醇蜕皮激素信号传导的重要功能蛋白[2627]。另外,在赤拟谷盗Tribolium castaneum [19]、橘小实蝇Bactrocera dorsalis [28]中也陆续证实了上述功能。ABCG1隶属于ABC转运蛋白家族(ABC transporter),是一类能够利用ATP促使物质逆浓度梯度跨膜转运的蛋白,是生物界中最大的转运蛋白家族,广泛存在于真核甚至原核生物中[2930]。研究发现ABC转运蛋白参与运输的底物包括氨基酸、糖类、脂类、金属、激素以及药物等[31]。昆虫ABC蛋白转运主要包括两种方式[32],一是在细胞膜上转运Ⅰ级、Ⅱ级代谢物或直接转运有毒外源物质;二是依靠囊泡运输类固醇激素、脂质等物质。根据ABC转运蛋白其核苷酸结合域(nucleotide binding domains, NBD)和跨膜结构域(transmembrane domains, TMD)具体的结合方式,分为全转运蛋白和半转运蛋白[29]。基于NBD的序列保守性,ABC蛋白家族被分為8个亚家族(由A到H,即ABCA 到ABCH)[31]。ABCG蛋白亚家族为半转运蛋白,由一个NBD和一个TMD组成[31],广泛存在于真菌、植物和大多数的多细胞动物甚至人类中。ABCG1蛋白在人体中可以形成同源二聚体,作用于细胞脂质体的内平衡,且参与胆固醇转运调控[3337]。而昆虫ABCG1功能与在人体中类似,主动将蜕皮激素转运出靶细胞、负向调控蜕皮激素信号转导运输[3839]。但ABCG1在昆虫中的研究十分有限,有待开展。本研究利用同源基因在序列上的高度保守性,在荻草谷网蚜基因组中检索出ABCG1基因;并进行基因克隆验证和系统进化关系分析;最后,对该基因在不同发育阶段、不同组织部位的表达模式进行分析,为深入研究蛋白功能打下基础。
1 材料与方法
1.1 试验材料
荻草谷网蚜试验种群来源于中国农业科学院植物保护研究所廊坊试验基地。2017年于小麦田采集野生种群,经室内单头饲喂纯化扩繁为单性系试验种群Langfang1[6]。养虫室设定条件为恒温(25±2)℃、恒湿(60±10)%、固定光周期L∥D=16 h∥8 h,供饲小麦品种为‘AK58’。
分别收取荻草谷网蚜有翅、无翅型各龄期整蚜(伪胚胎20头、1~4龄若蚜各10头、成蚜5头)以及成蚜不同组织部位(触角60对、头20颗、胸10个、腹10个、翅100对)于1.5 mL离心管里,取样过程保持样品浸于液氮中。取样完成后储存于-80℃冰箱。每组样品设3次生物学重复。
1.2 试验方法
1.2.1 荻草谷网蚜ABCG1基因结构预测
在荻草谷网蚜转录组数据库中筛选出ABCG1基因。利用TBtools的Gene Location展示基因定位情况,并通过在线软件GSDS(http:∥gsds.gaolab.org/)对其基因结构进行分析预测。
1.2.2 荻草谷网蚜ABCG1基因克隆
采用RNA微量提取试剂盒(天漠生物科技开发有限公司)提取总RNA。用超微量分光光度计(美国Nanodrop公司)检测RNA浓度和质量。OD260 nm/OD280 nm为1.8~2.0的RNA样品视为合格,利用TRUEscript RT Kit+gDNA Eraser(北京艾德莱生物科技有限公司)进行反转录合成cDNA第一链,cDNA于-20℃保存备用。
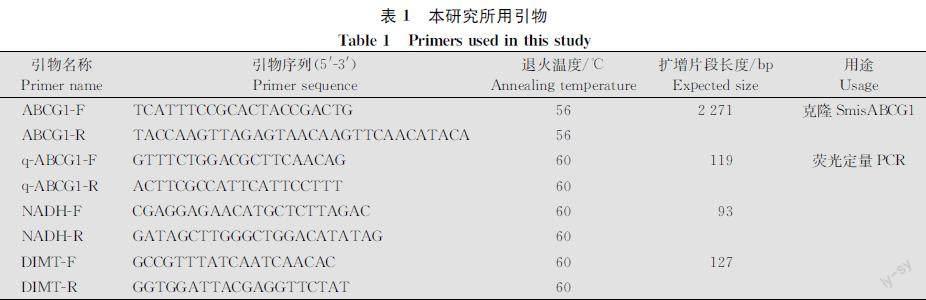
以荻草谷网蚜ABCG1的预测序列为模板,设计特异性引物ABCG1F/ABCG1R(表1,Primer Premier 5.0软件),并由北京新时代众合有限公司合成,对荻草谷网蚜ABCG1进行PCR扩增。20 μL PCR 反应体系:2×Transstart FastPfu PCR SuperMix 10 μL, 正、反向引物各 1 μL,cDNA 模板 2 μL,ddH2O 6 μL。 反应条件:95℃预变性2 min;95℃变性30 s,55℃退火 30 s,72℃延伸60 s, 35个循环;72℃延伸 10 min。通过 2.0% 琼脂糖凝胶电泳检测 PCR 产物目的条带,将大小相符的DNA片段切胶回收纯化后连接到pTOTOTA通用载体(北京艾德莱生物科技有限公司),并转化到大肠杆菌DH5α感受态细胞(北京新时代众合有限公司)中,在 LB 平板上过夜培养后挑取白色菌落,LB培养液摇培4 h,进行PCR检测,取阳性克隆送北京新时代众合科技有限公司进行测序。
1.2.3 荻草谷网蚜ABCG1基因生物信息学分析
利 用 ORF finder(https:∥www. ncbi. nlm.nih.gov/orffinder/)预测荻草谷网蚜ABCG1基因的开放阅读框(open reading frame,ORF);并通过ExPASy的ProtParam工具(http:∥web.expasy.org/protparam/)预测ABCG1蛋白的分子量、等电点;使用SignalP 4.1 Server (http:∥www.cbs.dtu. dk/services/SignalP4.1/)预测ABCG1蛋白是否存在信号肽序列,使用TMHMM Server 2.0 (http:∥www.cbs.dtu.dk/services/TMHMM)预测ABCG1蛋白的跨膜结构域。利用NCBI在线工具BlastN (http:∥blast. ncbi.nlm.nih.gov)进行荻草谷网蚜近缘种的核苷酸序列相似性比对,使用DNAMAN软件进行不同物种的氨基酸序列同源性分析。使用SOPMA 工具(https:∥npsaprabi. ibcp. fr/cgibin/npsa_automat. pl? page=npsa_sopma.html)预测蛋白质二级结构。
在NCBI数据库中下载了12个与SmisABCG1一致性较高的同源序列。利用DNAMAN将SmisABCG1与其他氨基酸序列进行比对。利用 MEGA 7软件以邻接法构建系统进化树,设bootstrap 值为1 000 進行检验。
1.2.4 荻草谷网蚜ABCG1基因的表达模式
以克隆的SmisABCG1基因结果为模板,设计特异性引物qABCG1F/qABCG1R(表1,Primer Premier 5.0软件),同时选择NADH和DIMT为内参基因[40],使用荧光定量PCR仪FS007对荻草谷网蚜不同发育阶段、不同组织器官cDNA进行实时荧光定量PCR检测。每样本设置 3 个技术重复和3个生物学重复。以荻草谷网蚜ABCG1基因的无翅成蚜触角的表达量为外参,利用 2-ΔΔCt方法[41]计算ABCG1基因在荻草谷网蚜不同龄期不同组织的相对表达量。
1.3 数据分析
利用SPSS 20.0软件进行数据统计分析,用Student’s t测验检验同一龄期或同一组织不同翅型之间 ABCG1基因表达量的差异显著性(P<0.05为显著性差异,P<0.01为极显著差异),用One way ANOVA检验同一翅型不同组织之间ABCG1基因表达量的差异显著性。
2 结果与分析
2.1 荻草谷网蚜ABCG1基因克隆以及生物学信息分析
荻草谷网蚜ABCG1位于编号为Lachesis_group1的染色体上(10 700 580~10 721 726 bp,图1a)。荻草谷网蚜ABCG1基因被12个内含子分割为13个外显子区,外显子包括编码区、非编码5′UTR区和非编码3′UTR区(图1a)。
基因克隆验证结果显示,SmisABCG1开放阅读框全长1 851 bp。与本研究使用的荻草谷网蚜试验种群Langfang1基因组组装结果相比,存在5个碱基的差异,以基于一代测序技术的基因克隆结果为准,对基因组进行校正(图1b)。
荻草谷网蚜ABCG1开放阅读框共编码616个氨基酸,预测蛋白分子量为69.28 kD,等电点PI为 8.43。ABCG1蛋白氨基酸序列有7个跨膜螺旋区(氨基酸位点分别为359~380、392~414、434~456、476~498、503~525、532~554 aa和587~609 aa)。该蛋白无信号肽序列,为非分泌性膜蛋白,二级结构中α螺旋、延伸链、β转角和无规则卷曲所占比例分别为 45.78%、15.42%、4.87% 和33.93%,说明α螺旋为SmisABCG1蛋白的主要结构形式(图1c)。NCBI序列登录号为:OP626323。
2.2 荻草谷网蚜ABCG1与同源序列的比对以及系统进化分析
在 NCBI 中选择与编码SmisABCG1的氨基酸序列相似性较高的12个同源序列进行比对分析。结果显示其与豌豆蚜序列一致性最高,达到98.21%;与禾谷缢管蚜Rhopalosiphum padi、棉蚜Acyrthosiphon pisum、花生蚜Aphis craccivora、雪松长足大蚜Cinara cedri、白背飞虱Sogatella furcifera、褐飞虱Nilaparvata lugens、灰飞虱Laodelphax striatellus、新疆菜叶蜂Athalia rosae、阿里山潜蝇茧蜂Fopius arisanus、赤拟谷盗和蜂箱小甲虫Aethina tumida序列一致性分别为98.05%、97.73%、92.53%、87.99%、55.59%、55.52%、55.19%、54.87%、53.65%、53.56%和52.32%。系统进化分析结果显示,一致性越高,亲缘关系则越近。荻草谷网蚜ABCG1与豌豆蚜亲缘关系最近,并与其他蚜虫例如禾谷缢管蚜、棉蚜、花生蚜以及雪松长足大蚜聚为一支。其次是半翅目的白背飞虱、褐飞虱和灰飞虱,与膜翅目的新疆菜叶蜂、阿里山潜蝇茧蜂以及鞘翅目的赤拟谷盗、蜂箱小甲虫亲缘关系较远 (图2)。
2.3 荻草谷网蚜ABCG1基因表达特征分析
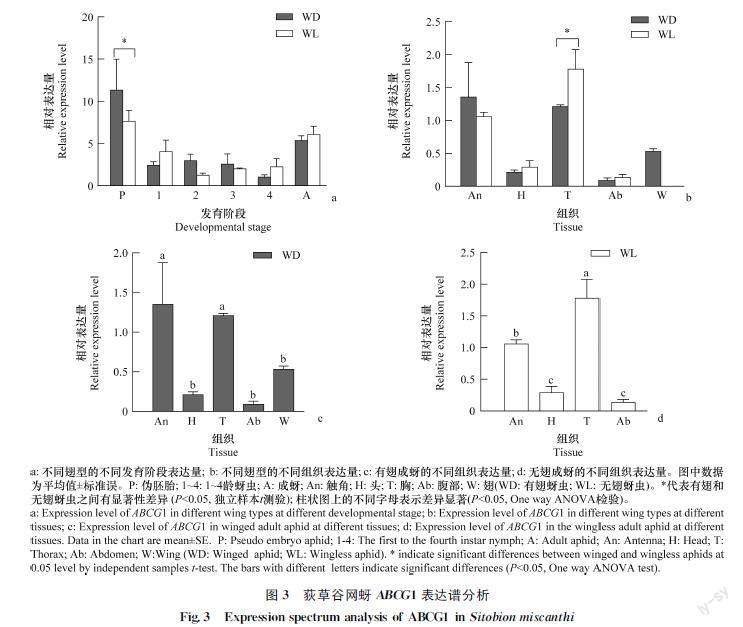
从各发育阶段表达量分析结果来看,荻草谷网蚜ABCG1主要在伪胚胎和成蚜阶段具有较高的转录水平。有翅成蚜体内伪胚胎的转录水平显著高于无翅成蚜;而含有伪胚胎的有翅和无翅成蚜整蚜转录水平无差异(图3a)。成蚜各组织部位表达量分
析结果显示,有翅成蚜主要在触角和胸部表达,且表达量无差异;无翅成蚜主要在胸部表达,在触角中也有一定的转录水平(显著低于胸部但高于其他组织)(图3c,3d)。相比较而言,无翅成蚜胸部的转录水平显著高于有翅成蚜,其他组织部位转录水平在有、无翅型成蚜间则无差异(图3b)(P<0.05)。
3 结论与讨论
ABC转运蛋白是最大、最古老的蛋白家族之一,广泛存在于真核和原核生物中。在人类基因组中发现49个ABC转运蛋白[31];大肠杆菌中发现79个ABC转运蛋白[42];昆虫中的ABC转运蛋白数量在40~103个之间。 SmisABCG1与其他蚜虫如豌豆蚜、禾谷缢管蚜、棉蚜、花生蚜和雪松长足大蚜等的ABCG1氨基酸序列均有较高的一致性(>87%),且聚在一个分支上。与半翅目其他昆虫(白背飞虱、褐飞虱、灰飞虱)甚至半翅目以外昆虫(新疆菜叶蜂、阿里山潜蝇茧蜂、赤拟谷盗和蜂箱小甲虫)的ABCG1氨基酸序列的一致性也>50%。系统进化分析表明该基因在物种间亲缘关系(图2)的远近与各物种间的进化关系[6]完全一致。以上结果均显示出昆虫ABCG1氨基酸序列进化的保守性。另外,模式昆虫果蝇和赤拟谷盗等的ABCG1具有转运类固醇(蜕皮激素)的功能,该功能与高等动物甚至人的ABCG1蛋白功能一致,说明了该蛋白的功能保守性。昆虫ABCG1基因序列及功能均高度保守,因此,推测ABCG1蛋白在昆虫中广泛行使转运蜕皮激素的功能。
本研究发现SmisABCG1在无翅成蚜胸部显著高转录,其他部位的表达量在有翅和无翅型蚜虫间则无差异。而在检测含伪胚胎的完整有翅和无翅成蚜时,却显示整体转录水平无差异。因此推测,造成以上差异的原因可能来自伪胚胎。接下来的检测结果证实来自不同翅表型成蚜体内的伪胚胎其ABCG1的转录水平存在显著差异,具体是有翅成蚜伪胚胎的表达量显著高于无翅成蚜。综上所述,无翅成蚜自身ABCG1的转录水平较高,而有翅成蚜较低。该差异主要是由无翅蚜胸部的高转录水平引起。黑腹果蝇ABCG1的表达是由蜕皮激素诱导启动的。ABCG1通过主动将蜕皮激素转运出靶细胞来负向调控蜕皮激素信号转导,并且发现其过表达则会导致蜕皮激素缺失、引起黑腹果蝇畸形和致死[27]。高浓度蜕皮激素具有调节豌豆蚜若蚜向无翅型成蚜发育的功能,会引起后代无翅蚜比例上升[8, 21]。在荻草谷网蚜中也发现同一种群内的有翅成蚜蜕皮激素滴度水平高于无翅成蚜,有翅成蚜后代发育为无翅蚜的比例也更高[25]。有翅成蚜蜕皮激素滴度水平高于无翅成蚜,这与SmisABCG1的表达模式正好相反,存在负调控蜕皮激素的基础。因此推测,有翅蚜较高水平的蜕皮激素滴度与较低水平的ABCG1协同,共同调控若蚜翅原基的消解、促进后代发育为无翅蚜。而伪胚胎表达量高于其他发育阶段,且有翅成蚜的伪胚胎表达量显著高于无翅成蚜,这可能涉及复杂的母蚜对子代的跨代影响,具体机制有待进一步解析。
本研究对荻草谷网蚜蜕皮激素转运蛋白基因SmisABCG1进行了初步研究。为进一步解析该基因的功能奠定了基础。而且,相关研究有助于推动通过靶向调节蚜虫生理进程、调控其翅型分化来有效遏制蚜虫迁飞为害技术的开发,为充实绿色、高效的蚜害综合防控技术提供全新思路。
参考文献
[1] 董庆州, 魏凯, 孟庆祥, 等. 宁夏地区麦长管蚜远距离迁飞的研究[J]. 昆虫学报, 1987, 30(3): 277284.
[2] 陆云, 尹姣, 李克斌, 等. 我国麦蚜飞翔及迁飞研究进展[J]. 中国植保导刊, 2013, 33(12): 2124.
[3] 刘向东, 翟保平, 张孝羲. 蚜虫迁飞的研究进展[J]. 昆虫知识, 2004(4): 301307.
[4] 杜光青. 麦长管蚜迁飞的时空动态及生态景观对其降落的影响[D]. 北京: 中国农业科学院, 2014.
[5] 张广学. 西北农林蚜虫志, 昆虫纲, 同翅目, 蚜虫类[M]. 北京: 中国环境科学出版, 1999.
[6] JIANG Xin, ZHANG Qian, QIN Yaoguo, et al. A chromosomelevel draft genome of the grain aphid Sitobion miscanthi [J/OL]. Gigascience, 2019, 8(8): giz101. DOI: 10.1093/gigascience/giz101.
[7] 劉星春, 潘志庆. 麦蚜发生规律及其防治研究[J]. 植物保护, 1980(6): 79.
[8] BRAENDLE C, DAVIS G K, BRISSON J A, et al. Wing dimorphism in aphids [J]. Heredity, 2006, 97(3): 192199.
[9] HAYES A M, LAVINE M D, GOTOH H, et al. Mechanisms regulating phenotypic plasticity in wing polyphenic insects [J]. Advances in Insect Physiology, 2019, 56: 4372.
[10]羅瑞梧, 杨崇良, 尚佑芬, 等. 麦长管蚜虫源问题研究[J]. 植物保护学报, 1988, 15(3): 153158.
[11]张向才, 周广和, 史明, 等. 麦蚜远距离迁飞和传毒规律的研究[J]. 植物保护学报, 1985, 12(1): 915.
[12]田喆, 陈志刚, 张跃进, 等. 应用GIS对麦长管蚜迁飞的初步研究[C]∥农业生物灾害预防与控制研究. 北京: 中国农业科学技术出版社, 2005: 861864.
[13]杨素钦, 杨逸兰. 北方冬麦区麦长管蚜远距离迁飞与气流运动的关系初探[J]. 中国植保导刊, 1991(2): 1116.
[14]CAILLAUD M C, BOUTIN M, BRAENDLE C, et al. A sexlinked locus controls wing polymorphism in males of the pea aphid, Acyrthosiphon pisum (Harris) [J]. Heredity, 2002, 89 (5): 346352.
[15]王小艺, 杨忠岐, 魏可, 等. 昆虫翅型分化的表型可塑性机制[J]. 生态学报, 2015, 35 (12): 39883999.
[16]NIJHOUT H F. Control mechanisms of polyphenic development in insects: In polyphenic development, environmental factors alter some aspects of development in an orderly and predictable way [J]. BioScience, 1999, 49(3): 181192.
[17]MLLER C B, WILLIAMS I S, HARDIE J. The role of nutrition, crowding and interspecific interactions in the development of winged aphids [J]. Ecological Entomology, 2001, 26(3): 330340.
[18]HARDIE J. Juvenile hormone mimics the photoperiodic apterization of the alate gynopara of aphid, Aphis fabae [J]. Nature, 1980, 286: 602604.
[19]BROEHAN G, KROEGER T, LORENZEN M, et al. Functional analysis of the ATPbinding cassette (ABC) transporter gene family of Tribolium castaneum [J/OL]. BMC Genomics, 2013, 14(1): 6. DOI: 10.1186/14712164146.
[20]GRUNTENKO N E, RAUSCHENBACH I Y. Interplay of JH, 20E and biogenic amines under normal and stress conditions and its effect on reproduction [J]. Journal of Insect Physiology, 2008, 54(6): 902908.
[21]VELLICHIRAMMAL N N, GUPTA P, HALL T A, et al. Ecdysone signaling underlies the pea aphid transgenerational wing polyphenism [J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(6): 14191423.
[22]ZHANG Chuanxi, BRISSON J A, XU Haijun. Molecular mechanisms of wing polymorphism in insects [J]. Annual Review of Entomology, 2019, 64(1): 297314.
[23]TAN A, PALLI S R. Ecdysone receptor isoforms play distinct roles in controlling molting and metamorphosis in the red flour beetle, Tribolium castaneum [J]. Molecular and Cellular Endocrinology, 2008, 291(1/2): 4249.
[24]ZHAI Yifan, ZHANG Zhiming, GAO Huanhuan, et al. Hormone signaling regulates nymphal diapause in Laodelphax striatellus (Hemiptera: Delphacidae) [J/OL]. Scientific Reports, 2017, 7(1): 13370. DOI: 10.1038/s4159801713879y.
[25]張思宇. 激素调控下荻草谷网蚜翅型分化的分子机制解析[D].荆州: 长江大学, 2022.
[26]YAMANAKA N, MARQUS G, O’CONNOR M B. Vesiclemediated steroid hormone secretion in Drosophila melanogaster [J]. Cell, 2015, 163(4):907919.
[27]HOCK T, COTTRILL T, KEEGAN J, et al. The E23 early gene of Drosophila encodes an ecdysoneinducible ATPbinding cassette transporter capable of repressing ecdysonemediated gene activation [J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(17): 95199524.
[28]何旺. 桔小实蝇ABC转运蛋白G亚家族基因表达模式及BdABCG2纯合突变品系构建[D]. 重庆: 西南大学, 2021.
[29]HIGGINS C F. ABC transporters: From microorganisms to man [J]. Annual Review of Cell Biology, 1992, 8: 67113.
[30]DERMAUW W, VAN LEENUWEN T. The ABC gene family in arthropods: Comparative genomics and role in insecticide transport and resistance [J]. Insect Biochemistry and Molecular Biology, 2014, 45: 89110.
[31]DEAN M, HAMON Y, CHIMINI G. The human ATPbinding cassette (ABC) transporter superfamily [J]. Journal of Lipid Research, 2001, 42(7): 10071017.
[32]MISRA J R, HORNER M A, LAM G, et al. Transcriptional regulation of xenobiotic detoxification in Drosophilae [J]. Genes & Development, 2011, 25(17): 17961806.
[33]WANG Nan, LAN Debin, CHEN Wengen, et al. ATPbinding cassette transporters G1 and G4 mediate cellular cholesterol efflux to highdensity lipoproteins [J]. Proceedings of The National Academy of Sciences of The United States of America, 2004, 101(26): 97749779.
[34]徐達. 基于冷冻电镜的人ABC转运蛋白ABCG1和ABCD4结构与功能研究[D]. 北京: 中国科学技术大学, 2021.
