云南怒江番茄种植新区番茄病毒检测及病毒种传特性
2024-02-06刘玉莹熊志琦苏晓霞王田田吴阔郑宽瑜张仲凯
刘玉莹 熊志琦 苏晓霞 王田田 吴阔 郑宽瑜 张仲凯





摘要
病毒病對番茄生产造成严重危害,近年来在番茄种植新区发生严重,疑似为种子带毒传播。本研究通过对云南省怒江州番茄种植新区的番茄病毒病样品采用RNAseq高通量测序,RTPCR验证的方法检测病毒种类;对番茄病果种子进行超薄切片制样透射电子显微镜观察,将病果种子播种后对种苗进行RTPCR带毒检测。结果表明,RNAseq高通量测序及RTPCR检测到的病毒有番茄环纹斑点病毒(tomato zonate spot orthotospovirus,TZSV)、番茄黄斑驳相关病毒(tomato yellow mottleassociated virus,TYMaV)、辣椒脉斑驳病毒(chili veinal mottle virus,ChiVMV)、南方番茄病毒(southern tomato virus,STV)。透射电镜观察到种胚细胞及胚乳细胞中分布典型的正番茄斑萎病毒属Orthotospovirus病毒粒体。病果种子播种28 d后的种苗具有病毒病症状,通过RTPCR检出TZSV、ChiVMV、STV,检出率分别为60%、100%、80%。上述研究结果为TZSV通过种子传播提供了有利的证据,并为源头防控番茄病毒病提供了依据。
关键词
番茄; 番茄病毒; 病毒检测; RNAseq; 种传病毒
中图分类号:
S 436.412
文献标识码: A
DOI: 10.16688/j.zwbh.2022753
Detection and seed transmission characteristics of tomato viruses in tomato planting new area of Nujiang, Yunnan
LIU Yuying1,2, XIONG Zhiqi1,2, SU Xiaoxia1, WANG Tiantian1, WU Kuo1,ZHENG Kuanyu1*, ZHANG Zhongkai1*
(1. Biotechnology and Genetic Germplasm Resources Research Institute, Yunnan Academy of Agricultural Sciences,
Yunnan Provincial Key Lab of Agricultural Biotechnology, Kunming 650205, China; 2. School of Agriculture,
Yunnan University, Kunming 650504, China)
Abstract
Virus diseases have caused serious harm to tomato production. In recent years, it has occurred seriously in some new tomato planting area, and the source of the viruses were suspected from the tomato seeds. In this study, RNAseq highthroughput sequencing and RTPCR were used to detect virus species in diseased tomato samples in the new tomato planting area of Nujiang prefecture, Yunnan province. Furthermore, the diseased tomato fruit seeds were collected for ultrathin section preparation and electron microscopy observation. After seeding of diseased tomato fruit seeds, the seedlings were detected for viruses by RTPCR. The results showed that the viruses detected by RNAseq and RTPCR include tomato zonate spot orthotospovirus (TZSV), tomato yellow mottleassociated virus (TYMaV), chili veinal mottle virus (ChiVMV) and southern tomato virus (STV). The Orthotospovirus virions were observed in the embryo cells of the diseased tomato fruit seeds by transmission electron microscopy (TEM). 28 days after the diseased fruit seeds were sown, the viral like symptoms were observed on seedlings. TZSV, ChiVMV and STV were detected on seedling by RTPCR, and the infection rates were 60%, 100% and 80%, respectively. These results provide strong evidence for TZSV transmission by seeds and provide a basis for source prevention and control of tomato virus disease.
Key words
tomato; tomato virus; virus detection; RNAseq; seedtransmitted virus
番茄Solanum lycopersicum L.是全球蔬菜生产中的大宗作物,而我国则是全球番茄生产面积与产量最大的国家。病毒病是危害番茄生产的主要病害。根据文献报道至少有312种病毒及病毒类致病因子(类病毒、卫星病毒和病毒卫星分子等)与番茄相关[1]。已报道的侵染番茄的主要病毒为烟草花叶病毒属Tobamovirus病毒[2],马铃薯Y病毒属Potyvirus病毒[34],正番茄斑萎病毒属Orthotospovirus病毒[56],菜豆金色花叶病毒属Begomovirus病毒[7],以及黄瓜花叶病毒(cucumber mosaic virus,CMV)[8]、南方番茄病毒(southern tomato virus,STV)[9]等。通过对我国19个地区采集的170份番茄样品进行检测,发现有22种番茄病毒,其中STV、番茄环纹斑点病毒(tomato zonate spot orthotospovirus,TZSV)、辣椒脉斑驳病毒(chili veinal mottle virus,ChiVMV)等为主要的流行病毒[10]。
TZSV是Orthotospovirus属病毒,首次发现于云南省,为目前云南番茄上的主要流行病毒[11]。感染TZSV的番茄果实表面均分布有同心圆状的斑纹,叶片出现坏死斑等症状[12]。自然条件下TZSV由蓟马传毒,但其同属的番茄斑萎病毒(tomato spot wilt orthotospovirus,TSWV)已被证实可以通过种子进行传播[13]。ChiVMV是Potyvirus属病毒,我国首次发现于海南省[14],侵染寄主以马铃薯、番茄、辣椒为主,主要通过蚜虫传播[15],目前未见ChiVMV通过种子传播的报道,但一部分Potyvirus属病毒,如大豆花叶病毒(soybean mosaic virus,SMV)、菜豆普通花叶病毒(bean common mosaic virus,BCMV)等已经被证实可以通过种子传播[16]。STV是无鞭毛病毒属Amalgavirus病毒[9],侵染番茄导致花叶病和黄色发育障碍,我国于2012年首次在山东省发现[17]。STV目前明确为种传病毒,尚未发现其他传播途径,也未明确其病毒粒体形态[18]。番茄黄斑驳相关病毒(tomato yellow mottleassociated virus,TYMaV)是细胞质弹状病毒属Cytorhabdovirus病毒,首次发现于重庆,携带这种病毒的番茄叶片表现小叶叶片外翻、黄色斑点、皱缩和斑点等症状;在进化上与从蚜虫中分离的昆虫病毒非常接近,可能由蚜虫传播[10]。
种子是病毒传播的主要途径之一[19]。带病毒种子通过贸易、调运等方式进行远距离传播,并且作为田间的初侵染源,是导致病毒病发生流行、产生危害的重要原因[20]。近年来的调查发现,在无初侵染源和传毒介体昆虫分布的番茄种植新区,番茄病毒病发生危害普遍,疑似种子携带病毒传播。本研究对高黎贡山相对隔离的怒江州泸水市鲁掌镇的1个番茄种植新区发生的番茄病毒病进行采样检测,应用高通量测序方法检测病毒种类,对发病果实的种子进行超薄切片制样,透射电子显微镜观察明确种子是否携带病毒,采用病毒特异性引物对种子和苗进行RTPCR检测,确定带病毒种子是否传毒,为源头防控番茄病毒病提供依据。
1 材料与方法
1.1 样品来源
2020年7月在怒江州泸水市鲁掌镇的番茄种植新区进行病毒病害调查。泸水市鲁掌镇番茄种植新区四面环山,为相对隔离的种植环境(图1a),调查该种植区内番茄病害情况,发现番茄果实主要表现2种症状,一种为成熟果实上具黄色斑点及环斑(图1b),样品编号为20YV048;另一种为未成熟果实上褐色坏死斑(图1c),样品编号为20YV049。
1.2 方法
1.2.1 RNAseq高通量测序分析
分别对样品20YV048及20YV049进行RNAseq高通量测序。使用TRIzol (Thermo Fisher Scientific, Madison, WI, USA)提取病果番茄總RNA,并用RiboZero Plant (Illumina, San Diego, CA, USA)去除核糖体RNA后,使用HiFiScriptgDNA Removal RT MasterMix(康为世纪,北京,中国)试剂盒将RNA反转录为cDNA,使用Illumina测序平台进行建库测序 (IlluminaHiSeq X ten),单
图1 怒江州泸水市鲁掌镇番茄种植新区生境及番茄症状
Fig.1 Habitat of new tomato planting area in Luzhang town, Lushui city, Nujiang prefecture and tomato symptoms
条reads读长150 bp,每个样品测序3 G的原始数据量。使用Trinity 软件(trinityrnaseq_r20131110)进
行序列拼接,并在NCBI上进行BLASTN及BLASTX比对注释。以拼接注释到的病毒全序列为模板,进一步在clean reads数据库中进行比对,统计各病毒比对到的reads数,进一步根据各病毒reads数计算Transcripts Per Kilobase Million (TPM),即各病毒在样本中的相对占比。使用NCBI BLAST进行序列相似性分析,使用MEGA 6.0软件,邻接法1 000次重复比对进行系统进化树分析。
1.2.2 超薄切片制样透射电子显微镜观察
将番茄病果样品种子取出,去除种皮,对种胚按照文献中的方法进行超薄制样[21],应用FEI透射电子显微镜(Tecnai G2 Spirit TWIN)对样品进行观察和拍照。
1.2.3 番茄病果种子采集与播种
采集番茄病果种子,用20%次氯酸钠进行表面消毒5 min后[22],单粒分别放入垫有灭菌滤纸的培养皿中,加入无菌蒸馏水,保持培养皿的湿润,光照培养箱28℃进行催芽,待番茄种子发芽后,移栽到灭菌的土壤中进行种植,待长出4片真叶后取叶片进行病毒检测。
1.2.4 RTPCR检测
使用RNA快速提取试剂盒(宝生物,日本)对番茄种苗的总RNA进行提取,通过一步法反转录试剂盒(康为世纪,中国)将RNA反转录为cDNA。根据RNAseq测序结果,分别针对TYMaV、TZSV、ChiVMV、STV序列设计特异性引物(表1)进行RTPCR扩增。RTPCR反应体系为20 μL:2×Taq Master Mix 10 μL,cDNA模板3 μL,RNaseFree水6 μL,上游引物 0.5 μL,下游引物 0.5 μL。98℃预变性10 s;98℃变性10 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃延伸5 min。
2 结果与分析
2.1 怒江州番茄种植新区番茄病毒病样品的病毒种类
RNAseq高通量测序得到20YV048 raw reads为23.89 M,去除冗余序列和低质量序列后得到的clean reads为23.48 M,Q30为94.53%;20YV049 raw reads为25.11 M,去除冗余序列和低质量序列后得到的clean reads为24.61 M,Q30为94.14%。对得到的clean reads使用Trinity软件进行拼接,拼接后的序列经注释后,在2个样本20YV048及20YV049中均发现有4种植物病毒,包括TZSV、TYMaV、STV、ChiVMV。进一步采用RTPCR对两个样本20YV048及20YV049进行病毒检测及测序,结果在2个样本中均检测到以上4个病毒。以上4个病毒全基因组序列为模板,对clean reads数据库进行比对,统计各病毒的reads数,以TPM值计算各病毒reads数在样本中的相对丰度占比,发现TZSV在20YV048中丰度占比为94.77%,在20YV049中丰度占比为99.01%,在2个样本中均为优势病毒。比较2个样本中TZSV_S、TZSV_M及TZSV_L片段的相对丰度占比,发现20YV048中TZSV_S片段相对丰度占比(61.96%)高于20YV049(52.95%),而20YV049中TZSV_M及TZSV_L片段相对丰度占比(33.68%,12.38%)高于20YV048(24.05%,8.76%)(表2)。
2.2 怒江州番茄种植新区番茄病毒病样品的病毒序列分析
根据BLAST比对结果,TZSV怒江分离物N基因序列与云南烟草分离物11YV229(JN116581)N基因序列具有最高相似性,达97.37%;根据系统进化树,与TZSV云南鬼针草分离物MG656993聚在同一分支(图2a)。ChiVMV怒江分离物与四川分离株 Yp8(KC711055.1)具有最高相似性(97.28%);根据系统进化树,ChiVMV怒江分离物与四川分离物KC711056,MK405594, KC711055聚在同一分支,親缘关系最近,而与云南烟草分离物JX088636亲缘关系相对较远(图2b)。STV怒江分离物与泰国分离物LC487710.1相似性最高,达99.91%;根据系统进化树,STV怒江分离物与泰国分离物LC487710.1、孟加拉分离物KT634055.1、英国分离物KY810783.1、塞尔维亚分离物MT269808.1聚在同一分支(图2c)。TYMaV怒江分离物与目前报道的TYMaV分离物相似性在85.1%~85.6%,其中与浙江分离物OP296980.1具有最高相似性,达85.6%,根据系统进化树分析,与广东分离物MW527091.1亲缘关系最近,聚在同一分支,相似性为85.4%(图2d)。
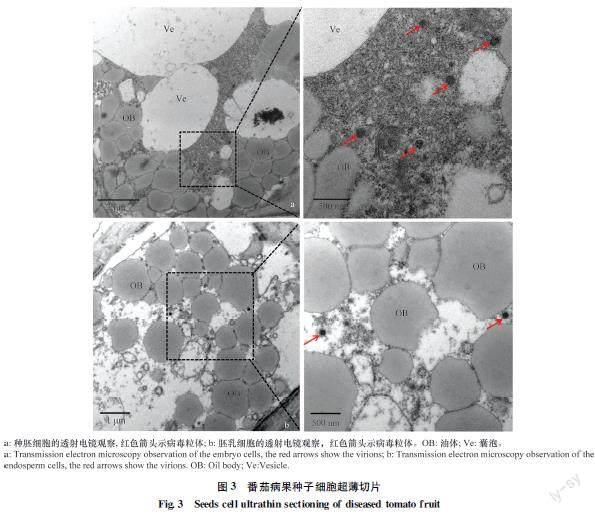
2.3 番茄病果种胚及胚乳中病毒粒体的电子显微镜观察
通过FEI透射电子显微镜80 kV加速电压观察,在20YV048及20YV049样品果实种子的种胚细胞及胚乳细胞上发现具囊泡包裹的球状病毒粒体,直径约80~120 nm,为典型的正番茄斑萎病毒属病毒粒体的形态特征[6,21],病毒粒体呈单颗粒,外有单层膜包裹,分布于细胞质中(图3)。
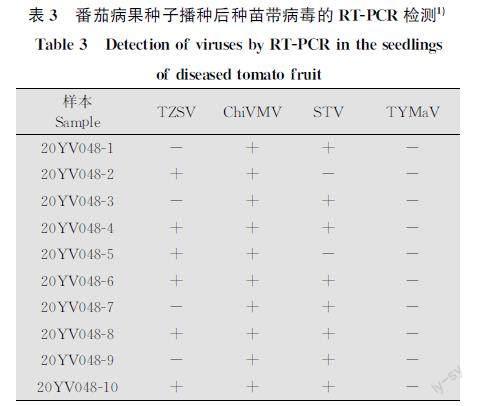
2.4 番茄病果种子播种种苗的RTPCR检测
进一步将收集的20YV048病果种子播种,约28 d后,发现其种苗叶脉坏死,叶片出现黄斑、黄化及坏死斑等(图4)典型病毒病症状。选取10株种苗分别进行TZSV、TYMaV、ChiVMV、STV病毒的RTPCR检测(表3),检测结果显示,病果种子发育的种苗上检测到TZSV、ChiVMV及STV 3种病毒,TZSV的检出率为60%,ChiVMV检出率为100%,STV的检出率为80%,TYMaV检出率为0%。
3 结论与讨论
种传病毒分为两种:一种是胚外感染,即病毒粒体存在于种皮或表面,或者胚乳中,未进入种胚;另一种是胚内感染,即病毒粒体进入种胚[23]。烟草花叶病毒属病毒,如烟草花叶病毒(tobacco mosaic virus,TMV)、黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)、褐色皱纹果病毒(tomato brown rugose fruit virus,ToBRFV)、番茄花叶病毒(tomato mosaic virus,ToMV)等主要以胚外感染为主[2425]。此类病毒可长期稳定地存在于种皮(或种皮表面),即使在种子收获和脱水后病毒也能长期保持侵染活性,受病毒污染的种子发芽后则通过摩擦接触或机械传播等方式二次传播侵染幼苗[24]。Potyvirus属病毒中SMV、BCMV、豌豆种传花叶病毒(pea seedborne mosaic virus,PSbMV)等为胚内感染的病毒[16],病毒粒体可侵染种胚,其侵染途径可发生在种胚发育前,由胚珠、大孢子母细胞或花粉母细胞携带病毒发生侵染,或在种胚发育过程中由病毒直接侵染[16]。Orthotospovirus属病毒目前报道的可种传病毒有2个,一个为大豆脉坏死病毒(soybean vein necrosis virus,SVNV)[26],一个为TSWV,其中TSWV被证实能侵染种胚,但同时研究显示胚乳带毒率要显著高于种胚带毒率[13]。TZSV与TSWV为同属病毒,本研究虽然在番茄种胚及胚乳中均发现番茄斑萎病毒属病毒粒体,结合RNAseq及RTPCR检测结果,初步证明TZSV可通过种子传播,但TZSV主要通過种胚感染还是胚外感染进行种传仍需要进一步研究。此外,在病果的子代种苗中检测到ChiVMV和STV,说明ChiVMV和STV也可能为种传病毒。但由于本研究中的试验材料为复合侵染样品,样品中TZSV为优势种病毒,ChiVMV和STV表达丰度较低,未能在种胚或胚乳中发现ChiVMV和STV病毒粒子,种传证据还不够充分。下一步应通过单接种病毒及种子不同组织部位带毒检测、免疫标记定位等手段进一步明确ChiVMV和STV在种子中的分布特征及种传特性。
种子携带病毒可以在亲本与子代之间垂直传播,也可以在作物与作物之间水平传播[27]。种子带毒是田间的重要初侵染源,可通过接触摩擦、介体传毒等方式进一步形成二次侵染,引起病毒病的暴发流行,造成严重危害。因此,加强对种子带病毒的检测,降低种子带病毒率可有效防止病毒病的发生。采用盐酸浸种、干热处理、温汤浸种以及臭氧(10 g/m3)熏蒸处理可将种传病毒的浓度降低,且对种子发芽不会产生任何影响[19]。对于进入种子胚中的病毒,一般采用干热处理钝化种子胚中的病毒。
参考文献
[1] RIVAREZMPS, VUCˇUROVIC' A, MEHLE N, et al. Global advances in tomato virome research: current status and the impact of highthroughput sequencing [J/OL]. Frontiers in Microbiology, 2021, 12: 671925. DOI: 10.3389/fmicb.2021.671925.
[2] ISHIBASHI K, ISHIKAWA M. Replication of tobamovirus RNA [J]. Annual Review of Phytopathology, 2016, 54: 5578.
[3] ZHAO Feifei, XI Deihui, LIU Jian, et al. First report of chilli veinal mottle virus infecting tomato (Solanum lycopersicum) in China [J]. Plant Disease, 2014, 98(11): 1589.
[4] PRIGIGALLO M I, KRINIK M, PAOLA D, et al. Potato virus Y infection alters small RNA metabolism and immune response in tomato [J/OL]. VirusesBasel, 2019, 11(12): 1100. DOI: 10.3390/v11121100.
[5] HU Zhongze, FENG Zhike, ZHANG Zhijun, et al. Complete genome sequence of a tomato spotted wilt virus isolate from China and comparison to other TSWV isolates of different geographic origin [J]. Archives of Virology, 2011, 156(10): 19051908.
[6] ZHANG Zhongkai, ZHENG Kuanyu, DONG Jiahong, et al. Clustering and cellular distribution characteristics of virus particles of tomato spotted wilt virus and tomato zonate spot virus in different plant hosts [J/OL].Virology Journal, 2016, 13: 11. DOI: 10.1186/s129850160466x.
[7] KIL E J, KIM S, LEE Y J, et al. Tomato yellow leaf curl virus (TYLCVIL): a seedtransmissible geminivirus in tomatoes [J/OL]. Scientific Reports, 2016, 6: 19013. DOI: 10.1038/srep19013.
[8] 劉勇, 李凡, 李月月, 等. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J]. 中国农业科学, 2019, 52(2): 239261.
[9] ELVIRA G L, PEIR R, RUBIO L, et al. Persistent southern tomato virus (STV) interacts with cucumber mosaic and/or pepino mosaic virus in mixedinfections modifying plant symptoms, viral titer and small RNA accumulation [J/OL]. Microorganisms, 2021, 9(4): 689. DOI: 10.3390/microorganisms9040689.
[10]XU Chenxi, SUN Xuepeng, TAYLOR A, et al. Diversity, distribution, and evolution of tomato viruses in China uncovered by small RNA sequencing [J/OL]. Journal of Virology, 2017, 91(11): e0017317. DOI: 10.1128/JVI.0017317.
[11]LI Yueyue, TAN Guanlin, XIAO Long, et al.A multiyear survey and identification of pepperand tomatoinfecting viruses in Yunnan province, China [J/OL].Frontiers in Microbiology, 2021, 12: 623875. DOI: 10.3389/fmicb.2021.623875.
[12]DONG Jiahong, CHENG Xiaofei, YIN Yueyan, et al. Characterization of tomato zonate spot virus, a new tospovirus in China [J]. Archives of Virology, 2008, 153(5): 855864.
[13]WANG Hongwei, WU Xiujuan, HUANG Xiande, et al. Seed transmission of tomato spotted wilt orthotospovirus in peppers [J/OL]. VirusesBasel, 2022, 14: 1873. DOI: 10.3390/v14091873.
[14]WANG Jianhua, LIU Zhixin, NIU Shuxian, et al. Natural occurrence of chilliveinal mottle virus on Capsecum Chinese in China [J/OL]. Plant Disease, 2006, 90: 377. DOI: 10.1094/PD900377C.
[15]GAO Fangluan, JIN Jing, ZOU Wenchao, et al.Geographically driven adaptation of chilli veinal mottle virus revealed by genetic diversity analysis of the coat protein gene [J]. Archives of Virology, 2016, 161(5): 13291333.
[16]SASTRY K S. Seedborne plant virus diseases [M]. Delhi:Springer India, 2013.
[17]PADMANABHAN C, ZHENG Yi, LI Rugang, et al. Complete genome sequence of southern tomato virus identified in China using nextgeneration sequencing [J/OL]. Genome Announcements, 2015, 3: e0122615. DOI: 10.1128/genomeA.0122615.
[18]SABANADZOVIC S I, VALVERDE R A, BROWN J K, et al. Southern tomato virus: the link between the families Totiviridae and Partitiviridae [J]. Virus Research, 2009, 140(1/2): 130137.
[19]周玉忠, 王忠全, 夏世龙, 等. 不同处理方式对蔬菜种传病毒病的消毒效果评价[J]. 中国果菜, 2020, 40(3): 6164.
[20]郑棚峻,张宇, 张松柏, 等. 葫芦科作物重要种传病毒研究进展[J]. 江苏农业科学, 2017, 45(3): 59.
[21]尚卫娜. 番茄斑萎病毒和番茄环纹斑点病毒细胞病理学及其运动蛋白的研究[D]. 杭州:浙江大学, 2012.
[22]刘昊,杨雨晴,邵一飞,等.番茄种子消毒方法探究[J].山东农业大学学报(自然科学版),2019,50(3):393398.
[23]李莉. 玉米种子传播甘蔗花叶病毒的研究[D]. 北京: 中国农业科学院, 2003.
[24]SALEM N M, SULAIMAN A, SAMARAH N, et al. Localization and mechanical transmission of tomato brown rugose fruit virus in tomato seeds [J]. Plant Disease, 2022, 106(1): 275281.
[25]SUI Xuelian, LI Rugang, SHAMIMUZZAMAN M, et al. Understanding the transmissibility of cucumber green mottle mosaic virus in watermelon seeds and seed health assays [J]. Plant Disease,2019, 103(6): 11261131.
[26]GROVES C, GERMAN T, DASGUPTA R, et al. Seed transmission of soybean vein necrosis virus: the first tospovirus implicated in seed transmission [J/OL]. PLoS ONE, 2016, 11(1): e0147342. DOI:10.1371/journal.pone.0147342.
[27]MONTES N, PAGN I. Light intensity modulates the efficiency of virus seed transmission through modifications of plant tolerance [J/OL]. Plants, 2019, 8(9): 304. DOI: 10.3390/plants8090304.
(責任编辑:田 喆)
