罗伊氏粘液乳杆菌HCS02-001 培养方法优化及改善睡眠功能研究
2024-02-05李雪龙林欣余萍杨思彭永振矫艳平陈雪娇
宋 佳,李雪龙,林欣 梅,余萍,杨思 程,彭永振,矫艳平,陈雪娇
1.江西仁仁健康微生态科技有限公司,江西 樟树 331200;2.仁仁微生物科技研究(沈阳)有限公司,沈阳 110170;3.杭州民生健康药业股份有限公司,杭州 310000
失眠是一种较为常见的健康问题,主要表现为入睡困难,并带有烦躁和疲劳症状[1]。失眠的病因受多方面影响,如环境因素导致入睡困难,身体不适或者存在焦虑等情绪导致的难以入睡等。另外,伴随着年龄增长,体内的褪黑素分泌减少,中枢神经系统发生变化,导致睡眠功能下降[2-4]。失眠的治疗方法繁多,主要为药物治疗和非药物治疗[5]。药物治疗效果好、见效快,但是长时间服用药物会产生依赖性,导致不良反应[6]。非药物治疗如物理疗法和膳食疗法等,没有不良反应,但见效较慢,需要长期治疗[7]。因此,亟需开发能够高效改善睡眠质量、无不良反应的产品。
γ 氨基丁酸(GABA)是哺乳动物中枢神经系统的主要神经传递物质,具有抑制兴奋、抗焦虑、催眠的作用[8-9]。GABA 可以提高葡萄糖磷脂酶的活性,使大脑内的血流得到活化,加速大脑的能量代谢,提升脑部供氧能力,改善神经功能,从而达到促眠的作用[10-11]。人体胃、肠道内存在着大量的益生菌,已有研究发现肠道菌群和中枢神经系统之间存在密切关系[12]。睡眠受到大脑调控,人体肠道内的微生物及其代谢物同样对睡眠起到调节作用,从而形成了菌-肠-脑轴的关系,其中GABA是益生菌发挥改善睡眠效果的途径之一[13-14]。
本实验室前期筛选、鉴定了1 株高产GABA的罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)HCS02-001[15]。本研究通过响应面试验优化L.reuteriHCS02-001 高产GABA 的最佳培养方法,并通过直接睡眠试验、戊巴比妥钠阈下剂量催眠试验等小鼠实验,验证L.reuteriHCS02-001 对睡眠的改善作用,以期为其在助睡眠领域的应用提供研究基础。
1 材料与方法
1.1 实验仪器
恒温培养箱(DHP-500BS)购自北京市永光明医疗仪器有限公司;灭菌锅(LDZX-50KBS)购自上海申安医疗器械厂;无菌操作台(SW-CJ-1D)购自上海沪净医疗器械有限公司;高速冷冻离心机(TGL-16M)购自湖南湘仪实验室仪器开发有限公司;分析天平(京制00000246 号)购自赛多利斯科学(北京)有限公司;纯水仪(UPT-II-20T)购自四川优普超纯科技有限公司;酶标仪(EPOCH2NSC-SN)购自美国伯腾仪器有限公司;水浴锅(XMTD-7000)购自北京市永光明医疗器械有限公司。
1.2 实验材料
1.2.1 试剂 酵母蛋白胨购自安琪酵母股份有限公司;番茄汁由本实验室自制;牛肉粉(生化试剂)购自上海缘肽生物技术有限公司;酵母粉(生化试剂)购自安琪酵母股份有限公司;磷酸氢二钾、七水合硫酸镁、硫酸锰、柠檬酸(均为分析纯)购自江苏科伦多食品配料有限公司;葡萄糖(分析纯)购自石药集团圣雪葡萄糖有限责任公司;吐温-80购自江苏四新界面剂科技有限公司。
1.2.2 培养基 改良的MRS培养基:葡萄糖10 g、酵母蛋白胨20 g、酵母浸出物6 g、牛肉粉3 g、磷酸二氢钾2 g、一水柠檬酸15 g、乙酸钠5 g、七水合硫酸镁0.58 g、硫酸锰0.25 g、吐温-80 0.6 g、L-谷氨酸钠15 g,定容至含1%番茄汁的1 L蒸馏水中,调pH至6.5,115 ℃灭菌30 min后室温冷却备用。
GABA 标准品(B21979)购自上海源叶生物科技有限公司;L-谷氨酸钠(生化试剂)、碳酸钠(分析纯)、无水乙醇(分析纯)购自国药集团化学试剂有限公司;苯酚(分析纯)购自天津市大茂化学试剂厂;次氯酸钠(分析纯)购自天津市富宇精细化工有限公司;硼砂(分析纯)购自天津市瑞金特化学品有限公司;罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)益生菌冻干粉由本实验室自制,规格2×1011CFU·g-1;戍巴比妥钠和巴比妥那(纯度>99%)均购自上海化学试剂公司。
1.3 实验方法
1.3.1 单因素试验 将保藏于-80 ℃的L.reuteriHCS02-001 菌株室温解冻并混匀,取1 环菌液于MRS 固体平板划线,37 ℃静置培养48 h。挑单菌落至5 mL MRS 液体培养基中,37 ℃培养20 h 得种子液。以5%的接种量将种子液接种至改良MRS液体培养基中培养。
以GABA 质量浓度为考察指标,优化培养温度、培养时间和初始pH。固定培养时间24 h,初始pH 为6.5,优化培养温度水平分别为35、36、37、38、39 ℃;固定初始pH为6.5,培养温度为37 ℃,优化培养时间水平分别为20、22、24、26、28 h;固定培养时间24 h,培养温度为37 ℃,优化初始pH 分别为6.1、6.3、6.5、6.7、6.9。
1.3.2 响应面试验 采用3 因素3 水平响应面试验,以GABA 质量浓度为响应值,对培养温度、培养时间、初始pH 3个工艺参数进行优化,确定L.reuteriHCS02-001最优培养方法,试验设计见表1。
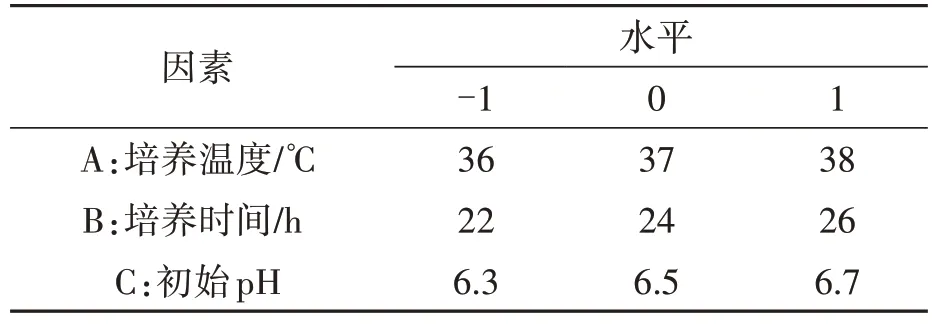
表1 响应面各因素水平Table 1 The levels of response surface factors
1.3.3 GABA质量浓度的测定 标准曲线的绘制:分别取0.4 mL 配制好的标准溶液,加入0.1 mL 0.1 mol·L-1碳酸钠、0.5 mL 0.2 mol·L-1pH 9.0 的硼酸盐缓冲液、1 mL 6%苯酚和1 mL 10%次氯酸钠溶液,混匀后放置4~8 min,沸水浴10 min 后冰浴20 min,待溶液出现蓝绿色后,加入2 mL 60%的乙醇溶液,混匀后静置30 min,于640 nm 处测定吸光度值。以GABA 浓度为横坐标,OD640为纵坐标绘制标准曲线。
样品检测:培养好的菌液5 000 r·min-1离心20 min 后取上清液1 mL,用超纯水稀释20 倍后,经0.22 μm 滤膜过滤备用,检测步骤同标准曲线的绘制。
1.3.4 改善睡眠实验及动物实验分组 实验参照《保健食品检验与评价技术规范(2003 版)》中改善睡眠功能规范部分进行评价[16]。将50 只SPF级6周龄雄性小鼠动物根据体重随机分为5组,每组10 只,分为空白对照组、GABA 溶液组、L.reuteriHCS02-001低剂量组、中剂量组和高剂量组。在环境适宜的条件下饲喂小鼠1 周后,开始灌胃处理。空白对照组每天灌胃无菌生理盐水,GABA 溶液组灌胃8.33 mg·kg-1·bw 的GABA,L.reuteriHCS02-001 实验组按照成人益生菌食用量(2×1010CFU·d-1)的5 倍、10 倍、20 倍设置低剂量组灌胃浓度为8.33 mg·kg-1·bw、中剂量组灌胃浓度为16.67 mg·kg-1·bw、高剂量组灌胃浓度为33.33 mg·kg-1·bw,每天灌胃1次,小鼠的灌胃量为20 mL·kg-1·bw,连续灌胃4 周。环境温度维持在25 ℃左右,湿度控制在50%左右[17]。
1.3.5 直接睡眠实验 当日灌胃后观测并记录小鼠出现直接入睡的情况。将小鼠处在背卧位置,立即翻身时出现的现象为翻正反射。小鼠是否进入睡眠通过是否出现翻正反射判断,如果小鼠30~60 s 内不能翻回身位,说明翻正反射现象消失,小鼠进入睡眠;当小鼠翻回正常身位,说明小鼠结束睡眠恢复清醒[18]。
1.3.6 延长戊巴比妥钠催眠小鼠的睡眠时间实验 小鼠经过灌胃后,30 min 后向小鼠注射戊巴比妥钠诱导睡眠,注射量为10 mL·kg-1·bw,以翻正反射消失后再次出现的时间为小鼠的睡眠时间,记录各组小鼠睡眠时间是否延长[19]。
1.3.7 戊巴比妥钠阈下剂量催眠实验 动物的给药方式同1.3.6,以翻正反射消失达到1 min以上的小鼠被认为进入睡眠状态,记录各组小鼠30 min内入睡数量和入睡率[20]。
1.3.8 巴比妥那睡眠潜伏期实验 动物的给药方式同1.3.6,注射巴比妥那腹腔注射剂后,小鼠的潜伏期为小鼠注射巴比妥那到翻正反射消失的时间,观察受试物对巴比妥那潜伏期的影响[21]。
1.3.9 结果判定 延长戊巴比妥钠催眠小鼠的睡眠时间实验、戊巴比妥钠阈下剂量催眠实验、巴比妥那睡眠潜伏期实验,3 项实验中有2 项为阳性,且无明显直接睡眠的作用,即可认为该样品具有改善睡眠的作用。
1.4 统计学分析
每个试验进行3 次平行测定,得到的数据使用SPSS 17.0 软件进行单因素方差分析(one-way ANOVA),采用Duncan's 法进行多重比较,结果使用Origin 8.0进行图形绘制。数据以平均值±标准误表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 三级培养温度对GABA 产量的影响 温度是影响胞内酶的产生和生物合成等相关代谢的重要因素之一。考察不同培养温度对L.reuteriHCS02-001 产GABA 量的影响,结果如图1 所示。GABA 质量浓度随着温度的升高先升高后下降,在发酵温度为37 ℃时GABA 质量浓度最高达到5.62 g·L-1。这说明温度过高或过低都会影响菌体内部的代谢活动,影响着菌体内部谷氨酸脱羧酶的活性,进而降低GABA 的产量。因此,L.reuteriHCS02-001的最佳培养温度为37 ℃。

图1 培养温度对罗伊氏粘液乳杆菌HCS02-001中GABA产量的影响Fig.1 Effect of culture temperature on GABA production by Limosilactobacillus reuteri HCS02-001
2.1.2 三级培养时间对GABA 产量的影响 选择培养温度为37 ℃,培养初始pH 为6.5,考察不同培养时间对L.reuteriHCS02-001 中GABA 产量的影响,结果如图2 所示。随着培养时间的增加,GABA 的产量先升高后达到平稳的状态,培养时间为24 h时GABA质量浓度最高,达到5.61 g·L-1。这说明发酵后期菌体进入稳定生长期,菌体将培养基中的底物转化为GABA,因此选择培养时间24 h为最佳。
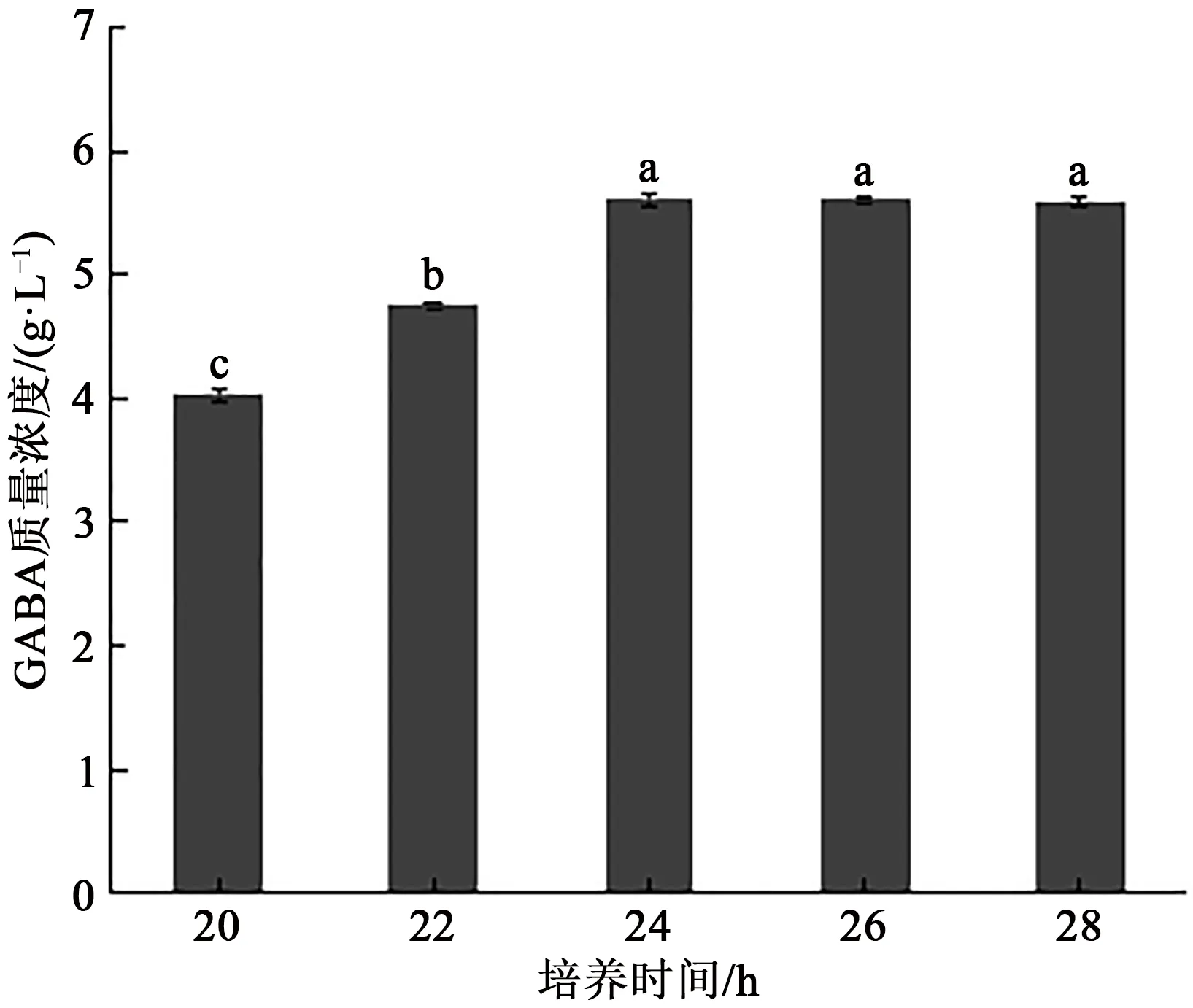
图2 培养时间对罗伊氏粘液乳杆菌HCS02-001中GABA产量的影响Fig.2 Effect of culture time on GABA production by Limosilactobacillus reuteri HCS02-001
2.1.3 三级培养初始pH对GABA产量的影响 pH是微生物发酵的重要因素之一,偏低时抑制了菌体的正常生长,谷氨酸脱羧酶的量降低不能满足GABA 的转化。选择培养时间为24 h,培养温度为37 ℃,考察不同初始pH 对L.reuteriHCS02-001中GABA产量的影响,结果如图3所示。在初始pH为6.5时GABA质量浓度最高,达到5.53 g·L-1。当pH 超过6.5时,谷氨酸脱羧酶的活性降低,因此选择最适pH为6.5。

图3 初始pH对罗伊氏粘液乳杆菌HCS02-001中GABA产量的影响Fig.3 Effect of initial pH on GABA production by Limosilactobacillus reuteri HCS02-001
2.2 响应面实验
在单因素试验的基础上,以GABA 产量为响应值,选择培养温度(A)、培养时间(B)、初始pH(C)为3 种因素,应用Box-Behnken 设计方案进行3因素3水平响应面试验,并将结果列于表2。
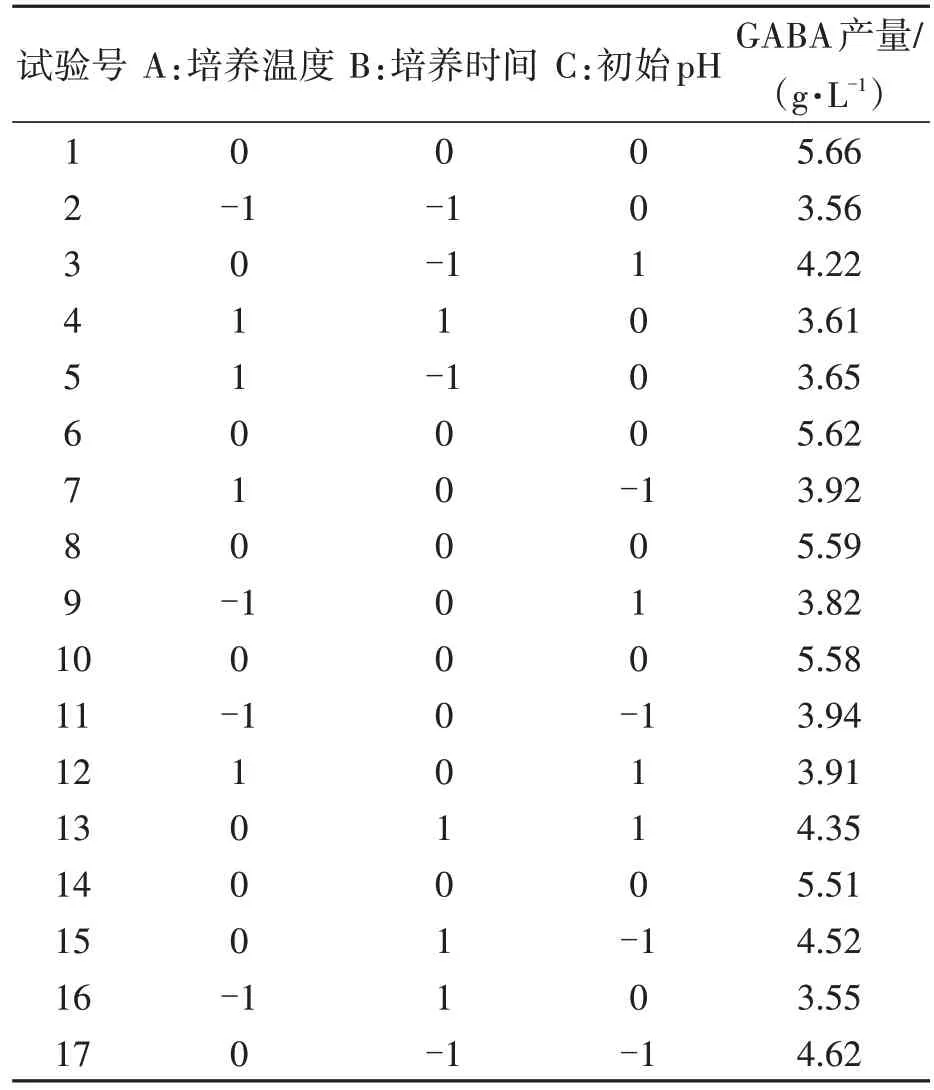
表2 响应面设计方案和结果Table 2 Response surface design scenarios and results
2.2.1 回归模型的建立及方差分析 根据表3 的试验结果,应用Design-Expert V 8.0.6 软件对其进行多元回归拟合,从而得到回归方程为:Y=5.59+0.028A-2.500×10-3B-0.088C-7.500×10-3AB+0.028AC+0.058BC-1.26A2-0.73B2-0.43C2。经软件分析可知,该模型的相关系数R2=0.996 5,接近于1,表明模型数据的拟合程度较高,能够较好的描述各因素与响应值GABA 之间的真实关系,模型的校正决定系数Radj2=0.991 9,表明该模型能够解释99.19%的响应值GABA变化。
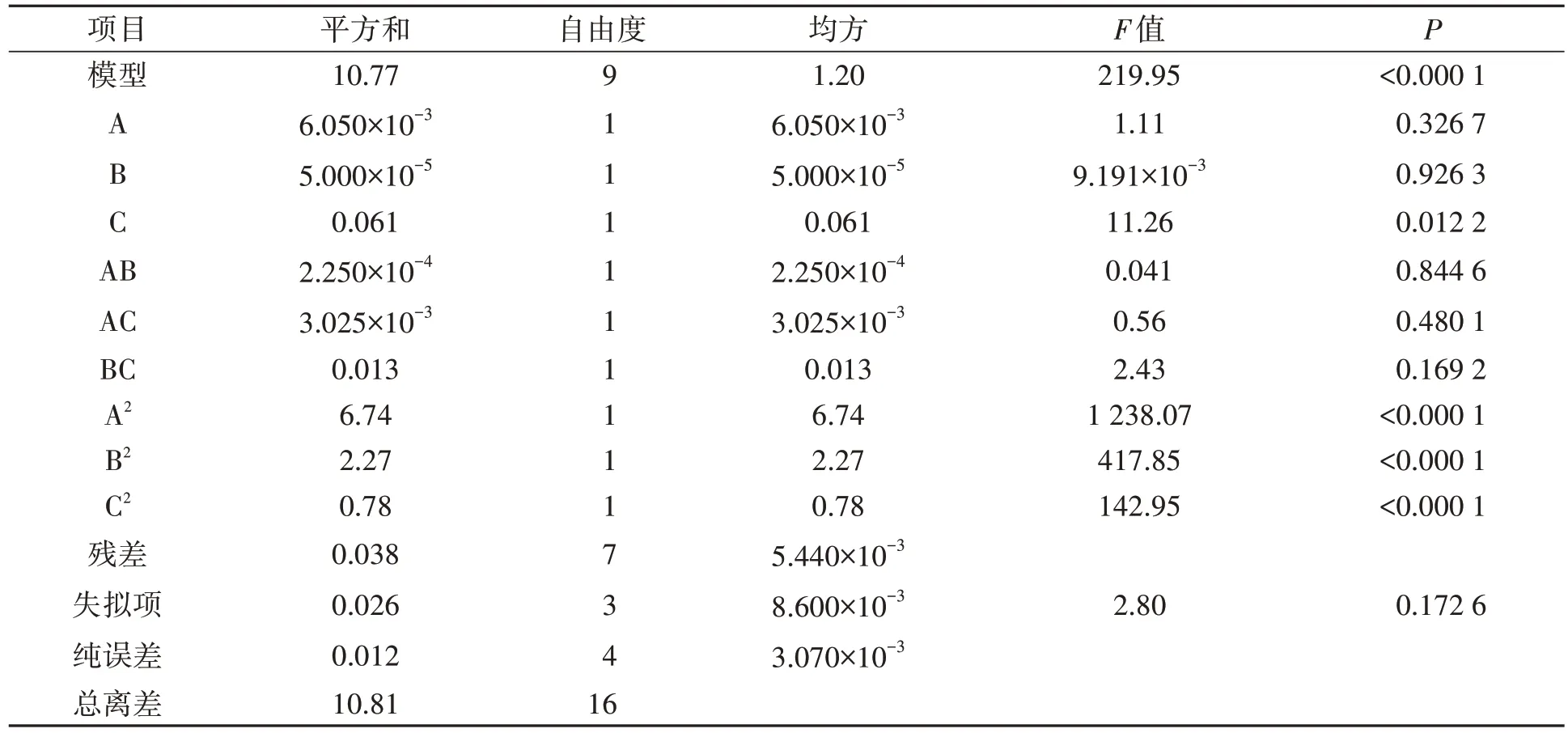
表3 回归模型方差分析Table 3 Regression model ANOVA
由表3可知,影响L.reuteriHCS02-001中GABA产量的顺序为:初始pH>发酵温度>发酵时间。回归方程模型P<0.000 1 极显著,失拟项P=0.172 6不显著,表明该模型具有极显著性意义,且未知因素对试验干扰性小。
2.2.2 响应面两两因素交互作用 由图4 可知,GABA 产量随初始pH、培养温度和培养时间的增加呈非线性的增加,达到顶点后又随其增加下降。通过Design Expert 软件分析预测其最佳工艺参数为:培养时间24 h、培养温度37 ℃、初始pH 6.5时,模型预测GABA 产量为5.56 g·L-1。为验证试验的可靠性,选取最优添加量培养L.reuteriHCS02-001测定其GABA的产量,取3组平行,GABA产量的平均值为5.58 g·L-1,与预测值相符,表明响应面优化L.reuteriHCS02-001培养方案的可靠性较高。
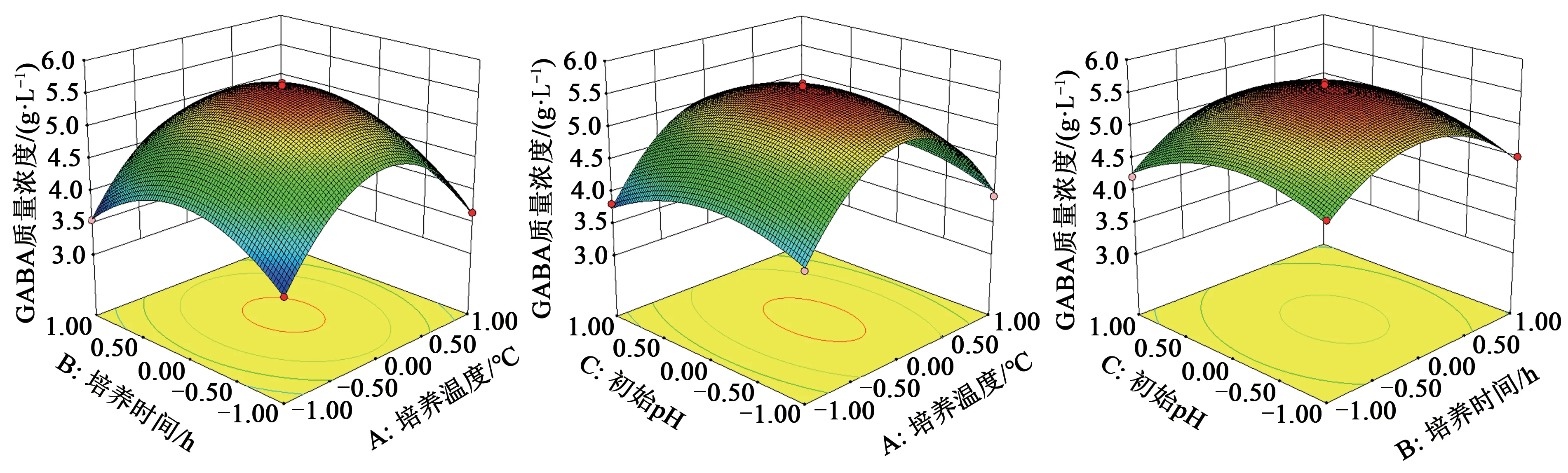
图4 培养时间、培养温度和初始pH对GABA产量的影响交互作用Fig.4 Interaction of culture time,culture temperature and initial pH on GABA production
2.3 小鼠睡眠实验
2.3.1 直接睡眠实验 小鼠饲喂生理盐水、GABA溶液和罗伊氏粘液乳杆菌低剂量组、中剂量组和高剂量组后,5组小鼠均正常活动未出现睡眠现象,说明所饲喂的物质未对小鼠起到直接催眠作用。
2.3.2 延长戊巴比妥钠催眠小鼠的睡眠时间实验 小鼠的睡眠时间如图5 所示,与空白对照组对比,服用中剂量和高剂量的L.reuteriHCS02-001 的小鼠睡眠时间显著高于空白对照组(P<0.05),高剂量组的睡眠时间显著高于GABA组(P<0.05)。结果表明L.reuteriHCS02-001 对于小鼠的睡眠起到延长作用。
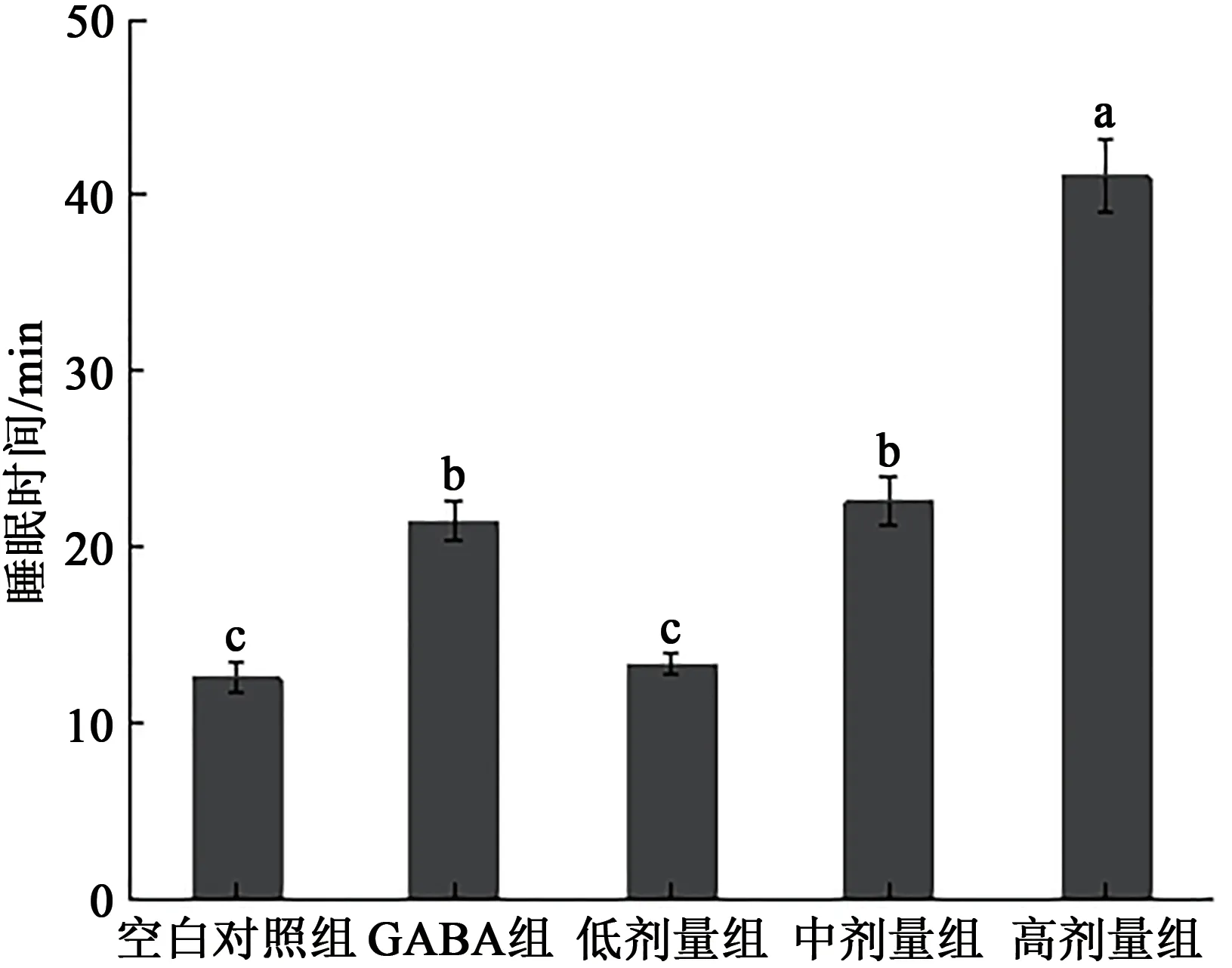
图5 罗伊氏粘液乳杆菌HCS02-001对小鼠睡眠持续时间的影响(n=10)Fig.5 Effects of Limosilactobacillus reuteri HCS02-001 on sleep duration in mice(n=10)
2.3.3 戊巴比妥那阈下剂量催眠实验 由于戊巴比妥钠通过肝酶代谢,想要排除通过影响肝酶进而延长戊巴比妥钠睡眠时间,需要进行戊巴比妥钠的阈下剂量实验。实验结果如表4 所示,高剂量组的小鼠入睡率达到40%,与空白对照组相比有显著差异(P<0.05)。中剂量组的小鼠经过灌胃后入睡率达到20%,说明戊巴比妥钠的催眠实验对于小鼠睡眠效果显著。

表4 罗伊氏粘液乳杆菌HCS02-001对小鼠睡眠率的影响Table 4 Effects of Limosilactobacillus reuteri HCS02-001 on sleep duration in mice
2.3.4 巴比妥那睡眠潜伏期实验 小鼠在腹腔注射巴比妥那后,当小鼠缩短了潜伏期更快入睡时,说明灌胃的L.reuteriHCS02-001 与巴比妥那起到协同的作用。小鼠的入睡潜伏期实验结果如图6所示,与空白对照组相比,罗伊氏粘液乳杆菌HCS02-001 的低、中、高剂量组的睡眠潜伏时间显著降低(P<0.05),说明受试物可以缩短小鼠的睡眠潜伏期,使小鼠可以更快入睡。
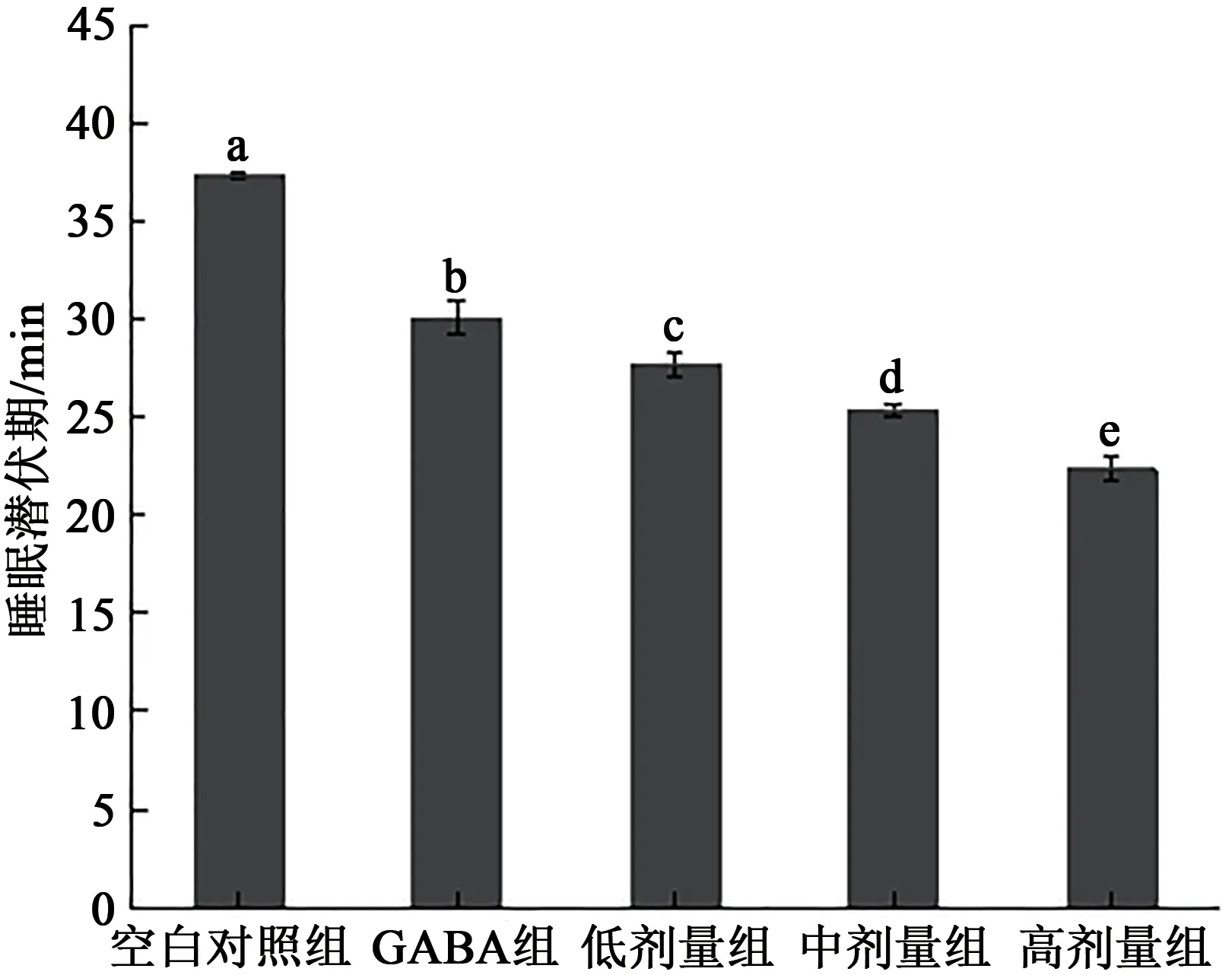
图6 巴比妥那小鼠睡眠潜伏实验Fig.6 Sleep latency experiment of barbital sodium mice
综上,根据《保健食品检验与评价技术规范(2003 版)》中改善睡眠功能评价规范的要求,3 个睡眠实验中有2 项结果呈阳性,且无直接睡眠作用,可判定L.reuteriHCS02-001 具有改善睡眠的作用。
3 讨论
睡眠是机体必不可少的复杂生理过程,对维持身心健康起着至关重要的作用。睡眠不足对人类的生活质量、情绪、认知功能和健康都有负面影响,如引起免疫力下降、认知障碍、增加抑郁症和心血管疾病风险等。睡眠作为一个动态的生物过程,是通过多种内部和外部因素的相互作用实现的,包括且不限于:①大脑对睡眠的直接调节;② 周围器官通过循环系统和外周神经系统传递信号到大脑以调节睡眠;③肠道中的微生物群产生代谢物,如GABA、多巴胺、5-羟色胺(5-HT)和其他能够影响睡眠的物质[22]。
睡眠与肠道微生物群落有着复杂的相互作用,失眠可能是由肠道中促进睡眠的神经化学因子相对减少和促进清醒的神经化学因子增加引起的。因此,可以产生睡眠和觉醒相关神经递质的微生物在失眠领域应该引起更多的关注。GABA是一种抑制性神经递质,在人体中发挥着重要的生理作用,包括降低神经元活动、调节心率、增强记忆力和调节激素分泌,有助于防止失眠焦虑、压力和平衡情绪等。乳酸菌被认为是GABA 的主要生产者[23]。Yunes 等[24]从135 株菌株中筛选出58株能够产生GABA 的菌株,并确定L.brevis和L.plantarum是产生GABA 的主要乳杆菌属,产率最高可达6 g·L-1。同样,我们通过对罗伊氏粘液乳杆菌HCS02-001 进行单因素实验和响应面实验,优化出最佳的培养条件为培养温度37 ℃培养时间24 h、初始pH 6.5 时,罗伊氏粘液乳杆菌HCS02-001 表现出最高的GABA 生产能力,产量达5.58 g·L-1。
在睡眠改善测试中,罗伊氏粘液乳杆菌HCS02-001 有效地延长了小鼠的睡眠时间,提高了入睡率,缩短了睡眠潜伏期,可与巴比妥那协同发挥作用。同样地,Lin等筛选出一种特定的发酵乳杆菌PS150TM,该菌株能够改善由咖啡因引起的睡眠障碍小鼠的睡眠,以及在小鼠的第一夜效应期间增加非快速眼动期[25-26]。Yu 等[27]认为GABA 对神经系统的间接影响是通过肠道介导的。首先,GABA 会改变肠道微生物群,并促进某些影响睡眠的神经递质的产生。其次,胃肠道组织和迷走神经的传入神经元表达大量的GABA受体。GABA刺激后,迷走神经向外传递信号,从而调节脑内神经递质的分泌,影响睡眠。综上所述,罗伊氏粘液乳杆菌HCS02-001 具备助睡眠的作用,这为开发助睡眠的产品提供了依据。
