诺如病毒疫苗研究概况
2024-02-05焦红燕李国超常亮李岩异翟丽丽
焦红燕,李国超,常亮,李岩异,翟丽丽
1.华北制药集团新药研究开发有限责任公司,抗体药物研制国家重点实验室,抗体药物河北省工程研究中心,石家庄 052160;2.华北制药金坦生物技术股份有限公司,石家庄 050035
诺如病毒又名诺瓦克病毒(norwalk viruses,NV),是杯状病毒科(Caliciviridae)诺如病毒属(Norovirus)中的一种单链正义RNA 病毒[1]。大约五分之一的急性胃肠炎(acute gastroenteritis,AGE)是由NoV 引起的,以呕吐、腹泻为特征,部分患者出现恶心、发烧、寒战和疲劳等症状[2]。NoV 在各年龄段均易感,5 岁以下儿童、老年人以及免疫力低下人群尤其严重[3-6]。全球每年约有6.99 亿NoV 病例和21.9 万死亡病例,造成的直接治疗成本约42 亿美元,间接社会成本约603 亿美元[3]。全世界每年死于NoV 相关疾病的5 岁以下儿童约有7 万人[3]。每年都会有NoV 的流行和爆发,我国5岁以下儿童的感染比例高达15.6 %[7]。
目前,尚无NoV疫苗或抗病毒药物获批使用。NoV胃肠炎患者的治疗主要以预防脱水为主[8],因此开发有效的NoV疫苗防范诺如病毒流行尤为重要。本文对NoV 疫苗的研究进展进行了综述,重点阐述了病毒样颗粒(virus like particles,VLP)疫苗、病毒载体疫苗和基于P 颗粒疫苗研究现状和发展前景,以期为NoV疫苗的研发提供新思路。
1 NoV概述
NoV 基因组全长约7.7 kb,分为3 个开放阅读框(open reading frame,ORF)(图1A)[8-9]。ORF1 编码一个大的多聚蛋白,后续被切割为6种非结构蛋白(non-structural protein,NSP),参与病毒的复制[10]。NoV 衣壳蛋白(norovirus capsid protein,NVCP)VP1由ORF2编码,其相对分子质量约为58 kD,VP1单体包含一个保守的外壳S结构域(黄色)和一个突出的P结构域(蓝色)(图1B),S结构域形成病毒的二十面体衣壳,而P结构域参与病毒和细胞受体间相互作用,可与组织血型抗原(histoblood group antigen,HBGA)结合[11-12]。P 结构域分为P1 和P2 亚结构域,P2亚结构域高度可变,显示不同变体的特定表位[13]。VP1可通过自组装产生VLP,VLP与天然病毒粒子具有相似的形态和抗原性[9]。VP2 是NoV 的次要结构蛋白,该蛋白由ORF3 编码,可能参与了维持衣壳稳定的过程[9,14]。

图1 NoV基因组及其衣壳结构[15]Fig.1 NoV genome and capsid structure[15]
NoV具有高度的基因多态性,根据病毒的VP1衣壳蛋白的氨基酸序列不同,NoV 分为10 种基因型(GⅠ~GⅩ),并且在GⅠ、GⅡ、GⅣ、GⅧ和GⅨ基因组中鉴定出至少35种人类感染基因型[8,16-17]。感染人的NoV主要是GⅠ和GⅡ基因型的成员,其他基因型在人类感染中少有检出[18-19]。目前,在全世界范围内主要流行的是GⅡ.4 毒株,其变异较快,2~5 年就会出现一种新的变体。GⅡ.4 sydney 变异株最早于2012 年出现在澳大利亚,随后在世界范围内普遍流行[6,8]。
2 NoV疫苗研究现状
疫苗按照性质可分为4类,分别是减毒活疫苗、灭活疫苗、亚单位疫苗和基因工程疫苗(表1)[20]。传统疫苗(包括灭活疫苗、减毒活疫苗和亚单位疫苗)的制备需要体外制备大量病原体。由于NoV对内源性干扰素敏感、体外培养时需要辅助因子(例如胆汁酸、肠道共生菌)等原因,直至2014 年Jones 等才发现在表达HBGA 的肠道菌群的辅助下,GⅡ.4-Sydney NoV 毒株可以感染并在人类B细胞内进行复制[22-23]。2016 年,Ettayebi 等[24]发现NoV 的GⅠ和GⅡ基因型的多个毒株可以在干细胞来源的、非转化的人肠道类肠(human gut like intestine,HIEs)单层培养的细胞中复制,然而NoV在这些细胞中的复制量并不高。目前,尚没有合适的用于体外大量培养NoV 的细胞,因此利用NoV病毒制备疫苗的传统方法并不适用于NoV疫苗的开发[25]。

表1 疫苗类型[21]Table 1 Types of vaccines[21]
由于缺乏成功的动物模型,抗NoV 药物和非传统疫苗的后续评价受到了限制[18]。针对此问题目前已发现无菌猪和无菌牛可感染人类NoV GⅡ.4 基因型菌株,但由于动物与人的肠道环境不同,人和动物感染的症状并不完全相同,因此人类NoV 感染的标准化动物模型还需进一步探索[26-27]。体外评价系统中,多项研究表明抗体阻断VLP 结合配体(如合成的HBGA、人类唾液、猪粘液素)的效率与对NoV 的保护效应呈正相关。目前,实验室常采用HBGA 体外阻断试验(合成的 HBGA)评价NoV疫苗的保护效应。
2.1 VLP疫苗
VLP 是一种跟病毒结构类似的纳米结构,颗粒大小在20~200 nm 间[28]。VLP 由一种或多种结构蛋白组成,可在细菌、酵母、昆虫等多种细胞中重组表达并自组装[29]。根据有无脂质包膜,可将VLP 分为包膜型和非包膜型,其结构蛋白可形成单层、双层或三层的蛋白衣壳(图2)[29-30]。病毒衣壳蛋白自发聚合可以产生具有几何对称性的VLPs,不同的病毒衣壳形成不同的对称几何体,通常为二十面体、球形或杆状结构[29]。VLP 的多个重复结构作为高密度的表位,具有高度的免疫原性,可引发体液和细胞免疫反应[31]。VLP 缺乏病毒遗传物质,不能感染宿主细胞,具有较好的安全性,在预防医学领域越来越受欢迎[32]。

图2 VLP分类[28]Fig.2 VLP classification[28]
目前,已有3 款基于VLP 的疫苗(乙肝疫苗、宫颈癌疫苗和戊肝疫苗)上市。22 nm 球形乙型肝炎病毒(hepatitis B virus,HBV)表面抗原(HBsAg)疫苗是一种灭活疫苗,最初来源于人血浆,该疫苗于1981 年在美国获得许可[33]。1986 年,默克公司用酿酒酵母也生产出22 nm 的HBsAg颗粒人用疫苗RECOMBIVAX HB[33]。第2 种人用VLP 疫苗是2006 年由默克公司研制的人类乳头瘤病毒(human papilloma virus,HPV)疫苗[33]。第3 种是由我国厦门大学和养生堂万泰公司联合研制的戊型肝炎疫苗Hecolin,该疫苗于2012年上市,是全球首款上市戊型肝炎疫苗。Hecolin是由大肠杆菌表达的重组Ⅰ型戊型肝炎病毒(hepatitis E virus,HEV)ORF2 截短蛋白HEV239(aa368-aa606),经纯化和折叠后,HEV239 可以自组装成VLPs 颗粒,而这些颗粒与成熟HEV 病毒粒子的衣壳结构具有高度的相似性[34]。Hecolin 在16~65 岁人群中具有较好的耐受性和较高的保护率,并且该疫苗在2~8℃长期保存具有较好的稳定性[35]。
由于NoV 存在基因多样、高度变异且无法在体外大规模培养等问题,导致NoV 疫苗的研制进程缓慢。NoV 的ORF2 编码的主要衣壳蛋白VP1可以通过自组装产生VLP,VLP 与天然病毒颗粒具有相似的形态和抗原性[9]。NoV VP1 衣壳蛋白可以在昆虫-杆状病毒表达系统、毕赤酵母表达系统、植物表达系统和乳杆菌表达系统等多个表达系统中表达。目前,NoV 疫苗研发主要集中在VLP 疫苗、病毒载体疫苗和基于P 颗粒疫苗等方面。现阶段全球处于临床阶段的NoV 疫苗共有8款,其中6 款为重组蛋白疫苗,1 款为腺病毒载体疫苗,1款为mRNA核酸疫苗(表2)。

表2 全球处于临床研究的NoV疫苗Table 2 NoV vaccines in clinical research worldwide
武田公司开发的HIL-214疫苗目前处于Ⅱ/Ⅲ期临床研究,该疫苗由昆虫-杆状病毒表达系统表达,包含150 μg GⅡ.4 流行株共有序列衍生的GⅡ.4 衣壳蛋白VLP 和50 μg GⅠ.1 衣壳蛋白VLP,纯化后的纯度达到95%以上[36-37]。以500 μg 氢氧化铝为佐剂,肌内注射第一剂和第二剂HIL-214疫苗间隔两个月,受试者NoV 特异性血清抗体滴度至少增加了3 倍,并且会诱导对其他毒株的交叉反应[36]。
HIL-214 疫苗中的GⅡ.4 组分是由3 个流行株的共有序列衍生的,以期能提供对多株NoV 的多价保护[37]。事实上HIL-214 疫苗的临床Ⅰ期试验结果显示接种疫苗可以快速诱导中和抗体的产生,并阻断一系列疫苗VLP 和非疫苗VLP 与肠道上皮细胞配体的结合[38]。值得注意的是,HIL-214疫苗诱导的抗体能够结合接种疫苗时还未传播的NoV(GⅡ.4.2012 和GⅡ.4.2006b.P.D302)VLP,并能阻断这两种VLP 与肠道上皮配体的结合[38]。这些数据表明接种HIL-214 疫苗能够诱导一定的交叉免疫保护作用。然而,该项研究的规模很小(n=10),并且抗体结合和抗体阻断实验并不能完全模拟人体免疫系统对NoV 感染时的反应,因此需要更多的研究来揭示HIL-214 疫苗对NoV 的多价保护。
中国科学院上海巴斯德研究院黄忠课题组与智飞龙科马生物制药有限公司用毕赤酵母异源表达了NoV 的GⅠ.1、GⅡ.3、GⅡ.4、GⅡ.17 基因型的VLP,制备了四价重组诺如病毒疫苗,该疫苗免疫小鼠可诱导产生与单价疫苗相当的抗体水平[18,39]。2019 年5 月30 日,该四价重组诺如病毒疫苗(毕赤酵母)进入临床研究,现处于Ⅰ/Ⅱ期临床阶段[38]。此外,远大赛威信生命科学(南京)有限公司研发的四价重组诺如病毒疫苗(汉逊酵母)包含GⅡ.2、GⅡ.4、GⅡ.6、GⅡ.17 4 种基因型的VLP,该VLPs形态和免疫原性与天然病毒相似,可与宿主受体HBGA 结合,诱导机体产生针对诺如病毒的免疫应答。四价重组诺如病毒疫苗(汉逊酵母)于2023 年10 月11 日在我国获批开展临床Ⅰ期试验。
目前,临床上最高价NoV 疫苗是康华生物研制的由毕赤酵母表达的重组六价诺如病毒疫苗。将GⅠ.1、GⅡ.2、GⅡ.3、GⅡ.4、GⅡ.6 和GⅡ.17 的VP1基因序列经酵母遗传密码子优化后,插入pPinkhc 中,分别转入毕赤酵母中进行表达,用BMGY(buffered glycerol-complex medium)培养基,28 ℃,220 r·min-1培养,甲醇作为诱导剂[7]。纯化后VLP纯度达到95 %以上,电镜检测VLP 颗粒完整,大小均一,获得的VLP 结构完整、性能稳定[7]。用该疫苗免疫小鼠后可诱导持久、高滴度的抗体反应,并产生特异性的阻断抗体和T 细胞免疫反应[7]。该疫苗于2023 年2 月28 日在澳大利亚获批进入临床试验,于2023 年9 月7 日在美国获批进入临床试验。
2.2 病毒载体疫苗
病毒载体疫苗可以在哺乳动物细胞内进行翻译和修饰。减毒活疫苗在各种疫苗中免疫效果最好、免疫持续时间最久,但是NoV 在体外不能大量培养,因此研发NoV 的减毒活疫苗和灭活疫苗不能实现,复制病毒载体疫苗提供了一种既不需要完整病原体参与也不需要培养病原体的活疫苗方法[1,40]。
2.2.1 处于临床阶段的病毒载体疫苗 Vaxart 公司开发的口服腺病毒载体疫苗能够启动肠道免疫反应,这对于预防感染肠粘膜的病原体是有利的[41]。Vaxart 公司构建了一种表达GⅠ.1 NoV 株VP1的腺病毒载体疫苗用于诱导保护性免疫和预防诺如病毒疾病,该疫苗目前处于Ⅰ期临床研究。NoV腺病毒载体疫苗可在人肠上皮细胞中以类似于自然NoV 感染的方式表达VP1。Kim 等[42]研究发现用双链RNA 作为佐剂,口服免疫该片剂疫苗时耐受性良好,并可产生全身和黏膜免疫反应。NoV毒株的基因是多样化的,并且变异较快,单一毒株的感染只能提供短期的免疫保护[43]。此外,Vaxart 公司构建的腺病毒载体疫苗可以在同一载体上表达多种抗原,这对于预防基因多样化的NoV具有较大的潜力[42]。
2.2.2 NoV 的病毒载体疫苗临床前研究 Harrington 等[44]构建了表达NVCP 的委内瑞拉马脑炎(venezuelan equine encephalitis,VEE)病毒复制子颗粒(virus replicon particles,VRPs),并通过口腔免疫小鼠,发现VRPs 可以在小鼠中诱导高水平的全身和粘膜免疫反应。然而,利用VEE 复制子载体疫苗的安全性还有待进一步研究。
王金冬等[1]发现用NVCP VP1 和VP2 以及其3′UTR 区构建重组腺病毒疫苗免疫小鼠时,其免疫效果比单独表达VP1 的重组腺病毒载体疫苗好。然而,人类普遍存在对腺病毒的免疫,腺病毒载体疫苗的免疫效果可能受到宿主免疫反应的影响[45]。
水泡性口炎病毒(vesicular stomatitis virus,VSV)很少感染人类,因此,人体基本不存在预先对VSV 的免疫[46]。Ma 等[45]构建了一种表达NVCP VP1的减毒重组水泡性口炎病毒载体疫苗(rVSVVP1),rVSV-VP1可以引起小鼠针对NoV的高水平的体液、细胞和粘膜免疫。
新城疫病毒(newcastle disease virus,NDV)只编码7种蛋白质,受宿主范围的限制,其感染人类时高度减毒,并且基因重组发生较少[47]。Kim[40]制备了表达NoV VA387 株衣壳蛋白VP1 的重组新城疫病毒载体疫苗(rNDV),rNDV 载体疫苗在小鼠体内诱导了高水平的血清、细胞和粘膜免疫反应。
2.3 mRNA疫苗
mRNA 疫苗的原理是将编码病原体特异性抗原的mRNA 通过一定处理后,注入人体使其通过人体的蛋白质合成系统生产出所需的抗原,该免疫方法模拟了病原体感染细胞的过程,可同时引发体液免疫和细胞免疫。与传统疫苗相比,mRNA疫苗具有研发周期短、安全性高、水溶性好、易成药、设计性强、可快速制备等优点。然而,mRNA疫苗研发过程中主要存在的问题有:①裸露的mRNA 不易穿过细胞膜,需要高效的递送系统辅助;②mRNA 稳定性较差,易降解,在体内半衰期短;③mRNA 免疫原性过高,可能会引起人体强烈的炎症反应;④翻译效率较低。
Karikó 等[48]发现掺入修饰的核苷m5C、m6A、m5U、s2U或假尿苷可防止机体将合成的mRNA视为敌人,此发现解决了mRNA 疫苗易引起人体强烈炎症反应的问题,这些研究成果为mRNA 疫苗的研发奠定了基础。2023年诺贝尔生理学或医学奖授予Katalin Karikó和Drew Weissman,以表彰他们在核苷酸碱基修饰研究领域的贡献。目前,全球上市的mRNA疫苗主要用于预防新型冠状病毒肺炎(corona virus disease 2019,COVID-19),包括Biontech 公司研发的Comirnaty 和Moderna 公司研发的Spikevax。此外,多款新型冠状病毒mRNA疫苗获得紧急使用授权,如沃森生物、中国人民解放军军事科学院军事医学研究院和艾博生物共同研发的沃艾可欣和斯微生物自主研发的mRNA疫苗以及石药集团研发的SYS6006疫苗。
mRNA 疫苗在应对NoV 基因多样、高度变异方面具有很强的优势。目前,Moderna 公司开发的用于预防幼儿和老年人急性胃肠炎的2 款多价VLP 疫苗mRNA-1403(三价)和mRNA-1405(五价)正处于临床Ⅰ期试验招募阶段。
2.4 P颗粒疫苗
2.4.1 NoV P颗粒疫苗 NVCP VP1的P结构域包含P1 和P2 亚结构域,其中P2 亚结构域位于病毒衣壳的表面,在进化上高度可变,存在与HBGA结合的界面[49]。P 颗粒是由12 个P 二聚体形成的八面体对称结构,直径约20 nm,分子量约为830 kD(图3A)[49-51]。P颗粒能与HBGA结合,并诱导NoV特异性抗体阻断VLP 与HBGA 受体的结合[48]。P颗粒容易在大肠杆菌中产生,非常稳定,具有高度的免疫原性,因此P 颗粒可以作为NoV 的候选疫苗[49-50,52]。在P 结构域两端加入半胱氨酸残基能促进P颗粒的形成,进一步修饰P结构域的C端形成一种新的亚病毒粒子,即小P 粒子[53]。小P 颗粒由6 个P 二聚体组成,呈四面体对称,直径约为14 nm,中心有一个空腔,具有与VLP 和P 颗粒相似的抗原性和HBGA 结合特性[53]。P 颗粒尺寸较大,可能更具免疫原性,但小P 颗粒尺寸更小,可能具有穿透独特的组织或宿主细胞等独特的应用[51,53]。
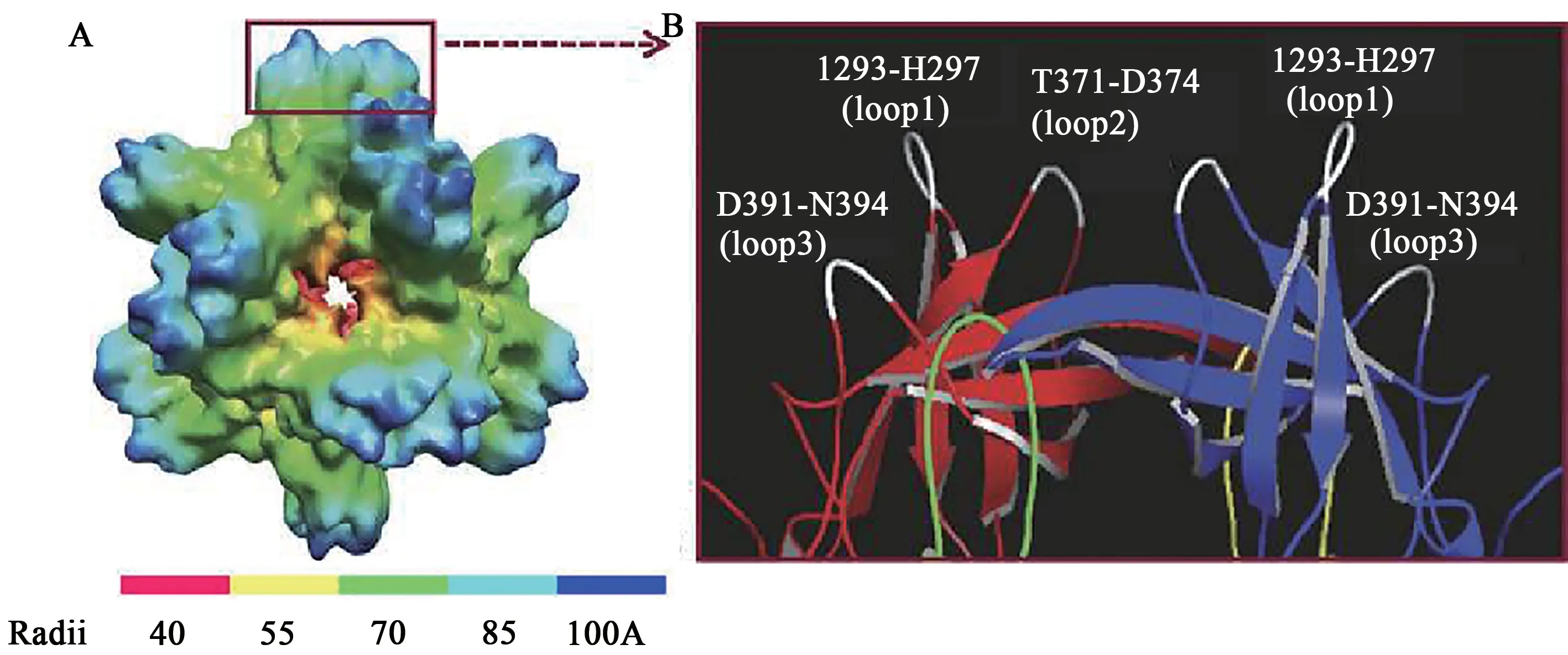
图3 NoV P颗粒及其表面环[49-50]Fig.3 NoV P particles and their surface rings[49-50]
2.4.2 P 颗粒嵌合疫苗 P 颗粒的每个P 结构域单体存在3 个表面环(白色)(图3B),这些表面环可以允许大序列插入,是外来抗原呈递的潜在位点[50]。研究发现,将轮状病毒VP8 蛋白插入P 结构域的表面环不影响P 颗粒的形成,并且VP8 抗原能很好地呈现在P 颗粒表面[50,54]。该研究还发现P颗粒-VP8嵌合蛋白能够同时诱导针对轮状病毒和NoV 的抗体,并且与游离的抗原相比,P 颗粒诱导的VP8 抗体滴度显著增加[50]。Tan 等[50]认为P 单体的3 个环均可插入外源抗原,可通过在P 颗粒的72 个表面环上插入串联重复序列增加拷贝数,从而增加免疫反应,或将不同的抗原插入P单体的不同表面环中,开发多价疫苗。开发以P 颗粒为载体的纳米疫苗具有广阔的前景,目前已有以P 颗粒为载体的嵌合疫苗处于临床前研究阶段。
通过将甲型流感病毒中高度保守的流感病毒基质蛋白2(M2e)抗原插入P结构域的第二个表面环制备成的NoV P颗粒-流感病毒嵌合疫苗能增强小鼠对M2e 的免疫反应,还可诱导阻断NoV VLP或P 颗粒与HBGA 结合的抗体[55]。将NoV 和戊肝病毒的P结构域融合制备的融合疫苗诱导的抗体水平显著高于单独的NoV P 二聚体或单独的戊肝二聚体诱导的抗体水平[56]。将NoV、戊肝病毒和星状病毒的P 结构域融合,可形成针对NoV、戊肝病毒和星状病毒的三价嵌合疫苗[57]。将HIV病毒包膜与HIV 的广泛性中和抗体(BnAbs)结合的MPER 表位4E10 或10E8 插入NoV P 颗粒的表面环中生产的Nov PP 融合蛋白可以作为呈递4E10或10E8表位的载体,从而诱导针对HIV-1 gp41的特异性免疫应答[58]。将β 淀粉样蛋白的Aβ1-6 表位插入NoV P 颗粒的表面环中构建的新型阿尔兹海默症候选疫苗可诱导小鼠产生高浓度的Aβ 特异性抗体,该疫苗避免了接种全长Aβ42 而引起的自身免疫性脑膜炎问题,并且该疫苗比截短的Aβ 小肽表位免疫效果好[59]。孙瑶等[60]将含多个磷酸化靶点的pTau(细胞骨架蛋白tau)多肽抗原表位偶联至NoV P 颗粒上,制成了P 颗粒-磷酸化Tau表位疫苗,该疫苗在Tau相关疾病的小鼠模型P301S中降低了小鼠脑内磷酸化Tau的积累,缓解了Tau 相关的运动功能障碍,表现出较好的免疫原性、安全性和有效性。
3 展望
NoV 具有高传播性,是引发全球性急性胃肠炎疾病的主要病原体之一,同时NoV 的多种毒株增加了人类对NoV 防控的难度,目前还没有上市的疫苗或药物用于NoV的预防和治疗。NoV的多发性和传播性突出了NoV 疫苗开发的必要性,本文综述了NoV VLP 疫苗、腺病毒载体疫苗和基于P 颗粒疫苗的研发现状,有助于发现安全有效,具有临床应用价值的NoV疫苗。
随着研究的不断深入,NoV 体外难培养和动物评价模型建立困难等难题正在逐步攻克,NoV疫苗技术已经日渐成熟。NoV VLP 疫苗、腺病毒载体疫苗和基于P颗粒疫苗等多种疫苗的研发都有了突飞猛进的发展,多款疫苗的研发已经进入临床试验阶段。尽管目前NoV 疫苗的研究有了一些突破,但仍面临许多挑战。首先,诺如病毒有多种基因型且变异速度快,人们在研发NoV 疫苗时,需要考虑疫苗的广谱性;其次,人们对自然NoV 感染的免疫力是短暂的,需要考虑疫苗产生免疫力的时效性;最后,NoV疫苗的应用目前仍有一些迫切需要突破的瓶颈,例如NoV 基因组结构和NoV 发病机制需要进一步深入研究。未来,随着现代生物学技术的不断发展和完善,NoV 疫苗研发将提升至一个新的高度,为阻断NoV 的传播提供重要助力。
