银离子比色检测技术研究进展
2024-02-05杨敏褚厚娟朱龙佼胡清华许秀丽张峰谢语诗许文涛杨松林
杨敏,褚厚娟,朱龙佼,胡清华,许秀丽,张峰,谢语诗,许文涛,杨松林
1.中国农业大学营养与健康系,食品精准营养与质量控制教育部重点实验室,北京 100083;2.中国航天员中心,北京 100094;3.人因工程全国重点实验室,北京 100094;4.中国检验检疫科学研究院,北京 100176
在过去的几十年里,随着金属银及其化合物在工业和日常生活中的广泛应用,含Ag+的废水不断地排放到环境中,特别是在发展中国家[1]。Ag+长期以来备受关注,被归入最高毒性类别。长期接触Ag+会对人类健康造成严重不良后果,如器官衰竭、细胞毒性、脑损伤、线粒体功能下降和免疫系统破坏等[2-3]。根据美国环境保护局(Environmental Protection Agency,EPA)的二级饮用水标准规定,饮用水系统中Ag+的最大允许水平为0.1 mg·L-1(0.93 μmol·L-1)。因此,发展精确检测痕量Ag+的灵敏分析方法对于水质控制、公共健康和环境监测至关重要。
Ag+检测的典型灵敏技术包括电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)[4]、原子吸收光谱法(atomic absorption spectroscopy,AAS)[5]、电感耦合等离子体发射光谱法(inductively coupled plasma emission spectroscopy,ICP-OES)[6]、荧光光谱法和电化学法。然而,这些技术通常需要复杂的仪器、复杂的检测流程和专业的操作人员,极大地限制了在实际中的应用,尤其是在资源有限的偏远地区[7]。比色法是指基于被测物质溶液的颜色或加入显色剂后生成的有色溶液的颜色深度与物质含量之间的关系进行定量分析的方法,其被广泛认为是一种简单且经济有效的Ag+检测技术,甚至可以由受过较少培训的人员通过肉眼轻松完成检测。除此之外,基于颜色的变化还可以制备比色试纸,提高了检测的便携性。本文综述了利用比色法检测Ag+的研究进展,对显色的机理进行了归纳总结,分别从DNA、纳米材料和化学小分子3 种不同的材料对比色传感策略进行了介绍,旨在让读者了解Ag+检测比色传感器的发展现状,为将来Ag+新型检测技术的发展提供参考。
1 Ag+比色检测技术的显色原理
比色检测技术在食品质量监控、环境监测、临床诊断等领域的研究和应用越来越广泛。目前,Ag+比色检测技术主要利用以下3种显色方式。
1.1 基于酶的催化显色

图1 银离子比色检测技术的显色原理及传感策略Fig.1 The colorimetric principles and sensing strategies of Ag+ colorimetric detection
纳米酶是一类具有类似于天然酶活性的纳米材料,自1993 年首次报道以来,已发现了50 多种不同材料和结构的纳米酶。最常见的纳米酶有四氧化三铁纳米酶、铂纳米酶、钯纳米酶、金纳米酶等[8-9]。常见的类酶活性包括过氧物酶、氧化酶、过氧化氢酶、超氧化物歧化酶和漆酶,其中具有类过氧化物酶活性的纳米酶是Ag+检测中最常用的。在H2O2(作为电子受体)的存在下,它可以将显色底物,如3,3',5,5'-四甲基苯二胺(tetramethylbenzidine,TMB)氧化为有色产物,从而使溶液颜色由无色变为蓝色。此外,G-四链体-氯化血红素(G4-hemin)也具有过氧化物模拟酶活性,能高效催化H2O2氧化反应底物[10]。Ag+的存在可以通过削弱纳米酶与底物的亲和性或者增加纳米酶活性位点两种不同的方式对酶活产生负向或者正向调节,从而影响溶液颜色并实现检测银离子的目的。
1.2 基于表面等离子体共振的显色
等离子体纳米材料作为一种典型的光响应材料,具有由集体载流子振荡产生的大消光截面。当入射光频率与等离子纳米材料的振荡频率匹配时,消光最大,对于尺寸小于入射波长的纳米材料,电磁波等离子体通常被限制在纳米材料的表面,这种共振方式被称为局域表面等离子体共振(localized surface plasmon resonance,LSPR)[11]。LSPR特性使单分散纳米粒子和聚集纳米粒子呈现出不同的颜色,当纳米粒子聚集时,溶液的颜色会发生变化,很容易用肉眼检测到[12]。这种聚集过程是由溶液的组成或颗粒表面的性质通过纳米颗粒与其周围环境之间的静电相互作用、共价结合以及氢键等引起的[13]。此外,通过“非聚集”过程,如刻蚀或者生长也能使纳米颗粒的LSPR改变[14]。蚀刻是通过化学反应或物理作用去除部分材料的过程,而生长则是通过化学反应在纳米材料表面沉积新材料的过程[15-16]。具有较强LSPR 的贵金属纳米材料表面经过还原剂或氧化剂反应,会产生刻蚀或生长反应,这些反应会导致材料的形状或尺寸发生改变,从而伴随LSPR消光峰偏移和材料颜色的变化[14,17]。除了贵金属之外,在石墨烯、重掺杂半导体以及过渡金属氧化物和硫化物材料体系中也能观测到相应的等离子体共振信号[18]。
1.3 基于小分子的化学显色
基于化学小分子的比色传感器是具有高灵敏度、选择性的常用传感器,通过与Ag+之间的作用,可以实现对Ag+的检测,检测限低,颜色变化容易分辨。基于化学小分子的显色反应主要依赖于Ag+的氧化作用、配位作用以及催化作用。Ag+只有一个不稳定的4d10电子层,这使得Ag+具有较强的氧化能力,因此可以通过氧化作用将一些无色分子转变成有色分子[19]。除了氧化作用,Ag+具有的空电子轨道还允许其与一些分子发生配位作用。在与一些配体结合时,会发生金属-配体电荷转移(metal-to-ligand charge transfer,MLCT)和分子内电荷转移(photo-induced charge transfer,ICT)等现象[20-21],从而导致分子的吸收光谱发生变化。例如,邻菲罗啉与Ag+配位形成螯合物后,进一步通过静电引力和疏水力与曙红阴离子结合形成三元配合物,并伴随着曙红Y的吸收光谱变化,以此用于构建Ag+的比色传感器[22-23]。Ag+还具有一定的催化作用,通过与底物形成配合物,使反应底物靠近,加快反应速度。在Ag+的催化作用下,过硫酸铵可以将低价的锰离子氧化成紫红色的高锰酸根离子。Ag+对铁氰化钾(K3[Fe(CN)6])氧化4-氨基安替比林、邻菲罗林显色反应有明显的催化作用[24]。在稀HCl介质中,Ce(IV)与氯化物发生褪色反应,Ag+对该反应具有明显的催化作用[25]。此外,Ag+还可以催化硫酸钾氧化甲基紫[26],催化体系的吸光度会随Ag+浓度的增加而增加,从而实现对Ag+的比色检测。
2 基于DNA的比色检测技术
DNA 由带负电荷的磷酸盐骨架和氮化核碱基组成,其独特的化学组成通过静电或配位相互作用为金属离子提供了多种结合位点[27]。在生理pH 下,带负电荷的磷酸盐骨架通过简单的静电吸引与带正电荷的金属阳离子相互作用[28]。此外,金属阳离子的空轨道可以接受来自磷酸氧或核碱基部分的电子,形成配位络合物[29-30]。据报道,Ag+仅与核碱基络合时优先与碱基的氮原子相互作用,其中嘌呤碱的N7 和嘧啶碱的N3 被认为是Ag+结合的活性位点[31]。由于Ag+和C、G碱基之间具有高特异性结合能力,因此富含C、G 碱基的DNA链也被广泛应用于Ag+的检测。
Ag+可以和C碱基形成稳定的C-Ag+-C结构,主要的稳定相互作用包括π-π核碱基堆积以及相邻C-Ag+-C 碱基对中C 碱基之间的新型平面间H键。Xu 等[32]基于亚甲基蓝(methylene blue,MB)与富C单链DNA(C-rich ssDNA)之间的相互作用,开发了一种用于比色检测Ag+的方法(图2)。当没有Ag+时,MB 与ssDNA 相互作用,溶液的颜色由蓝色变为紫色;当Ag+存在时,Ag+和ssDNA 通过C-Ag-C结构连接在一起,导致ssDNA 从MB 表面解吸到溶液中,溶液的颜色再次由紫色变为蓝色。该方法的优点在于其简单性和成本效益,避免了纳米颗粒的繁琐合成,不需要对DNA 进行进一步的化学修饰,并且检测范围宽(0.001~1.000 μmol·L-1),检出限低(1 nmol·L-1)。Li 等[33]开发了一种基于靶Ag+和外切酶Ⅲ(Exo Ⅲ)依赖的DNA 切割循环扩增的无标记适配体传感器,该系统由发夹状ssDNA和AuNPs组成。在没有Ag+的情况下,由于强静电排斥,阴离子AuNPs最初很好地分散在含有带负电荷发夹DNA 探针的溶液中。然而,当加入Exo Ⅲ和NaCl时,Exo Ⅲ不能消化发夹状的ssDNA,AuNPs 之间的静电排斥被屏蔽,导致AuNPs 聚集。在暗场显微镜观察下,聚集的AuNPs颜色显示黄色和红色;在Ag+存在的情况下,发夹样DNA两个末端突出的C碱基可以形成碱基对(C-Ag+-C)介导的刚性DNA 双链体。在这种情况下,Exo Ⅲ可以消化DNA双链体,并释放Ag+。随后,Ag+与剩余的发夹DNA 结合,并在Exo Ⅲ的帮助下启动另一个DNA切割循环。这样的Ag+依赖Exo Ⅲ的DNA裂解循环扩增导致更多的ssDNA分子产生,释放的ssDNA可以吸附在AuNPs表面,从而有效阻止AuNPs在高盐介质中的聚集。此时,在暗场显微镜观察下,颜色从黄色或红色(聚集的AuNPs)变为绿色(分散的AuNPs)。在此基础上,Ag+在Tris-HCl缓冲液和河水中的检测限分别达到41和39 fmol·L-1。

图2 基于MB与适配体相互作用的Ag+比色检测原理图[32]Fig.2 The schematic diagram of Ag+ colorimetric detection based on the interaction between MB and aptamer[32]
肖志友等[34]利用G-四链体DNA 与氯化血红素(hemin)结合形成G-四链体-hemin脱氧核酶,其能高效催化H2O2氧化反应底物TMB 由无色变为蓝绿色。当Ag+存在时,会阻碍G4结构的形成,导致催化活性降低。基于此,建立了比色法测定Ag+传感器。在最佳实验条件下,溶液的吸光度与Ag+浓度在100~1 000 nmol·L-1范围内具有良好的线性关系,检出限为55.9 nmol·L-1。张启秀等[35]基于G4修饰的AuNPs聚集以及Ag+可以打开稳定的G4结构,成功构建了一种快速、灵敏的Ag+比色传感器。在一定的盐浓度条件下,G4结构修饰的AuNPs具有较高的稳定性。因此,在没有Ag+的体系中,AuNPs为单分散状态,溶液呈现酒红色。然而,当有Ag+存在时,G 碱基中的N7 和C6O 基团与Ag+配位,导致G4结构的破坏,降低了AuNPs的稳定性,从而引起AuNPs 的聚集,使溶液颜色由酒红色变为蓝紫色。该方法对Ag+的检测具有较高的灵敏度,检测限为7 nmol·L-1。
3 基于纳米材料的比色传感器
纳米材料因其表面效应和尺寸效应而具有特殊的物理、光化学和生物学等特性,使其在药物研发、医疗诊断和生物传感等许多研究领域发挥了巨大的作用。因此,结合各种功能型纳米材料,也是比色传感器发展的一个重要方向。
3.1 纳米酶的比色传感器
近年来,基于纳米酶的比色传感技术取得了很大的进展。Deng 等[36]合成了壳聚糖稳定的铂纳米粒子(Ch-PtNPs),并将其作为人工过氧化酶,催化底物TMB 的氧化并产生颜色信号。在Ag+存在下,由于Ch-PtNPs 表面Ag+和Pt2+之间的强亲金属相互作用,Ag+可以削弱对底物的亲和力并使Ch-PtNPs 的催化活性失活,导致吸光度信号根据Ag+的量发生不同程度地降低。Ag+的线性测定范围为5~1 000 nmol·L-1,检出限为4 nmol·L-1。Li等[37]合成了TiO2纳米颗粒作为光纳米酶(photonanozymes,PNZs)。在光照以及H2O2存在下,TMB可以被TiO2PNZs 氧化,从而使溶液由无色变为蓝色,而Ag+可以加速这一反应,实现信号放大。一方面,TiO2PNZs中产生的热电子被Ag+捕获,生成原位沉积在TiO2PNZs 上的AgNPs,阻止了电子直接转移到H2O2中进行均解,产生的·OH 自由基使剩余的热空穴大量积累;另一方面,大量的热空穴从Ti-O-OH 的过氧桥中提取电子,显著促进了O-O 杂解对H2O2的光活化。因此,O-O 键的劈裂在光照下增强,同时加速TMB 氧化生成·TMB 自由基。基于此,该团队构建了一个Ag+比色检测平台,在1~100 μmol·L-1范围内对Ag+具有线性响应,检测限为0.92 μmol·L-1。Zhang等[38]构建了一个光热比色双模式Ag+检测平台。作为一种具有类似氧化酶活性的纳米材料,二氧化锰纳米片可以催化TMB 氧化为氧化三硝基苯。然而,通过谷胱甘肽还原MnO2NSs 会使MnO2NSs 的催化能力最小化。在该方法中,利用Ag+和GSH 的特殊相互作用来抑制还原过程。基于这种策略,Ag+可以很容易地通过比色法和光热评价来测量。通过比色法得出的检测限为5.5 nmol·L-1,而光热法得出的检测限为6.7 nmol·L-1。光热和比色双模式读出分析技术适用于更多的检测系统,其中2 种检测模式可以相互验证,从而获得更可靠的结果,特别是在复杂的环境中效果更明显。
3.2 LSPR比色传感器
3.2.1 金属纳米颗粒 金属纳米颗粒是目前研究最多的金属纳米材料,在可见光区具有明显的共振吸收带,并且其共振吸收峰对周围介电环境的变化十分敏感[39]。Jayeoye等[40]报道了一种灵敏度高、可选择性检测水溶液中Ag+的比色方法。首先,通过Au-S共价相互作用,获得3,3-二硫代二丙酸二(N-琥珀酰亚胺)酯[3,3'-dithiobis(succinimidyl propionate),DSP]修饰的金纳米粒子(DSP-AuNPs)。在pH 8.4 的磷酸盐缓冲液中,肌酸酐(creatinine,CRN)可以通过DSP 的羧基和CRN 的氨基之间的胺偶联反应组装到DSP-AuNPs 表面(DSPAuNPs@CRN),并形成酰胺键。在Ag+存在的条件下,通过Ag-N和Ag-π键相互作用再与DSP-AuNPs@CRN相互作用,从而引起纳米颗粒的聚集,使溶液从紫红色变为蓝色。该方法的检测限为0.13 μmol·L-1,远低于美国环境保护署(United States Environmental Protection Agency,USEPA)对饮用水中Ag+的最大可接受限值0.93 μmol·L-1。Zhao等[41]构建了一种基于MnO2包裹的金纳米粒子(AuNP@MnO2)的Ag+检测方法(图3),MnO2外壳可被谷胱甘肽还原成Mn2+。AuNP@MnO2单个纳米粒子的颜色不可避免地由黄色变为绿色,最大吸收峰从528 nm变为572 nm。然而,在体系中加入Ag+后,Ag+可以与谷胱甘肽结合,MnO2壳的蚀刻过程被抑制,因此探针的颜色保持黄色。这种基于单颗粒的比色法具有超灵敏的Ag+分析检测能力,检测限低至0.39 μmol·L-1,比相同体积溶液的传统比色分析结果低大约106倍。此外,这种方法还可以用于检测实际样品中的Ag+,显示了良好的环境监测和水质控制潜力。
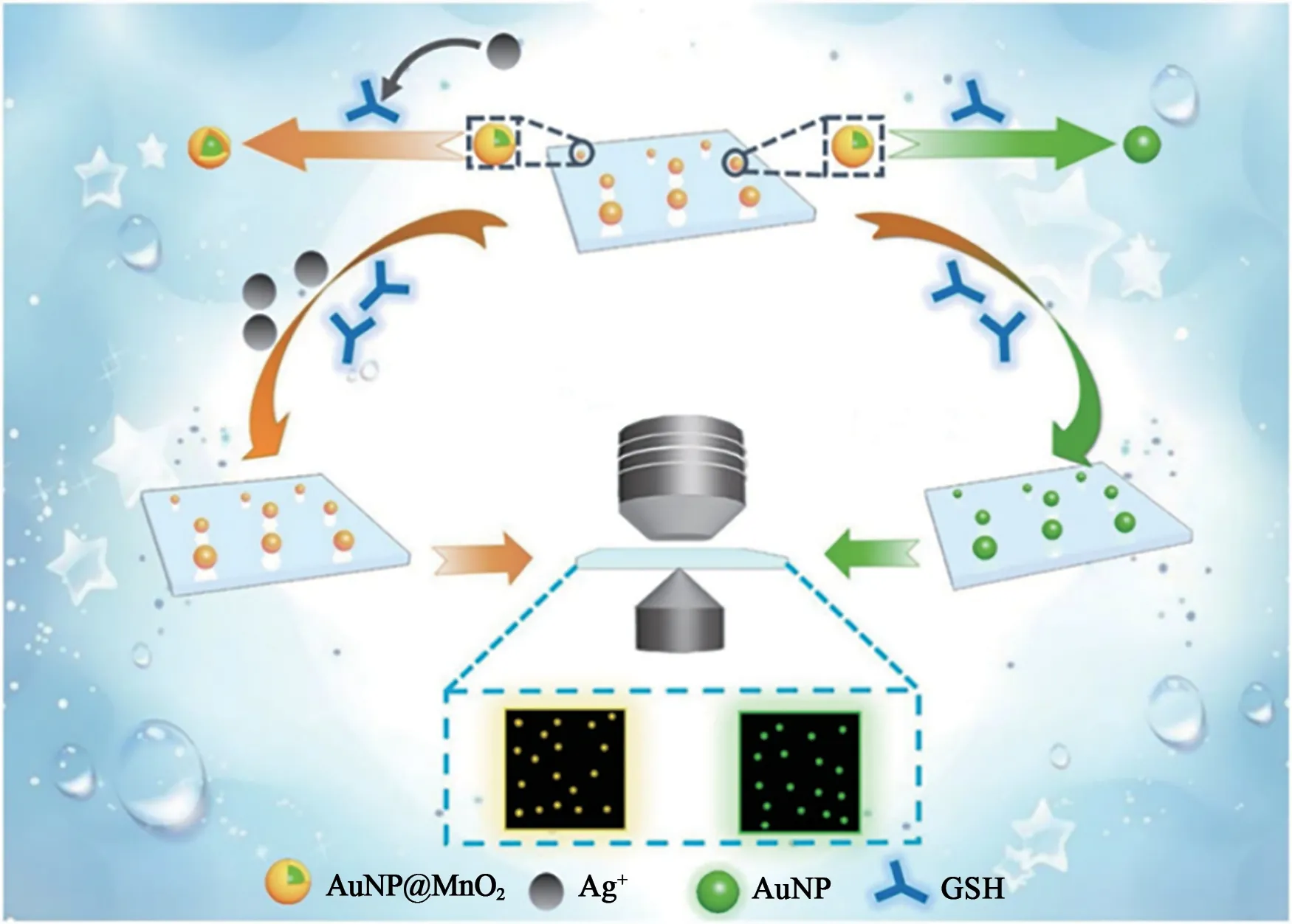
图3 基于谷胱甘肽刻蚀AuNP@MnO2纳米粒子比色检测银离子原理图[41]Fig.3 The schematic diagram of Ag+ colorimetric detection based on etching AuNP@MnO2 nanoparticles with glutathione[41]
3.2.2 碳点 碳点(carbon dots,CDs)也可用于Ag+的比色检测。从LSPR 传感机理来看,碳点比色传感器的原理可以分为2 个方面:基于量子点诱导表面金属纳米粒子的生长和基于量子点与重金属离子的相互作用。
Jin等[42]以蔗糖为前驱体,通过溶剂热法制备了CDs-1,开发了一种比色检测Ag+的方法。检测机理基于Ag+的还原和银纳米粒子的形成,银纳米粒子具有独特的表面等离子体共振性质,其中CDs-1在测定Ag+的反应中既可作为还原剂又可作为稳定剂。这种基于CDs-1 的检测系统可以在3 min内定量测定Ag+,检测限为26 nmol·L-1。此外,该传感分析可用于检测湖水样品中的Ag+。Sunitha等[43]以枸杞叶提取物为碳源,经氧化和水热工艺合成了具有OH 和COOH 官能团的碳点(PPCDs)。Ag+可以与COOH 和OH 官能团相互作用,从而引起PPCDs 吸收峰以及溶液颜色的变化。此外,由于在不同的pH 条件下,Ag+和PPCDs 的作用强度不同,因此分别得到了在pH 为5.1、7.2、10.0 条件下的Ag+响应曲线,检测限分别为7.800、0.758、0.340 μmol·L-1。
3.2.3 其他 金属有机骨架(metal-organic framework,MOF)由金属离子/簇和有机配体之间的强配位相互作用形成。由于其可调的微孔结构、大的比表面积和暴露的活性位点,MOFs 通常用于与催化相关的研究,并且极少数MOFs 可以作为重金属离子比色传感器的显色材料[44]。基于MOFs的比色传感器主要基于重金属离子和MOFs之间的相互作用,且伴随着明显的颜色变化。Zhong等[45]合成了多孔锌(Ⅱ)-羧酸盐框架(NOTT-6SMe-Zn)用于Ag+检测,NOTT-6SMe-Zn 的软硫原子与软Ag+的配位诱导溶液颜色由淡黄色变成棕色,且随着Ag+浓度的增加,颜色变深。基于上述原理,Ag+的检测限可以达到30 mg·L-1。二维纳米材料由于其超薄的结构,具有很大的比表面积,可以为分子间的相互作用提供丰富的活性位点[46]。Wang 等[47]提出了一种用于Ag+传感的无标记纳米等离子体比色法。Ti3C2MXenes 对Ag+的优异吸附亲和力和还原性有利于在纳米片上形成AgNPs并使溶液变成棕褐色。该方法的检测限为0.615 μmol·L-1,并且可在智能手机环境下,“红绿蓝”(red,green,blue,RGB)分析显示出与紫外-可见光谱仪测量结果一致的可视化结果。此外,这种原位银NPs生成方法也可能有利于废水中银的富集和贵重金属的回收。
4 基于化学小分子的比色检测技术
以化学小分子为主体的比色传感器在重金属离子检测中得到了广泛的关注和应用。这不仅源于它们优异的颜色指示和简单的作用机理,也和其优异的合成重现性、纯化和稳定性有关。此外,分子染料溶液更容易适应分析平台,如仪器/设备、试剂盒和测试条,并且由于液体溶液的均匀性、流动性和用户友好性,在应用中具有巨大的潜力。
基于有机小分子染料的化学传感器在重金属离子检测中的广泛应用。Goh 等[21]设计并合成了一种磺胺基复合物,该复合物可以通过氧原子与Ag+配位结合,导致吸收峰的变化,使溶液颜色从无色变为黄色。此外,通过密度泛函理论计算揭示了该现象归因于MLCT 机制。实验结果表明,该方法对Ag+的检测限为2.42 μmol·L-1。Gil 等[20]利用4-氯-7-硝基-2,1,3-苯并氧杂恶二唑(7-nitrobenz-2-oxa-1,3-diazole,NBD)和2-氨基二苯醚(2-aminodiphenyl ether moieties)合成了N,N-二甲基-7-硝基苯并[c][1,2,5]噁二唑-4-胺(7-nitro-N-(2-phenoxyphenyl)benzo[c][1,2,5]oxadiazol-4-amine,NPB),并基于ICT 设计了一种新型比色化学传感器NPB 用于检测Ag+(图4)。NPB 通过氧和氮原子与Ag 的络合显示出从二苯醚到NBD 更强的ICT 过程,并引起溶液由浅棕色到粉红色的颜色变化,该方法的检测线为3.6×10-6mol·L-1。Song 等[7]报道了一种基于喹啉的探针用于检测Ag+,称为AgP。AgP 本身在532 nm 处表现出较强的发射峰,荧光为亮绿色,与Ag+反应后,在383 nm处出现了新的吸收带,并伴有肉眼可见的从透明到浅橙色的比色变化。同时其荧光明显减弱,有轻微的蓝移,荧光颜色由明亮的黄绿色变为完全消失。AgP与Ag形成的金属配合物由于配体对金属电荷的转移导致探针结构发生变化,从而使吸收光谱以及发射光谱发生变化。通过在真实水样中的实际应用,表明该探针具有较高的灵敏度和选择性响应,此外,该研究还成功地将该探针用于模式植物拟南芥体内Ag+的检测。AgP及其浸渍试纸在响应Ag+后呈现出明显的比色变化,便于直接目视观察的Ag+浓度为0~250 μmol·L-1,该探针将为环境和生物样品中Ag+的检测提供一种新的策略。

图4 基于NBD的比色化学传感器NPB用于检测Ag+[20]Fig.4 NBD-based colorimetric chemosensor NPB for detecting Ag+[20]
表1 对上述检测方法进行了比较,可以看出对于不同的传感材料,基于DNA 的银离子检测技术具有较高的灵敏度,而且DNA 的生产成本低,可以大量制备,因此具有良好的应用前景。相比于DNA 与纳米材料,基于化学小分子的检测技术具有较高的检测限,这可能是由于化学反应速率的限制。此外,对于3种传感机制而言,基于酶催化和LSPR的检测技术更容易实现高灵敏度检测。

表1 银离子不同比色检测方法的比较Table 1 Comparison of different colorimetric detection methods for Ag+
5 展望
本文综述了Ag+介导的显色机理以及不同显色材料作为Ag+检测比色传感器的研究进展。与其他常用的检测方法相比,比色法因其操作简单、成本低等优点,在发展过程中受到了广泛的关注。此外,比色法并不局限于实验室或实验人员,尽管比色法在Ag+检测方面有很好的前景,但仍然存在一些挑战。
首先,在显色材料上,传统的复杂、高成本和低效的合成对环境和人类有害。随着环境保护和绿色化学的倡导,迫切需要环境友好材料。此外,在合成后,材料通常以溶液状态保存,稳定性差。例如,虽然化学小分子对Ag+具有敏感的颜色响应,但它们容易被氧化,给这些材料的保存带来了巨大的挑战。另一方面,与传统的有机染料相比,无机纳米材料为制造优异的比色传感器提供了新的途径。然而,它们都有一个固有的缺点,即很难像分子一样量化,控制批次生产的差异,使合成标准化。因此,需要建立相关规模化生产与质量控制体系,为转化应用奠定基础。
其次,在传感策略上,将比色感测系统结合到智能手机平台是一种潜在的有前景的方式,使得智能手机能够感测、转换和分析在线检测信息,因此,集成基于智能手机的技术将是推动Ag+比色传感器向前发展的另一种方式。用于同一样品的多模式检测技术将提高检测的准确性和可靠性。虽然比色等离子体传感器对于现场检测是非常有效的工具,但是它们通常只允许半定量地确定目标。
最后,在实际样品上,样品的制备是比色检测的关键步骤之一,复杂的样品基质,如工业废水可能会含有大量的有色杂质,会给Ag+检测带来很大的干扰,甚至使检测无法进行。此外,样品的酸度也可能会对检测产生影响。有些样品需要进行前处理,如稀释、过滤、提取等,以消除干扰物质或增强信号,这可能增加了实验的复杂性和时间成本。为了保持比色法的优势,亟需开发快速、简单的样品前处理技术,使复杂样品的现场检测成为可能。
