定点饱和突变提高赭曲霉11α羟化酶的催化性能
2024-02-05史京辉陈文慧陆坤郑婷婷任志远鲍国庆王敏骆健美
史京辉 陈文慧 陆坤 郑婷婷 任志远 鲍国庆 王敏 骆健美
(工业发酵微生物教育部重点实验室(天津科技大学),天津市工业微生物重点实验室 天津市微生物代谢与发酵过程控制技术工程中心,天津科技大学生物工程学院,天津 300457)
11α,17α-双羟基黄体酮(11α,17α-dihydroxy progesterone)俗称脱溴物,是许多重要甾体药物合成过程中的中间体[1],如泼尼松龙、醋酸泼尼松龙、可的松、氢化可的松等[2]。这些药物具有提高免疫力、抗炎、抗凝血等作用[3-6]。与化学合成法相比,微生物转化法不仅具有合成步骤少、生产周期短、副产物少、反应条件温和、环境友好等特点,而且具有高度的立体选择性和区域选择性,能对甾体药物母核上化学合成法难以或无法实现的位点引入特定官能团[7-10]。2022年,天津科技大学骆健美团队[11]考察了不同微生物对17α-羟基黄体酮转化生成11α,17α-双羟基黄体酮能力的影响,结果表明赭曲霉(Aspergillus ochraceus)、雅致小克银汉霉(Cunningpamycetes elegans)、蓝色犁头霉(Absidia coerulea)、球孢白僵菌(Beauveria bassiana)、金龟子绿僵菌(Metarhizium anisopliae)和黑曲霉(Aspergillus niger)均具有良好的转化能力,其中,赭曲霉的转化效果最好。
甾体11α羟化酶(11α-hydroxylase)属于细胞色素P450酶(CYP)超家族[12-13],主要包括胞质结构域、跨膜结构域和辅基血红素(heme)。其中,heme堆叠在I和L螺旋之间,位于相对较大的口袋中,通过与近端半胱氨酸残基结合的硫醇铁(Fe-thiolate)的配位结合连接到蛋白质骨架上,周围有疏水性氨基酸残基以容纳疏水性底物[14]。近年来,研究者将不同来源11α羟化酶基因在大肠杆菌(Escherichia coli)[15]、耻垢分枝杆菌(Mycolicibacterium smegmatis)[16]、酿酒酵母(Saccharomyces cerevisiae)[17]和毕赤酵母(Pichia pastoris)[18]中异源表达并进行功能验证,但关于羟化酶关键氨基酸位点及其分子改造的报道较少。
大量研究表明,关键氨基酸位点对甾体羟化酶的选择性和活性产生显著的影响。2022年,天津科技大学刘晓光团队[19]通过敲除实验证明,赭曲霉CICC 41473的11α羟化酶CYP68J5是负责催化黄体酮和左旋乙基甾烯二酮发生11α羟化反应的关键酶。之后,基于CYP68J5与睡莲炭疽病菌(Colletotrichum nymphaeae)和西蒙氏炭疽病菌(Colletotrichum simmondsii)来源的CYP的序列一致性比对(分别为52.01%和50.91%),对3个氨基酸保守位点V64、E65和N66进行定点饱和突变。结果表明,突变体V64K对黄体酮的11α羟基化选择性达高达90.6%,而对左旋乙基甾烯二酮的11α羟基化选择性几乎完全丧失,说明CYP68J5的V64位点在两种底物的11α羟基化反应选择性上发挥着完全不同的作用[20]。2023年,沈阳药科大学田威团队[21]通过分子对接,确定了球黑孢霉(Nigrospora sphaerica)羟化酶CYP-N2中与底物结合的关键氨基酸位点分别为F120、A124、T128、S140、V312和T316,对其进行丙氨酸扫描发现,突变体T316A对甲地孕酮、黄体酮、可的松和去氢表雄酮几乎没有活性,说明T316位点是CYP-N2催化4种底物的关键位点。而突变体T128A对甲地孕酮和可的松的活性分别提升了19.3%和10.4%,对去氢表雄酮的活性几乎不变,对黄体酮的活性降低了15.1%,突变体F120A、S140A和V312A对上述4种底物的活性均有不同程度的改变。这些结果说明,对于CYP-N2,同一个位点对不同底物表现出不同的活性。
课题组前期通过结构预测、分子对接以及丙氨酸扫描等手段,确定了赭曲霉CICC 41473的11α羟化酶CYP68J5的关键氨基酸位点为D118、F216、M488[11]。本研究在此基础上对3个关键位点进行定点饱和突变,筛选出催化性能优良的突变体,并通过分子对接和分子动力学模拟阐明其活性提高的分子机制。研究结果对羟化酶CYP68J5的遗传改造和11α,17α-双羟基黄体酮的生产具有重要的理论意义和应用价值。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 菌株:赭曲霉CICC 41473、大肠杆菌DH5α、酿酒酵母INVSc1。质粒:pYES2-cyp68j5。以上材料均由实验室自主保藏。
1.1.2 培养基 LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10,pH 7.5,ddH2O定容至1 L。固体培养基加入琼脂粉20。YEPD培养基(g/L):蛋白胨20,酵母提取物10,ddH2O定容至900 mL。121℃,20 min灭菌后补加20%葡萄糖100 mL,固体培养基加入琼脂粉20。Ura营养缺陷型培养基(g/L):YNB 6.7,加入ddH2O定容至900 mL。121℃,20 min灭菌后补加20%葡萄糖100 mL、DO Supplement-Ura 1.29,固体培养基加入琼脂粉20。
1.1.3 主要实验材料 本实验所用引物(表1),苏州金唯智生物科技有限公司。DNA琼脂糖凝胶回试剂盒、细菌质粒提取试剂盒、酵母质粒提取试剂盒,天根(北京)生化科技有限公司。核酸限制性内切酶、T4连接酶,大连TaKaRa公司。KOD-Plus-Neo突变试剂盒,东洋纺(上海)生物科技有限公司。17α-羟基黄体酮、11α,17α-双羟基黄体酮,天津市津津药业有限公司(中国)。一次性无菌接种环,湖南比曼克生物科技有限公司。
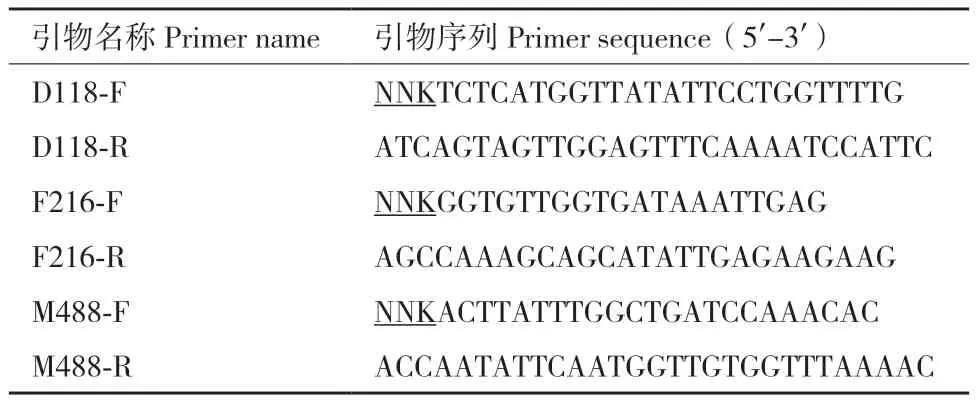
表1 饱和突变的PCR引物Table 1 PCR primers for the saturated mutation
1.1.4 主要仪器设备 PCR基因扩增仪、小型台式高速冷冻离心机,德国Eppendorf公司。电泳仪,北京市六一仪器厂。紫外可见分光光度计,岛津仪器(苏州)有限公司。电热恒温水浴桶,河北黄华市航空仪器厂。Agilent高效液相色谱仪,美国Agilent公司。
1.2 方法
1.2.1 酿酒酵母的培养 单菌落培养:用一次性无菌接种环从YEPD平板上长出的单菌落上挑取少量菌体,将其在新的YEPD固体平板上均匀涂成约1 cm2的方块(patch),30℃恒温培养箱倒置培养1-2 d,观察方块范围内涂抹的菌体生长情况。过夜培养:用一次性无菌接种环从任意一个目的patch上挑取大头针头大小的菌体,将其接种在装有5 mL的YEPD液体培养基的试管中,在30℃恒温摇床中220 r/min培养12-16 h。
1.2.2 羟化酶CYP68J5的饱和突变
1.2.2.1 重组质粒的构建 以课题组前期构建的pYES2-cyp68j5质粒为模板,采用反向PCR进行扩增。采用简并密码子NNK设计简并引物,如表1所示。所有引物均由金唯智生物技术服务公司合成并使用tPAGE纯化方式纯化。
反向PCR扩增条件:94℃ 2 min,98℃ 10 s,Tm-5℃ 30 s,68℃ 7.4 min,共20个循环,4℃保温。
PCR产物用Dpn I限制性内切酶在37℃下酶切4 h以去除未突变的模板质粒,参考KOD-Plus突变试剂盒说明书,使用T4多聚核苷酸激酶和连接酶对酶切产物进行自身环化连接反应(16℃,16 h)。连接后的质粒转入大肠杆菌DH5α感受态细胞,复苏后的菌液均匀涂布于含有氨苄青霉素的LB固体培养基上,37℃过夜培养,挑选转化子进行菌落PCR验证,验证正确的阳性转化子提取质粒送样测序,将突变正确的质粒保存并进行后续实验。
1.2.2.2 重组菌株的构建 将验证正确的重组质粒通过醋酸锂法导入酿酒酵母感受态细胞,具体构建过程参照Invitrogen公司操作手册。
1.2.3 底物转化实验 用一次性无菌接种环从做patch的YEPD平板上刮取一环菌体至装有50 mL YEPD液体培养基的250 mL三角瓶中,在30℃,200 r/min条件下振荡培养24 h后分别加入0.5 g/L和2.0 g/L的底物17α-羟基黄体酮(甲醇助溶,底物∶甲醇=1∶20(mg∶μL)),并投加3.75 mL浓度为20%半乳糖溶液进行诱导(终浓度为1.5%),每24 h补加1次。在30℃,220 r/min条件下转化84 h,每12 h取样检测。取样时,将1.0 mL的发酵液加至2 mL离心管中,加入1.0 mL乙酸乙酯终止转化反应。用超声清洗仪超声萃取20 min,吸取萃取后的上层溶液200 μL于1.5 mL离心管中,13 000 r/min离心10 min后的上清液用于后续定量检测。
1.2.4 甾体化合物的检测
1.2.4.1 薄层色谱法(TLC) 使用移液枪将上清液点在薄层硅胶GF254板上,点样量为2 μL,点样的直径不能大于2 mm,点样样品间隔至少为0.6 cm,样点与硅胶板边沿间隔至少1 cm;再将硅胶板样品放到盛有展开剂的层析缸中进行层析,展开剂的配比为:正己烷∶丙酮∶乙酸乙酯=1.4∶1∶0.5(V/V/V)。待溶剂前沿与硅胶薄板上边缘的距离约为1 cm时层析完毕,取出硅胶板挥干。最后将硅胶板放在254 nm紫外灯下观察斑点。
1.2.4.2 高效液相色谱法(HPLC) 吸取200 μL上清液于离心管中,放在通风橱中自然挥干,然后加入1 mL流动相进行复溶[22]。超声清洗仪超声20 min,13 000 r/min离心10 min后取上清液300 μL用于HPLC检测。具体条件为:Agela C18 柱(250 mm×4.6 mm,5 μm),流动相为甲醇∶水=80∶20(V/V),流速为1 mL/min。检测波长为254 nm。柱温为35℃。通过比较标准品和样品中底物和目标产物的保留时间和峰面积进行定性和定量分析,根据标准曲线,利用峰面积计算样品中底物和产物的浓度。
生产强度是指一定时间内单位发酵罐容积所产生的产物量。根据HPLC检测结果,按照公式(式1和式2)计算摩尔产率和生产强度。
1.2.5 分子对接和分子动力学模拟
使用AlphaFold 2对CYP68J5进行结构预测,ChemDraw软件画出底物17α-羟基黄体酮的结构式,通过AutoDock Tools软件(http://autodock.scripps.edu/resources/adt)对CYP68J5及其突变体与底物17α-羟基黄体酮进行分子对接。结合PyMOL(https://www.pymol.org)生成详细的蛋白质结构图。采用GROMACS 5.0.2软件和AMBE99SB力场进行分子动力学模拟(molecular dynamic simulation,MD)。具体方法如下:将底物17α-羟基黄体酮与羟化酶CYP68J5和最优突变体的复合物分别放入一个10 nm3的立方体盒子中,采用TIP3P水模型,设置溶质-盒子的距离为10 Å,为了平衡系统中的电荷,一部分水分子被相同数量的负离子(Cl-)和正离子(Na+)取代,根据pH 7.0设置残基的质子化状态,使用最速下降算法执行10 000步的能量最小化步骤,通过指定模拟系统中每个原子的初始速度不同,在温度(300 K)和大气压(1.01 bar)等参数下进行50 ns的分子动力学模拟,基于GROMACS的MM/PBSA算法对分子动力学模拟轨迹,按照公式(式3)[23]计算结合自由能,并进行能量拆解分析。
2 结果
2.1 优良突变体的筛选
课题组前期借助结构预测、分子对接和丙氨酸扫描等手段确定了CYP68J5的3个关键氨基酸位点分别是第118位的天冬氨酸、第216位的苯丙氨酸和第488位的甲硫氨酸(图1)。因此,本文选择上述3个位点进行定点饱和突变。

图1 CYP68J5与底物对接结构中D118V、F216和M488三个位点的分布情况Fig. 1 Distribution of the D118V, F216 and M488 in the docking structure of CYP68J5 with substrate
通过定点饱和突变共获得54个CYP68J5的突变体。通过底物转化实验,考察不同突变体对17α-羟基黄体酮的转化性能,由TLC结果可知,突变体D118V的转化性能最好,M488W次之,而突变体F216W、M488L的转化能力较弱,其余突变体的转化性能显著降低甚至完全丧失(图2)。
对上述4个突变体D118V、F216W、M488L和M488W的转化液进行HPLC分析。如图3-A所示,底物浓度为0.5 g/L时,CYP68J5的产物浓度在72 h达到最大值,为434.50 mg/L。而突变体D118V的产物浓度在24 h达到最大值,为452.56 mg/L。该水平较野生型CYP68J5有所提升,且达到的时间缩短了66.70%。如图3-B可知,突变体D118V的生产强度为431.66 mg/(L·d),较野生型CYP68J5(138.15 mg/(L·d))提高了2.12倍。而其他3个突变体M488W、F216W和M488L的产物浓度和生长强度均低于野生型CYP68J5。
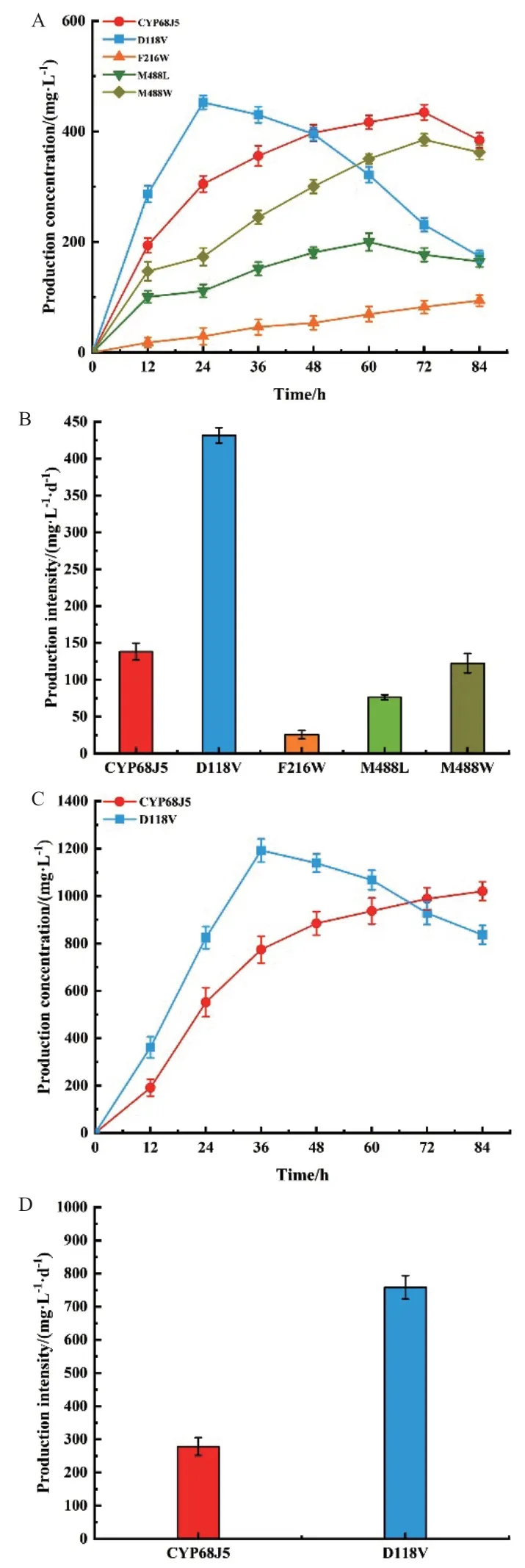
图3 表达CYP68J5及其突变体D118V、F216W、M488L和M488W的酿酒酵母在0.5 g/L底物浓度(A, B)和2.0 g/L底物浓度(C, D)的产物生成曲线和生产强度Fig. 3 S. cerevisiae expressing CYP68J5 and its mutants D118V, F216W, M488L, and M488W at 0.5 g/L substrate concentration product formation curves and production intensities(A, B)and 2.0 g/L substrate concentration(C, D)
对于在底物浓度为0.5 g/L时转化性能最优的突变体,进一步探究其在底物浓度为2.0 g/L时的转化性能。如图3-C所示,底物浓度的增加使产物达到峰值的时间往后推迟了12 h,但产物的最大生成量提高了1.63倍。其中,突变体D118V产物浓度在36 h达到最大值,为1.19 g/L,而野生型CYP68J5的产物浓度在84 h达到最大值,为1.02 g/L。突变体D118V的生产强度(758.15 mg/(L·d))比野生型CYP68J5(277.94 mg/(L·d))提高了1.72倍(图3-D)。
2.2 CYP68J5及突变体与底物的分子对接分析
使用AutoDock对CYP68J5及突变体D118V、F216W、M488L和M488W与底物进行分子对接,并通过Discovery Studio软件展示了分子对接获得的复合物的分子间相互作用力。
如图4所示,CYP68J5和最优突变体D118V的V304位点与底物之间具有C-H键,R223位点和heme与底物之间形成氢键,W89、F111、L368和heme与底物之间具有疏水作用力。但值得注意的是,D118V还存在V118与底物之间的疏水作用,这是由于第118位的极性的天冬氨酸突变为非极性的疏水性缬氨酸,使得底物结合口袋的整体疏水作用增强,可以更好地结合和稳定疏水性的底物,导致酶的催化性能显著提高。
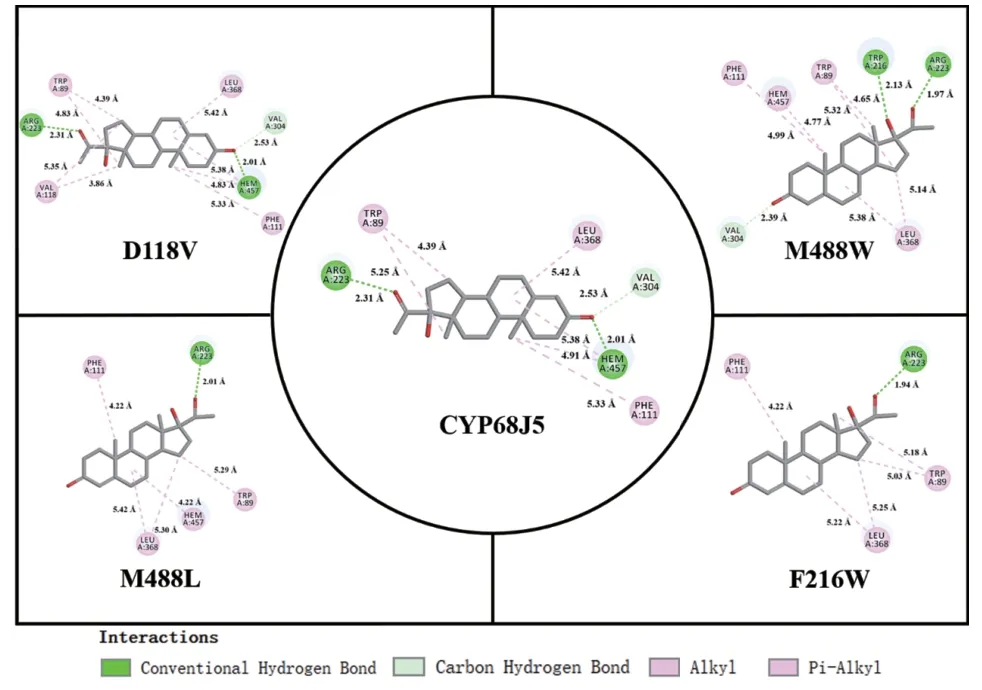
图4 使用Discovery Studio绘制的CYP68J5及其突变体D118V、F216W、M488L和M488W残基和血红素(heme)与底物的分子间相互作用2D图Fig. 4 2D plot of the intermolecular interactions of CYP68J5 and its the mutant D118V, F216W, M488L,and M488W residues and heme with substrates using Discovery Studio
与CYP68J5相比,突变体M488W和M488L的活性下降,这可能是因为二者只存在heme与底物之间的疏水作用,而heme与底物之间的氢键作用力消失。突变体M488L的V304位点与底物之间没有形成C-H键,这可能是其催化性能更低的主要原因。相较于CYP68J5和其他突变体,突变体F216W的heme与底物之间没有任何作用力,且V304位点与底物之间也没有形成C-H键,推测这些分子间作用力的消失是F216W转化性能最低的主要原因。
综上所述,V118位点与底物之间形成新的疏水作用力,导致了酶的底物结合口袋的整体疏水性增强,有利于底物的结合,是该突变体催化性能提升的主要原因。对于突变体M488W、M488L和F216W,分子间相互作用力的减少(如heme与底物之间的氢键和疏水作用力;V304位点与底物之间的C-H键)是酶催化性能降低的主要原因。
2.3 CYP68J5及突变体D118V的分子动力学模拟分析
对CYP68J5和优良突变体D118V分别进行分子动力学模拟,进一步分析催化性能提高的原因。均方根偏差(root-mean-square deviation,RMSD)是蛋白质构象与原始结构之间的平均偏差,RMSD值越低,说明MD模拟过程中,蛋白结构越稳定。由图5-A可知,CYP68J5的RMSD在10 ns后基本趋于稳定,而突变体D118V的RMSD在15 ns后基本趋于稳定,二者的平均值分别为(0.74±0.02) nm和(0.60±0.01) nm。这说明D118突变为V118后,残基的改变使整个11α羟化酶结构更加稳定。均方根波动(root-mean-square fluctuation,RMSF)可以反映模拟过程中每个残基的波动情况,表征蛋白质的刚性和柔性,RMSF值越高,说明残基的波动情况越大,蛋白质的柔性越强。如图5-B所示,CYP68J5和突变体D118V的RMSF平均值分别为(0.27±0.01)nm和(0.18±0.01) nm,突变体D118V大部分残基的RMSF值低于CYP68J5,表明突变体D118V整体区域的刚性增强,这与RMSD的结果是一致的。其中,氨基酸99-103(α螺旋)、115-118(α螺旋)、119-127(loop区)和251-264(α螺旋)等多处位置表现出更低的RMSF值,这种变化有利于酶和底物的稳定结合,降低底物“脱靶”的敏感性。回转半径(radius of gyration,Rg)反映分子中心与原子质量的关系,表征蛋白质结构的紧密性,Rg值越小说明蛋白结构越紧密,反之结构越疏松。如图5-C所示,CYP68J5和D118V的Rg平均值分别为(2.60±0.01)nm和(2.47±0.01)nm,这表明D118突变为V118后,11α羟化酶整体构象更稳定,这与RMSD和RMSF的结果是一致的。溶剂可及表面积(solvent-accessible surface area,SASA)是溶剂可接触的分子表面积,是描述蛋白质疏水性的重要参数,蛋白质折叠后SASA值变小,疏水作用增强。如图5-D所示,CYP68J5和突变体D118V在MD模拟过程中的SASA平均值分别为(267.02±2.95)nm2和(256.51±2.27)nm2,且在整个模拟过程中,D118V的SASA值始终小于CYP68J5,这说明D118V比CYP68J5的疏水性更强,这与分子对接时发现突变后产生了新的疏水作用是一致的。氢键对于维持蛋白质的稳定具有重要作用,如图5-E所示,突变体D118V氢键存在概率明显大于CYP68J5。结合自由能(binding free energy)反映蛋白质的能量,能量越低,蛋白质越稳定。采用MM/PBSA方法对分子动力学模拟轨迹进行结合自由能计算。如图5-F所示,突变体D118V的结合自由能(-24.42±1.18 kcal/mol)低于CYP68J5(-19.81±1.22 kcal/mol),说明突变体D118V和底物形成的复合物的结构更稳定。其中,范德华力、静电作用和非极性溶剂化自由能可以促进酶和底物结合,极性溶剂化自由能对其具有抑制作用,范德华力、静电作用和非极性溶剂化的总自由能可以抵消极性溶剂化自由能的不利影响,从而维持这些酶与底物的稳定结合。
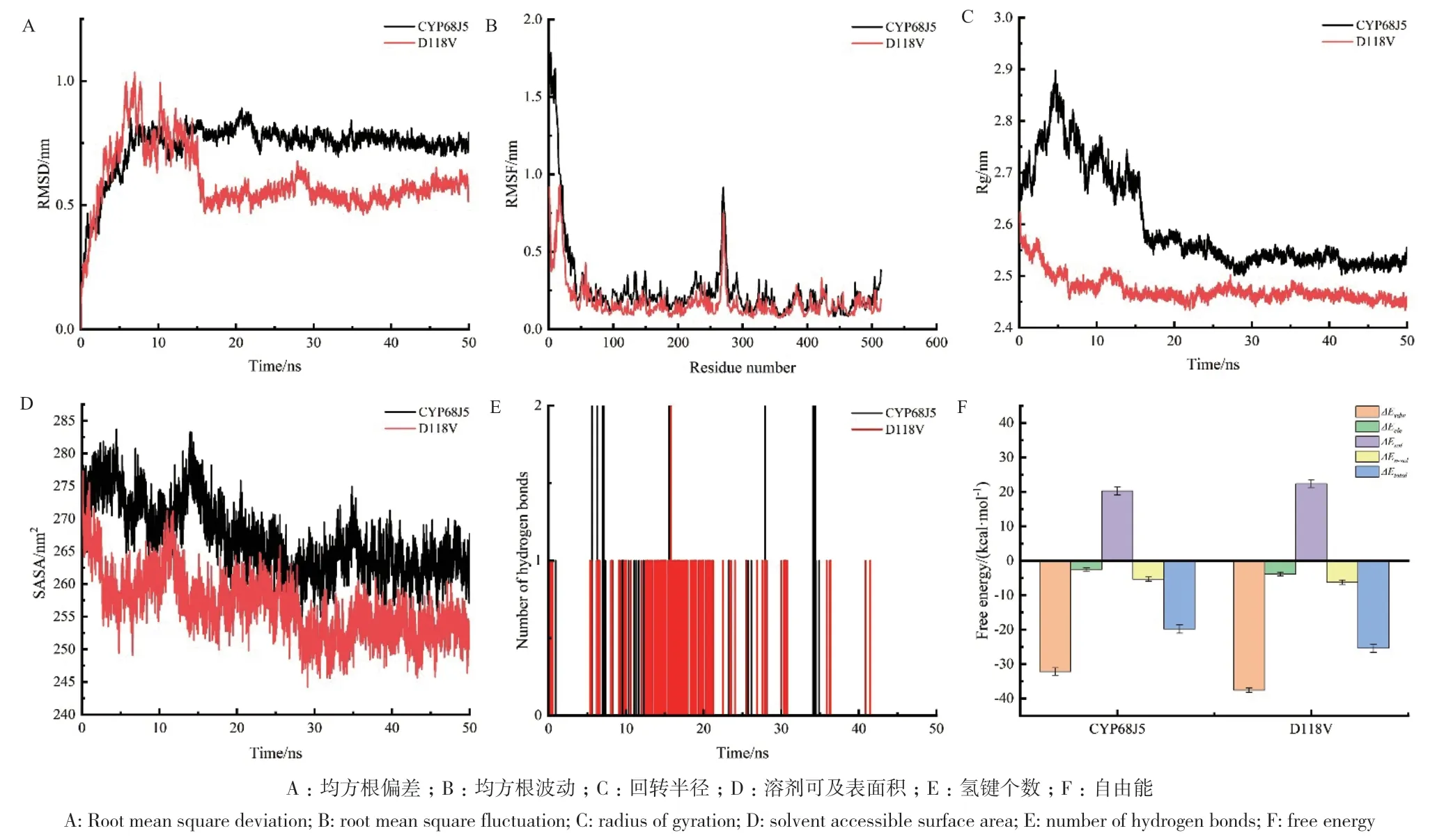
图5 CYP68J5和优良突变体D118V的分子动力学模拟Fig. 5 Molecular dynamics simulations of CYP68J5 and its elite mutant D118V
综上所述,与野生型CYP68J5相比,突变体D118V的RMSD、RMSF和Rg值更低,氢键存在的概率增大,说明11α羟化酶结构更加稳定,整体结构的刚性增强,构象更加稳定,SASA值降低,说明突变体的疏水性增强,结合自由能降低,说明突变体与底物形成的复合物结构更稳定,这些变化是酶的催化性能显著提升的重要原因。
3 讨论
目前常见酶的改造方法有定点突变(包括饱和突变)和随机突变。其中,基于关键氨基酸位点的定点饱和突变技术,可通过高质量突变体文库的构建获得优良的突变体。相比于易错率高和突变位点不可控的随机突变,具有成本低、效率高等优点[24-25]。2020年,南京工业大学陈可泉团队[26]对赤红球菌(Rhodococcus ruber)来源的羟化酶CYP116B3的关键氨基酸位点E88、N199和Q209进行定点饱和突变,筛选得到的优良突变体E88C、N199Q和Q209A,三者转化萘生成α-萘酚的产量比野生型分别提高了2.0、13.0和3.7倍。
本文针对课题组前期鉴定的3个关键氨基酸位点进行了定点饱和突变,结果表明,118位点极性的亲水性天冬氨酸突变为非极性的疏水性缬氨酸后,酶的催化性能显著提升;216位点非极性的疏水性苯丙氨酸突变为非极性的疏水性色氨酸后,酶的催化性能显著降低;488位点非极性的疏水性甲硫氨酸突变为非极性的疏水性色氨酸和异亮氨酸后,酶的催化性能发生不同程度的降低。而上述3个位点突变成极性氨基酸、酸性氨基酸和碱性氨基酸后,突变体的催化性能几乎完全丧失。说明3个位点上非极性的疏水性氨基酸(缬氨酸、色氨酸和亮氨酸)对于酶的催化活性非常重要。
值得注意的是,随着转化时间的延长,表达CYP68J5及其突变体的酿酒酵母工程菌株转化底物生成目标产物的浓度逐渐下降,推测可能是目标产物逐渐转化为副产物或者分解。类似地,表达蓝色犁头霉(Absidia coerulea)来源的11β羟化酶CYP5311B2的酿酒酵母工程菌株,催化11-脱氧皮质醇发生11β-羟化反应的过程中,除了目标产物氢化可的松之外,还会产生11β-和11α-羟基化衍生物的立体异构体混合物,其比例达到20%[27]。
分子对接结果表明,D118V突变之后,疏水性的缬氨酸与底物之间产生疏水作用力,导致酶催化性能显著提升。而突变体M488W、M488L和F216W的催化性能有不同程度的降低,原因可能是heme与底物之间的氢键、疏水作用力和V304位点与底物之间的C-H键等分子间相互作用力减少。类似的,古生菌酸热硫化叶菌(Sulfolobus acidocaldarius)来源的羟化酶CYP119进行改造发现,5个突变体由于缺少了heme和T257之间的氢键,导致酶的活性显著降低[28]。
与野生型相比,突变体D118V的115-118(α螺旋)和119-127(loop区)区域的刚性显著提升,蛋白质整体结构刚性增强,稳定性提高,即缬氨酸可以降低主链的结合熵,导致酶的催化性能提升。2023年,浙江大学的王健波团队[29]将巨大芽孢杆菌(Bacillus megaterium)来源的羟化酶P450-BM3位于底物入口通道的D68位点进行定点饱和突变,当极性的天冬氨酸突变为非极性的疏水性缬氨酸后,底物入口通道的宽度由2.6 Å增大为5.3 Å,减小了底物进入的空间位阻,从而显著提升了酶的催化性能显著提升。2020年,天津科技大学秦慧明团队[30]对赖氨酸羟化酶进行改造,获得的优良突变体MT3催化性能显著提升(kcat/Km值较WT提高了24.97倍),通过MD模拟发现,突变后的蛋白构象更为开放,在相同的模拟时间内,底物可以更深入到结合口袋中。因此,我们推测,本文获得的优良突变体D118V催化性能提升也与突变后缬氨酸侧链位阻较小,与底物能更深入酶的催化口袋有关。但是课题组前期研究[11]发现,突变体D118A不能转化生成11α,17α-双羟基黄体酮,这可能是突变后的丙氨酸的位阻更小,底物结合口袋过大,不能很好地与底物结合,造成了底物的“脱靶”现象,这些结果说明合适尺寸的底物结合口袋对酶的催化性能具有重要作用。
4 结论
通过对赭曲霉的羟化酶CYP68J5三个关键氨基酸位点的定点饱和突变,获得了催化活性提高的优良突变体D118V。其在底物浓度为0.5 g/L和2.0 g/L时的生产强度较野生型分别提高了2.12和1.72倍。分子对接和分子动力模拟发现,V118位点突变之后与底物之间产生了新的疏水相互作用,酶的整体构象更稳定以及酶与底物的结合更紧密,这些变化共同作用提高了酶的催化性能。