元蘑多糖的结构特征及其调节巨噬细胞免疫活性机制
2024-02-05王子璇隋玉尚学钰马思嘉吴天香刘洋王琦
王子璇 隋玉 尚学钰 马思嘉 吴天香 刘洋 王琦,3
(1. 吉林农业大学食药用菌教育部工程研究中心,长春 130118;2. 吉林农业大学植物保护学院,长春 130118;3. 吉林农业大学中药材学院,长春 130118)
元蘑(Sarcomyxa edulis)隶属于担子菌门(Basidiomycota)、蘑菇纲(Agaricomycetes)、蘑菇目(Agaricales)、小菇科(Mycenaceae)、美味扇菇属(Sarcomyxa)[1],又称冻蘑、冬蘑等。中医认为,元蘑味鲜,性质温和,还具有除湿活血、舒缓经络、祛风等作用[2]。元蘑营养美味,分布广泛,且已实现人工栽培,具有重要的经济和药用价值。
巨噬细胞是机体重要的免疫细胞,具有分泌细胞因子、调控机体平衡以及保护机体免受外界病原体侵害等多种生物学功能[3]。多糖是真菌中重要的活性成分,大量研究表明,食药用菌多糖如裂褶菌多糖[4]、羊肚菌多糖[5]等可调节免疫细胞,促进其细胞因子的产生,增强其吞噬功能,进而提高机体免疫能力[6]。
现已研究发现,元蘑多糖具有保护肠道健康[7]、抗氧化[8]、降血糖[9]、抗衰老[10]、抗疲劳[2]等多种生物活性,而其对巨噬细胞的免疫活性尚未见报道。本研究以元蘑多糖为研究对象,采用DEAE-52离子交换层析和Sephacryl S-400葡聚糖凝胶过滤层析对其进行分离纯化,采用高效凝胶渗透色谱法、傅里叶变换红外光谱分析等方法,明确其理化性质和结构特征,并系统考察了其对巨噬细胞免疫调节作用及机制。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 元蘑(干品)由黑龙江省牡丹江市温春农校提供,RAW264.7细胞由吉林农业大学食药用菌教育部工程研究中心提供。DEAE-52纤维素、5%中性红染液购自北京索莱宝科技有限公司;CCK-8购自Biosharp;Trizol、反转录试剂盒、qPCR试剂盒购自SparkJade;胎牛血清、胰酶购自Hyclone;RIPA裂解液、PMSF、BCA蛋白定量检测试剂盒、SDS-PAGE凝胶制备试剂盒、一抗(β-actin)、GAPDH、Histone H3、二抗均购自Servicebio。
1.1.2 仪器与设备 多功能酶标仪、ICS5000离子色谱仪(Thermo Fisher Scientific);ST 16R高速冷冻离心机(日立);BSZ-100自动部分收集器(上海青浦沪西仪器厂);BPN-80CH CO2培养箱(上海恒一);XD-101倒置生物显微镜(德国Zeiss);D3024R台式高速冷冻离心机(Dragonlab);荧光定量PCR扩增仪(赛默飞);MX-F涡旋混合器、BV-2垂直电泳仪、BT-2转印电泳仪购于Servicebio。
1.2 方法
1.2.1 元蘑多糖的提取与分离纯化 参照隋玉等[11]水提醇沉法提取多糖。精确称取元蘑子实体干品500 g,粉碎后加入去离子水,料液比为1∶30(g/mL),提取温度80℃,提取时间3 h,以8 000 r/min的速度离心12 min,收集上清液,将其浓缩至原体积的1/4,加入3倍体积无水乙醇,4℃静置过夜后,离心15 min,转速为6 000 r/min,收集的沉淀即为多糖粗品,干燥备用。使用Sevag法除蛋白后,选择截留分子量为3 500 Da的透析袋流水透析48 h,冻干得到元蘑多糖SEP。
将元蘑多糖SEP进行DEAE-52离子交换层析。配制4 mg/mL的SEP溶液,缓慢沿DEAE-52纤维素凝胶柱(1.8 cm×25 cm)柱壁均匀上样,依次用蒸馏水、0.1 mol/L、0.3 mol/L NaCl进行洗脱,流速1 mL/min,6 mL/管,不同洗脱梯度各收集50管。采用苯酚-硫酸法[12]对各管收集的洗脱液进行检测,以管数为横坐标,490 nm处吸光度值为纵坐标绘制洗脱曲线,并收集水洗多糖组分,命名为SEP-0。
进一步对SEP-0进行Sephacryl S-400葡聚糖凝胶过滤层析,配制10 mg/ mL SEP-0溶液,除杂除气泡后缓慢推进上样,用0.15 mol/L NaCl进行洗脱,流速0.5 mL/min,4 mL/管,收集40管。采用苯酚-硫酸法对每管收集的样品进行多糖含量检测,并绘制洗脱曲线。根据洗脱曲线收集单一峰作为多糖组分SEP-0a。
1.2.2 元蘑多糖理化性质检测
1.2.2.1 多糖含量测定 采用苯酚-硫酸法对元蘑多糖SEP-0a进行多糖含量检测。向含有200 μL浓度为0.25 mg/mL的元蘑多糖溶液中加入100 μL 5%苯酚溶液后,再加入500 μL 98%浓H2SO4,室温条件下静置20 min,490 nm处检测吸光度值(OD值),根据葡萄糖标准曲线计算样品多糖含量。
1.2.2.2 蛋白含量测定 采用考马斯亮蓝法[13]对蛋白含量进行测定。向含有1 mL浓度为1.0 mg/mL的元蘑多糖SEP-0a中加入5 mL考马斯亮蓝G250溶液,室温静置5 min,595 nm处检测吸光度值(OD值),根据标准曲线计算样品蛋白质含量。
1.2.2.3 均一性及分子量测定 采用高效凝胶渗透色谱法(High Performance Gel Permeation Chromatography Evaporative Light-scattering Detector,HPGPC-ELSD)对元蘑多糖SEP-0a进行均一性及分子量检测。配制5 mg/mL SEP-0a溶液,过滤采用0.22 μm水系滤膜进行,进样量为10 μL,按照色谱条件进行洗脱,记录保存色谱图,按照标准曲线方程计算样品的分子量。
色谱条件:检测器为RID-10A视差折光检测器,TSK-gel G-3000PWXL色谱柱(7.8 mm×300 mm),柱温:35℃,流动相:0.2 mol/L氯化钠水溶液,流速:0.6 mL/min。
1.2.2.4 单糖组成检测 采用离子交换色谱法(Ion Exchange Chromatography High Performance Liquid Chromatography,IEC-HPLC)对元蘑多糖SEP-0a进行单糖组成的分析。称取5 mg(±0.05 mg)SEP-0a,加入5 mL三氟乙酸(2 mol/L),温度121℃,加热2 h,通入N2,加3 mL甲醇洗涤并吹干,重复上述步骤3次,加入无菌水溶解,用0.22 μm滤膜过滤,转移至色谱瓶,上机检测。
色谱条件:DionexTMCarboPacTMPA10液相色谱柱(4.0 mm×250 mm,10 μm),柱温:30℃,电化学检测器,流动相:A相:H2O;B相:100 mmol/L NaOH,进样量:20 μL,流速:0.5 mL/min。
1.2.3 元蘑多糖的红外光谱分析 称取元蘑多糖SEP-0a 1.9 mg与KBr粉末190.0 mg,使其充分混匀后进行压片,在傅里叶变换红外光谱仪(Fourier transform infrared spectrometer, FT-IR)波长频率为4 000-400 cm-1的范围内扫描检测,重复3次,取平均值。
1.2.4 SEP-0a对巨噬细胞存活率的影响 采用CCK-8法[14]检测SEP-0a对巨噬细胞存活率的影响。取浓度为2.5×104个/mL的RAW264.7细胞接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养12 h,弃上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,吸掉培养液,加入CCK-8(CCK-8∶DMEM基础培养液=1∶10)100 μL,避光培养45 min,450 nm处检测吸光度值,计算细胞存活率。
1.2.5 SEP-0a对巨噬细胞吞噬作用的影响 采用中性红法[15]检测SEP-0a对巨噬细胞吞噬作用的影响。将RAW264.7细胞(5 000个/孔)接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养24 h,弃去上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,吸掉培养液。配制0.1%中性红染液,加入100 μL,在含有5%二氧化碳恒温(37℃)培养箱中避光培养60 min,弃上清,用PBS(200 μL/孔)进行清洗,重复3次,加入细胞裂解液(100 μL/孔)裂解2 h,此操作避光进行,在540 nm处检测吸光度值。
1.2.6 SEP-0a对巨噬细胞产生ROS的影响 采用2',7'-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针法[16]检测SEP-0a对巨噬细胞产生ROS的影响。取浓度为5×104个/mL的RAW264.7细胞接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养12 h,弃去上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,将培养液吸出,每孔加入DCFH-DA 200 μL,培养箱培养20 min,用不含血清的基础培养液洗涤3次后再加入200 μL基础培养液,在激发波长为488 nm,发射波长为525 nm的条件下检测荧光强度。
1.2.7 SEP-0a对巨噬细胞分泌NO影响 采用一氧化氮法[17]检测SEP-0a对RAW264.7细胞分泌NO影响。取浓度为2.5×105个/mL的RAW264.7细胞接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养12 h,弃上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,吸取上清,在新的96孔板中,加入50 μL的细胞上清与稀释后的标准品,每组4个复孔,先分别加入Griess Reagent I(50 μL/孔),然后立即加入Griess Reagent II(50 μL/孔),在540 nm处检测吸光度值。
1.2.8 SEP-0a对巨噬细胞分泌TNF-α、IL-1β以及IL-6的影响 采用ELISA法[18]检测SEP-0a对RAW264.7细胞分泌TNF-α、IL-1β以及IL-6的影响。将RAW264.7细胞(5 000个/孔)接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养24 h,弃去上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,吸取上清,并将其转移至新的无菌离心管中,2 500 r/min离心20 min,取上清待测。使用ELISA试剂盒根据说明对TNF-α、IL-1β以及IL-6进行测定,在450 nm处检测吸光度值。
1.2.9 SEP-0a对巨噬细胞中TNF-α、IL-1β以及IL-6基因表达的影响 采用qPCR法[19]检测SEP-0a对RAW264.7细胞中TNF-α、IL-1β以及IL-6基因表达的影响。取浓度为1×106个/mL的RAW264.7细胞接种于6孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养24 h,弃去上清,设置6个实验组,分别为空白对照组(DMEM基础培养液)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、阳性对照组(LPS 1 μg/mL),继续培养24 h,吸取细胞悬液至新的无菌管中,离心收集细胞,每管加1 mL RNA提取液(Trizol),吹打细胞至完全裂解后静置5 min。按照5∶1的比例加入200 μL氯仿后混匀静置3 min,4℃ 12 000 r/min离心15 min,取上层无色水相并加入等体积的异丙醇,颠倒混匀沉淀15 min,离心弃上清。加入1 mL 75%乙醇洗涤,4℃ 12 000 r/min离心5 min,弃上清后离心管倒置晾干,加入20 μL无菌水使其充分溶解得到总RNA。按照反转录试剂盒说明书,将总RNA反转录成cDNA,进行qPCR检测,根据2-△△Ct相对定量法计算目的基因的相对表达量。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.10 SEP-0a对巨噬细胞NF-κB信号通路相关蛋白表达的影响 采用Western blot法[20]检测SEP-0a对巨噬细胞NF-κB通路蛋白表达的影响。将RAW264.7细胞(1×106个/孔)接种于6孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养23 h,弃去上清,按要求加入BAY11-7082和DMEM基础培养液后培养1 h,弃去上清,设置8个实验组,其中分别为空白对照组(DMEM基础培养液)、阳性对照组(LPS 1 μg/mL)、SEP-0a不同浓度给药组(50、100、500、1 500 μg/mL)、500 μg/mL SEP-0a(加入10 μmol/L BAY11-7082孵育过的一组)、抑制剂组(10 μmol/L BAY11-7082孵育过的另一组与DMEM基础培养液),继续培养24 h,弃上清,PBS重复洗涤两次,将细胞悬液转移至离心管中,离心5 min,4℃ 1 200 r/min,弃去PBS,向离心管内加入RIPA裂解液3-5 min。裂解时间为30 min,此操作在冰上进行,离心10 min,条件为4℃ 12 000 r/min,上清为总蛋白溶液。
BCA法定量蛋白,加入5×上样缓冲液,进行15 min沸水浴,-20℃保存备用。蛋白样品进行SDSPAGE电泳,电转移至PVDF膜。加入5%脱脂牛奶后将其室温封闭30 min,加入一抗(1∶1 000),4℃孵育摇床过夜。TBST中脱色摇床快速洗脱5 min,一共洗脱3次,加入二抗(1∶5 000),室温慢摇30 min,TBST中脱色摇床快速洗脱5 min,一共洗脱3次。采用ECL化学发光法检测目的条带的信号强度,曝光条件要根据不同的发光强度进行调整,保存成像。
1.2.11 SEP-0a对巨噬细胞在使用NF-κB特异阻断剂后的促进作用 取浓度为2.5×105个/mL的RAW264.7细胞接种于96孔板,在含有5%二氧化碳恒温(37℃)培养箱中培养12 h,弃去上清,设置4个实验组,其中两组加入用基础培养液稀释为10 μmol/L的BAY11-7082 100 μL,剩余两组分别加入100 mL DMEM基础培养,在含有5%二氧化碳恒温(37℃)培养箱中孵育培养1 h,取出后弃去上清,其中加入BAY11-7082组在弃去上清以后,一组加入SEP-0a 500 μg/mL,一组加入DMEM基础培养液,剩余两组也分别加入DMEM基础培养液与500 μg/mL SEP-0a,放回培养箱继续培养24 h后,吸取上清于无菌离心管中,在2 500 r/min下离心20 min。NO检测方法同1.2.7,细胞因子TNF-α、IL-1β、IL-6的检测方法同1.2.8,NO、TNF-α、IL-1β、IL-6基因检测方法同1.2.9,引物序列见表2。

表2 引物序列Table 2 Primer sequences
2 结果
2.1 元蘑多糖分离纯化
采用DEAE-52离子交换层析对元蘑多糖SEP进行分离纯化。如图1-A所示,经过蒸馏水、0.1 mol/L NaCl、0.3 mol/L NaCl洗脱后,得到3个多糖组分,收集含量最高的水洗多糖组分并命名为SEP-0。

图1 元蘑多糖洗脱曲线Fig. 1 Elution curve of S. edulis polysaccharide
进一步利用Sephacryl S-400葡聚糖凝胶过滤层析对元蘑多糖SEP-0进一步纯化得到多糖组分SEP-0a,洗脱曲线如图1-B所示,SEP-0a为单一对称峰。
2.2 理化性质测定
成分测定结果表明,元蘑多糖SEP-0a中总糖含量为81.67%,未检测到蛋白质含量。
采用HPGPC-ELSD法对元蘑多糖SEP-0a的分子量进行检测。如图2所示,SEP-0a分子量洗脱峰为单一对称峰,表明其为均一多糖组分。按照标准曲线(y=-0.162 6x+7.407 9,R2=0.995 9)计算得到SEP-0a的相对分子量为4.23×104Da。
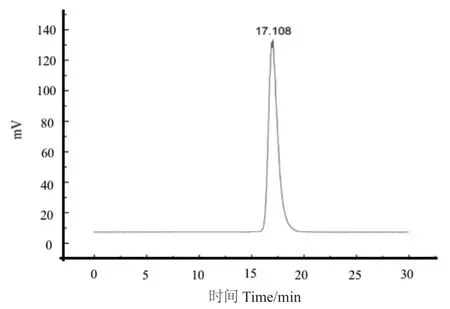
图2 SEP-0a高效凝胶渗透色谱洗脱曲线Fig. 2 Elution curve of SEP-0a high performance gel permeation chromatography
采用IEC-HPLC法对元蘑多糖SEP-0a的单糖组成进行检测。结果如图3所示,元蘑多糖SEP-0a主要由半乳糖(Gal)、甘露糖(Man)、葡萄糖(Glc)和岩藻糖(Fuc)组成,其摩尔百分比为48.27∶26.02∶16.26∶9.03。
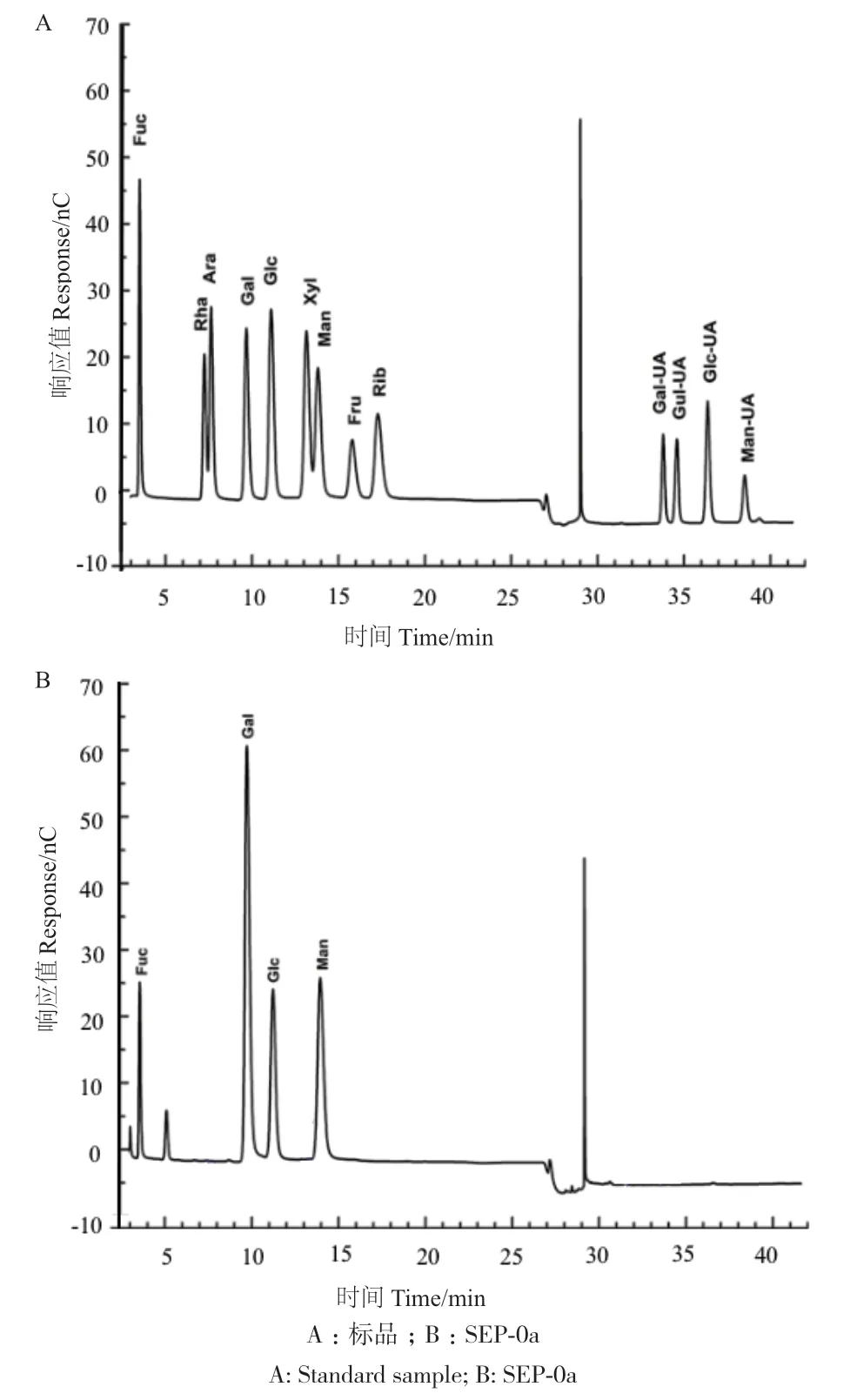
图3 SEP-0a离子色谱图Fig. 3 SEP-0a ion chromatogram
2.3 傅里叶变换红外光谱分析
进一步采用傅里叶变换红外光谱检测元蘑多糖SEP-0a的结构,结果如图4所示,3 388 cm-1处有信号峰的出现,这是因为O-H的伸缩振动;在2 929 cm-1周围的吸收峰是C-H的伸缩振动;吸收峰出现在1 353 cm-1、1 147 cm-1和1 074 cm-1,这意味着SEP-0a含有吡喃糖环;β-D-吡喃糖的特征吸收峰在872 cm-1处表示;因为802 cm-1和附近存在吸收峰,所以还证明了α构型的存在。
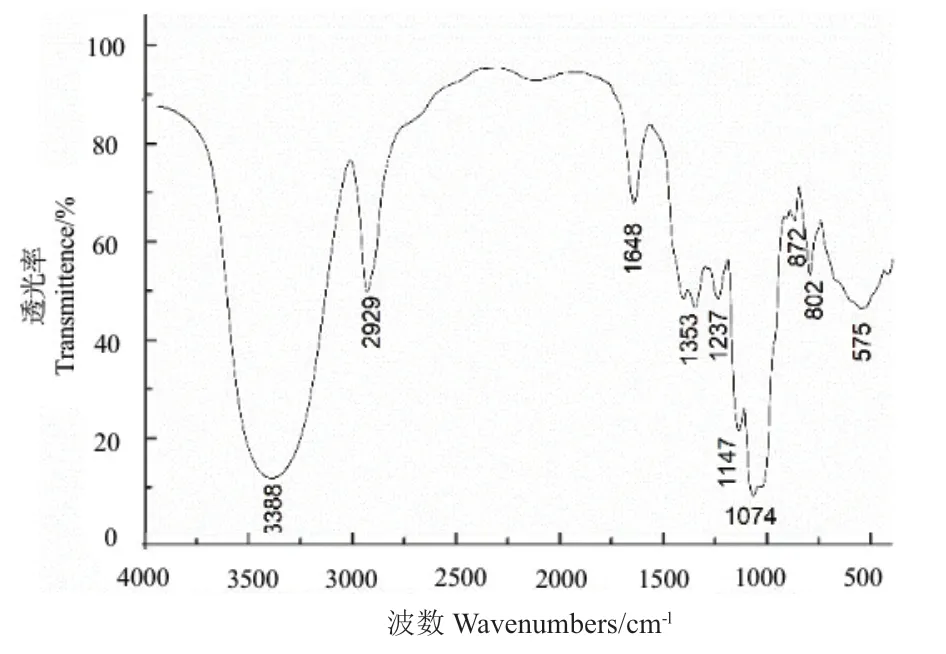
图4 SEP-0a红外光谱图Fig. 4 Infrared spectrum of SEP-0a
2.4 SEP-0a对巨噬细胞增殖的影响
采用CCK-8法检测SEP-0a对RAW264.7细胞增殖的影响,结果如图5所示,随着SEP-0a浓度不断增加,其细胞增殖率也逐渐提高,并且具有一定的浓度依赖性。当SEP-0a浓度在100-1 500 μg/mL的范围时,与空白组相比差异极显著(P<0.01),说明SEP-0a可以增强巨噬细胞的增殖能力。
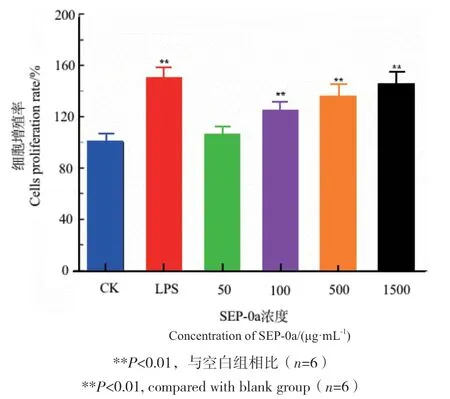
图5 不同浓度SEP-0a对RAW264.7细胞增殖的影响Fig. 5 Effects of SEP-0a at different concentrations on the proliferation of RAW264.7 cells
2.5 SEP-0a对巨噬细胞吞噬作用的影响
采用中性红法检测SEP-0a对RAW264.7细胞吞噬作用的影响,结果如图6所示,随着SEP-0a浓度的增加,其吸光度值也逐渐增强,并且具有一定的浓度依赖性。当SEP-0a浓度为500-1 500 μg/mL时,与空白组相比有极显著差异(P<0.01)。这表明SEP-0a可以增强巨噬细胞的吞噬能力。

图6 不同浓度SEP-0a对RAW264.7细胞吞噬作用的影响Fig. 6 Effects of SEP-0a at different concentrations on the phagocytosis of RAW264.7 cells
2.6 SEP-0a对巨噬细胞产生ROS的影响
采用2',7’-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针法检测SEP-0a对RAW264.7巨噬细胞产生ROS的影响,结果如图7所示,随着SEP-0a浓度的不断升高,荧光强度逐渐增强,且具有一定的浓度依赖性,当SEP-0a浓度范围在500-1 500 μg/mL时,与空白组相比有极显著差异(P<0.01),说明其可促进RAW264.7细胞产生ROS。
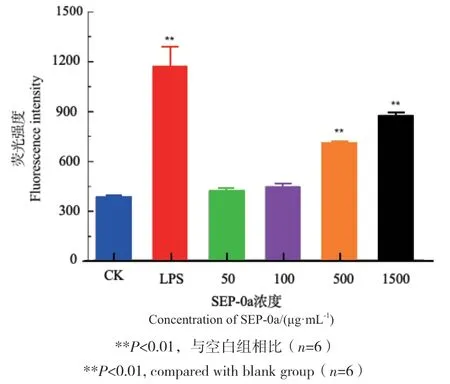
图7 不同浓度SEP-0a对RAW264.7细胞分泌ROS的影响Fig. 7 Effects of SEP-0a at different concentrations on the ROS secretion of RAW264.7 cells
2.7 SEP-0a对巨噬细胞分泌NO影响
采用一氧化氮法检测SEP-0a对RAW264.7细胞分泌NO影响。结果如图8所示,NO的含量随着SEP-0a浓度的增加而提高,并与空白组相比,差异极显著(P<0.01),具有一定的浓度依赖性,这表明SEP-0a能提高RAW264.7细胞分泌NO的能力。
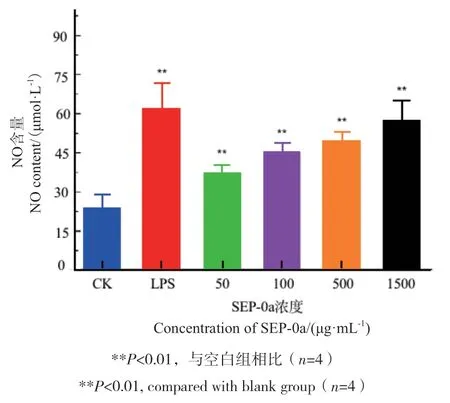
图8 不同浓度SEP-0a对RAW264.7细胞分泌NO的影响Fig. 8 Effects of SEP-0a at different concentrations on NO secretion by RAW264.7 cells
2.8 SEP-0a对巨噬细胞分泌TNF-α、IL-1β以及IL-6的影响
采用ELISA法检测SEP-0a对RAW264.7细胞分泌TNF-α、IL-1β以及IL-6的影响。结果如图9所示,随着SEP-0a浓度梯度不断增加,TNF-α、IL-1β和IL-6的含量也逐渐提高,有一定的浓度依赖性。当浓度为100-1 500 μg/mL时,与空白组相比TNF-α与IL-6含量显著增加(P<0.01);而当浓度为500-1 500 μg/mL时,与空白组相比IL-1β含量显著提高,具有极显著性差异(P<0.01),说明SEP-0a可促进RAW264.7细胞分泌TNF-α、IL-1β和IL-6。
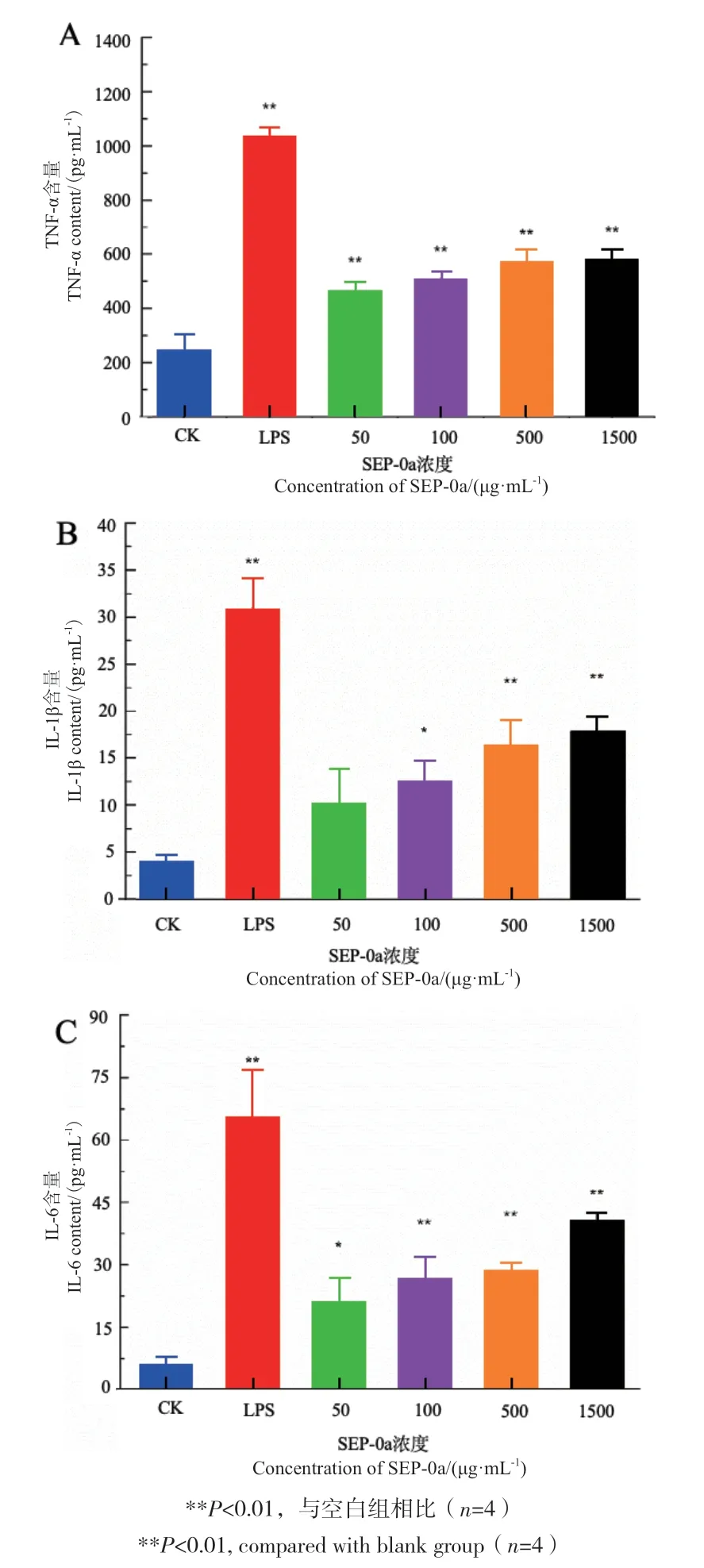
图9 不同浓度SEP-0a对RAW264.7细胞分泌TNF-α(A)、IL-1β(B)、IL-6(C)的影响Fig. 9 Effects of SEP-0a at different concentrations on TNF-α(A), IL-1β(B)and IL-6(C)secretion by RAW264.7 cells
2.9 SEP-0a对巨噬细胞中TNF-α、IL-1β以及IL-6基因表达的影响
采用qPCR法检测SEP-0a对RAW264.7细胞TNF-α、IL-1β以及IL-6基因表达的影响。结果如图10所示,随着SEP-0a浓度梯度不断增加,TNF-α、IL-1β和IL-6的基因表达量也显著增高,与空白组相比,差异极显著(P<0.01),有一定的浓度依赖性。说明SEP-0a可以促进巨噬细胞内TNF-α、IL-1β和IL-6基因的表达,与ELISA结果一致。
2.10 SEP-0a对巨噬细胞NF-κB信号通路相关蛋白表达的影响
NF-κB是一种重要的核转录因子,可以快速激活巨噬细胞,刺激转录系统,导致主要趋化因子、细胞因子和炎症介质的瞬时表达[21]。它是Rel家族中蛋白质异源或同源二聚化形成的重要转录因子之一,包括NF-εB1(也称为p50)、NF-ωB2(也称为p52)和RelA(也称为p65),其中p65是最为常见的形式,p65蛋白表达上调证明NF-κB通路被激活[22-23]。本研究进一步采用Western blot法考察了SEP-0a对巨噬RAW264.7细胞NF-κB通路蛋白表达的影响,实验结果如图11所示,随着SEP-0a浓度梯度增加,对RAW264.7细胞NF-κB信号通路p-p65蛋白表达上调越明显,具有一定的浓度依赖性,差异极显著(P<0.01)。但是在加入BAY11-7082抑制剂后,p-p65蛋白表达则会明显下调。该实验结果进一步证实SEP-0a能够通过NF-κB信号通路调控巨噬细胞免疫功能。
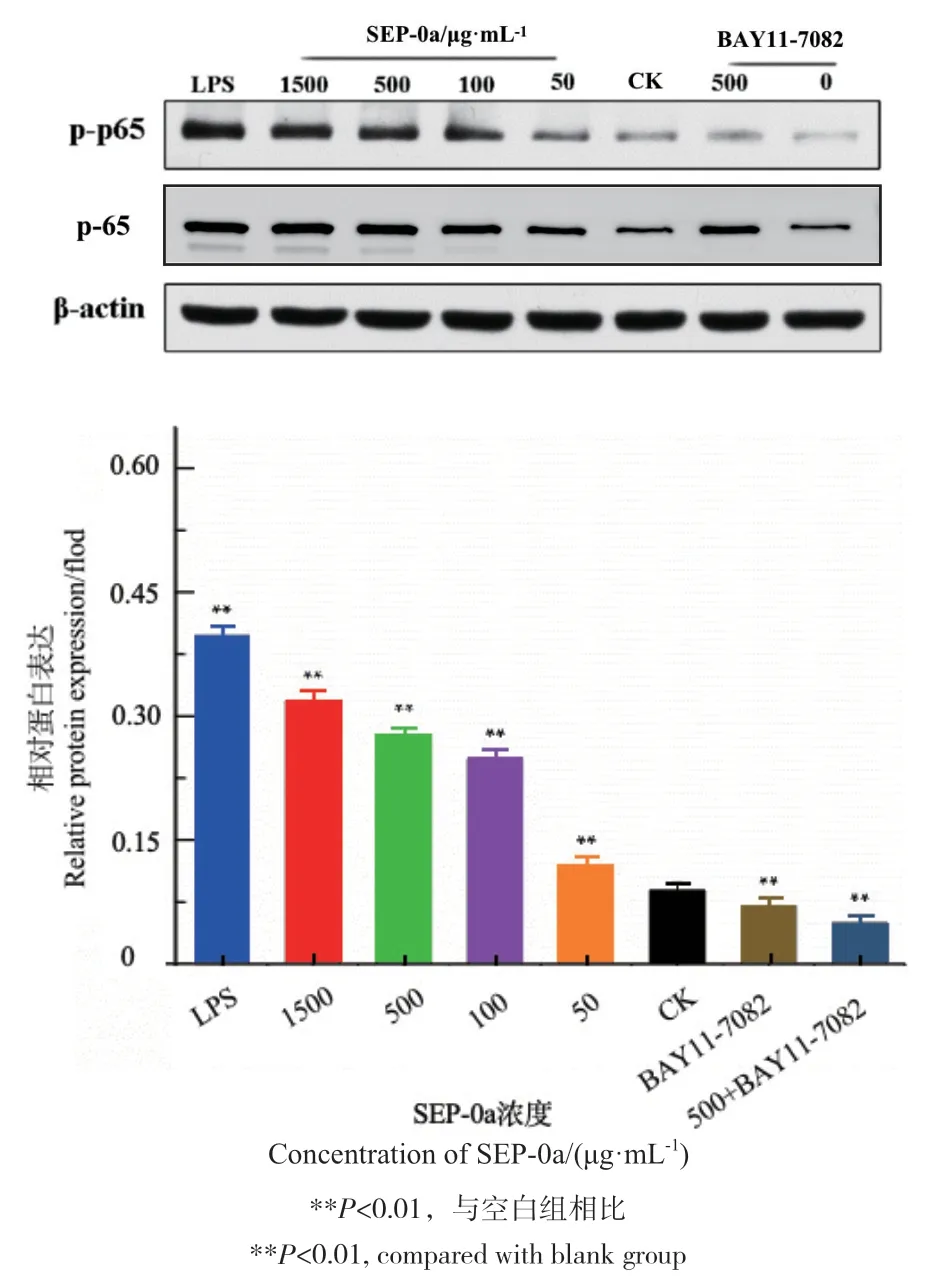
图11 SEP-0a对RAW264.7细胞蛋白磷酸化的影响Fig. 11 Effects of SEP-0a on protein phosphorylation in RAW264.7 cells
2.11 SEP-0a对巨噬细胞在使用NF-κB特异阻断剂后的促进作用
BAY11-7082是一种NF-κB的特异性阻断剂,采用通路阻断法初步研究SEP-0a对RAW264.7细胞的免疫调节作用。结果如图12,RAW264.7细胞经BAY11-7082抑制剂与SEP-0a共同作用下,与SEP-0a组比,其NO、TNF-α、IL-1β和IL-6的表达量显著下降(P<0.01),这说明BAY11-7082抑制剂阻断了SEP-0a刺激RAW264.7细胞NO、TNF-α、IL-1β和IL-6的表达。

图12 NF-κB抑制剂对SEP-0a诱导RAW264.7分泌NO(A)、TNF-α(B)、IL-1β(C)和IL-6(D)的影响Fig. 12 Effects of NF-κB inhibitors on the secretions of NO(A), TNF-α(B), IL-1β(C)and IL-6(D)induced by SEP-0a in RAW264.7 cells
基因表达变化数据如图13,RAW264.7细胞经BAY11-7082抑制剂与SEP-0a共同作用下,与SEP-0a组比,其NO、TNF-α、IL-1β和IL-6的基因表达明显减弱(P<0.01),与ELISA结果一致。进一步说明SEP-0a可以激活NF-κB信号通路从而发挥免疫调节作用。

图13 NF-κB抑制剂对SEP-0a诱导RAW264.7中NO(A)、TNF-α(B)、IL-1β(C)和IL-6(D)基因表达的影响Fig. 13 Effects of NF-κB inhibitors on SEP-0a on the gene expressions of NO(A), TNF-α(B), IL-1β(C)and IL-6(D)by RAW264.7 cells
3 讨论
多糖的相对分子质量、单糖组成等与它的生物活性紧密相关[24]。Li等[25]对元蘑多糖NTHSP进行分离纯化,检测其结构组成发现NTHSP是分子量为1.19×103-1.55×104Da,并且由阿拉伯糖、甘露糖、葡萄糖、半乳糖组成的一种具有高分支结构的葡聚糖。Li等[26]研究元蘑多糖结构,结果得到元蘑多糖HW-HSP分子量分布为3.87×104-4.62×106Da,并且由葡萄糖、半乳糖、甘露糖、阿拉伯糖和核糖5种单糖组成,含有O-H、C-H以及吡喃糖环等。本研究获得的元蘑多糖SEP-0a主要由半乳糖、甘露糖、葡萄糖和岩藻糖组成,相对分子量为4.23×104Da,并且具有α构型与β构型,与其他元蘑多糖相比,其单糖组成及分子量分布均不相同,因此,推测本研究发现的SEP-0a可能是一种新的元蘑多糖。
巨噬细胞对于机体免疫系统来说十分重要,可以分泌ROS、NO、TNF-α、IL-1β和IL-6等,具有调节免疫、抑制癌细胞增殖等作用[27]。ROS可以氧化细胞脂质,使蛋白质失活,并杀伤病原微生物及自身异常细胞[28]。NO是重要的活性介质,对病毒及癌细胞等的免疫应答有着抑制和杀伤作用,从而使免疫能力得到提高[29]。TNF-α可以激活中性粒细胞和淋巴细胞,并促进其他细胞因子的合成和释放[30];IL-1β常大量产生在炎症初期阶段,其可以对局部进行激活,同时也是继发性炎症介质产生的诱因之一[31];IL-6作为十分重要的促炎细胞因子,可以诱导B细胞的分化以及T细胞增殖分化,影响抗体的产生,参与机体免疫应答[32]。研究发现,真菌多糖具有较好的免疫活性。苗月等[33]发现蛹虫草多糖可以增强巨噬细胞的吞噬活性,促进NO和IL-1β的分泌,调节小鼠巨噬细胞RAW264.7免疫活性。Ren等[34]发现可以刺激RAW264.7产生NO、IL-6和TNF-α并且增强它们的活性从而调节其对RAW264.7巨噬细胞的潜在免疫活性。郝正祺等[35]发现绣球菌子实体多糖能够提高巨噬细胞内TNF-α、IL-1β、IL-6、IL-3、IL-10、IFN-β免疫因子mRNA的表达量。本研究考察了元蘑多糖组分SEP-0a对巨噬细胞RAW264.7的体外免疫调节活性,并发现经过元蘑多糖SEP-0a给药后,RAW264.7细胞的增殖与吞噬能力显著提高,并且可以增强ROS和NO的分泌,提高TNF-α、IL-1β和IL-6的表达,均具有剂量依赖性。说明本研究报道的元蘑多糖SEP-0a对巨噬细胞RAW264.7具有较强免疫调节活性。
NF-κB可以通过快速调节细胞内基因的表达来调节某些生理和病理过程,作为核转录因子,它很容易被激活,从而诱导信号级联反应的发生,进行核转位,启动下游基因的转录,促进蛋白的表达及炎症相关因子的合成与分泌[36-37]。其中p65是NF-κB信号通路中最常见的形式,它在NF-κB通路中的表达通常与局部或全身的细胞炎症反应呈正相关,因此p65蛋白表达上调可以证明NF-κB信号通路被激活[38]。Liao等[39]发现竹荪多糖可以通过MAPK/NF-κB信号通路来调节NO和TNF-α等活性因子的分泌,从而发挥免疫调节作用。Wang等[40]发现NF-κB通路参与了黑虎掌菌诱导的RAW264.7细胞活化,经过NF-κB信号通路的抑制剂BAY11-7082处理后,其诱导RAW264.7细胞所分泌NO和TNF-α的能力被有效抑制。本研究发现,SEP-0a可以使NF-κB信号通路中p65蛋白磷酸化的表达被明显上调,但是在加入NF-κB特异阻断剂BAY11-7082后,NF-κB信号通路中p65蛋白的高表达则被抑制。同时,使用BAY11-7082与SEP-0a共同处理后,与SEP-0a组比其NO、TNF-α、IL-1β以及IL-6的表达量均明显降低。这些结果进一步证实,元蘑多糖SEP-0a能够通过NF-κB信号通路发挥巨噬细胞的免疫调节功能。
4 结论
本研究通过分离纯化从元蘑中获得一种新的均一多糖组分SEP-0a,该多糖主要由半乳糖、甘露糖、葡萄糖和岩藻糖组成,相对分子量为4.23×104Da,并且具有α构型与β构型。体外细胞实验证明SEP-0a可以通过NF-κB信号通路,提高巨噬细胞的增殖和吞噬能力,并增强ROS与NO的分泌,以及TNF-α、IL-1β和IL-6的表达,进而发挥免疫调节作用。