小麦镉胁迫响应基因TaMYB1的功能分析
2024-02-05张怡张心如张金珂胡利宗上官欣欣郑晓红胡娟娟张聪聪穆桂清李成伟
张怡 张心如 张金珂 胡利宗 上官欣欣 郑晓红胡娟娟 张聪聪 穆桂清 李成伟
(1. 周口师范学院植物遗传与分子育种重点实验室,周口 466001;2. 河南省作物育种与生物反应器重点实验室,周口 466001;3. 河南工业大学粮油食品学院,郑州 450000)
重金属是影响农用地土壤环境质量的主要污染物。2014年公布的《全国土壤污染状况调查公报》显示,全国耕地土壤点位超标率为19.4%,重金属污染物镉(cadmium, Cd)、汞、砷、铜、铅、铬、锌、镍等占全部超标点位的82.8%,其中,Cd的超标率高达7%[1]。尚二萍等[2]研究表明,2018年我国粮食主产区的农田重金属点位超标率为21.5%,4年时间已增长2个百分点,Cd污染比重仍然最高为17.4%,说明我国农田污染程度及污染面积均在增加,尤其是Cd,严重威胁农业生产。2023年中央一号文件特别指出要“加强农用地土壤镉等重金属污染源头防治”。Cd在植物中过量积累会严重影响植物的正常生长,导致氧化损伤、光合和呼吸作用被抑制、矿质营养元素吸收减弱,使植株叶片枯黄、根尖褐化、生长迟缓,严重时甚至导致植株死亡[3]。另外,由于Cd具有可溶性且半衰期较长,会通过食物链危害人类健康,已成为全球首要的重金属污染物[4]。
小麦是我国仅次于水稻的第二大口粮作物,其品质和产量关系着我国粮食生产的安全与稳定,近年来,我国部分小麦主产区的Cd污染日趋严重,部分区域Cd污染已达到严重污染,小麦籽粒Cd超标率达34.3%-76.7%[5-8],如何减少土壤和粮食作物的Cd污染,保障粮食安全是我国亟待解决的重要问题。目前,治理Cd土壤污染的措施主要有物理法、化学法、植物修复、低Cd积累品种选育,但物理法和化学法效果不佳且二次污染潜在风险较高[9-10]。植物修复主要利用Cd超积累植物将土壤中Cd富集到植物体内并转移到地上部,通过收集植物从而达到净化土壤的效果,较物理法和化学法对环境和人类更友好。然而,大部分超积累植物由于生物量小、生长缓慢导致实际修复效果不佳,并限制下游应用[11]。因此,基于我国Cd污染现状,挖掘植物Cd耐受基因,利用植物育种的方法培育低Cd积累品种或耐Cd品种,是实现小麦粮食安全的重要且可持续的手段,具有重要的现实意义和应用价值。
植物的Cd积累和耐受机制是由一系列基因构成的高度复杂的信号调控网络,近年来,在水稻和拟南芥等植物中的研究表明,由lncRNAs、microRNAs和转录因子组成的多层转录网络响应Cd胁迫,如lncRNA2705.1和lncRNA11415.1通过调控它们的靶基因L-乳酸脱氢酶A(LDHA)和热休克蛋白18.1(HSP18.1)增强白桦对Cd胁迫的耐受[12],水稻lncRNA-XLOC_086307通过调控丝氨酸代谢途径相关基因响应Cd胁迫[13];油菜、水稻和大麦的microRNAs如miR167、miR166、miR156等在调控植物Cd运输和耐受中起重要作用[14-16];小麦和拟南芥转录因子TaWRKY74和AtWRKY12通过影响谷胱甘肽合成途径相关基因的表达参与植物对Cd的耐受[17-18]。MYB家族是参与调控各种生物学过程的重要转录因子[19-21],根据MYB转录因子的数量、位置及高度保守结构域,MYB家族分为4类:1R-MYB/MYB-related、R2R3-MYB、R1R2R3-M YB和4R-MYB[22]。水稻和苎麻等植物的研究表明,MYB转录因子响应重金属Cd的胁迫,在调控植物Cd耐受调控网络中起重要作用[23-27]。然而,小麦的MYB转录因子在重金属Cd胁迫中的生物学功能研究较少。
本研究以酵母和小麦为研究材料,通过在酵母培养基中加入不同浓度的Cd筛选Cd胁迫小麦根系酵母双杂交文库,获得小麦Cd胁迫应答相关基因TaMYB1,利用病毒诱导的基因沉默技术对TaMYB1进行功能验证和表型分析,并对其进行生物信息学分析,为TaMYB1响应Cd胁迫的功能研究和低积累Cd小麦新品种的培育奠定基础。
1 材料与方法
1.1 材料
植物材料为周麦26,由河南省作物分子育种与生物反应器重点实验室提供。
1.2 方法
1.2.1 Cd胁迫野生型小麦 小麦种子表面消毒后,放置于光照16 h(25℃)/黑暗8 h(15℃)、湿度60%的人工气候箱中,水培至一叶一心期后,挑选长势一致的小麦幼苗,部分幼苗作为对照在Hoagland全营养液中培养,部分幼苗在Hoagland全营养液中加入0.2 mmol/L的CdCl2进行处理,一部分植株在处理0、3、6、12和24 h后分别对地上部分和根系取样,液氮速冻后-80℃保存备用;另一部分植株在CdCl2处理10 d后,观察小麦生长状态,取其根系洗干净后在液氮中速冻,置于-80℃保存,并测量不同处理植株的地上部和根系长度,同时将植株于105℃烘箱中烘干测其干重。
1.2.2 小麦根系总RNA提取和cDNA反转录 利用TRIzol试剂(Invitrogen公司)提取高质量小麦RNA,部分RNA参照cDNA反转录试剂盒(TaKaRa,RR047A)说明书合成cDNA,用于基因克隆和实时荧光定量PCR反应。
1.2.3 Cd胁迫小麦根系酵母双杂交文库的构建及筛选 取1.2.2中提取的Cd胁迫后高质量小麦RNA,使用Clontech公司试剂盒Make Your Own “Mate &P1ate” Library System Kit(Cat. No. 630490)构建Cd胁迫的小麦根系酵母双杂交文库,并对文库质量进行检测。同时,将空载体pGADT7转化入野生型酵母菌株Y187中,作为后续文库筛选的对照。
1.2.4 小麦Cd胁迫应答相关基因的筛选及生长曲线测定 首先在酵母培养基SD-Leu中加入不同浓度的Cd对转化有pGADT7空载体的酵母Y187进行临界浓度筛选[28],筛选到抑制pGADT7空载体酵母生长的临界浓度后,将Cd诱导小麦根系酵母双杂交文库涂布在临界Cd浓度的培养基上,30℃培养3-5 d,利用玻璃珠液氮法提取酵母质粒[29],并对质粒进行测序和序列比对分析。此外,挑取对照酵母菌落和耐Cd胁迫的酵母菌落于添加0.004 mol/L CdCl2的SD-Leu液体培养基中,30℃,220 r/min摇菌,每隔12 h取菌液,取样到60 h,测OD600,并记录数据。
1.2.5 Cd胁迫应答基因功能验证 将1.2.3获得的酵母质粒在NCBI中进行BLAST比对获得目的基因,下载TaMYB1(Accession No. XM_020305596.1)的CDS序列,设计病毒诱导基因沉默(virus-induced gene silencing, VIGS)引物并进行PCR扩增。PCR反应体系:上下游引物(TaMYB1-F/R)各1 μL(表1)、2×高保真mix酶(Novo protein, E035)25 μL、小麦cDNA 1 μL,加水至50 μL;PCR反应程序:94℃ 90 s;94℃ 20 s,58℃ 20 s,72℃ 30 s,30次循环;72℃ 5 min。将PCR产物纯化后,利用同源重组技术(Novo protein, NR005)构建至烟草脆裂病毒(tobacco rattle virus, TRV)载体pYL156,送至生物公司测序,将阳性重组载体TRV: TaMYB1和pYL156空载体分别转化至农杆菌GV3101,VIGS侵染方法如下:小麦种子表面消毒后在培养箱中萌发出2-3 mm新芽,将转化后对照质粒、重组质粒,以及辅助侵染质粒pYL192的农杆菌菌液培养至一定浓度,分别取pYL192辅助质粒与重组质粒、对照质粒菌液等量混合(加入19.62 mg/L乙酰丁香酮、400 mg/L半胱氨酸和5 mL/L吐温20),将消毒过的小麦种子放置其中,抽真空处理30 s,重复2-3次。之后将种子置于混悬液中28℃共培养3 h,再用无菌水冲洗种子表面的农杆菌,移至灭菌营养土中培养[30]。
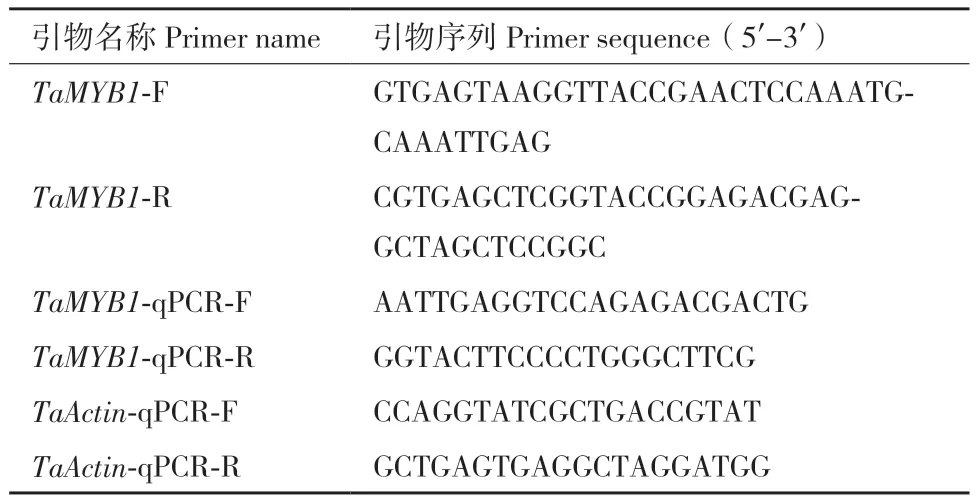
表1 引物序列Table 1 Primer sequences
1.2.6 小麦Cd含量及生理指标检测 在转有TRV:TaMYB1重组质粒和对照质粒的农杆菌侵染16 d后的小麦植株和对照植株根系浇灌0.2 mmol/L的CdCl2溶液,10 d后分别取对照植株和TaMYB1瞬时沉默植株的根系和叶片,清水洗干净后,105℃杀青30min,80℃烘干至恒重,分别取0.2 g根系和叶片送至农业农村部农产品质量监督检验测试中心(昆明),采用电感耦合等离子体质谱仪进行Cd含量检测。
选取上述正常生长和Cd处理的对照植株和TaMYB1沉默植株不同株系的叶片,叶绿素含量测定采用丙酮-乙醇提取法[31],MDA含量、SOD活性、POD活性均用南京建成生物工程研究所生产的试剂盒测定,测定方法按照试剂盒说明。
1.2.7 RT-qPCR 以CdCl2处理0、12、24、36和48 h的地上部分和根系RNA为模板,利用RT-qPCR反应分析TaMYB1是否响应Cd胁迫;同时以1.2.6剩余的TaMYB1瞬时沉默植株和对照植株的小麦根系和叶片为模板,进行RT-qPCR反应,分析TaMYB1的相对表达量。反应体系:2×SYBR Premix Ex Taq(TaKaRa, RR420A)10 μL、PCR上下游引物(TaMYB1-qPCR-F/R)各0.4 μL(表1)、小麦cDNA 2.0 μL和去离子水7.2 μL。反应程序:95℃ 10 s;95℃5 s,60℃ 30 s,40次循环,以TaActin(Accession No. KC775780)作为内参基因,每个处理进行3次重复,使用相对定量法2-ΔΔCt进行RNA转录本变化分析。
1.2.8 生物信息学分析 为阐明TaMYB1及其同源基因的序列与进化特征,利用Pfam在线工具对小麦TaMYB1及其同源基因的结构域组成进行鉴定[32],期望值E小于0.01,其他参数默认。同时,利用ClustalW软件对小麦TaMYB1及其同源蛋白进行比对[33],并将比对结果导入MEGA X软件中[34],采用最大似然法构建系统进化树,进化树注释由iTOL软件执行[35]。此外,利用GSDS[36]、MEME[37]和Weblogo[38]工具详细剖析TaMYB1及其同源基因的结构特征、保守基序组成与结构域隐马尔科夫模型。最后,以Pingault等[39]的转录组数据为对象,从ArrayExpress下载原始数据,利用TopHat和Cufflinks对这些数据进行分析[40],最终获取小麦TaMYB1及其同源基因的TPM值,利用这些TPM值矩阵,绘制出基因表达热图,此过程由HemI工具完成[41]。
1.2.9 数据分析 采用独立样本的t检验及LSD、Duncan检验(P≤0.01和P≤0.05)的单因素方差分析(ANOVA)对植株根系、地上部、基因的表达量、镉含量以及各种生理指进行分析,所有分析均参考SPSS Statistics 19.0软件的操作说明。
2 结果
2.1 Cd胁迫抑制小麦根长和生物量
周麦26小麦幼苗在含有0.2 mmol/L的CdCl2的Hoagland全营养液中培养10 d后,结果发现,与对照植株相比,Cd胁迫小麦植株的根长表现出明显差异(图1-A, B),地上部分长度有所降低(图1-D),但未达到显著性差异,Cd胁迫植株的根长与对照植株相比显著缩短,表明Cd胁迫明显抑制小麦根长的生长,同时对其生物量进行分析发现,Cd胁迫减少了小麦植株的生物量。结果表明,Cd胁迫主要抑制小麦根系的发育。
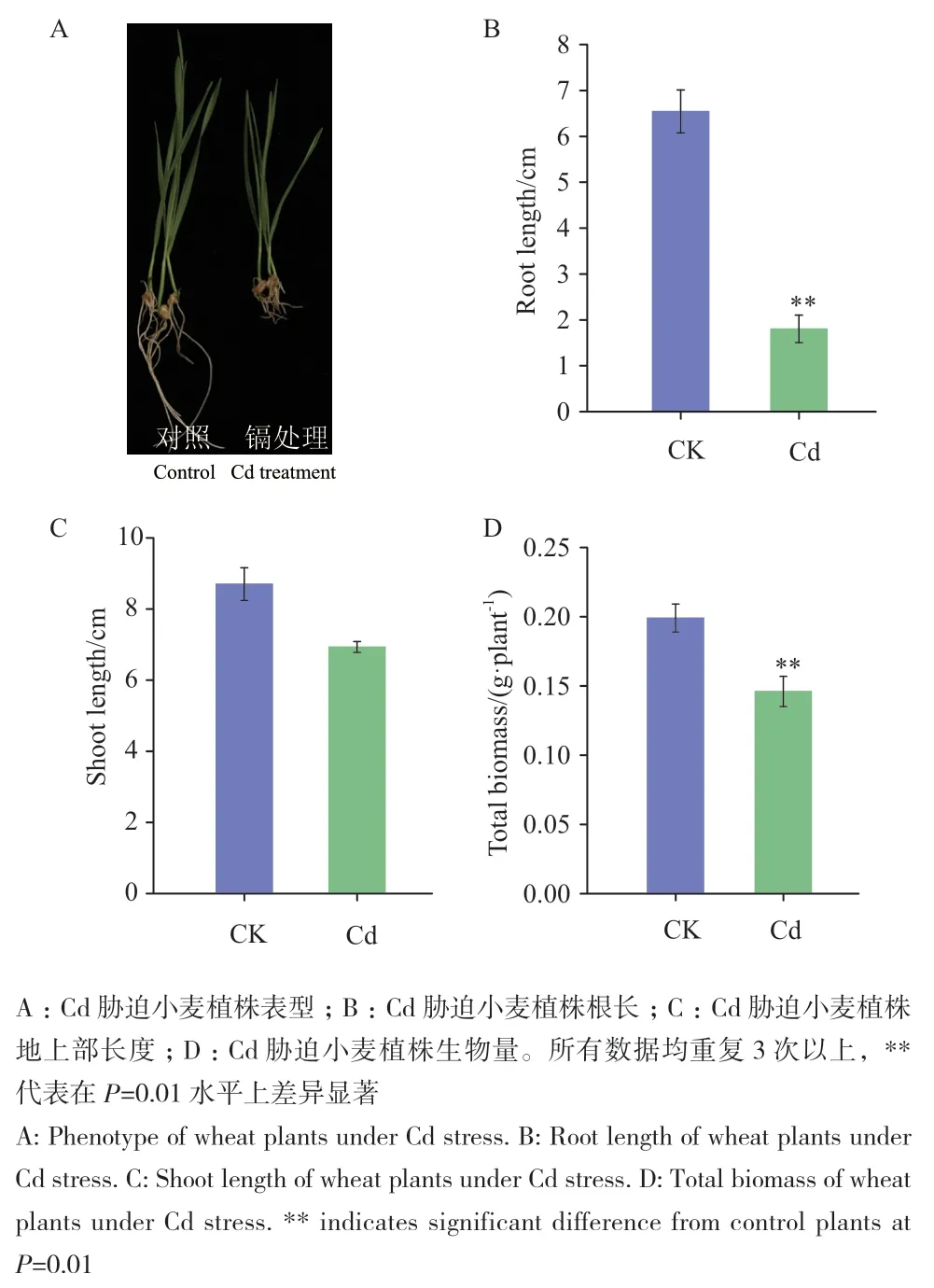
图1 Cd胁迫小麦表型检测Fig. 1 Phenotype analysis of wheat plant under Cd stress
2.2 Cd胁迫小麦根系酵母双杂交cDNA文库的构建及质量检测
采用TRIzol试剂提取高质量的Cd胁迫小麦根系RNA(图2-A),采用SMART技术反转录获得高纯度的cDNA(图2-B),并利用柱层析法纯化cDNA(图2-C),构建Cd胁迫小麦根系酵母cDNA文库。通过计数酵母文库克隆发现,小麦cDNA文库滴度为4.6×107CFU /mL。随机挑取32个酵母克隆进行PCR检测,均可扩增出条带,且插入片段长度分布在300-3 000 bp,重组率约为99%(图2-D, E),表明构建的cDNA文库质量较好。
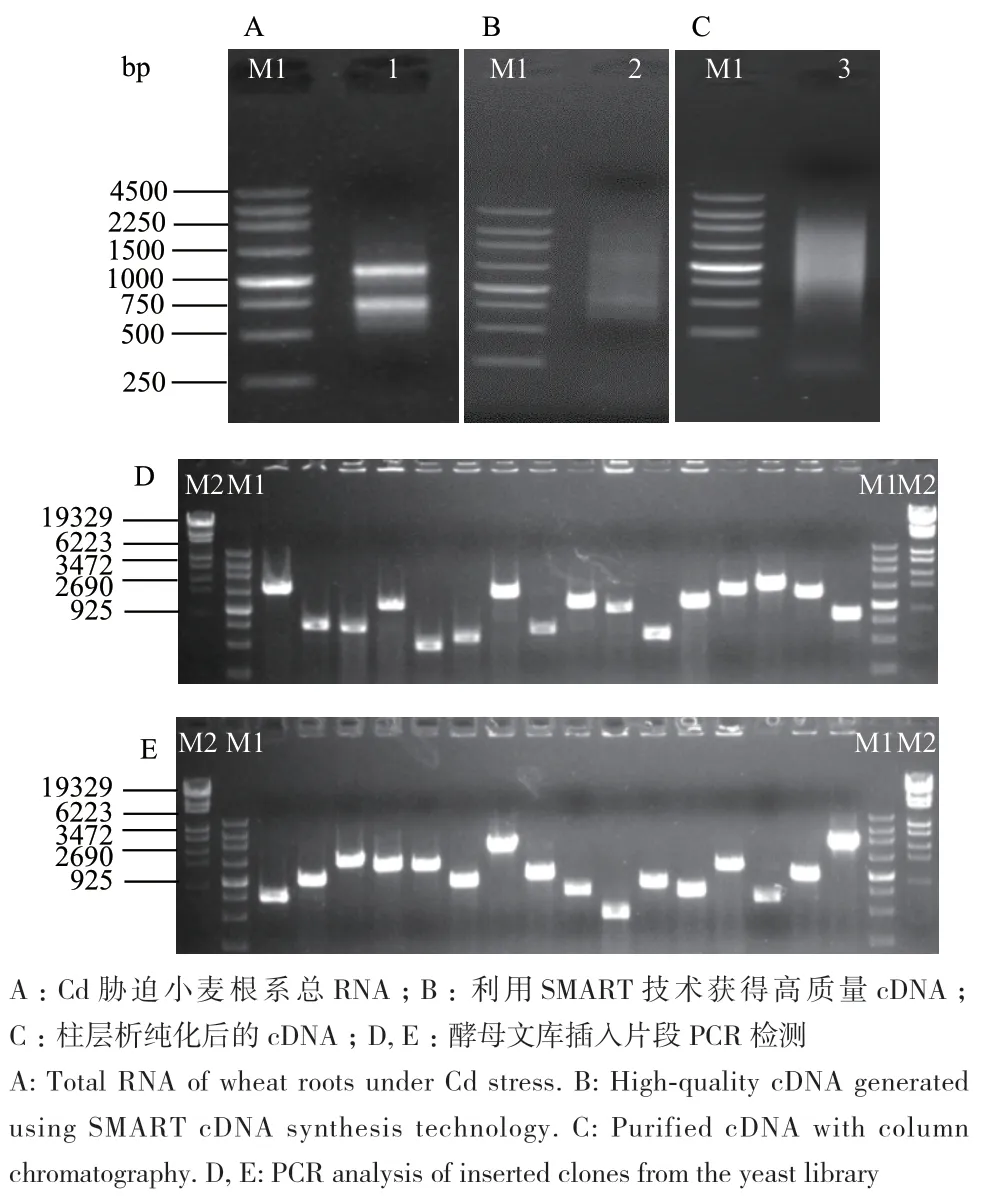
图2 Cd胁迫小麦根系的酵母双杂交文库质量检测Fig. 2 Quality detection of yeast two-hybrid library of wheat roots under Cd stress
2.3 耐Cd胁迫酵母菌落筛选和生长曲线测定
通过对转化有pGADT7空载体的酵母Y187进行Cd临界浓度筛选的结果发现,转化pGADT7空载体的酵母在含0.002 mol/L CdCl2培养基上不能生长,因此,采用0.002 mol/L CdCl2作为临界浓度对酵母文库进行筛选,在含0.002、0.003和0.004 mol/L CdCl2培养基上共筛选18个阳性耐Cd转化子(图3),提取酵母质粒、测序并比对,共获得4个候选基因,其中5个转化子(编号1、2、4、11和14)均编码转录因子基因TaMYB1,因此,选取TaMYB1作为目标基因并对其进行功能验证。进一步检测转化pGADT7和pGADT7-TaMYB1的酵母分别在正常培养基和高Cd培养基(0.004 mol/L)中的生长曲线,结果发现,在正常培养基中,2种酵母生长速率相当(图4-A)。而在高Cd培养基中,转化pGADT7的对照菌株其生长速率明显受到抑制,而转化pGADT7-TaMYB1的酵母菌株则生长良好,表明TaMYB1的表达提高了酵母的耐Cd能力(图4-B)。
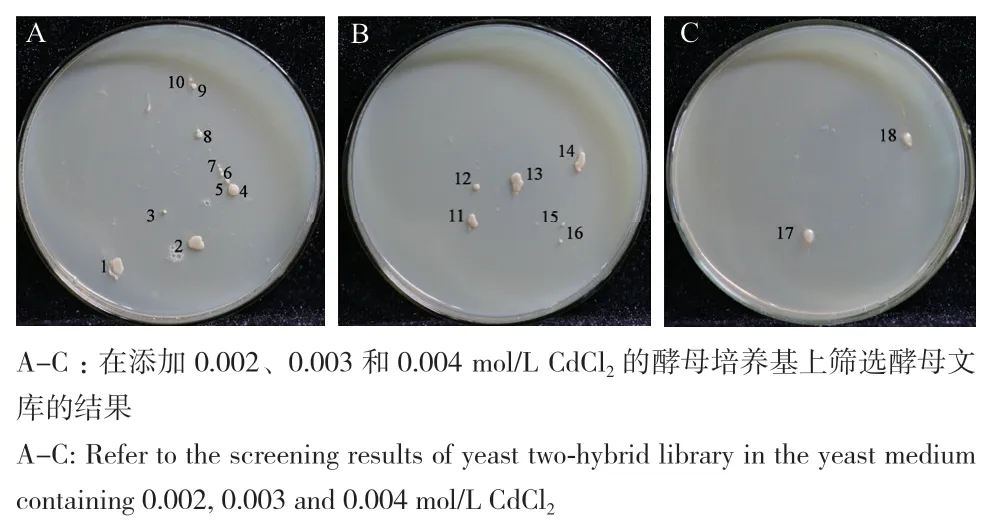
图3 转化子在添加不同Cd浓度的培养基上生长情况Fig. 3 Transformants with the medium containing different cadmium concentration
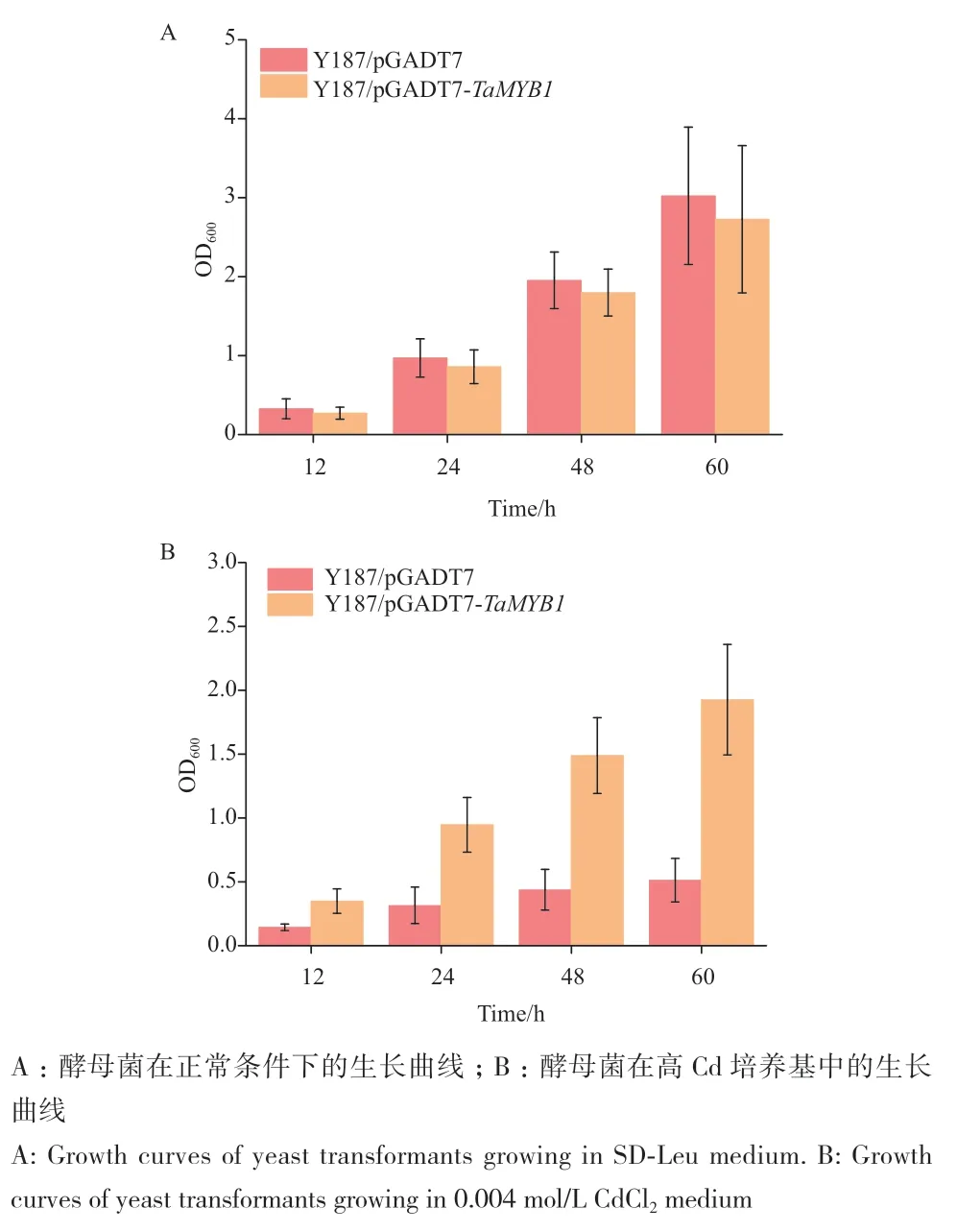
图4 酵母菌落在添加CdCl2的SD-Leu培养基中的生长曲线Fig. 4 Growth curves of yeast colonies in the SD-Leu medium added with CdCl2
2.4 TaMYB1响应Cd胁迫的表达模式
在Cd胁迫的不同时间点,利用RT-qPCR分析TaMYB1在小麦幼苗不同组织中的表达情况,并使用Origin 9软件分析数据。结果表明,在Cd胁迫浓度为0.2 mmol/L时,TaMYB1在小麦根系中的相对表达量呈先升高后下降的趋势,与对照相比,Cd胁迫处理3、6、12和24 h后,TaMYB1在小麦根系中的转录水平分别上升1.26、1.69、2.97和2.49倍(图5-A)。而TaMYB1在地上部分中相对表达量呈整体上升的趋势,Cd胁迫处理3和6 h,TaMYB1相对表达量分别上调了1.61和1.47倍,之后逐渐上升,在处理24 h达到最高峰,约为对照的2.86倍(图5-B)。结果表明,TaMYB1在小麦幼苗中响应Cd胁迫。
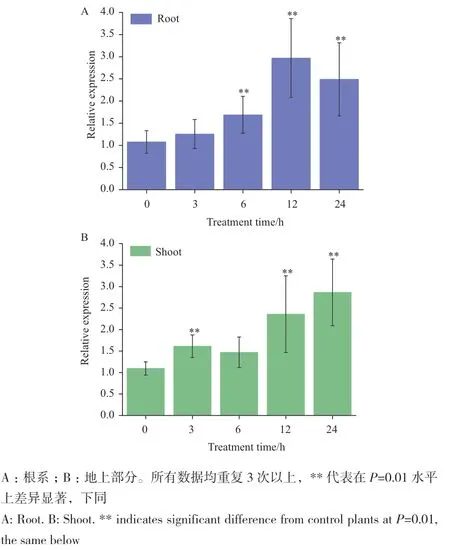
图5 TaMYB1响应Cd胁迫表达量分析Fig. 5 Expression analysis of TaMYB1 under Cd stress
2.5 Cd胁迫应答基因TaMYB1功能验证
采用同源重组的方法将TaMYB1 CDS区域的529-728 bp构建至TRV病毒载体pYL156,TRV病毒接种小麦16 d后分别进行Cd胁迫处理10 d,结果发现,正常生长条件下,TaMYB1沉默植株(TRV:TaMYB1)和对照植株(TRV:00)均正常生长,然而,0.2 mmol/L的CdCl2胁迫处理的TRV:00植株生长受到严重抑制,植株矮小,根系总根长明显缩短,叶片枯萎发黄,TRV:TaMYB1植株受到Cd胁迫后生长良好,与正常条件下的TaMYB1沉默植株和对照植株生长态势相当(图6-A)。RT-qPCR结果表明,与对照相比,TRV:TaMYB1植株的根系和叶片中TaMYB1的表达量显著下降,表明沉默效果良好(图6-B)。采用电感耦合等离子体质谱仪对TRV:00和TRV:TaMYB1植株根系和叶片中的Cd含量进行检测,结果表明,TRV:00植株的根系和叶片Cd含量均显著高于TRV:TaMYB1植株,且根系Cd含量远高于叶片Cd含量(图6-C)。此外,分别对TRV:00和TRV:TaMYB1植株叶片中的叶绿素含量、抗氧化酶类SOD、POD活性和MDA含量等生理指标进行检测,结果发现,受到Cd胁迫后,TRV:00植株叶片的叶绿素含量、SOD和POD活性均明显低于TRV:TaMYB1植株(图7-A, C, D),而TRV:00植株叶片的MDA含量则显著高于TRV:TaMYB1植株(图7-B)。表明沉默TaMYB1可能通过提高叶绿素含量、SOD和POD活性抵抗Cd对植物的毒害,从而降低小麦植株地上部和根系的Cd含量。
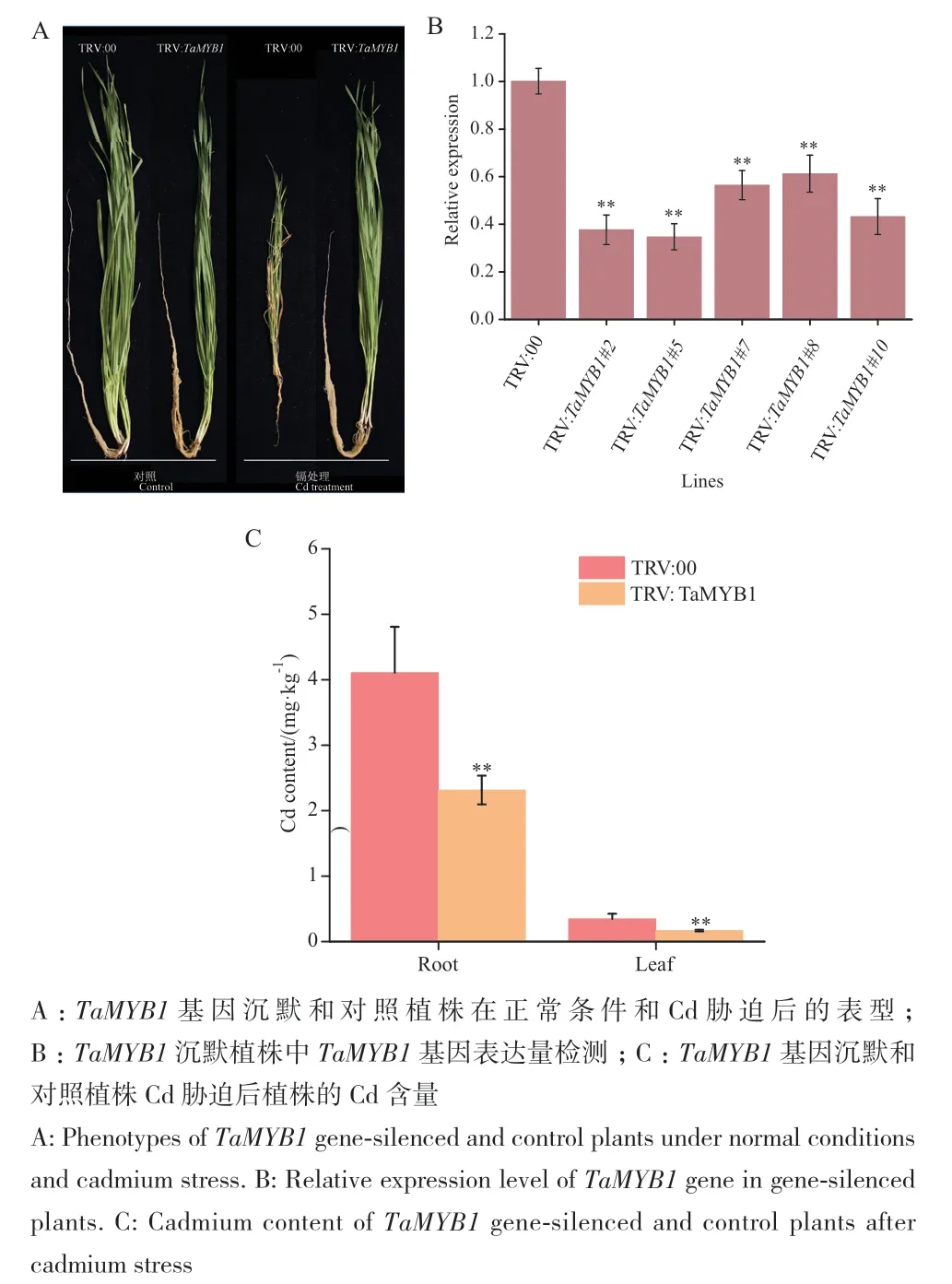
图6 沉默TaMYB1基因增强小麦对Cd耐受Fig. 6 Silencing of TaMYB1 enhanced wheat tolerance to cadmium
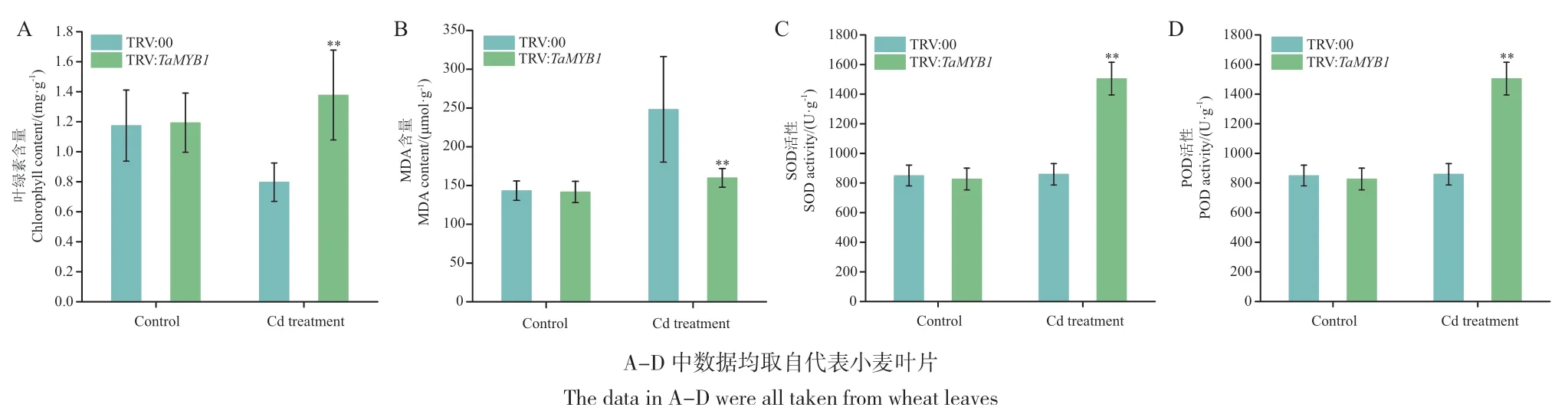
图7 TaMYB1沉默和对照植株在正常条件和Cd胁迫后的生理指标检测Fig. 7 Physiological index detection of TaMYB1 gene-silenced and control plants under normal conditions and cadmium stress
2.6 TaMYB1及其同源基因的鉴定与系统进化关系
以TaMYB1(图8实心五角星)及其在拟南芥和水稻中的同源基因作为检索序列,在小麦基因组中共鉴定出43个TaMYB基因(命名为TaMYB1L1-TaMYB1L43,图8空心五角星),比对分析发现该TaMYB1定位于小麦D亚基因组的第2染色体上,其在A和B亚基因组中的同源基因命名为TaMYB1L2和TaMYB1L5,对15个拟南芥、17个番茄、18个水稻、22个玉米、20个二穗短柄草以及44个TaMYB蛋白进行系统进化分析,结果表明,小麦TaMYB1及其他植物同源基因被分为6大类群(图8),TaMYB1与同源基因TaMYB1L2、TaMYB1L5聚在同一支上;除了1个类群中缺失小麦TaMYB1L基因外,剩余类群中均包括多个TaMYB1L基因;此外,除了少数成员外,绝大部分TaMYB1及TaMYB1L蛋白均含有保守的MYB和CC结构域组成模式,这说明少数成员在进化过程中丢失了MYB结构域。
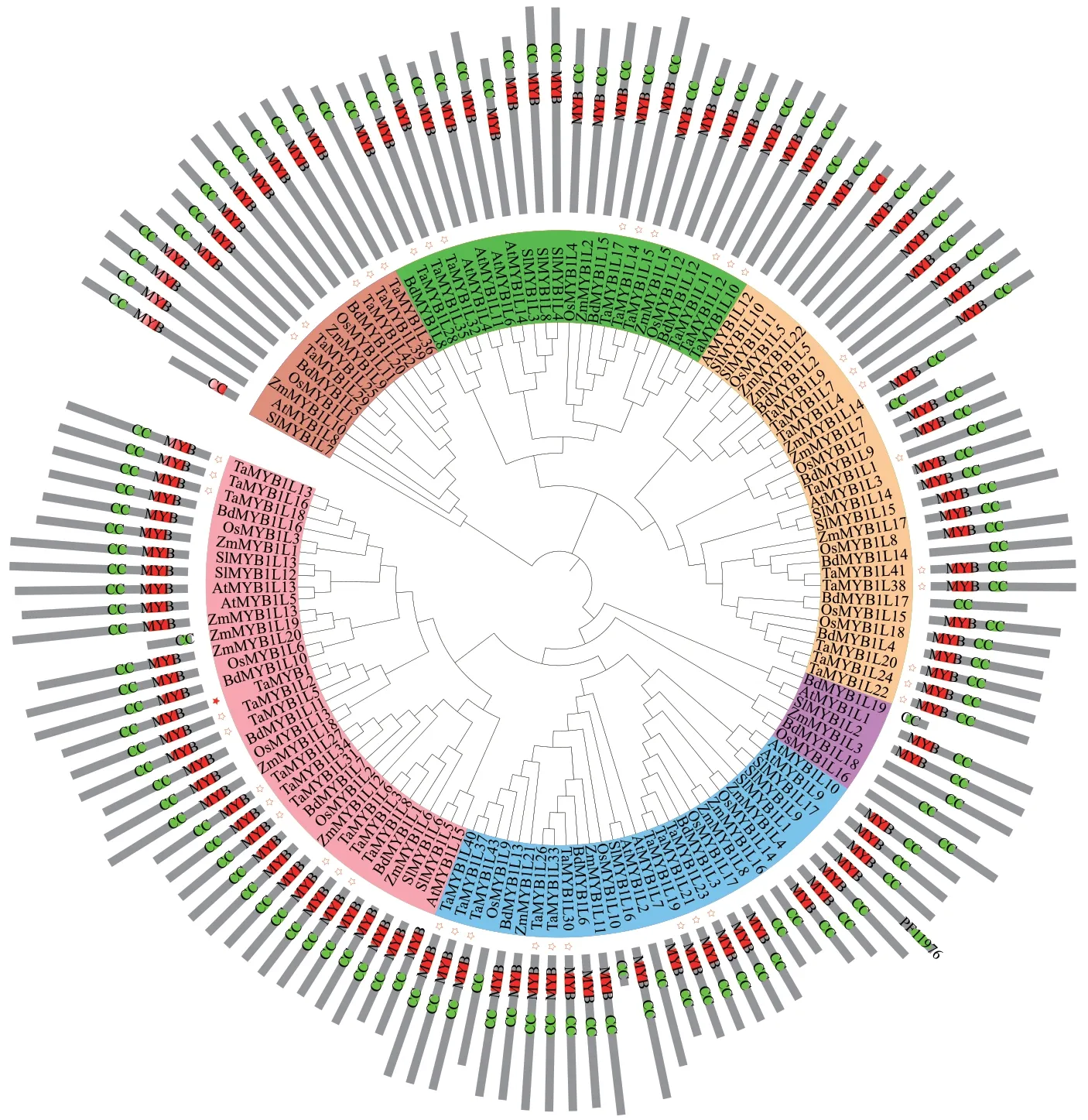
图8 TaMYB1及其他物种同源蛋白的系统进化关系Fig. 8 Phylogenetic relationships of TaMYB1 and its homologous proteins in other species
2.7 TaMYB1及其同源基因的序列特征
为在系统进化背景下,阐明TaMYB1及其在小麦中同源基因的序列特性,对这些基因的系统进化、保守基序和结构模式进行分析,结果显示,在小麦TaMYB1同源基因的系统进化树末端,大多数进化分支上存在3个不同TaMYB1同源基因,分别定位于小麦A、B和D亚基因组,序列特征具有高度相似性(图9-A);TaMYB1属于1R-MYB家族成员,与其在小麦中同源基因的基因结构包含10个保守基序,TaMYB1包含motif1、motif2、motif3、motif4、motif7和motif9,其中核心基序为motif1和motif2;根据基序的组成和顺序,TaMYB1及其在小麦中同源基因共分为15种基序结构模式,TaMYB1的结构模式为motif7-motif1-motif3-motif2-motif4-motif9,基序结构模式类型为motif1-motif3-motif2-motif4-motif5-motif6的成员最多(图9-B);保守基序motif1和motif2与MYB家族的保守结构域MYB和MYB-CC存在部分蛋白序列重叠(图9-D-E);内含子数目和相位结果表明,TaMYB1包含7个外显子和6个内含子(图9-C)。
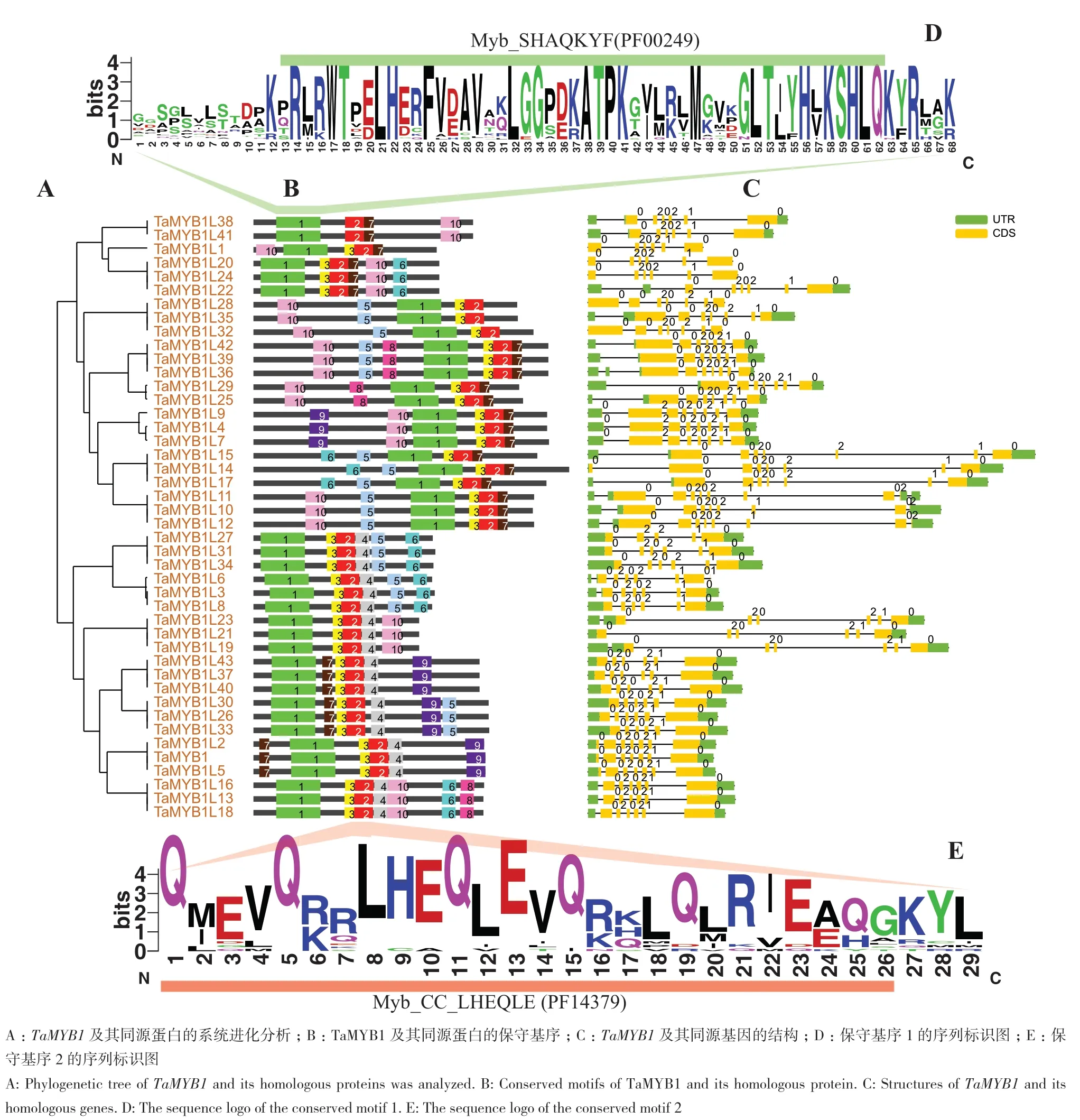
图9 TaMYB1及其小麦同源基因的序列特征及系统进化关系Fig. 9 Sequence features and phylogenetic relationships of TaMYB1 and its homologous genes in wheat
2.8 TaMYB1及其同源基因的组织表达规律
为进一步分析TaMYB1在正常组织中的表达情况,利用前人的RNA-seq数据[42],对TaMYB1及其43个同源基因在不同发育阶段的根、茎、叶、穗和种子(15个样品)进行表达谱分析,结果表明,小麦TaMYB1(图10实心五角星)与TaMYB1Ls的组织表达模式呈现出较高的多样性,这意味着TaMYB1及其43个同源基因可能参与诸多生物学功能;与其他TaMYB1Ls不同,TaMYB1在拔节中期的花序和成熟期的花序中表达最高,在灌浆前期种子和灌浆中后期种子中表达量最低,这说明TaMYB1在不同组织中已经形成了独特的表达模式(图10)。

图10 TaMYB1及其小麦中同源基因的组织表达谱Fig. 10 Tissue expression profile of TaMYB1 and its homologous genes in wheat
3 讨论
植物在长期的进化和发育过程中,进化出了一系列响应Cd胁迫的转录调控和翻译后调控网络,转录因子在其中发挥着重要作用。小麦MYB基因的研究主要集中在响应生物胁迫方面,如过表达R2R3-MYB成员TaRIM1增强小麦对禾谷丝核菌的抗性[43];过表达R2R3-MYB成员TaMYB391正调控小麦对条锈菌的抗性[44];MYB蛋白TaPIMP2受真菌诱导表达,并上调水杨酸和茉莉酸的水平[45]。而目前小麦MYB家族成员在响应Cd胁迫方面的研究报道较少。本研究通过酿酒酵母筛选小麦耐Cd胁迫酵母菌株,获得小麦Cd胁迫应答基因TaMYB1,病毒诱导TaMYB1沉默试验结果表明,对照植株在Cd胁迫下植株生长受到抑制。然而,TaMYB1沉默植株在Cd胁迫下的生长状态明显优于对照植株,且TaMYB1沉默植株根系和叶片的Cd含量显著低于对照植株,表明TaMYB1参与了小麦对重金属Cd的调控机制。TaMYB1沉默区域是MYB-CC结构域高度保守区,推断可能同时沉默了TaMYB1及其同源基因。与本研究结果一致,水稻R2R3类型成员OsMYB49过表达植株显著增加Cd的积累,而Osmyb49突变体则减少Cd的积累[25]。另外,Hu等[24]研究结果发现水稻R2R3-MYB蛋白OsMYB45受重金属Cd诱导表达,突变体Osmyb45降低了水稻对Cd胁迫的耐受;苎麻1R-MYB蛋白BnMYB2正调控Cd的耐受和积累[26]。由此推测,MYB家族的不同成员在不同植物中的功能存在差异。同时,研究者对低积累和高积累Cd型马铃薯以及Cd胁迫下的小麦进行转录组测序,差异表达基因结果分析发现,MYB基因家族成员数目均位列第二,表明MYB家族成员在植物响应Cd胁迫中发挥重要作用[46-47]。
植物中的转录因子通过激活下游基因的表达从而参与各种生物学功能,结合前人研究和生物信息学分析预测,转录因子TaMYB1的靶基因中存在多个重金属相关异戊二烯化植物蛋白(heavy metalassociated isoprenylated plant protein, HIPPs),而在拟南芥中沉默大白菜BcHIPP16降低了植株的Cd含量,推测在小麦中TaMYB1可能也采用相似的作用机制降低Cd含量,在植物中尤其是多倍体物种的金属离子调控机制较酵母更为复杂[48],从而导致在酵母中的试验结果与小麦中相反,后期将进一步利用酵母单杂交技术筛选TaMYB1并验证下游靶基因的功能。
植物在受到重金属胁迫后会造成活性氧的激增,进而损伤植物细胞,经过长期进化,植物激活抗氧化系统清除过量的活性氧,避免对植物细胞的毒害作用,同时,MDA是Cd胁迫引起植物膜脂过氧化的主要产物之一,可加剧细胞的损伤,是研究抗性生理的参考指标[49]。研究发现,植物可以通过提高SOD、POD活性来抵抗重金属Cd胁迫造成的氧化伤害[50]。本研究检测了TaMYB1沉默植株和对照植株在正常生长条件和Cd胁迫下的叶绿素含量、SOD、POD活性和MDA含量,与前人研究结果类似[51-52],相对于对照植株,TaMYB1沉默植株增强了Cd的耐受,叶绿素含量、SOD和POD活性均显著上升,而MDA含量则显著下降。以上结果推测,TaMYB1的沉默降低了MDA的含量,增强了小麦的抗氧化酶系,降低了Cd对小麦的毒害损伤。综上所述,本研究为小麦MYB家族响应重金属Cd胁迫的功能研究奠定基础,后续将利用基因编辑技术获得TaMYB1的编辑植株,为重金属Cd污染的农田土壤修复提供借鉴。
4 结论
Cd胁迫条件下严重影响了小麦的生长,尤其是根;构建了Cd胁迫小麦根系酵母双杂交cDNA文库,筛选获得Cd胁迫应答基因TaMYB1;TaMYB1是MYB家族的1R-MYB成员,TaMYB1沉默降低了植株Cd含量,增强小麦对Cd的耐受性。