半乳糖氧化酶的生物学改造研究进展
2024-02-05夏光丽曹娜孙慧慧赵玲曹荣
夏光丽 曹娜 孙慧慧 赵玲 曹荣,3
(1. 中国海洋大学食品科学与工程学院,青岛 266404;2. 中国水产科学研究院黄海水产研究所,青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,青岛 266237)
酶介导的催化反应具有高效节能、绿色环保等优点,此外,酶还具有化学选择性、区域选择性和立体选择性等特性,使其成为可持续催化剂应用于许多合成转化中。酶分子良好的催化活性、热稳定性和催化效率是其工业化生产和商业化应用的基础,但天然酶往往存在一些缺陷,如催化活性低、稳定性差等,难以满足工业化生产的需求。因此,蛋白质工程通过利用结构生物信息学和生物学手段,对酶分子进行改造,以提升其催化性能。此外,固定化技术也可以提高酶的稳定性并提高酶的重复使用率。因此,对天然酶进行生物学改造的研究吸引了众多学者的关注,本文在概述半乳糖氧化酶基本信息的基础上,综述半乳糖氧化酶改造的研究现状,为进一步开发和改造利用半乳糖氧化酶提供理论基础和研究思路。
1 半乳糖氧化酶概述
半乳糖氧化酶(EC 1.1.3.9)是碳水化合物活性酶数据库中新建立的辅助活性(auxiliary activity,AA)AA5_2家族中的一种铜依赖性氧化酶,能够催化多种醇(糖)的羟基氧化生成相应的醛,具有广泛的底物特异性。半乳糖氧化酶在催化糖反应中表现出严格的区域选择性,在没有任何复杂有机辅因子的作用下仅针对D-半乳糖分子上的C6位羟基进行氧化[1-2](图1),基于这一特性,半乳糖氧化酶已成功应用于多个领域。在食品分析中,它可用于奶类产品和相关乳制品中的乳糖测定[3];在造纸行业中,半乳糖氧化酶生成的醛衍生物可用于提高纸张的强度[4-5];在香料工业中,半乳糖氧化酶催化长链脂肪醇生成的醛可用于香料的合成[6];在医药领域,半乳糖氧化酶可用于抗HIV药物的合成[7];在化学合成领域,其醛基产物可以进一步氧化形成羧基,这种方法在合成药物中间体、制备新型糖类以及核苷酸等产品中具有广泛的应用[8-10]。

图1 半乳糖氧化酶的催化反应Fig. 1 Catalytic reaction of galactose oxidase
1.1 半乳糖氧化酶来源
半乳糖氧化酶是一种含铜的细胞外氧化还原酶,能够催化一系列羟基醇氧化成醛,并将氧气还原为过氧化氢[11]。该酶最早于1959年由Cooper等[12]从真菌Polyporus circinatus中分离出来。第一个被克隆并测序的半乳糖氧化酶基因是从Dactylium dendroides中提取的gaoA基因[13],其长度为2 043 bp,编码一个含680个氨基酸序列的蛋白质[14],该基因已在毕赤酵母[15]、大肠杆菌[16]以及其他真菌中异源表达。目前已报道的半乳糖氧化酶主要来自镰刀菌属,其中亚谷状镰刀菌是半乳糖氧化酶的主要生产者[14]。此外,也有其他真菌来源半乳糖氧化酶的报道,如Magnaporthe oryzae[17]、Neurospora tetrasperma[18]、Colletotrichum graminicola[19]等。关于细菌来源的半乳糖氧化酶,目前在核苷酸序列分析的基础上已经确定了半乳糖氧化酶是Stigmatella aurantiaca中fbfB基因的产物同源物[20],该基因编码一种参与子实体形成的蛋白质,但是该蛋白质产物尚未被表征,其cDNA也尚未被检测到[21]。
1.2 半乳糖氧化酶结构
目前已对多个来源的半乳糖氧化酶的晶体结构和催化机制进行了研究,其中包括来自Hypomyces rosellus、Fusarium sp.、F. graminearum等的8个晶体结构(图2)。其分子结构可分为3个结构域,几乎全部由β折叠和转角构成(以来源于H. rosellus的半乳糖氧化酶为例,PDB ID:1GOG,图3)[22]。第一结构域由1-155位的氨基酸组成,呈现三明治结构,包含8个反向平行的β折叠,形成粗糙的八面体空间构型。该结构域与第二结构域通过一条有序的多肽链连接,第二结构域由156-532位氨基酸组成,是最大的结构域。其整体外形呈现七瓣花状,每个花瓣由4个反向平行的β折叠组成,这种结构在各种真核配体结合蛋白以及与半乳糖氧化酶密切相关的其他酶中也很常见[23]。在第二结构域中,有3个与金属铜离子相连的氨基酸残基,分别是Tyr272、Tyr495和His496,它们共同构成了半乳糖氧化酶的催化活性位点,而铜离子作为活性位点的中心嵌入在这一结构域中[20,22]。此外,第二结构域中还存在由Tyr272-Cys228形成的硫醚键,该键的交联形成Tyr-Cys辅助因子,经过可逆氧化反应在蛋白质中形成苯基自由基[24-25]。第三结构域包含533-639位氨基酸残基,由7个反向平行的β折叠构成。在第三和第四个折叠之间存在一段包含572-590位氨基酸的不规则长片,它从第三结构域贯穿至第二结构域中间,并提供了第4个与铜离子结合的氨基酸位点His581[22]。

图2 八种已报道的半乳糖氧化酶晶体结构Fig. 2 Crystal structures of eight reported galactose oxidases
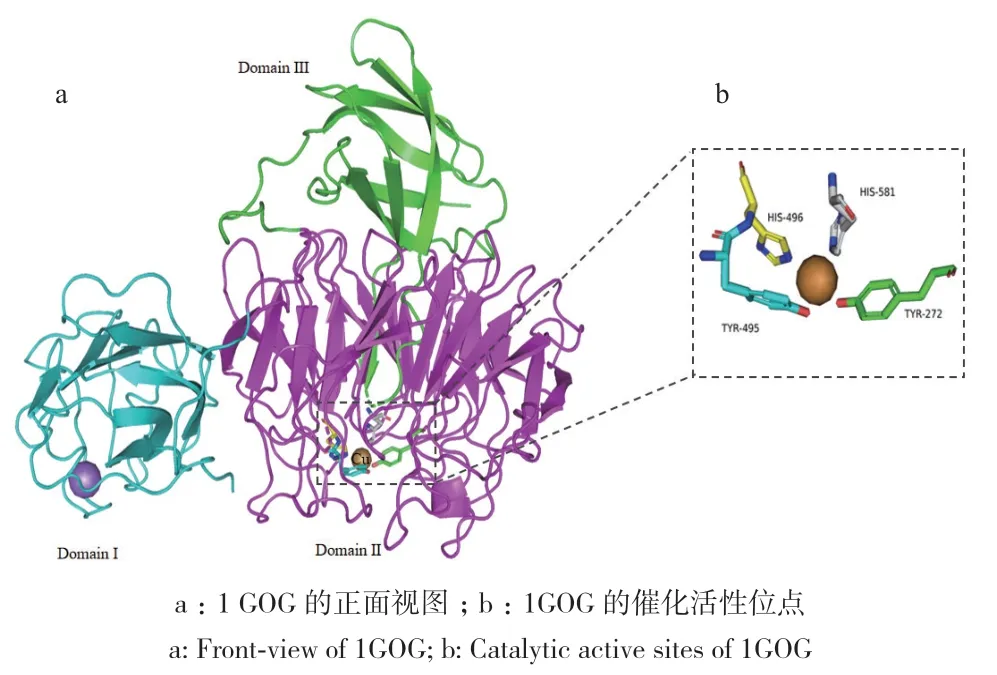
图3 半乳糖氧化酶的晶体结构(以来源于F. graminearum的半乳糖氧化酶为例,PDB ID:1GOG)Fig. 3 Crystal structure of galactose oxidase(Taken the galactose oxidase from F. graminearum as the template, PDB ID:1GOG)
1.3 半乳糖氧化酶催化机理
半乳糖氧化酶催化氧化是由Cu(I)介导的双电子氧化还原反应[26],研究表明,该酶的活性位点结合了两个不同的单电子受体,即一个Cu(II)金属中心和一个稳定的蛋白质自由基(Tyr*),形成一个金属基配合物,作为一个双电子氧化还原单元参与催化转化过程。半乳糖氧化酶可以表现出与两个单电子还原步骤相关的3种不同的氧化态:(1)完全氧化形式:由Cu2+和自由基(Tyr*)组成,作为醇底物的氧化还原活性形式;(2)半还原形式:具有催化活性,包含Cu2+和Tyr的形式;(3)还原形式:无催化活性,含有Cu+和Tyr,可以参与催化循环[27]。半乳糖氧化酶催化的氧化还原反应可以分为两步:第一步反应是底物醇氧化为醛,同时酶活性中心处的Cu2+被还原成Cu+。第二步反应是氧气还原为过氧化氢,同时Cu+被氧化成Cu2+,恢复到催化循环的起始状态[5](图4)。
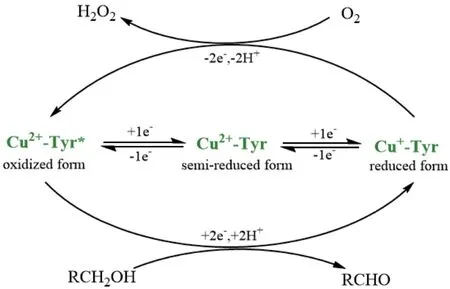
图4 半乳糖氧化酶氧化还原过程示意图Fig. 4 Schematic diagram of galactose oxidase redox process
2 半乳糖氧化酶的分子生物学改造
天然半乳糖氧化酶往往存在稳定性差、活性低的问题,导致其催化效率低、缺乏商业价值,无法满足工业化应用的需求。因此,近年来,对半乳糖氧化酶进行分子生物学改造以提高其工业应用性能成为研究的热点。研究人员采取了多种策略,包括定向进化、半/理性设计和固定化等方法,对半乳糖氧化酶进行了多方面的性能改造,为开发具有优良性能、适用于工业生产的半乳糖氧化酶奠定了基础。
2.1 定向进化
定向进化是一种在实验室中模拟自然进化过程的方法,通过迭代有益突变实现蛋白质性能的飞跃,无需对其结构信息和催化机制有深入了解,可用于产生具有特定性质或功能的酶[28]。定向进化的一般步骤是以天然存在的酶为起点,确定目标酶的性质或功能,通过随机突变和DNA改组等技术构建基因突变文库,然后采用快速、高通量的筛选方法,最终确定最佳的突变菌株。与其他方法相比,定向进化的优点在于不需要对半乳糖氧化酶的结构有很深入的了解,只需进行大量筛选,最终可以获得性能明显提高的菌株[29]。
2.1.1 随机突变 随机突变是一种构建基因突变文库的常用方法,通过利用epPCR(error-prone polymerase chain reaction,epPCR)技术,在扩增目标片段时有意引入错配碱基实现对单一的DNA片段形成随机突变,以获得所需酶的期望性能。该技术最早于1985年提出,1993年发现该技术可用于酶分子改造[30],目前已广泛应用于定向进化中。例如,Escalettes等[31]以来源于F. graminearum的半乳糖氧化酶突变体M3为研究对象,通过对具有对映选择性的M3变体进行随机突变,优化了对1-苯乙醇的催化活性。最终筛选得到突变体M3-5在与(R)-1-苯乙醇进行固相试验时表现出良好的催化活性和高对映体选择性。此外,Wilkinson等[32]对来源于Fusarium spp. NRRL 2903 的天然半乳糖氧化酶进行了改造,以D-半乳糖和1-甲基-α-D-半乳糖为底物,获得了活性提高的半乳糖氧化酶突变体。研究中采用epPCR构建了单、双、三突变体,其中C383S/Y436H对D-半乳糖的催化效率提高了5.3倍,C383S/V494A对1-甲基-α-D-半乳糖的催化效率提高了4.9倍。V494A和Y436H单独对催化效率影响不大,但与C383S迭代后可以显著提高催化效率,推测这两个位点的突变引起了微妙的变化,影响了C383S变体的修饰活性部位。Delagrave等[33]采用随机突变结合数字成像光谱和固相筛选相结合的方法,高效地筛选出具有活性的突变体。其中突变体8-1(C383S/Y436H/V494A)的催化效率提高了16倍,突变体7.5.1(C383S/Y436H/N318D/V477D/A626S/V494A)的催化效率提升了19倍,这是首次报道的活性提高的半乳糖氧化酶突变体。
2.1.2 DNA改组 DNA改组技术是一种通过随机打乱目标基因中的片段,并在DNA水平上重组这些片段形成新的基因的技术。该技术在酶定向进化中发挥了重要作用,因为它可以快速生成大量的基因变体,为寻找最佳性能的酶提供了更广泛的选择。例如,Sun等[34]利用epPCR和StEP(stagger extension process)重组技术对来源于F. graminearum的天然半乳糖氧化酶进行改造,最终获得了突变体A3.E7,其携带突变S10P/M70V/P136(沉默突变)/G195E/V494A/N535D。与野生型酶相比,该突变体的催化效率提高了1.7倍,蛋白表达量提高了18倍(达到10.8 mg/L)。该突变体不仅保留了野生型半乳糖氧化酶的活性和底物特异性,还具有更高的热稳定性和表达水平,这些特性有望促进酶的进一步进化和应用。
2.2 理性设计
理性设计要求全面了解蛋白质的三维空间结构以及结构与功能之间的关系,从而预测具有所需性质的潜在突变体[30]。通过选择对催化反应起关键作用的位点,并使用基因改造技术,如定点突变、片段插入/删除等手段进行精确设计,以实现预期的效果。在第三次酶工程浪潮中,利用计算机技术、分子对接和分子动力学模拟等方法,可以快速、高效地改造和筛选生物催化剂[35-36],甚至可以从头设计不存在于自然界中的新酶[37],或者对现有酶进行改造以赋予其新的功能。
2.2.1 定点突变 为了评估活性位点上的氨基酸残基如何促进催化过程以及自由基的形成和稳定,Baron等[38]对来源于Fusarium spp.的半乳糖氧化酶的活性位点W290、C228、Y272进行了定点突变,并成功在A. nidulans中表达。然而,突变体Y272F由于失去了赤道铜配体(Y272)而无法与铜结合,导致其难以被纯化。野生型酶和突变体(W290H和C228G)已经通过X射线晶体学和可见光谱进行了表征。实验结果显示,突变体C228G和W290H的kcat/Km比野生型酶低近千倍,且更容易变性,这表明C228-Y272之间的硫醚键以及在该键上堆叠的W290对活性和稳定性至关重要。有研究者提出,轴向的Y495在半乳糖氧化酶催化机制的第一步中接受来自底物的质子。为了验证这一假设,Reynolds等[39]制备了半乳糖氧化酶GOase的突变体Y495F。动力学实验结果表明,突变体的Km值与野生型酶相似,但kcat/Km降低了1 100倍;可见吸收光谱显示,突变体在410 nm和810 nm处的消光系数分别降低了4倍,这一结果有力地支持了Y495是野生型酶催化反应中摄取质子的重要碱基。类似地,Baron等[40]为了研究半乳糖氧化酶中氧化还原活性位点W290和C228在催化机制中的作用,对这些位点进行了定点诱变,得到了突变体W290H和C228G。将这两个突变体的晶体结构与野生型的晶体结构进行比较分析,并测定它们的活性,结果显示突变体的晶体结构无明显变化,但其活性比野生型酶低近千倍,证实了C228和W290在酶催化过程中的关键作用。AA5_2亚家族中的部分酶不能氧化半乳糖和半乳糖苷,但能有效地催化多种脂肪醇的氧化。基于此,Koncitikova等[41]选取了来自C. graminicola(CgrAlcOx)的醇氧化酶和来自F. graminearum(FgrGalOx)的半乳糖氧化酶,通过定点诱变的方式探究了AA5_2亚家族中驱动醇氧化酶和半乳糖氧化酶之间底物偏好性的关键氨基酸残基,产生并表征了多个醇氧化酶变体。与半乳糖氧化酶相比,醇氧化酶突变体M4F(W39F/F138W/M173R/T246Q)和M6(W39F/F138W/M173R/F174Y/T246Q/L302P)对碳水化合物表现出相似的亲和力,其中CgrAlcOx-M4F对D-半乳糖的Km值比FgrGalOx高5倍,CgrAlcOx-M6变体表现出对D-半乳糖的最佳亲和力,其Km值与FgrGalOx的Km值相似。从而鉴定了活性位点附近的6个残基W39、F138、M173、F174、T246、L302对底物识别至关重要。
2.2.2 片段插入/删除 Mathieu等[15]在蛋白质一级和三级结构的指导下,对来自C. graminicola 的醇氧化酶CgrAAO的活性位点进行了研究。他们通过截短活性位点中的一个独特的loop环,探究其对催化活性的影响。突变体CgrAAO-Δloop由于环的缺失显著降低了酶对低聚半乳糖C6位羟基的固有活性,但获得了C1位的氧化活性。与野生型酶相比,突变体CgrAAO-Δloop更倾向于将大多数被测试的碳水化合物(如乳糖、半乳糖、木糖、葡萄糖、蜜二糖等)的C1位优先氧化,生成相应的糖醛酸,但其对半乳糖的催化效率相对于野生型酶略有降低。值得注意的是,突变体CgrAAO-Δloop获得了对D-葡萄糖和麦芽糖的催化活性。这种C1位的区域特异性在AA5酶家族中前所未有,为改进生物催化剂的各种潜在应用奠定了基础。
2.3 半理性设计
半理性设计是一种在不完全了解蛋白质结构与功能信息的情况下进行基因改造的方法。它结合了定向进化和理性设计的优点,既确定了基因改造的方向,同时又降低了筛选的工作量[42]。尽管半理性设计通过定点诱变技术在一定程度上克服了筛选的限制,但仍需要建立“小而精”的突变体文库,其经典方法是位点饱和突变[43]。例如,Sun等[44]对半乳糖氧化酶进行了修饰,引入了葡萄糖氧化酶的活性。研究中利用比野生型表达更好、更稳定的突变体A3.E7作为模板,通过组合饱和突变,得到了葡萄糖氧化酶M-RQW(R330K/Q406T/W290F)。该突变体具有区域选择性,仅对D-葡萄糖的C6-OH基团起作用,在自然界中尚未观察到D-葡萄糖在C6-OH位置的氧化。与A3.E7相比,M-RQW对D-葡萄糖的活性增加了100倍,酶活性水平为1.6 U/mg。Deacon等[45]通过在成熟半乳糖氧化酶序列中引入沉默突变,增强了酶的翻译,并在优化了半乳糖氧化酶表达条件(包括大肠杆菌宿主菌株、自诱导培养基、诱导温度、培养时间和细胞裂解程序)的基础上,对影响底物结合的残基C383进行了饱和突变文库的构建。通过蛋白质纯化和初步表征发现,大多数突变体的酶活性水平高于野生型半乳糖氧化酶,但也有一部分突变体的催化效率远低于野生型酶。这个基于大肠杆菌的高效表达系统为突变文库的分析提供了良好的基础,并对未来的定向进化研究具有重要意义。
2.4 固定化
针对游离酶存在的稳定性差、分离纯化困难以及重复使用率低等问题,酶的固定化技术应运而生。固定化可以将酶分子固定在载体上,同时允许底物和产物自由进出[3,31]。酶的固定化有多种方法,不同的固定化方式会使酶具有不同的性能。目前常见的固定化方法包括物理吸附法、包埋法、交联法、结合法以及新型的固定化技术,每种方法都存在一定的优势和不足。
2.4.1 物理吸附法 物理吸附法是利用酶和载体之间的物理相互作用力(如氢键、范德华力、疏水作用力等),将酶固定在载体表面的一种固定化方法[46]。该方法具有工艺简单、条件温和、载体价廉易得、可反复使用等优点[47]。然而,由于酶与载体之间的相互作用力较弱,使得酶容易从载体上脱离,因此稳定性较差[46]。
近年来,一些研究者利用Langmuir-Blodgett(LB)膜吸附在固体载体上的脂质基质作为载体用于酶的固定化,并能保留酶的活性[48]。例如,de Souza Furtado等[49]将半乳糖氧化酶与脂质基质结合后,将浓缩的酶脂质单层转移到LB膜的固体载体上制备固定化酶。酶活性检测结果显示,与游离酶相比,固定化酶在30 d后表现出增强的稳定性,这表明超薄膜可以帮助维持固定化酶的催化活性,同时为纳米技术和生物传感制造提供了可能性。
2.4.2 包埋法 包埋法是一种将酶或细胞包埋在多孔载体(如海藻酸钠、琼脂糖、明胶等)内部发生聚合、沉淀或凝胶化使之固定化的方法。包埋法工艺简便,酶活回收率高,但是对载体要求较高[45,50]。同时该方法反应条件温和,一般不会改变酶的结构,但酶与载体之间的相互作用力也较弱,容易出现脱落现象[51]。研究人员已经对包埋法进行了优化和改进。例如,Akbaari Gourdani等[52]制备了一种用于链接反应的非均相酶体系,利用包埋技术将半乳糖氧化酶固定在藻酸钙珠中,合成海藻酸多糖珠(GOBead),并通过优化珠粒尺寸和酶与藻酸钠的比例,以获得最高的酶活性。结果表明,GO-Bead可以回收并在多次运行中有效地重复使用,但与游离酶相比其催化活性略有损失。
2.4.3 交联法 交联法是利用一些双功能试剂,如戊二醛、双重氮联苯胺-2,2-二磺酸等,与酶分子之间进行交联形成共价键,从而得到三维的交联网架结构的固定化方法。除了酶分子之间形成交联外,还存在着分子内交联[51]。将生物分子附着在涂有连接层的金属表面上是一种保持其天然生物活性的方法。Kaminska等[53]使用反式二苯乙烯(4,4'-二异硫氰酸酯)-2,2'-二磺酸(DIDS)作为交联剂,将半乳糖氧化酶固定在Ag和Au表面的硫醇自组装单层上,提供了一种制造酶电极的潜在方法。DIDS是一种对称的双功能试剂,可以与硫醇的胺部分和酶的伯氨基反应。该研究利用表面增强拉曼光谱和表面等离子体共振技术研究了固定化后的半乳糖氧化酶。实验表明,使用DIDS的Au电极修饰的半胱胺产生了约8.4×107g/cm2的表面覆盖率,而仅使用半胱胺修饰的Au基底仅产生了约1.2×107g/cm2的表面覆盖率。结果证明,在不损失半乳糖氧化酶催化活性的前提下用该方法固定化的半乳糖氧化酶层非常稳定,不会被缓冲溶液轻易地从表面去除。
2.4.4 结合法 共价结合法是一种常见的固定化酶的方法,通过共价键连接载体和酶蛋白分子。但是该方法需要先对载体进行化学改性,引入可反应的官能团,例如氨基、羟基、醛基等[45]。当载体表面的官能团与酶蛋白分子上的可反应基团发生反应后,就可以形成牢固的共价键连接。这种方法所得的复合酶与载体之间的连接稳定性高,使得酶不易从载体上脱落,可以重复使用。然而,共价结合反应往往比较剧烈,可能导致酶蛋白分子的高级结构发生变化,从而影响酶的活性,因此需要注意反应条件的控制[54-55]。
Mattey等[56]通过共价连接半乳糖氧化酶变体M1、M3-5、工程胆碱氧化酶和单胺氧化酶于固体载体上,成功制备了固定化酶生物催化剂。这些固定化酶表现出长期稳定性和可重复使用性,在稳定性(超过20倍)、60℃的耐热性以及对纯有机溶剂如己烷和甲苯的耐受性方面优于它们的游离对应物。这些非均相氧化催化剂可以回收并多次重复用于不同底物的氧化。Çevik等[57]利用半乳糖氧化酶构建了一种简单的生物传感器,用于检测半乳糖。该生物传感器将半乳糖氧化酶共价连接在聚甲基丙烯酸缩水甘油酯-乙烯基二茂铁膜上,并研究了生物传感器的制备和操作的优化实验条件。该生物传感器响应快、价格低廉,并表现出良好的稳定性、灵敏度及检测限等性能。Kondakova等[58]将来自禾谷镰刀菌IMV-1060的半乳糖氧化酶吸附在改性的二氧化硅载体上并共价连接,制备了固定化酶,成功用于D-半乳糖和含半乳糖的复杂混合物的分析测定。
2.5 新型固定化技术
传统的固定化技术存在一些缺陷,如固定化酶活性降低和传质受阻等问题,因此新型的固定化技术应运而生[59]。随着材料仿生学的不断研究,出现了一种新的固定化方法——仿生矿化。秦琼[4]利用金属离子(Cu2+)和无机盐形成金属无机结构核心,从而与半乳糖氧化酶(GAO)杂交结合,形成一种蛋白-金属无机杂交结构。考虑到GAO催化底物会产生过氧化氢,因此引入过氧化氢酶来去除过氧化氢,而产生的氧气又可以提供给GAO的催化反应。研究者将GAO与过氧化氢酶按照一定比例共同矿化固定到磷酸铜载体中,成功矿化后,得到的复合结构产物不仅具有稳定的结构,而且催化活性和温度耐受性都得到了显著提升。此外,Chen等[60]使用NECu(II)和Zr(IV)包封半乳糖氧化酶(GO),成功制备了GO无机纳米花。在NECu(II)和Zr(IV)的协同催化下,副产物H2O2分解生成·OH和O2。固定化的GO在10 h内实现了98.1%的5-羟甲基糠醛转化率,远远高于游离GO(22.2%)的转化率。
3 总结与展望
近年来,利用分子生物学技术对半乳糖氧化酶进行改造的研究取得了快速的发展,改造后的酶具有使用方便、活性高等一系列优势,广泛应用于食品、医疗等领域。本文总结了半乳糖氧化酶生物学改造的最新研究进展,包括定向进化、半/理性设计和固定化技术等。这些技术的推广和不断改进已显著提高了酶的性能,使其更加适用于生产和应用。未来的研究将继续深入挖掘半乳糖氧化酶改造的潜力,有以下几个关键方向值得关注:(1)结构与催化机理的深入研究。研究人员可以借助分子动力学和分子模拟等高级技术,更深入地研究半乳糖氧化酶的结构和催化机理。通过解析酶的原子级别结构以及催化底物的交互方式,揭示更多有关其活性中心和底物特异性的信息,这将为设计更高效的改造策略提供重要的指导。(2)新领域的应用探索。尽管半乳糖氧化酶的催化功能正在不断被发掘,但在这些酶的系统发育多样性中决定催化功能差异的蛋白质结构特征仍然是未知的。以往的研究集中在改变生物酶的立体构象以增强其催化活性和稳定性,而对酶催化功能多样性的研究知之甚微。最近的研究揭示了AA5_2亚家族的部分半乳糖氧化酶除了能催化部分含羟基的底物生成醛基产物外,还可将该醛基产物进一步氧化生成羧酸类物质,该物质在合成药物中间体、制备新型糖类产品以及核苷酸产品中具有重要的作用。研究人员可以继续探索这些新领域,并寻求创新的方法,以充分发挥半乳糖氧化酶的催化作用。这将有助于满足不断增长的市场需求,同时促进相关领域的发展。(3)提升和创新改造技术。研究人员还可以进一步探索新型酶工程方法,如基因编辑和蛋白工程,以创造具有特定催化性能的新型半乳糖氧化酶,这将为更广泛的应用领域带来新的机会。这些研究将有助于更好地利用半乳糖氧化酶的催化作用,推动相关领域的发展。