基于网络药理学探讨复方苁蓉益智胶囊治疗轻度认知障碍的作用机制
2024-02-04许宵钰耿艺菲刘静静孙晓波
韩 沁,许宵钰,耿艺菲,刘静静,孙晓波,罗 云
(1.中国医学科学院药用植物研究所,北京 100193;2.安徽雷允上药业有限公司,安徽 亳州 136200)
轻度认知障碍(mild cognitive impairment,MCI)是一种介于正常衰老与痴呆之间的认知障碍综合征,表现为轻度记忆和智能损伤[1]。由于MCI常被认为是阿尔茨海默病(Alzheimer’s disease,AD)的前驱状态,因此被视作阻断MCI向AD发展的“黄金治疗窗”。临床常推荐AD的常规治疗药物抗氧化剂、胆碱酯酶抑制剂、单胺氧化酶-2(cyclooxygenase-2,COX-2)抑制剂等来治疗MCI,这对于认知功能变化的不同阶段显然不具有普适性,因此目前西药治疗MCI尚未形成系统的用药方案。中医中未有关于轻度认知功能障碍的载录,然而却多次提到与其临床症状相关的描述,例如“善忘”、“喜忘”、“健忘”。该病本病病位在脑,被归为神志病的范畴,却多涉及心、肾、肝、脾、肺等多个脏腑。因其病机为本虚标实,虚实夹杂,因此中医治疗时贯穿“标本兼治”的理念,应以补虚、祛痰、化瘀为主要治疗原则[2]。
复方苁蓉益智胶囊(fufang congrong yizhi capsule,FCYC)以肉苁蓉、何首乌、荷叶、漏芦和地龙合而为方,功善益智养肝、活血化浊、健脑增智,临床常用于治疗血管性痴呆、AD以及轻度认知障碍等疾病。目前已有研究表明,FCYC能够抑制神经元可塑性的重要蛋白MARCKS的表达,从而介导树突棘的可塑性变化,逆转AD大鼠的学习记忆功能[3]。马涛等[4]发现,该药能够提高机体的抗氧化能力,降低脂质过氧化损伤,主要表现为提高小鼠脑组织中SOD、GSH-PX活性,降低脂质过氧化产物MDA含量。众所周知,中药含有许多功能不同的化合物,因此无法用某种有效化合物概括其全部药用价值。网络药理学利用计算机、高通量组学数据分析等学科技术深入研究药理机制,并且其提出“多成分、多靶点”的整体系统研究的概念与中医的治疗原则相符,从分子层次阐释中药方剂作用原理[5-6]。因此本研究拟采用网络药理学探讨FCYC治疗MCI的潜在化合物及靶点,并结合体外实验进一步验证,为下一步开展具体的机制研究工作提供基础。
1 材料与方法
1.1 网络药理学
1.1.1FCYC化合物及靶点收集 结合中药系统药理学数据库与分析平台(https://tcmspw.com/tcmsp.php)、《中国药典》(2020年版)以及相关文献收集FCYC的5味中药材肉苁蓉、何首乌、荷叶,漏芦和地龙的所有化合物,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18为条件筛选潜在化合物,并在Drugbank数据库(https://go.drugbank.com/)中获得筛选得到的化合物靶标。
1.1.2轻度认知障碍靶点收集 以“Mild cognitive impairment”为关键词,“homo sapiens”为物种限制条件为在OMIM(https://omim.org/)、GeneCards(https://www.genecards.org/)、TTD(http://db.idrblab.net/ttd/)数据库中检索并去重得到轻度认知障碍的相关靶点。
1.1.3中药-化合物-靶标-疾病网络构建 将获得的FCYC和MCI的靶点进行基因名称校正后筛选获得交集靶点,然后在Excel中反向寻找得到靶点对应的活性成分和中药,以此获得“中药-化合物-靶点-疾病”网络,并将其导入Cytoscape 3.6.1软件中实现可视化分析。
1.1.4蛋白质相互作用网络构建 为了更系统地了解各靶点间的相互作用,将FCYC和MCI的交集靶点导入STRING数据库(https://cn.string-db.org/),将条件设置为:物种(homo spaiens),最小相互作用分数(medium confidence, 0.4000)。然后将获得的相互作用网络导入Cytoscape 3.6.1中利用Network Analyer模块进行网络分析并可视化。
1.1.5靶点功能富集分析 将FCYC和MCI共有靶点导入DAVID数据库(https://david.ncifcrf.gov/)中获得GO和KEGG通路富集分析,设定条件为:物种(homo sapiens),阈值(Pvalue<0.05)。其中前者各选取生物过程(biological process, BP)、细胞组成(cellular component, CC)和分子功能(molecular function, MF)中富集靶点最多的前10条目在Graphpsd Prism绘制柱状图,后者通过易汉博生物信息平台绘制KEGG通路分析气泡图。

Fig 1 Network diagram of TCM-compound-target-disease
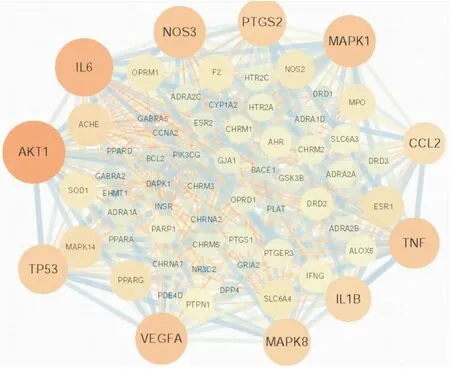
Fig 2 PPI diagram of FCYC acting on MCI targets

Fig 3 GO enrichment analysis
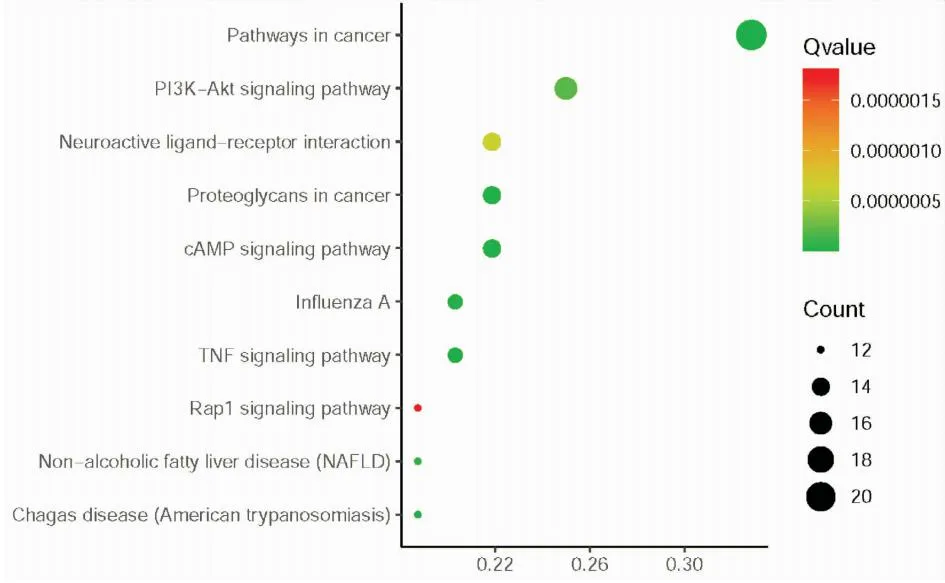
Fig 4 KEGG enrichment analysis
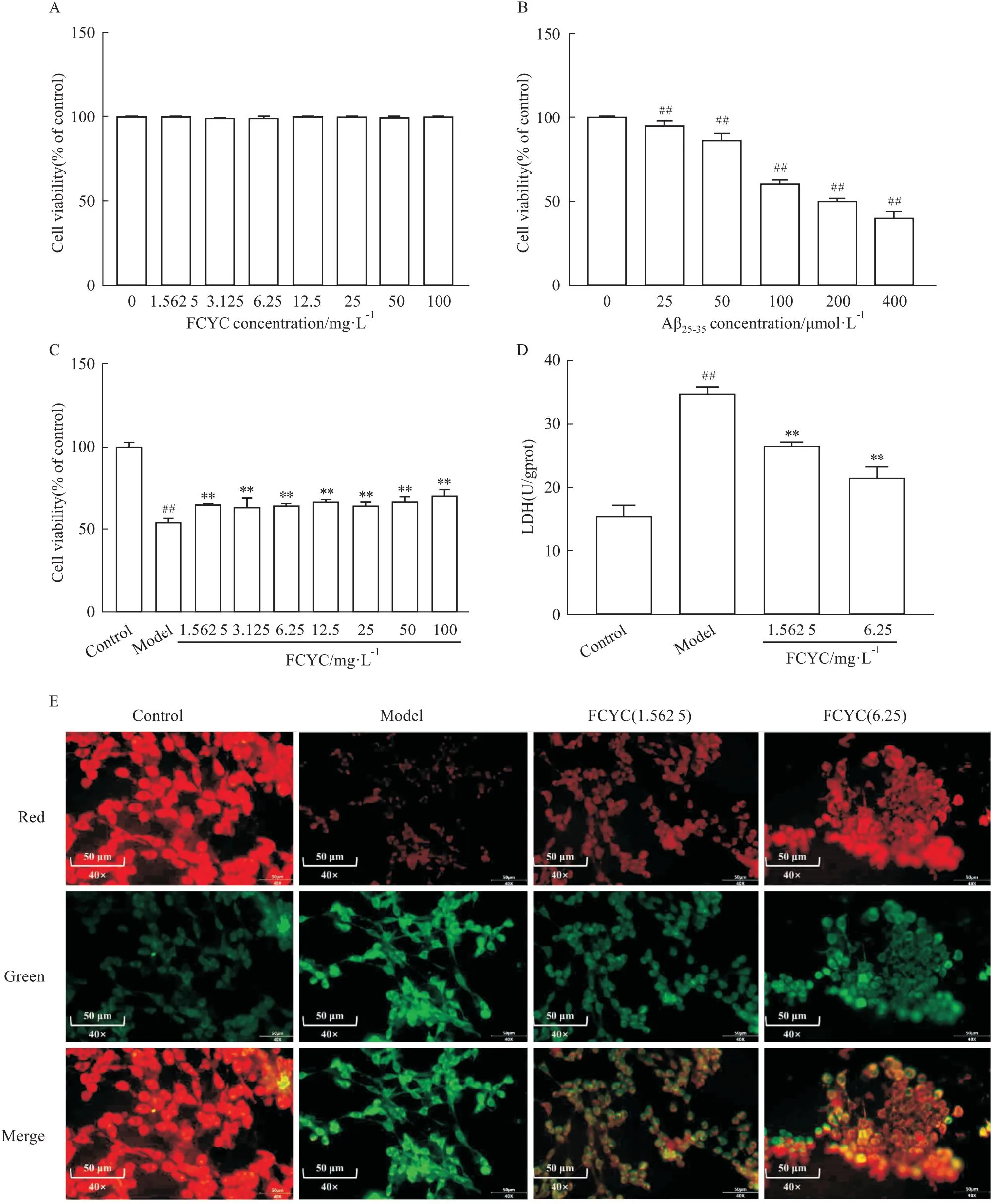
Fig 5 The protective effect of FCYC on PC-12
1.2 细胞实验验证
1.2.1试药与试剂 Pheochromocytoma 细胞(PC-12)由中国科学院干细胞库友情提供;Rosewell Park Memorial Institute RPMI 1640 培养基(含双抗)(31800-500)和胎牛血清(11012-8611)购自索莱宝;CCK-8试剂(C0038)、线粒体膜电位检测试剂盒(C2006)、LDH试剂盒(C0016)购自碧云天;白细胞介素-1β(Interleukin-1β)(ml037373)、白细胞介素-6(Interleukin-6)(ml059476)、TNF-α的ELISA试剂盒(ml002859)购自上海酶联免疫生物有限公司;Bax(50599-2-Ig)、Bcl2(68103-1-Ig)、AKT(60203-2-Ig)、p-AKT(Ser473)(66444-1-Ig)、PI3K(67121-1-Ig)抗体购自Proteintech; p-PI3K(Y607)(ab182651)抗体购自abcam;FCYC粉末由安徽雷允上药业有限公司提供;Aβ25-35(GP10082)购自GLPBIO;Alexa Fluor 488标记山羊抗兔IgG(H+L)(A0423)和Alexa Fluor 555标记驴抗兔IgG(H+L)(A0453)购自碧云天。
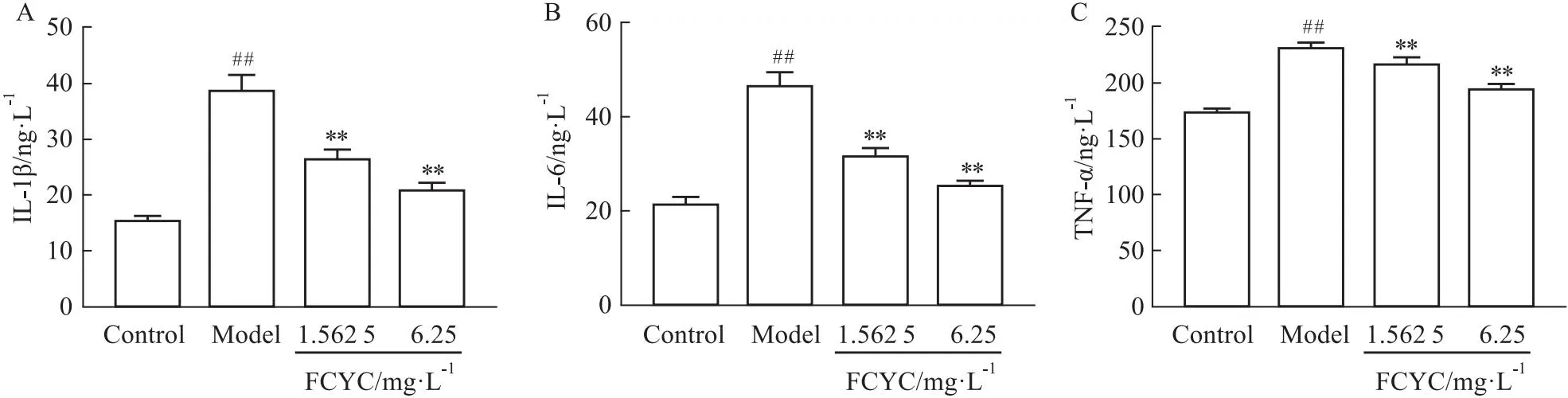
Fig 6 The anti-inflammatory effect of FCYC on Aβ25-35-induced PC-12 cell

Fig 7 The anti-apoptotic effect of FCYC on Aβ25-35-induced PC-12 cell
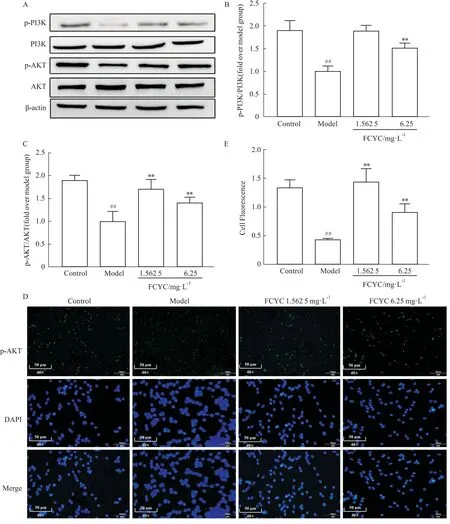
Fig 8 Regulation of FCYC on PI3K/AKT signaling
1.2.2细胞损伤模型建立与给药 PC-12细胞用含有5%胎牛血清的RPMI 1640培养基培养,以5×106个/孔的密度接种于96孔板中,置于5% CO2、37 ℃培养箱中培养24 h。将细胞分为空白组、模型组、FCYC不同浓度组(1.562 5、3.125、6.25、12.5、25、50、100 mg·L-1),FCYC组加入100 μL不同浓度药物,空白组和模型组细胞替以等体积RPMI 1640培养基,接着将细胞置于细胞培养基中孵育,24 h后弃去液体,除空白组外其余各组细胞加入不同浓度的Aβ25-35(0、25、50、100、200、400 μmol·L-1),继续培养3 h后进行后续实验。
1.2.3CCK-8法测定细胞活性 细胞培养结束后,每孔加入10 μL CCK-8溶液,孵育1 h后在450 nm波长下测定各孔细胞OD值,并计算细胞存活率。
1.2.4LDH法测定细胞毒性 PC-12分为空白组、空白对照组、模型组、模型对照组、FCYC组、FCYC对照组。各组细胞按照“1.2.2”法处理后,在预定结束时间点1 h前,在FCYC对照组中加入LDH释放剂,混匀后继续孵育;待离心后各孔取上清液与检测工作液混匀,在室温条件下避光孵育30 min,于490 nm下测定各孔OD值,并计算细胞毒性。
1.2.5ELISA法测定细胞炎症因子表达 将PC-12细胞接种于6孔板,培养24 h后,按上述方法处理各组细胞,培养结束后,离心取细胞上清液进行炎症因子(IL-1β、IL-6和TNF-α)测定。首先取样本稀释液和样本分别作空白孔和样本孔,加入辣根过氧化物酶(HRP)标记的检测抗体置于37℃恒温箱中孵育1 h后弃去液体,洗板5次,加入底物A、B孵育15 min,待加入终止液后于15 min内在450 nm下测定OD值。
1.2.6JC-1测定细胞线粒体膜电位 如上所述法处理完细胞后将细胞上清液移除,PBS洗净细胞,每孔加入细胞培养液和JC-1细胞染色工作液,充分混匀后在37 ℃细胞培养箱中避光孵育20 min,吸除上清后利用JC-1染色缓冲液洗涤2次并加入细胞培养液,最后在荧光显微镜下观察各组细胞。
1.2.7免疫荧光法检测蛋白表达 如上所述法处理完细胞后将细胞上清液移除,PBS洗净细胞,加入免疫细胞固定液,待固定牢固后加入细胞通透液继续孵育10 min,通透后继续用PBS洗涤,然后加入一抗Bax(1 ∶1 000)和p-AKT(1 ∶1 000)在室温下孵育1 h,结束后用TBST洗涤3次,加入荧光二抗,室温避光孵育1 h,然后利用TBST洗涤3次后滴入DAPI进行封片,最后在荧光显微镜下观察细胞。
1.2.8免疫印迹法检测蛋白表达 如上述所述法处理完细胞后提取各实验组细胞总蛋白, BCA法测定总蛋白浓度并定量,制备好样品后利用10%分离胶分离蛋白,转印至PVDF膜后置于5%脱脂牛奶中在室温条件下孵育2 h,随后加入抗体Bax(1 ∶1 000)、Bcl2(1 ∶1 000)、AKT(1 ∶800)、p-AKT(1 ∶1 000)、PI3K(1 ∶1 000)、p-PI3K(1 ∶800)、β-actin(1 ∶10 000)在4 ℃条件下孵育过夜,次日将PVDF膜与相应的二抗(1 ∶10 000)室温孵育2 h,最后使用增强化学发光试剂盒检测条带,并用Image pro软件进行条带定量分析。
2 结果
2.1 FCYC的化合物分析在中药系统药理学数据库与分析平台、《中国药典》(2020年版)以及相关文献中收集筛选得到肉苁蓉、何首乌、荷叶,漏芦和地龙共57个活性成分,其中肉苁蓉7个、何首乌12个、荷叶14个、漏芦4个和地龙20个,荷叶中主要含有儿茶素((-)-catechin),表儿茶素(ent-Epicatechin)、槲皮素(quercetin)等黄酮类化合物和荷叶碱(Nornuciferine)、杏黄罂粟碱(Armepavine)等生物碱类化合物;何首乌中主要含有大黄素(emodin)、大黄素甲醚(Physcion)和大黄酸(rhein)等黄酮类化合物;地龙中主要含有腺嘌呤(adenine)、3-苄基黄嘌呤(3-benzylxanthine)等嘌呤和赖氨酸(lysine)、缬氨酸(valine)等氨基酸;肉苁蓉中主要含有槲皮素(quercetin)等黄酮类化合物,花生四烯酸(arachidonate)等不饱和脂肪酸和β-甾醇(beta-sitosterol)等甾类化合物;漏芦中主要含有谷甾醇(sitosterol)等甾类化合物和甘草酸(liquiritin)等萜类化合物。
2.2 中药-化合物-靶点-疾病网络图分析为了分析FCYC、化合物、靶点、MCI之间的联系,构建了“中药-化合物-靶点-疾病”网络图(如Fig 1所示)。网络图中包含了108个节点和319条边,其中11种化合物有不少于20个靶点,包括MOL000098(槲皮素,75)、MOL000358(β -谷甾醇,62)、MOL000422(山奈酚,44)、MOL000354(异鼠李素,33)、CAS 3063-05—6(亮氨酸苯丙氨酸,31)、MOL007206(阿米巴碱,29)、CAS 82373-94-2(二苯基葡萄糖苷,34)、MOL007210(O-Nornuciferine,27)、MOL007213(nucifin,27)、MOL000472(大黄素,22),MOL007207(Machiline,21)。此外,PTGS2、PTGS1、HSP90A、NCOA2、SCN5A、CAMKK2、PIK3CG、PRKACA等靶点可与34、27、25、22、18、17、16、16个化合物相互作用,为度值最大的8个靶标。
2.3 蛋白质相互作用网络图分析在String数据库中获得的蛋白-蛋白相互作用网络图,从网络图中共获得靶点66个、相互作用线为497条。由Fig 2中结果显示,有11个节点度值大于25的代表性靶点,包括AKT1(41)、IL6(37)、NOS3(32)、VEGFA(32)、TNF(31)、MAPK1(31)、TP53(30)、PTGS2(29)、MAPK8(28)、IL-1β(27)和ACHE(25)。上述靶点涉及炎症反应、细胞增生和凋亡等方面,提示其可能是FCYC治疗轻度认知障碍的潜在靶点。
2.4 GO分析功能富集分析将FCYC和MCI的共同靶标上传到DAVID数据库进行GO富集分析,结果如Fig 3所示,共计得到339个BP分析条目,涉及信号转导、G-蛋白偶联受体信号通路、RNA聚合酶II启动子转录的正调控;39个CC分析条目,包括质膜整体成分、质膜整体成分、细胞核等;65个MF分析条目,包括蛋白结合、药物结合、酶结合等。
2.5 KEGG通路富集分析从KEGG通路富集分析结果中获得FCYC治疗MCI的相关途径。得到富集靶点的共94个通路,包括神经活性配体-受体相互作用、cAMP信号通路、PI3K-AKT信号通路、TNF信号通路等,提示FCYC主要通过神经系统、炎症反应等途径治疗MCI(如Fig 4所示)。
2.6 FCYC提高Aβ25-35诱导损伤的PC-12细胞活力首先通过给药不同浓度梯度的FCYC发现药品本身对PC-12细胞无明显损伤作用(P>0.05,Fig 5A);接着探究不同浓度Aβ25-35对PC-12细胞的作用,表明当在该浓度梯度范围内Aβ25-35对PC-12细胞均有损伤(P<0.01)。其中当其浓度为100 μmol·L-1时,细胞存活率约为60%,故选择该浓度进行后续细胞造模(Fig 5B)。通过预给药研究FCYC对Aβ25-35诱导PC-12细胞损伤的保护作用,结果显示,FCYC在1.562 5~100 mg·L-1浓度梯度范围内对PC-12细胞的活力均有的提升作用(P<0.01,Fig 5C)。同时,LDH毒性实验也证明,FCYC在1.562 5与6.25 mg·L-1浓度下与模型组相比均降低了LDH含量(P<0.01,Fig 5D)。接着通过JC-1探针检测了FCYC对细胞线粒体膜电位的影响,如Fig 5E所示,模型组红色荧光较空白组减弱并且绿色明显增强,说明线粒体膜电位下降,而随FCYC浓度增加,荧光强度逆转,提示细胞线粒体膜电位逐渐恢复,表明FCYC对Aβ25-35诱导PC-12细胞损伤具有明显的保护作用。
2.7 FCYC对Aβ25-35诱导PC-12细胞损伤的抗炎作用从PPI分析可知,FCYC治疗轻度认知障碍涉及IL-1β、IL-6、TNF等炎症因子,因此通过检测细胞上清液中炎症因子IL-1β、IL-6和TNF-α的水平探究FCYC对Aβ25-35诱导PC-12细胞损伤的抗炎作用。结果表明,与空白组相比,模型组IL-1β、IL-6和TNF-α的含量明显上升(P<0.01),FCYC预处理后炎症因子水平明显下降(P<0.01,Fig 6A-C),提示FCYC对Aβ25-35诱导PC-12细胞损伤有明显的抗炎作用。
2.8 FCYC对Aβ25-35诱导PC-12细胞损伤的抗凋亡作用进一步探究FCYC是否对Aβ25-35诱导PC-12细胞凋亡具有保护作用。由Fig 7A-D可知:与空白组相比,模型组细胞Bcl2/β-actin比值降低,Bax/β-actin比值升高,Bcl2/Bax蛋白表达水平明显降低;与模型组相比,FCYC明显上调Bcl2/β-actin、Bcl2/Bax比值,而下调Bax/β-actin比值(P<0.01)。免疫荧光结果显示,模型组红色荧光强度高于模型组,而FCYC预处理显著降低了红色荧光强度(Fig 7E、F),由此推断,FCYC对Aβ25-35诱导PC-12细胞损伤具有抗凋亡作用。
2.9 FCYC对PI3K/AKT信号通路的调节作用KEGG分析得知,FCYC可能通过调节PI3K/AKT信号通路治疗轻度认知障碍,因此检测了各组细胞中相关蛋白的表达。结果显示,与空白组比较,模型组细胞中p-PI3K(Y607)与p-AKT(Ser473)蛋白明显降低,而FCYC预处理后明显提高了p-PI3K与p-AKT蛋白表达(Fig 8A-C);免疫荧光结果也展现类似结果(Fig 8D)。提示,FCYC可通过调节PI3K/AKT信号通路的表达治疗轻度认知障碍。
3 讨论
轻度认知功能障碍是一种以β-淀粉样蛋白(Aβ)和神经纤维沉积为主要病理特征的神经退行性疾病,不同分型对应不同的神经系统体征,目前药物只能缓解MCI症状而无法完全阻止其发展[7]。FCYC是王永炎院士结合多年临床经验研发的中成药,适用于智力减退、思维迟钝、失眠多梦等症状。临床研究亦证明[8-9],FCYC治疗中风后MCI、血管性MCI等均有显著效果。本实验借助网络药理学手段初步探究了FCYC治疗MCI的物质基础及作用机制,数据表明该复方中含有57个活性成分可能通过66个潜在靶点发挥其治疗作用,结合FCYC全成分分析以及中药-化合物-靶点-疾病图中的对应靶点数目,综合考虑认为异鼠李素、山奈酚可能为FCYC治疗MCI的活性成分。异鼠李素能够清除自由基、减轻氧化应激、抑制炎症反应从而对抗神经功能障碍,发挥脑保护作用[10]。山奈酚及其衍生物能够抗炎、抗氧化、抗惊厥、抗抑郁、抗痴呆,其神经保护作用同样备受关注[11]。进一步通过PPI分析发现炎症因子IL-1、IL-6以及TNF是FCYC治疗MCI的关键靶点。目前也有证据阐明神经炎症在MCI的发生发展过程中发挥重要的作用,当小胶质细胞受异常物质吞噬时会释放促炎因子进一步放大炎症反应,促进神经细胞凋亡,最终致使神经元细胞的损伤[12]。因此许多学者认为保护神经元细胞免受神经炎症是治疗MCI等神经系统疾病的关键策略[13]。
PC-12细胞是一种交感神经系统细胞被广泛应用于神经系统疾病的体外研究,而Aβ作为MCI患者的主要病理特征常用于体外诱导PC-12细胞损伤作为理想模型。因此本实验利用Aβ25-35建立了PC-12细胞损伤模型,证明FCYC能够明显减轻Aβ25-35诱导的细胞损伤。实验结果表明,Aβ25-35处理后的PC-12细胞炎症因子IL-1β、IL-6以及TNF-α有明显的增加,而经过FCYC的预给药后促炎因子分泌量明显降低,这表明,FCYC可抑制神经炎症。神经炎症诱导的神经细胞凋亡是MCI发展的必然过程,这也加剧了由此产生了认知上的时间与空间障碍[14]。Bcl2和Bax是细胞凋亡主要调节蛋白,上调Bcl2或下调Bax的表达可抑制神经细胞的凋亡水平[15]。实验数据也表明FCYC可逆转Aβ25-35处理后Bcl2/Bax蛋白比例下降的趋势。以上结果提示FCYC可通过抑制神经炎症和细胞凋亡发挥治疗MCI的作用。
KEGG富集分析结果表明,PI3K/AKT信号通路是FCYC治疗MCI的关键通路。PI3K/AKT信号通路是参与神经退行性疾病调控过程的经典信号通路,其与突触可塑性、学习能力、记忆力等密切相关[16]。Zhang等[17]证明PI3K与AKT的低表达是MCI的潜在生物标志物,而AKT的激活则可能在神经保护、缓解MCI方面发挥重要作用。本实验中也发现Aβ25-35诱导后PI3K/AKT呈现低表达趋势,而FCYC预处理后p-PI3K与p-AKT表达上升,这与Wang等[18]发现通过激活海马中的PI3K/AKT信号传导可改善认知障碍的结果一致。由此证明FCYC可通过调节PI3K/AKT信号治疗MCI。
综上所述,FCYC可通过多成分、多靶点的方式对MCI协同起效;此外,FCYC可明显抑制神经炎症和神经细胞凋亡以及调控PI3K/AKT信号通过治疗MCI。本实验仍存在一定不足,在后续的实验中将在体内实验验证FCYC治疗MCI的靶点和作用机制,同时也将探讨FCYC的药效物质基础及其他相关靶点与通路。
