急性脑缺血/再灌注损伤后神经元细胞骨架蛋白的动态变化
2024-02-04付雪琴邹旭欢王漫漫王玮玮
张 勇,付雪琴,邹旭欢,王漫漫,王玮玮,兰 瑞
(1. 郑州大学第三附属医院中医科,河南 郑州 450052;2. 河南中医药大学第一临床医学院,河南 郑州 450008;3. 河南中医药大学第一附属医院脑病诊疗中心,河南 郑州 450000)
脑卒中是世界范围内人类残疾和死亡的主要原因。缺血性脑卒中可导致不同脑区域的脑损伤,引起多种表现各异的神经功能缺损[1]。越来越多的证据表明,梗死周围区域是神经元部分保持能量活动的区域,其结构和功能的变化可能有助于神经元的存活和功能恢复[2-3]。研究已发现,梗死周围区在卒中早期的重要作用,炎症、细胞凋亡和突触可塑性发生在缺血半暗带[2]。缺血介导的轴突、树突及细胞骨架蛋白的改变可能在脑损伤中发挥重要作用[4]。在急性脑缺血和再灌注期间,神经元细胞骨架的动态时间过程变化一直是大家关注的热点。本研究建立脑缺血/再灌注损伤大鼠模型,观察轴突、树突结构及神经元细胞骨架蛋白的时空变化。
1 材料
1.1 实验动物成年♂ Sprague-Dawley大鼠,SPF级,体质量230~250 g,购自郑州市惠济区华兴实验动物养殖场[生产许可证号:SCXK(豫)2019-0002]。饲养在温度(22±2)℃、湿度(55±5)%的河南省中医院SPF级动物实验中心,光照12 h/黑暗12 h,实验操作前可自由进食和饮水5 d。动物实验经河南中医药大学动物福利与伦理委员会批准(批准号:PZ-HNSZYY-2020-019),研究在河南省中医院中心实验室进行。
1.2 主要试剂微管相关蛋白2(microtubule associated protein 2,MAP2)抗体(货号:4542)、神经丝重链(neurofilament heavy chain,NF-H)抗体(货号:30564)、β-actin抗体(货号:4970)、DAPI(货号:4083),均购自Cell Signaling Technology公司;胶质纤维酸性蛋白(glial fibrillary acid protein,GFAP)抗体(货号:G6171)、神经元核抗原(neuronal nuclei antigen,NeuN)抗体(货号:MAB377),均购自Millipore公司;FITC标记山羊抗小鼠抗体(货号:GB22301)、CY3标记的山羊抗兔抗体(货号:GB21303)、HRP标记的山羊抗兔抗体(货号:GB23303),均购自武汉赛维尔生物科技有限公司;ECL显影液(货号:PE0010),购自北京索莱宝公司;尼龙线栓,购自北京沙东生物技术有限公司。
1.3 仪器Labofuge 400R低温高速离心机(美国Sigma公司);Multiskan酶标仪(Thermo Scientific公司);蛋白电泳仪、凝胶成像仪(美国BIO-RAD公司);荧光显微镜(日本Nikon公司)。
2 方法
2.1 实验分组及脑缺血/再灌注损伤模型制备实验大鼠随机分为对照组(Sham)、大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)90 min再灌注3 h组(IR3 h)、MCAO 90 min再灌注6 h组(IR6 h)、MCAO 90 min再灌注12 h组(IR12 h)、MCAO 90 min再灌注24 h组(IR24 h)、MCAO 90 min再灌注48 h(IR48 h)组。依据既往课题组采用的大脑中动脉线栓法,诱导脑缺血/再灌注损伤[5]。深度麻醉大鼠后,暴露左颈总动脉、颈外动脉和颈内动脉。统一直径的线栓推进到颈内动脉管腔,阻断大脑中动脉的起始部位,90 min后拔出线栓。假手术组大鼠不进行线栓插入。
2.2 神经行为学评价根据前期的研究,再灌注不同时间点评估神经功能缺损评分,并进行前肢放置实验[6]。对组别设盲,神经行为学评估结束后揭盲。神经功能缺损评分:0分,实验大鼠无神经功能缺损;1分,实验大鼠右前爪未完全伸展;2分,实验大鼠向左盘旋;3分,实验大鼠向左滑落;4分,实验大鼠不能移动;5分,实验大鼠死亡。1~3分的大鼠进入随后的研究。前肢放置实验方法如下:正常大鼠胡须接触桌角时引起同侧前肢放在桌面上,缺血/再灌注后,大鼠胡须接触桌角时,同侧前肢放置测试不能完成。在不同的再灌注时间点,每只大鼠触发前肢反射10次,记录触须后同侧前肢正确放置桌角的次数。
2.3 尼氏染色不同的再灌注时间点,大鼠深度麻醉下经心脏灌注预冷生理盐水、4%多聚甲醛。石蜡包埋脑组织,切成厚度为5 μm的冠状切片。参考前期的研究进行尼氏染色[7]。选取前囟后0.24 mm脑组织冠状切片脱蜡,用1%甲苯胺蓝溶液在50 ℃染色30 min。冲洗后封片,在光镜下随机观察缺血皮层、纹状体周边的细胞缺血/再灌注损伤,选择3个视野进行完整细胞计数。
2.4 免疫荧光染色取石蜡切片,经脱蜡和抗原修复后,脑切片用含0.1% Triton X-100的阻断缓冲液孵育,然后用封闭液孵育后,滴加稀释后的一抗,4 ℃冰箱孵育过夜。冲洗后,与相应的荧光二抗在室温下避光孵育1.5 h。DAPI染核后封片。荧光显微镜下观察并拍照。
2.5 免疫印迹在不同时间点再灌注,实验大鼠深度麻醉后,快速取出脑组织,分离出梗死周围皮层,提取蛋白。通过SDS-PAGE电泳分离,然后转移到PVDF膜,5%脱脂奶粉封闭后,与一抗4 ℃孵育过夜。TBST洗膜后,与HRP标记的二抗孵育90 min。洗膜后,ECL化学发光液显色。
2.6 透射电镜不同的观察节点,实验大鼠深度麻醉后,经心灌注生理盐水、4%多聚甲醛及0.5%戊二醛混合溶液。取脑梗死周围皮层组织,送至河南中医药大学电镜室进行电镜标本处理。透射电镜下观察轴突、树突、神经丝等超微结构变化。

3 结果
3.1 MCAO后再灌注不同时间点脑损伤情况Nissl染色显示(Fig 1A),随着再灌注时间的延长,脑梗死范围逐渐扩大,脑损伤加重,再灌注后24 h损伤最严重。定量分析显示(Fig 1B、C),再灌注3 h后梗死周围纹状体的完整细胞数量明显减少,细胞数量呈时间依赖性减少。值得注意的是,皮层损伤晚于纹状体,再灌注后6 h缺血皮层细胞数量明显减少,随着时间的推移,在24 h达到最低值。
3.2 MCAO后再灌注不同时间点的神经行为学功能采用神经功能缺损评分、前肢放置实验评价实验大鼠的神经行为学功能。Fig 2结果显示,再灌注3 h后,大鼠出现轻微的神经功能缺损。随着时间的推移,神经行为功能逐渐恶化。
3.3 MCAO后再灌注不同时间点MAP2蛋白的表达变化采用MAP2与GFAP/NeuN免疫荧光双染法检测MCAO后再灌注不同时间点MAP2的动态变化。结果显示(Fig 3),脑缺血/再灌注诱导MAP2免疫荧光强度降低,并且随着时间的延长,MAP2的急性丢失确定了梗死边界。MAP2与GFAP共标记表明,梗死区域MAP2、GFAP免疫荧光强度均减少,存在共染部分。然而,MAP2的免疫荧光强度在梗死周围区域降低,GFAP的荧光强度增加,提示活化的星形胶质细胞在梗死周围累积。MAP2与NeuN的共标记显示(Fig 4),脑缺血/再灌注梗死及周围皮层MAP2、NeuN共染细胞明显减少,提示神经元在梗死区丢失死亡,在梗死周围区域出现明显的缺血/再灌注损伤。
3.4 MCAO后再灌注不同时间点NF-H蛋白的表达变化采用NF-H与GFAP/NeuN免疫荧光双染法观察NF-H的动态改变。Fig 5、6结果显示,脑缺血/再灌注后缺血区、梗死区的NF-H荧光强度增强,12 h后明显升高。梗死周围区域NF-H免疫阳性细胞的形态异常,免疫信号断续。不同区域的NF-H相关免疫荧光强度不同。NF-H与GFAP免疫荧光双染显示,脑缺血/再灌注后NF-H与星形胶质细胞存在部分共染,提示NF-H与星形胶质细胞可能存在相互作用。NF-H与NeuN免疫共染显示,脑缺血/再灌注后NF-H与神经元突起,部分与树突明显不连续。
3.5 MCAO后再灌注不同时间点的轴突、树突和细胞骨架变化采用电镜、Western blot法观察再灌注不同时间点的缺血皮层神经元细胞骨架变化。

Fig 1 Nissl-stained images and quantitative analysis of intact cells at different regions after MCAO and

Fig 2 Neurological function tests after MCAO and

Fig 3 Double immunofluorescence labeling of MAP2 (red) and GFAP (green) in ratmodels of MCAO and reperfusion
Fig 7结果显示,脑缺血/再灌注后细胞骨架成分,如微管、神经丝排列受损。缺血皮层轴突神经丝密度明显降低,电子密度降低,树突肿胀。免疫荧光结果显示,假手术组MAP2、NF-H免疫阳性细胞形态正常,排列规律。然而,再灌注24 h可见肿胀、不连续的微管和神经丝。与上述观察结果一致,Western blot也证实,与假手术组相比,再灌注12、24、48 h后,MAP2和NF-H蛋白水平明显降低。
4 讨论
当动脉血流突然停止或下降至不合适的量时,相应的动脉供应区脑组织会发生细胞凋亡[8]、坏死[9]、铁死亡[10]、自噬[11]、炎症、氧化应激[12]等一系列事件,并进一步导致不可挽回的脑损伤[13]。缺血半暗带是急需被挽救的重要区域,保护缺血半暗带可减少缺血后的神经功能缺损,并有助于神经功能的改善[14-15]。MCAO法可成功建立梗死区、缺血半暗带区,并模拟大动脉梗死的病理生理过程,是研究脑缺血/再灌注脑损伤最广泛使用的模型[11]。本研究成功建立大脑中动脉闭塞再灌注损伤模型,动态观察MCAO 90 min再灌注3~48 h后,神经功能缺损、细胞损伤。Nissl染色发现,脑缺血/再灌注3 h纹状体区神经细胞呈现出缺血/再灌注损伤征象,而皮层的损伤出现较晚,随着再灌注时间的延长,梗死区逐渐扩大,缺血半暗带区完整神经细胞数减少,24 h的损伤最重。神经行为学评分结果表明,脑缺血/再灌注后大鼠的神经功能逐渐恶化,与梗死周围区完整细胞的数量、梗死面积一致。

Fig 4 Double immunofluorescence labeling of MAP2 (red) and NeuN (green) in rat models of MCAO and reperfusion
MAP2与NF-H是神经元细胞骨架蛋白,参与维持神经细胞完整性和稳定性[4],并调节轴突转运、突触功能,影响神经元的功能[16]。脑缺血后,神经元细胞骨架的影响被认为是缺血病变从可逆性损伤至不可逆组织损伤演变的一个关键机制[17]。脑缺血发生后,神经元最易发生损伤,目前神经丝蛋白NF-L、MAP2、磷酸化NF-H外周水平被证明为脑损伤及神经元破坏的敏感标志物,与脑卒中患者的临床结局有关。值得注意的是,神经骨架蛋白迄今为止未被深入研究并考虑为神经保护的潜在靶点[16,18]。既往的报道多采用脑缺血1个时间点的观察,不同的是,本研究采用免疫荧光染色、免疫印迹、透射电镜等多种实验方法,系统研究缺血/再灌注急性期不同时点神经元骨架蛋白的改变,有助于明确缺血性脑卒中的发病机制和探寻神经保护的作用靶点。本研究发现,MCAO后再灌注6 h,缺血区域MAP2的免疫反应性下降,随着时间的发展,MAP2免疫信号减少的区域逐渐扩大,提示梗死面积增加;再灌注12 h及更晚的观察时间点,MAP2急性丢失并出现明显的梗死-缺血边界,这与先前文献报道的缺血诱导的MAP2早期丢失一致[4,16]。同时,对比Nissl染色发现,MAP2染色更早、更准确反映缺血与梗死区域界限及细胞的形态变化。然而,本研究还发现脑缺血/再灌注12 h后,在梗死及缺血区域NF-H免疫反应性明显增强,与文献结果不太一致,可能是选用的动物及模型不同,而NF-H相关免疫强度增加,可能由于脑缺血/再灌注后与NF-H降解形成的小片段相结合导致。值得注意的是,脑缺血/再灌注后NF-H结构完整性被破坏,随后的免疫印迹结果提示,缺血半暗带皮层MAP2、NF-H蛋白水平呈现时间依赖性下调。为进一步获得脑缺血/再灌注导致的神经元细胞骨架亚显微结构变化,透射电镜观察轴突、树突结构、神经丝密度,发现缺血半暗带皮层神经丝肿胀、密度降低,轴突、树突数量减低,周围组织水肿,结构损害。超微结构的改变可能与观察到的缺血/再灌注后MAP2、NF-H水平下降相关。以上结果均提示,在脑缺血/再灌注后,神经细胞骨架蛋白可能是缺血/再灌注损伤的神经保护潜在靶点。

Fig 5 Double immunofluorescence labeling of NF-H (red) and GFAP (green) in rat models of MCAO and reperfusion

Fig 6 Double immunofluorescence labeling of NF-H (red) and NeuN (green) in ratmodelsof MCAO and reperfusion
本研究进行脑缺血/再灌注后细胞损伤、行为学、神经元细胞骨架蛋白纵向现象描述,通过设立不同的再灌注时间点,在蛋白、超微结构等水平揭示了脑缺血/再灌注后神经细胞骨架的动态损伤,轴突、树突、神经丝的破坏,缺血半暗带区完整细胞的下降,这些可能与神经行为学的恶化、脑损伤逐渐加重密切相关。脑缺血/再灌注早期神经元细胞骨架蛋白可能是未来治疗的靶点。随后研究需要将时间点扩展至更长时间,进一步观察神经元细胞骨架蛋白变化,并探索相关的潜在机制,同时探讨缺血/再灌注后如何保持神经细胞骨架的完整性。
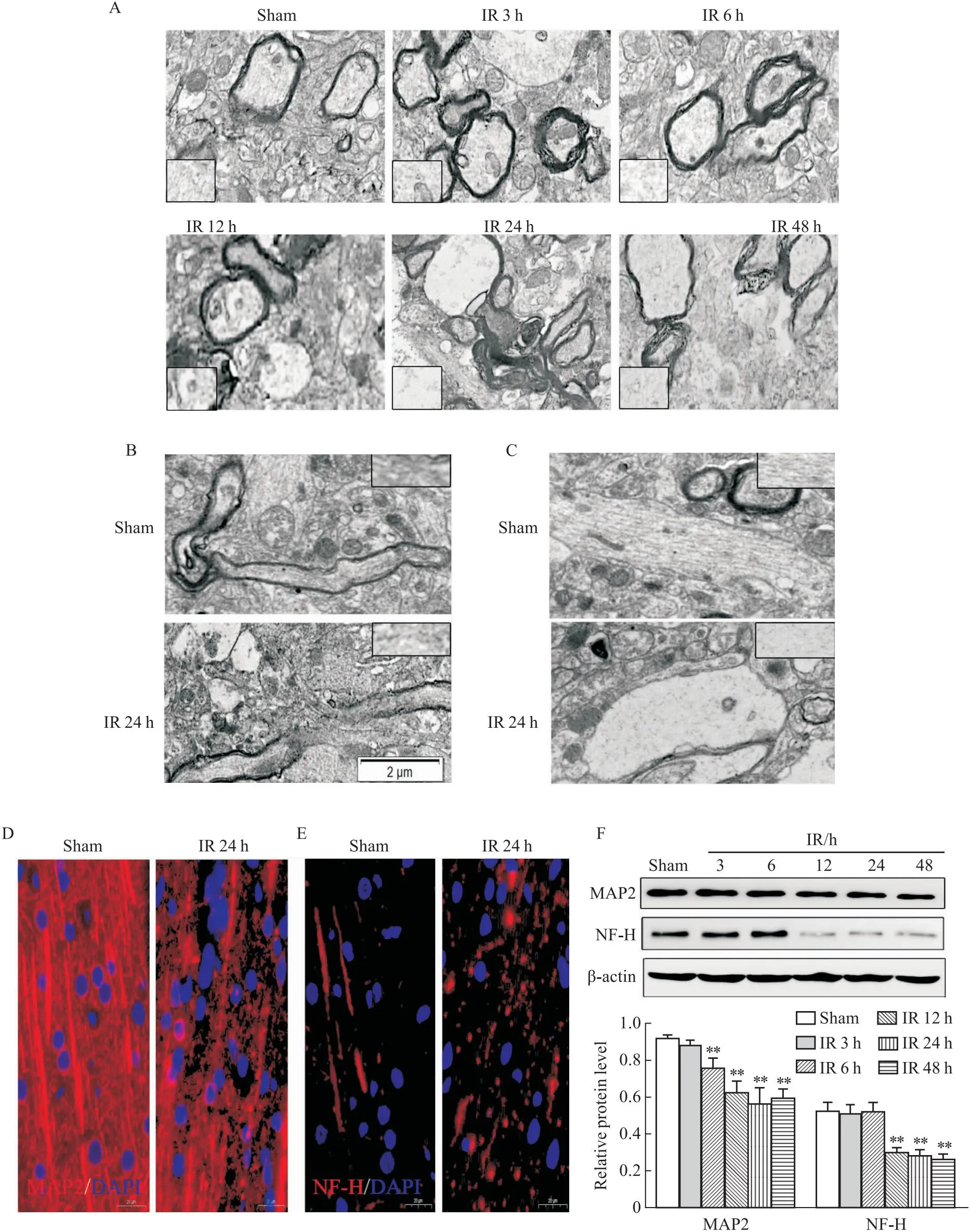
Fig 7 Alterations of axons and dendrites and MAP2/NF-H expression following MCAO and
