下调METTL5通过Wnt/β-catenin信号通路抑制三阴乳腺癌细胞增殖、迁移与侵袭
2024-02-04吴坤琳严乾壹王德星缪秀英张惠灏
吴坤琳,严乾壹,王德星,缪秀英,张惠灏
(福建医科大学附属第一医院 1. 甲状腺乳腺外科、2. 滨海院区国家区域医疗中心综合外科二区,3. 福建医科大学第一临床医学院,福建 福州 350005)
三阴乳腺癌(triple negative breast cancer,TNBC)是乳腺癌的一类分子亚型,其特征为缺乏雌激素受体、孕酮受体和人类表皮生长因子2型受体[1]。TNBC在年轻女性中发病率更高,约占所有乳腺癌病例的10%~20%,且比非TNBC更容易复发和转移[2-3]。因此,研究TNBC发生和发展的潜在机制,识别风险和预后生物标志物,对提高TNBC的早期检测和有效治疗具有重要意义。
N6-甲基腺苷(N6-methyladenosine,m6A)酶能通过使mRNA的碱基发生m6A甲基化修饰,其在肿瘤的发生、发展和命运等生物学过程中发挥重要作用。如甲基转移酶3(methyltransferase-like 3,METTL3)、肥胖相关蛋白、YTH结构域家族蛋白2等m6A酶已被发现在多种肿瘤中失调[4]。甲基转移酶5(methyltransferase-like 5,METTL5)作为核糖体RNA(rRNA)N6-甲基转移酶,可通过修饰18S rRNA的A1832位点,增强核糖体蛋白S6激酶的活性和翻译促进乳腺癌细胞的增殖[5]。METTL5可通过促进c-Myc的翻译来促进胰腺癌细胞增殖、迁移和侵袭[6]。此外,METTL5在肝细胞癌中上调并与不良预后相关[7]。这些研究表明,METTL5可能在肿瘤的发生和发展中起重要作用。而,METTL5在TNBC中的表达及作用仍然未知。因此,本研究探讨了METTL5在TNBC中的表达、功能和潜在的机制。
1 材料与方法
1.1 材料
1.1.1主要试剂 胎牛血清(#FSD500)购自苏州依科赛生物科技股份有限公司;DEME培养基(#E600003-0500)、青霉素/链霉素双抗溶液(#B540732-0010)和免疫组化试剂盒(#D601037-0050)购自生工生物工程(上海)股份有限公司;甲基转移酶5(methyltransferase-like 5,METTL5;#HPA038223)抗体购自瑞典Atlas Antibodies公司;基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2;#ab86607)、β-连环蛋白(β-catenin;#ab32572)、N-钙黏蛋白(N-cadherin;#ab76011)抗体购自英国Abcam公司;MMP-7(#3801S)和细胞周期蛋白D1(Cyclin D1,#2978S)抗体购自美国CST公司;GAPDH抗体(#APR28867N)和HRP-羊抗兔IgG(H+L)二抗(#ASG032N)购自艾柏森(北京)生物科技有限公司;METTL5 shRNA慢病毒颗粒(shRNA-METTL5;#sc-95031-V)、阴性对照shRNA慢病毒颗粒(shRNA-NC;sc-108080)、聚凝胺(#sc-134220)和RIPA裂解液(#sc-24948)购自美国Santa Cruz Biotechnology公司;细胞计数试剂盒(Cell Counting Kit-8,CCK-8)试剂盒(#BN15201)购自北京拜尔迪生物技术有限公司。
1.1.2主要仪器 SpectraMax iD3 多功能酶标仪(美国Molecular Devices公司);Tanon V8蛋白质印迹仪(上海天能科技有限公司);SH-Advance 523 蛋白印迹电化学发光成像系统(杭州申花科技有限公司);DM2000LED显微镜(德国Leica公司)。
1.1.3细胞系与细胞培养 人正常乳腺细胞系MCF-10A、乳腺癌细胞系BT-549、Hs578t、MDA-MB436、SKBR-3和MCF-7均购自中国科学院上海细胞库。将细胞在含10%胎牛血清和双抗(100 kU·L-1青霉素、0.1 mg·L-1链霉素)的DMEM培养基培养,3 d换液1次,细胞90%铺满瓶底按1 ∶3传代。
1.1.4临床组织样本 2020年2月~2022年5月收集福建医科大学附属第一医院甲状腺乳腺外科行肿瘤切除术的39例女性乳腺癌患者的组织标本(包括TNBC组织标本、非TNBC组织标本以及各自对应的远端正常乳腺组织)。本研究获得了福建医科大学附属第一医院伦理委员会审核批准,并获得了所有患者的签订的知情同意书。所有患者年龄为41~73岁;临床分期为Ⅱa~Ⅲb;乳腺癌起源类型:34例为乳腺导管癌,5例为乳腺小叶癌;病理分型:8例为TNBC、31例为非TNBC。纳入标准为符合手术指征,首次确诊,未进行过相关治疗,同意本研究。
1.2 方法
1.2.1免疫组织化学染色 取临床组织样本石蜡包埋,组织切片(5 μm厚),脱蜡水化后,3% H2O2阻断内源性过氧化物酶10 min,10%山羊血清封闭20 min。切片与METTL5(1 ∶500)抗体在4 ℃过夜,洗涤后,按照试剂盒步骤按SABC法进行免疫组化染色,用DAB显示阳性染色,苏木精复染后,DM2000LED显微镜下随机拍摄5个视野的染色图,用ImageJ软件自动分析免疫组化的阳性表达情况。
1.2.2细胞转染 按照shRNA慢病毒颗粒转染试剂说明书,在转染前1 d将BT-549和MDA-MB436以2×105个/孔铺板至6孔板中,次日,更换为无血清和双抗的培养基孵8 h,然后更换为含10 mg·L-1聚凝胺的无血清培养基,分别加入终浓度为5×104IFU的shRNA-METTL5或shRNA-NC,37 ℃孵育8 h,更换为正常DMEM培养基培养48 h,收集细胞用Western blot检验转染效果后,将细胞用于后续实验。
1.2.3CCK-8法检测细胞的增殖活性 将转染后的细胞按每孔5×103个铺在96孔板中,分别培养1~4 d后,加入10 μL CCK-8溶液在37 ℃和5% CO2下孵育2 h。SpectraMax iD3 多功能酶标仪上读取波长450 nm处的吸光度值,每组5个复孔,实验重复3次。
1.2.4集落形成试验 将转染后的细胞按每孔1×103个密度铺在6孔板中。常规培养14 d,用多聚甲醛固定细胞,用0.1%结晶紫染色后,拍摄细胞集落并计数。
1.2.5伤口愈合试验 将转染后的细胞接种在6孔板中,直到单层汇合达到90%。使用无菌200 μL移液管尖在孔表面划一道划痕,PBS清洗掉痕迹上划伤的细胞,用含0.2%胎牛血清的培养基培养细胞,用数码相机在DM2000LED显微镜下的相同位置于划痕后0和24 h对6孔板的平板拍照。
1.2.6Transwell实验 用Transwell法检测细胞迁移与侵袭。迁移检测实验:用含3%BSA的培养基(用于维持Transwell培养小室上下界面的渗透压)的培养液重悬细胞,取1×104个细胞接种于Transwell小室上室(总体积200 μL),下室中加含10%胎牛血清的培养液600 μL;将24孔板置于37 ℃、5% CO2、饱和湿度的培养箱内孵育24 h,弃去培养液,用PBS洗2次,4%多聚甲醛固定20 min,用棉签擦拭小室上室内表面,加入0.1%结晶紫染液染色30 min;DM2000LED显微镜下观察细胞并拍照。侵袭检测实验除了使用的Transwell板小室的滤膜是被基质胶包被的外,步骤与迁移检测实验一致。以穿膜的细胞数差异代表细胞迁移或侵袭的改变。每张膜选5个视野,计算平均细胞数,每组重复3孔。
1.2.7蛋白质印迹实验 用RIPA裂解液从培养的细胞中提取总蛋白,在将其加热变性后,然后在Tanon V8蛋白质印迹仪中进行SDS-PAGE蛋白分离并转移到PVDF膜上。在5%脱脂牛奶中封闭后,分别使用一抗METTL5(1 ∶1 000)、MMP-2(1 ∶2 000)、MMP-7(1 ∶2 000)、Cyclin B(1 ∶1000)及Cyclin D1(1 ∶1000)、β-catenin(1 ∶3000)、N-cadherin(1 ∶2 000)以及GAPDH(1 ∶6 000)4 ℃孵育过夜,洗膜后,使用二抗HRP-羊抗兔IgG(1 ∶2 000)孵育2 h。用ECL使电泳条带显像,并用SH-Advance 523蛋白印迹电化学发光成像系统观察蛋白条带和对条带相对光密度进行量化。
1.2.8体内成瘤实验 雄性BALB/c裸鼠(6周龄,SPF级,19~21 g)购买于苏州赛业生物科技有限公司(生产许可证号:SCXK(苏)2022-0016),在福建医科大学实验动物中心SPF级动物房[使用许可证号:SYXK(闽)2022-0004]中常规饲养3 d后,将其分为shRNA-METTL5组和shRNA-NC组,每组6只裸鼠。用100 μL PBS配置的细胞悬浮液(含1106个细胞,分别为转染shRNA-METTL5或shRNA-NC后的BT-549细胞)皮下注射到对应各组裸鼠的皮下,每5 d监测一次肿瘤大小。3周后,麻醉裸鼠,取出瘤体,按上述“1.2.1”方法免疫组化检测瘤体组织中METTL5、MMP-2、β-catenin和N-cadherin表达。动物实验都严格按照实验动物护理和使用指南进行。

2 结果
2.1 临床TNBC组织中METTL5表达情况对收集的正常乳腺组织、非TNBC及TNBC患者的肿瘤组织进行免疫组化检测,结果如Fig 1所示,与正常乳腺组织比较,非TNBC及TNBC组织中METTL5表达均上调(P<0.01),其中TNBC组织中METTL5表达高于非TNBC组织(P<0.01)。
2.2 敲降METTL5抑制TNBC细胞增殖Western blot检测不同细胞系中METTL5表达(Fig 2A),与正常人乳腺上皮细胞系MCF-10A比较,非TNBC细胞系(SKBR-3和MCF-7)和TNBC细胞系(BT-549、Hs578t和MDA-MB-436)中的METTL5表达增加(P<0.01),其中TNBC细胞系中表达高于非TNBC细胞系(P<0.01)。将shRNA-METTL5或shRNA-NC转染入BT-549和MDA-MB436细胞,与shRNA-NC转染组相比,shRNA-METTL5组具有较低的METTL5 mRNA表达水平(Fig 2B,P<0.01)。CCK-8(Fig 2C)和集落形成(Fig 2D)实验的结果显示,敲降METTL5抑制TNBC细胞增殖活性和集落形成能力(P<0.01)。
2.3 敲降METTL5抑制TNBC细胞的迁移和侵袭伤口愈合试验检测细胞迁移能力(Fig 3A),转染shRNA-METTL5组的BT-549和MDA-MB-436细胞的伤口愈合迁移距离明显缩短。Transwell迁移/侵袭实验分析(Fig 3B、C),与转染shRNA-NC组的BT-549和MDA-MB-436细胞相比,转染shRNA-METTL5组的细胞迁移细胞数和侵袭细胞数减少(P<0.01)。
2.4 敲降METTL5抑制Wnt/β-catenin信号通路的激活Western blot分析显示(Fig 4),敲降METTL5显著下调BT-549和MDA-MB-436细胞中Wnt信号通路的关键蛋白β-catenin的表达(P<0.01),同时,Wnt信号通路下游MMP-2、MMP-7、Cyclin D1和N-cadherin的表达水平也随着降低(均P<0.01),但Cyclin B的表达量未明显改变(P>0.05)。
2.5 敲降METTL5抑制TNBC体内肿瘤生长将稳定转染shRNA-NC和shRNA-METTL5的BT-549细胞注射在裸鼠皮下建立异种移植瘤。结果表明,shRNA-METTL5组肿瘤的体积小(Fig 5A),瘤体生长较shRNA-NC组慢(Fig 5B)。免疫组织化学染色的结果(Fig 5C)显示敲降METTL5降低了移植瘤组织中METTL5、MMP-2、β-catenin、N-cadherin的表达。这些数据表明敲降METTL5减弱了体内TNBC肿瘤的生长和瘤体组织中Wnt/β-catenin信号活性。
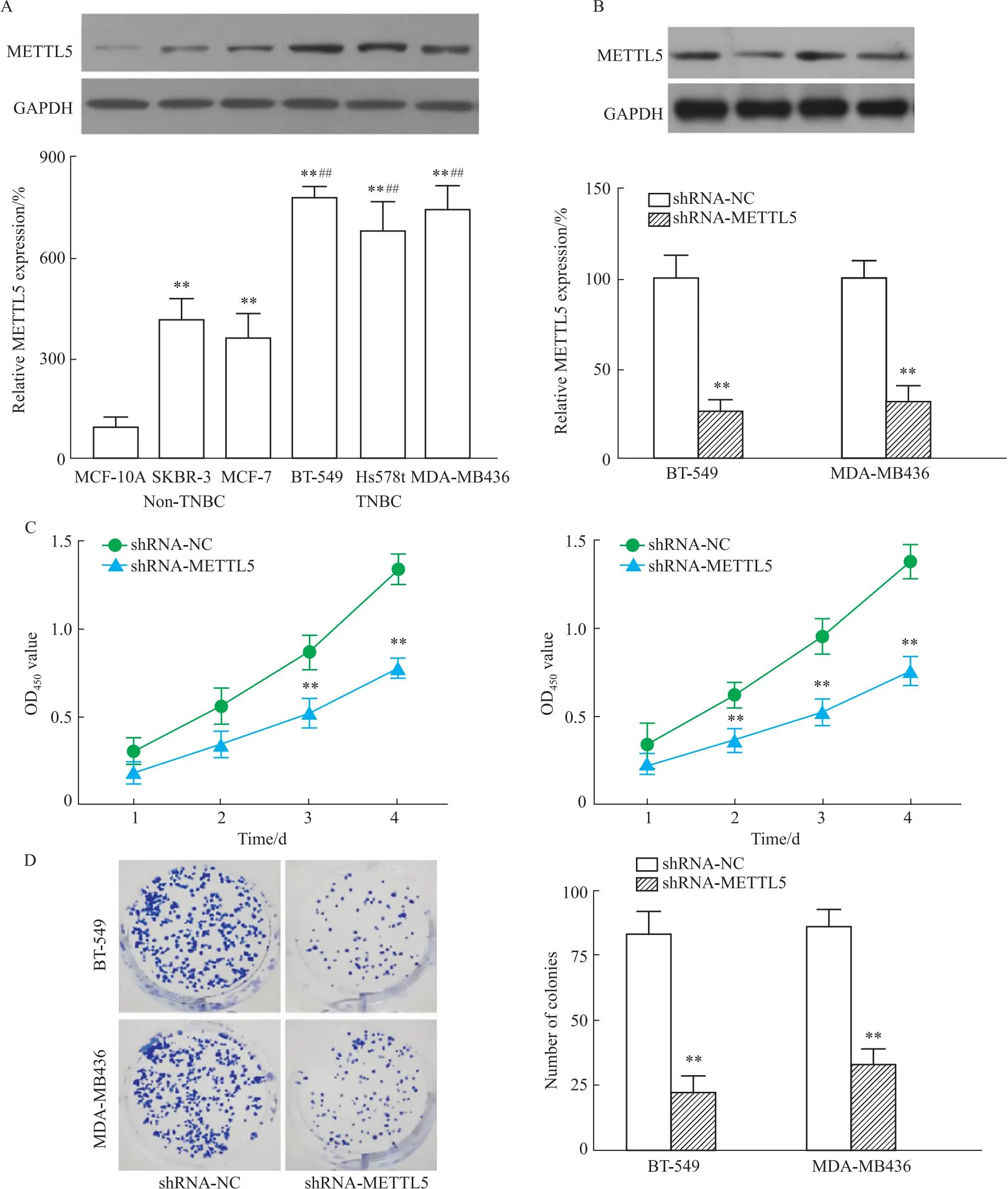
Fig 2 Knockdown of METTL5 inhibited TNBC cell proliferation n=3)
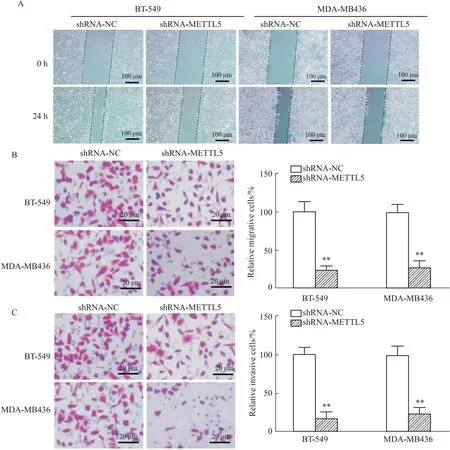
Fig 3 Knockdown of METTL5 inhibited TNBC cell migration and n=3)
3 讨论
TNBC是一种死亡率很高的恶性肿瘤,有效的治疗方案很少[1-2, 8],因此,迫切需要寻找新的TNBC的诊疗生物学标记物。METTL5已被报道在肝癌、胰腺癌与胃癌等多种肿瘤中高表达,且能促进上述肿瘤细胞的恶性生物学行为[6-7, 9],但其在TNBC中的表达和功能仍不清楚。本研究显示METTL5是一种在乳腺癌中异常增高的rRNA m6A甲基转移酶,且在TNBC癌组织中的表达比非TNBC癌组织中更高,这一结果不仅重现以前报道METTL5在乳腺癌中高表达的结果[5],而且提示METTL5可能作为TNBC诊断和治疗评估的一个新的生物标志物。此外,本研究还显示METTL5在TNBC细胞系表达高于非TNBC细胞系,敲降METTL5能抑制TNBC细胞的增殖、迁移和侵袭。这些结果提示METTL5表达与TNBC进展以及此病的不利临床结局可能有关。
本研究进一步探讨了METTL5在TNBC中异常表达对TNBC恶性生物学行为调节的可能机制。此前进行的GSEA分析显示,METTL5表达与如MAPK、JAK-STAT、Wnt和mTOR等一些致癌信号通路有关[10]。Wnt/β-catenin信号通路在TNBC中至关重要,它对TNBC的肿瘤发生、预后和耐药有重要影响[11]。本研究发现METTL5下调能降低TNBC细胞中β-catenin及Wnt下游靶分子Cyclin D1、MMP-2和MMP-7的表达。β-catenin是Wnt通路中的关键靶分子,它可以易位到细胞核并刺激Wnt靶分子如Cyclin D1和MMP-7的表达[12]。在TNBC患者中,β-catenin阳性患者的生存期明显短于β-catenin阴性患者,并显示其是恶性转化的关键驱动因素[13]。MMP-2和MMP-7属于基质金属蛋白酶家族,其通过降解细胞外基质的各种蛋白质成分在TNBC中起关键作用[14]。因此,推测METTL5可通过激活Wnt信号通路在TNBC癌中充当癌基因。但METTL5也可能会通过多种不同的机制调节TNBC的进展,此需进一步的研究以获得更全面的了解。

Fig 4 Knockdown of METTL5 inhibited activity of Wnt/β-catenin signaling pathway n=3)
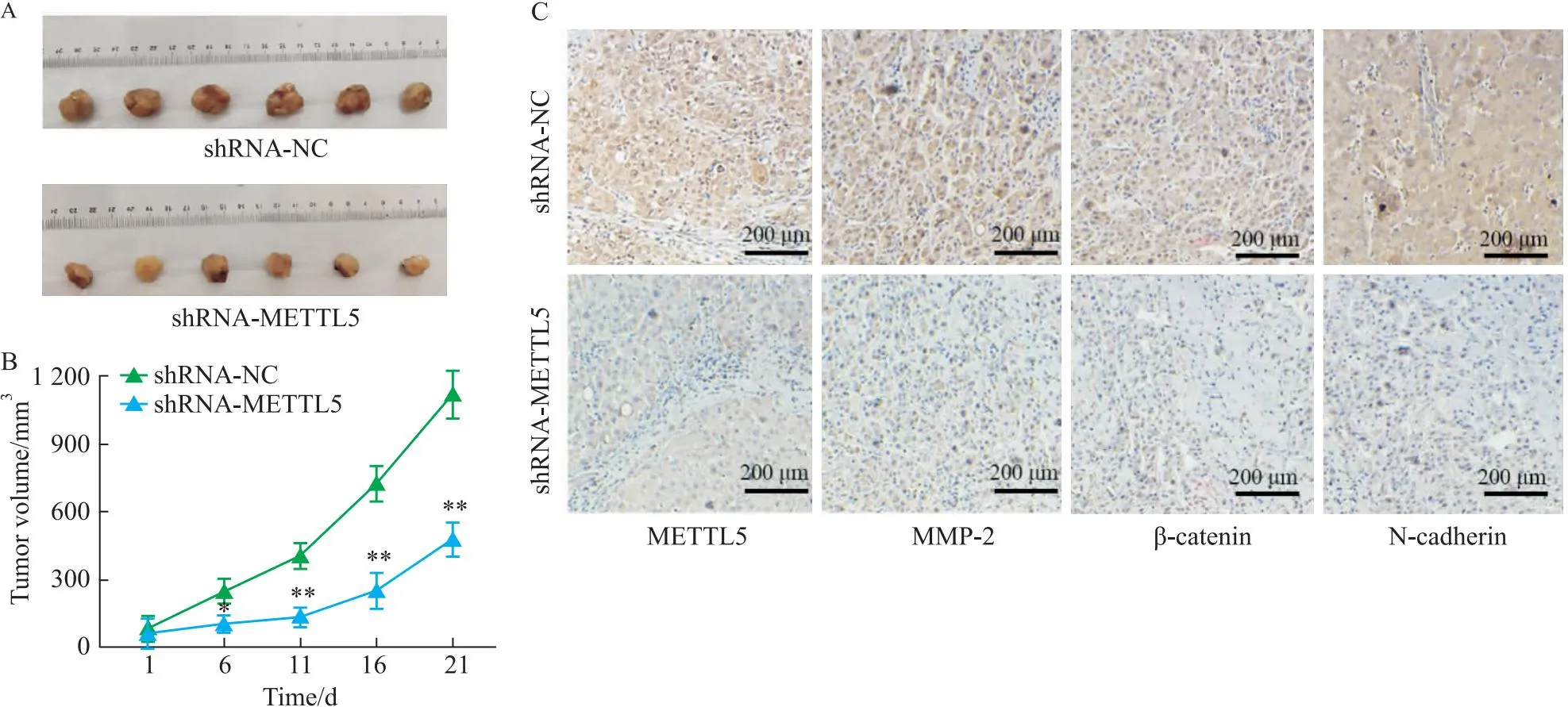
Fig 5 Knockdown of METTL5 reduced growth of TNBC tumors and Wnt/β-catenin signaling activity in tumor tissues in vivo n=6)
综上所述,本研究表明,METTL5是一种新的TNBC的癌基因,可在TNBC中普遍上调并促进肿瘤细胞增殖和侵袭;Wnt/β-catenin信号轴可能在调控METTL5诱导的TNBC细胞恶性行为中起重要作用。因此,本研究为METTL5蛋白在TNBC发生和发展中的作用提供了新的视角,其可能在TNBC中具有潜在治疗价值。
