高迁移率族蛋白B1对树突状细胞表型、吞噬功能及ERK/JNK/P38 MAPK信号通路的影响
2024-02-04陈颖颖牟志向胡小龙张艺艳翁娇青吕佩瑜关天俊
陈颖颖,陈 兰,牟志向,胡小龙,张艺艳,翁娇青,吕佩瑜,关天俊
(1. 厦门大学附属中山医院肾内科,2 厦门市血液透析质量控制中心,3.厦门市卫生健康委员会医政处,4. 厦门大学附属中山医院药学部,福建 厦门 361004)
慢性肾脏病(chronic kidney disease, CKD)是指持续性的(>3个月)肾脏结构和功能异常,目前已成为威胁人类健康的重要疾病之一。据估计,全球CKD患病率约为13.4%[1]。既往研究发现,潜在的慢性肾损伤可增加继发感染的风险,进而加重肾损伤并提高临床死亡率[2-3]。糖尿病、高血压、慢性肾炎、心力衰竭、长期用药和自身免疫性疾病是CKD的常见诱因[4]。此外,多项研究表明,免疫反应异常是导致CKD进展的重要因素。因此,调控免疫稳态对CKD的治疗具有重要意义。
树突状细胞(dendritic cells,DCs)是骨髓来源的抗原提呈细胞,在免疫反应的启动中起关键作用,其主要功能是通过细胞表面或胞内受体识别、捕获和加工抗原,并将其提呈给初始 T 细胞,从而激活适应性免疫应答。越来越多的证据表明,DCs与多种疾病的发生发展密切相关,如皮肤疾病、肠道疾病、肺部疾病、脑部疾病[5]等。前期研究发现,DCs在健康人群中大量存在,而在CKD患者中其数量明显减少[6]。因此,靶向DCs 可维持体内免疫平衡,从而为CKD提供新的治疗手段。
高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种参与染色质重塑和DNA重组修复过程的功能性蛋白[7]。HMGB1可从细胞质转运至细胞核从而在各种类型的细胞死亡如凋亡、焦亡、自噬等中发挥重要作用[8]。此外,HMGB1可作为损伤相关分子模式发挥促炎作用并通过与各种受体相互作用进而介导免疫反应[9]。既往研究表明HMGB1广泛参与多种肾脏疾病[10-11]。且有文献表明,HMGB1可参与调控DCs成熟和功能[12]。
本次研究旨在探究HMGB1对硫酸吲哚酚(indoxyl sulfate ,IS)诱导的人原代DCs表型及功能成熟的影响。
1 材料与方法
1.1 材料淋巴细胞分离液、RPMI 1640培养基购自江苏凯基生物技术股份有限公司;胎牛血清购自赛默飞世尔科技有限公司;重组人GM-CSF和重组人IL-4购自美国R&D Systems公司;IS购自美国GlpBio公司;HMGB1因子购自爱必信(上海)生物科技有限公司;anti-HMGB1购自美国Proteintech公司;FITC标记的Dextran购自美国MedChemExpress公司;RIPA裂解液、BCA蛋白定量试剂盒、HPR标记的羊抗兔二抗购自合肥Biosharp公司;多聚甲醛由美国Sigma公司提供;Triton X-100溶液、牛血清白蛋白购自德国BioFROXX公司;Hoechst 33258、抗荧光猝灭封片液购自上海碧云天生物科技有限公司;鼠抗人FITC-CD83、APC-CD86购自美国BioLegend公司;兔源磷酸化ERK1/2(p-ERK1/2)、ERK1/2、p38、JNK购自美国Proteintech公司;p-p38、p-JNK购自美国Affinity Biosciences公司;兔源β-actin、Cy3标记驴抗兔IgG购自武汉Servicebio公司;ECL发光液购自美国Millipore公司;FACSAriaTMIII流式细胞仪购自美国BD公司;一体式化学发光成像仪购自美国BioRad公司;倒置显微镜购自德国Leica公司;SPSS 22.0软件购自美国IBM公司。
1.2 方法
1.2.1原代细胞培养、处理与分组 收集肾功能正常(无免疫性疾病)健康志愿者外周血20 mL,经淋巴细胞分离液密度梯度离心后采用免疫磁珠法分离人外周血CD14+单核细胞。用含10%胎牛血清、100 μg·L-1重组人GM-CSF和50 μg·L-1重组人IL-4的RPMI 1640培养基调整细胞浓度至1×109L-1。3~4 d后换半量培养液,诱导培养6 d后收获不成熟的人外周血单核细胞来源DCs[13]。
分别以30、300、600 μmol·L-1IS干预人原代DCs 24 h[14],分为Control组、IS-30组、IS-300组、IS-600组。于倒置显微镜下观察细胞形态变化。
细胞经600 μmol·L-1IS干预24 h后,加入1 mg·L-1anti-HMGB1;或经1 mg·L-1HMGB1单独处理后分为Control组、IS组、HMGB1组、IS+anti-HMGB1组。倒置显微镜下观察细胞形态变化。
1.2.2流式细胞术检测细胞表型 收集各实验分组DCs,经PBS洗涤2次后,调整细胞浓度至1×109L-1。分别加入5 μL FITC-CD83或APC-CD86,4 ℃避光孵育30 min。1 000 r·min-1离心10 min后用PBS洗涤2次。重悬于PBS后用FACSAriaTMIII流式细胞仪检测,CeI1Quest软件分析检测结果。
1.2.3流式细胞仪检测细胞吞噬功能 收集各实验分组DCs,经PBS洗涤2次后,调整细胞浓度至1×109L-1。加入1.13 μmol·L-1FITC标记的Dextran,4 ℃避光孵育30 min。1 000 r·min-1离心10 min后用PBS洗涤2次。重悬于PBS后用FACSAriaTMIII流式细胞仪检测,CeI1Quest软件分析检测结果。
1.2.4蛋白质印迹分析(Western blot) 收集各实验分组细胞,调整细胞数为5×104个/孔,加至24孔板,弃上清,PBS洗涤。每组设置3个重复,每个重复3个复孔。经RIPA裂解液提取蛋白后,使用BCA法检测其浓度。取35 μg蛋白经10% SDS-PAGE分离后转至PVDF膜。将一抗与经5%牛血清白蛋白封闭后的PVDF膜于4 ℃下孵育过夜,洗膜后加入二抗室温孵育1 h。利用ECL发光试剂盒检测目的蛋白的存在。
1.2.5免疫荧光检测 利用4%多聚甲醛和0.5% Triton X-100分别对处理后的DCs进行固定和透化处理。经5% 牛血清白蛋白封闭后,4 ℃下与兔源ERK、p-ERK、p38、p-p38、JNK、p-JNK抗体孵育过夜,并与Cy3标记驴抗兔IgG 37 ℃孵育1 h。PBS洗涤后,加入Hoechst33258室温避光孵育10 min。抗荧光猝灭封片液封片后置于荧光显微镜观察。
2 结果
2.1 IS增加CD83+和CD86+细胞数流式细胞分析检测结果表明,与Control组比较,经不同浓度IS(30、300、600 μmol·L-1)处理后,DCs细胞中CD83+和CD86+表达明显升高;且CD83+和CD86+细胞数随IS浓度增加而增加,呈现剂量依赖性(Fig 1A,B)。
2.2 IS抑制DCs吞噬功能如Fig 2A所示,Control组细胞半悬浮生长,形态呈球形,均匀一致。给予IS刺激后胞浆增多,形态不规则,可见细胞集落,且变化有剂量依赖性。此外,经流式细胞分析检测发现,与Control组相较,随IS浓度增加,DCs的吞噬能力逐渐下降(Fig 2B)。由此,选用600 μmol·L-1IS进行后续实验。
2.3 拮抗HMGB1减少IS诱导的DCs CD83+和CD86+细胞数流式细胞分析检测结果表明,经IS或HMGB1因子诱导后,CD83+和CD86+细胞数增加;与IS组相比,IS+anti-HMGB1组的CD83+和CD86+细胞数明显减少(Fig 3A,B)。
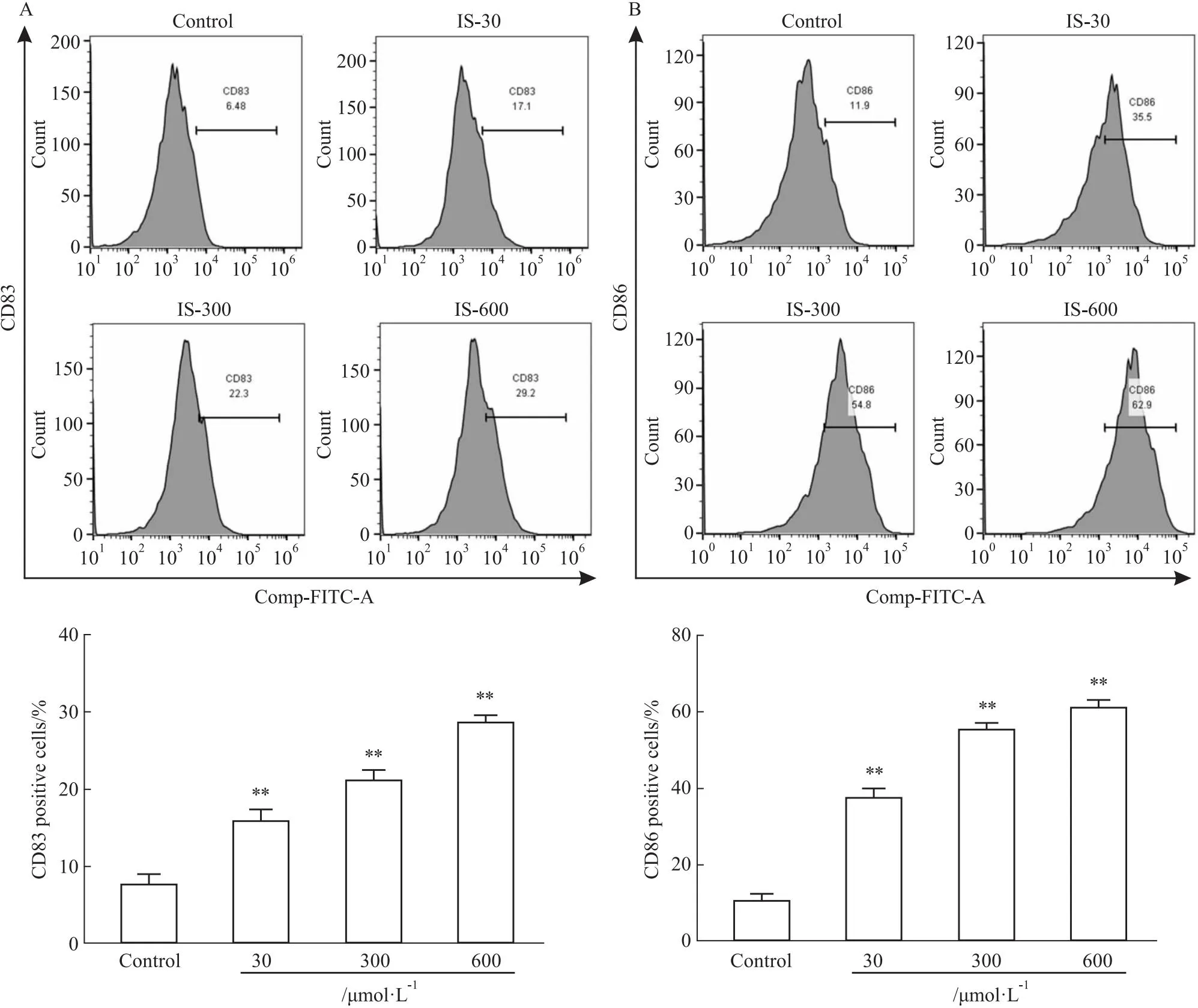
Fig 1 IS increased CD83+ andCD86+-positive cells in

Fig 2 IS suppressed phagocytosis of
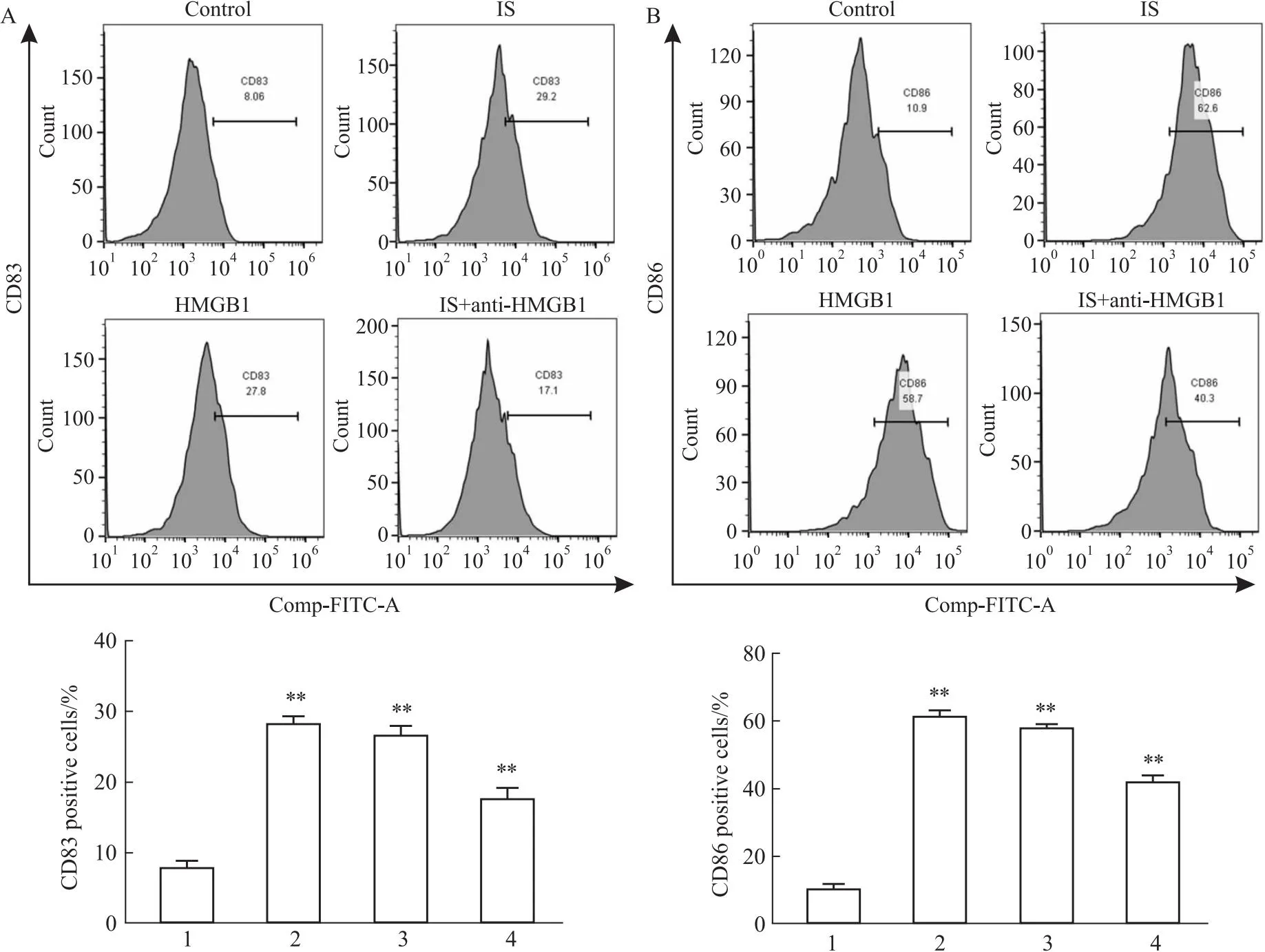
Fig 3 Anti-HMGB1 reduced CD83+ and CD86+-positive cells in IS-induced
2.4 拮抗HMGB1增强IS诱导的DCs吞噬功能如Fig 4A所示,经IS或HMGB1因子刺激后DCs胞浆增多,形态不规则,可见细胞集落。而IS+anti-HMGB1组较IS组细胞形态改变得以恢复。与Control相比,给予IS或 HMGB1刺激后DCs细胞的吞噬能力明显减弱;与IS组相比,IS+anti-HMGB1组的细胞吞噬能力明显增强(Fig 4B)。
2.5 拮抗HMGB1抑制ERK/JNK/P38 MAPK信号通路Western blot分析结果显示,IS组或HMGB1组较Control组p-ERK/ERK、p-p38/p38、p-JNK/JNK蛋白表达明显上调;而IS+anti-HMGB1组较IS组p-ERK/ERK、p-p38/p38、p-JNK/JNK蛋白表达再次下调(Fig 5A)。免疫荧光染色结果证实,与Control比较,IS或 HMGB1组p-ERK、p-p38、p-JNK的蛋白表达升高且由胞质向胞核转移;与IS组比较,IS+anti-HMGB1组p-ERK、p-p38、p-JNK蛋白表达明显降低(Fig 5B-D)。
3 讨论
CKD是一种免疫反应性疾病,患者常伴有先天和适应性免疫系统受损[15]。在CKD发展过程中,人体先天免疫系统被激活,从而诱发全身性炎症和氧化应激反应,最终加剧疾病进展[16]。
作为机体免疫的应答器,DCs可充当先天免疫和适应性免疫间的桥梁。人体大部分DCs处于未成熟状态,虽具有极强的抗原吞噬和胞饮能力,但其表面主要MHC-II类分子和共刺激分子表达较低。然而,外来抗原或炎症细胞因子刺激可通过促进DCs的成熟和功能进而启动效应T细胞并激发免疫应答。在其成熟过程中,内吞能力降低、表面MHC-Ⅱ类分子和共刺激分子包括CD40、CD80和CD86表达上调且细胞因子分泌增加。Kim等[6]研究发现,与健康人群比较,CKD患者中DCs数量较少。硫酸吲哚酚是一种肠源性的蛋白结合型尿毒症毒素,易在CKD患者体内蓄积,从而促进CKD进展并诱导其他组织器官病变进而引发CKD相关的并发症[17]。本次研究结果表明,与对照组相较,经不同浓度IS(30、300、600 μmol·L-1)处理后,DCs细胞中CD83+和CD86+细胞数增加,细胞形态发生变化:胞浆增多,形态不规则,可见细胞集落,吞噬能力明显下降,且呈现剂量依赖性。表明IS可诱导人外周血单核细胞来源DCs表型及功能成熟,该发现与何栩等[18]研究一致。
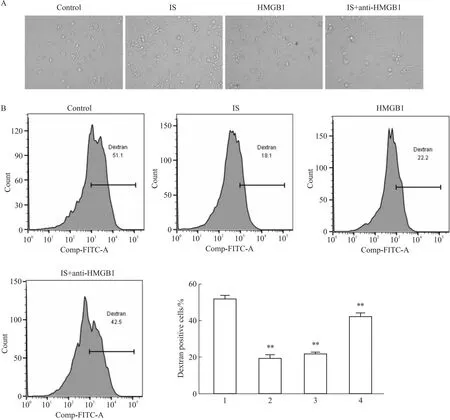
Fig 4 Anti-HMGB1 promoted phagocytosis of IS-induced DCs
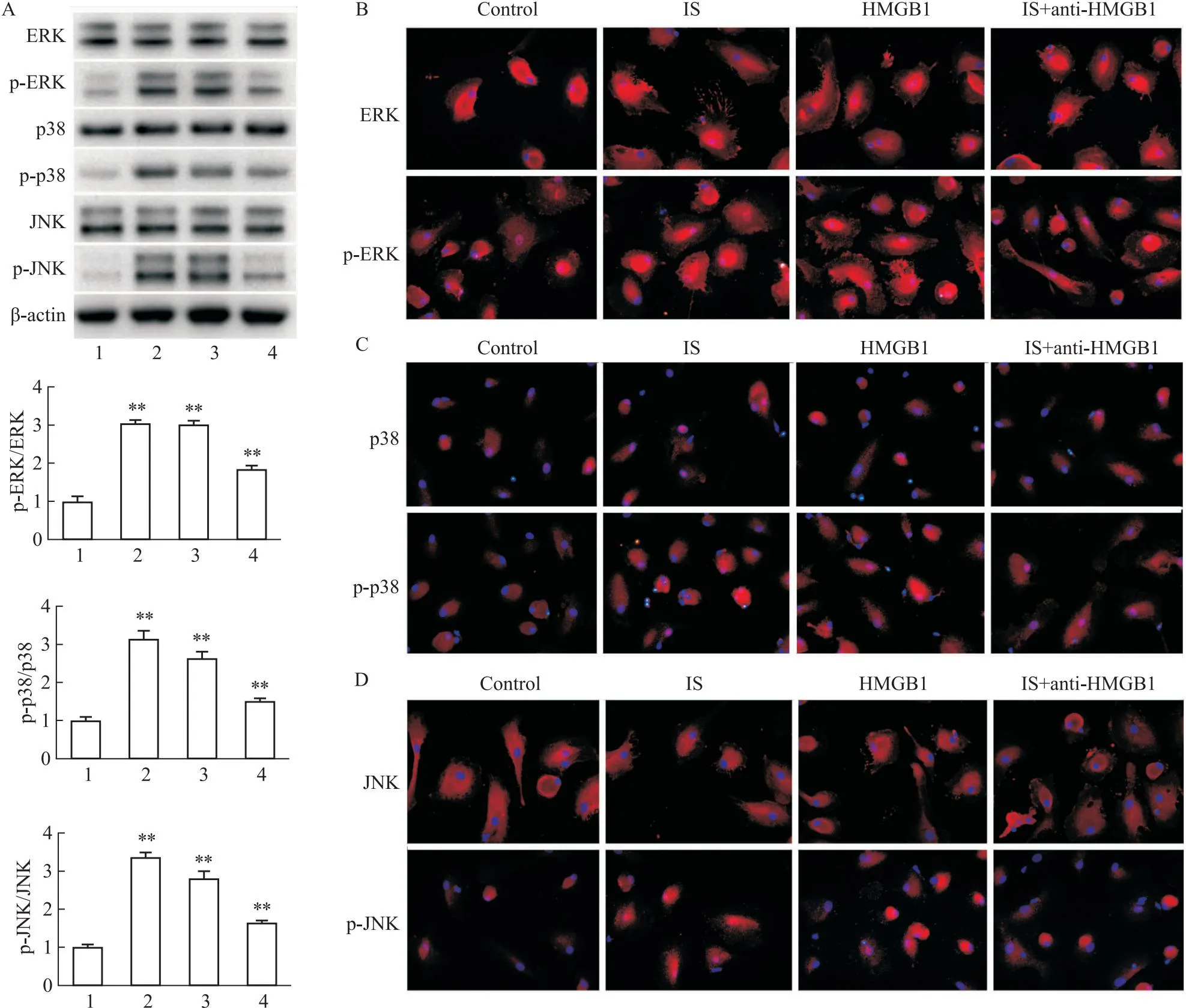
Fig 5 Anti-HMGB1 inactivated ERK/JNK/P38 MAPK signaling pathway
Bruchfeld等[19]于2008年的研究中提到,CKD患者血清中HMGB1水平升高,且与肾小球滤过率和炎症标志物相关。近年研究已充分证实,作为损伤相关分子模式的重要分子,HMGB1主要调控免疫和炎症反应[9]。此外,据报道,HMGB1不仅可诱导DCs向具有免疫抑制活性的调节性DCs分化从而介导T细胞免疫抑制,且体内持续过量的HMGB1刺激可导致DCs成熟障碍及分泌促炎因子IL-12减少[20]。CD83和CD86是成熟DCs表面的重要共刺激分子[21]。本次实验结果表明,经HMGB1因子诱导后,CD83+和CD86+细胞数明显增加,细胞形态发生明显变化:胞浆增多,形态不规则,可见细胞集落,吞噬能力明显下降;与IS组相比,IS+anti-HMGB1组的CD83+和CD86+细胞数明显减少,细胞形态改变得以恢复且细胞吞噬能力增强。表明抗HMGB1可抑制IS诱导的DCs表型及功能成熟。
已有研究揭示,HMGB1可通过上调磷酸化ERK, JNK and p38 MAPK水平而激活ERK/JNK/P38 MAPK信号通路[22]。MAPK途径是介导细胞反应的重要信号系统,主要包括ERK、JNK和p38 MAPK。通过磷酸化激活的ERK或JNK可从细胞质转运到细胞核,刺激MAPK信号传导,进而参与CKD进展[23]。此外,MAPK信号通路异常与免疫和炎症反应相关[24]。更有研究发现,HPS40可通过TLR38介导的p38 MAPK和JNK信号通路刺激DCs免疫反应[25]。本次研究发现, IS或HMGB1因子诱导可明显下调p-ERK/ERK、p-p38/p38、p-JNK/JNK蛋白表达,且导致p-ERK/ERK、p-p38/p38、p-JNK/JNK蛋白由胞质向胞核转移;而IS+anti-HMGB1组较IS组p-ERK/ERK、p-p38/p38、p-JNK/JNK蛋白表达明显降低。
由此,抑制HMGB1拮抗剂可阻碍IS诱导的DCs表型及成熟并使ERK/JNK/P38 MAPK信号通路失活,表明HMGB1可介导免疫抑制进而为CKD的免疫治疗提供新的策略。
