肌萎缩侧索硬化症发病机制及药物研究进展
2024-02-04周昱君陈秋宇唐婧姝兰嘉琦
周昱君,陈秋宇,孙 卓,唐婧姝,兰嘉琦,吴 镭,彭 英
(中国医学科学院北京协和医学院药物研究所,北京 100050)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是运动神经元疾病中最为常见的类型,起病隐匿,临床表现为上、下运动神经元合并受损的特征。ALS患者的首发症状常为肢体力弱、构音障碍和吞咽困难,进而出现进行性加重的肌无力、肌萎缩、肌束震颤、延髓麻痹和锥体束征,有少数患者也可出现体质量减轻、认知障碍及情绪失常等不典型症状。患者通常在起病3~5年后死于呼吸肌麻痹、呼吸衰竭。
ALS患病率约为(4.1~8.4)/10万[1],男性多于女性。其中散发性ALS(sporadic amyotrophic lateral sclerosis,sALS)约占ALS患者的0.90~0.95,家族性ALS(familial amyotrophic lateral sclerosis,fALS)约占0.05~0.10。
1 ALS相关发病机制
ALS的发病机制目前研究仍不明确,众多研究表明ALS发病和进展与基因突变、错误折叠蛋白聚集、氧化应激损伤、线粒体功能障碍、谷氨酸兴奋性毒性、轴突运输异常、神经炎症、RNA代谢异常等机制密切相关[2-3]。
1.1 基因突变和错误折叠蛋白聚集目前已发现超过100种ALS致病或疾病修饰基因,最常见的基因突变包括超氧化物歧化酶1(Cu/Zn superoxide dismutase 1,SOD1),9号染色体开放阅读框72(chromosome 9 open reading frame 72,C9orf72),TAR DNA结合蛋白43(TAR DNA-binding protein 43,TDP-43)以及肉瘤融合基因(fused in sarcoma,FUS)等。
错误折叠蛋白聚集是ALS中的常见特征,包括TDP-43、FUS、SOD1以及C9orf72重复扩增等,众多研究认为这些异常蛋白聚集可能通过“loss of function,功能缺失”以及“gain of function,功能增强”对神经元造成损伤。
SOD1是研究最多的ALS相关基因,约占fALS患者的0.20和sALS患者的0.07[4]。作为细胞内重要的抗氧化酶,SOD1主要定位于细胞质和线粒体内膜间隙,可保护细胞抵抗毒性活性氧簇(reactive oxygen species,ROS)攻击。目前在ALS患者的SOD1基因中已经发现了超过180种基因变异,常见突变有D90A、A4V和G93A等,SOD1突变导致其蛋白构象改变进而形成毒性聚集体,引起细胞氧化应激损伤。
TDP-43蛋白包含一个带有核定位序列信号的N末端区域,两个RNA识别模体和一段核输出信号的C末端区域。TARDBP基因突变约占fALS的0.05和sALS的0.01[5],常见的错义突变有A382T、M337V、A315T、Q331K、D169G、G294A、G294V和Q343R。TARDBP突变增加了TDP-43蛋白的聚集倾向和胞浆错误定位、引起TDP-43蛋白稳定性改变,并影响TDP-43蛋白与其他蛋白的相互作用。
TDP-43主要位于细胞核,并在胞核胞浆之间穿梭以完成mRNA剪接、RNA代谢功能以及mRNA翻译等生理功能。ALS患者的脊髓与大脑神经元中,胞浆部分TDP-43水平异常增加,形成胞浆TDP-43包涵体,并导致TDP-43无法正常完成其生理功能,通过“功能缺失”以及“功能增强”的方式对神经细胞产生毒性作用,包括损害线粒体功能、影响微管运输等。TDP-43 C末端区域具有无序且易于聚集的特点,与ALS相关的突变以及磷酸化位点大多集中在该区域,且与病理样TDP-43的传播有关。由TDP-43产生的25-35 ku C末端片段是ALS脑组织中包涵体的主要成分,具有高度细胞毒性[6]。此外,磷酸化与泛素化是最常见TDP-43的病理性翻译后修饰方式[7]。TDP-43磷酸化与其在神经元细胞中增加的胞浆错误定位和聚集的病理性变化有关。
FUS也是一种DNA/RNA结合蛋白,FUS突变约占fALS的0.04以及sALS的0.01,往往与早期发病型ALS有关[8]。生理条件下,FUS主要定位于细胞核,可在胞核胞浆之间穿梭参与调节DNA修复、转录、剪接以及miRNA加工等多种生物学过程。ALS中有关FUS的发病机制仍不明确,可能和FUS聚集体的毒性功能,或者FUS错误定位有关。
C9orf72中的六核苷酸重复(GGGGCC,G4C2)扩增约占fALS的0.40。G4C2重复序列数目一般在2~25个拷贝数之间,而C9-ALS/FTD患者G4C2重复序列数目可达到成百甚至上千个拷贝数[9-10]。C9orf72中的六核苷酸重复可导致细胞毒性。C9orf72mRNA可在C9-ALS/FTD患者的大脑、脊髓中积累,包含这种重复扩增序列的RNA转录本可形成离散的核结构,与多种RNA结合蛋白相互作用,进而导致这些蛋白无法发挥其正常功能而影响细胞生命活动进行。其次,C9orf72可形成长而重复的RNA,其编码的二肽重复蛋白可在CNS系统中形成包涵体,具有明显细胞毒性。
1.2 氧化应激氧化应激在ALS发病机制中起关键作用,在ALS患者以及SOD1-G39A转基因小鼠等ALS模型中,都检测到大量氧化应激指标升高的现象,如脂质过氧化损伤、蛋白氧化损伤、DNA氧化损伤以及氧自由基、氧化修饰蛋白、应激相关蛋白等。
核因子E2相关因子(nuclear factor erythroid-2 related factor 2,NRF2)抗氧化功能在ALS中受损,ALS患者运动皮层以及脊髓组织的尸检结果显示,NFE2L2mRNA水平以及NRF2蛋白水平均显著下调。此外,具有NRF2激动效应的化合物在ALS细胞、动物模型中展现出一定保护作用。GSH抗氧化系统在ROS、毒性物质清除以及被氧化蛋白修复等方面扮演重要角色。ALS中存在GSH代谢失衡,机体GSH稳态失衡进而导致氧化应激损伤加剧,最终加速ALS进展。氧化应激状态会放大ALS疾病中的其他病理过程。ROS水平过高会导致大量谷氨酸在突触累积,增加Ca2+内流进入运动神经元以及线粒体,损伤线粒体功能。
1.3 线粒体功能障碍线粒体属于易受攻击的细胞器,线粒体结构改变以及功能受损是ALS病理过程中的关键环节。据报道,ALS患者脊髓中线粒体发生了明显的改变,包括异常的细胞分布、线粒体肿胀和空泡化、线粒体发生相关基因转录水平下降、线粒体DNA拷贝数减少、线粒体呼吸链复合物活性降低以及其他线粒体酶活性降低等[11]。TDP-43-fALS患者成纤维细胞中同样发现线粒体分裂异常增加。ALS中线粒体功能受损主要包括线粒体相关蛋白失调、线粒体ROS增加、ATP产生减少、线粒体质量控制受损等。
病理条件下线粒体稳态遭到破坏时,细胞能量供应不足,大量线粒体ROS产生,级联放大氧化应激及谷氨酸兴奋性毒性等引起的ALS相关病理损伤,线粒体本身功能亦会进一步受损,形成恶性循环。
1.4 谷氨酸兴奋性氨基酸毒性谷氨酸兴奋性毒性是由于谷氨酸摄取和转运机制缺陷所致,神经元Ca2+摄入过多进一步导致下游线粒体功能障碍和ROS产生增加,加剧氧化应激损伤,也导致星形胶质细胞对谷氨酸摄取能力下降。细胞外谷氨酸堆积增加了神经元的兴奋毒作用。与来自同一区域的背角神经元相比,脊髓运动神经元的GluR2表达降低,因此AMPA受体Ca2+通透性增加,这可能与ALS疾病中选择性损伤运动神经元有关。此外有研究发现,sALS患者具有GluR2 RNA编辑功能缺陷,ALS患者脑脊液以及血清中均发现谷氨酸水平显著提高[12]。SOD1-G93A转基因小鼠在发生运动神经元变性、起病前2-3个月即可检测到谷氨酸释放增加、运动神经元以及中间神经元过度兴奋等现象。体内外实验均证实,SOD1突变可引起星形胶质细胞GluR2表达降低,从而降低其抵抗谷氨酸兴奋性毒性的能力。
1.5 神经炎症在sALS以及fALS患者中,神经炎症以星形胶质细胞和小胶质细胞激活为主要特点,伴随一定程度的外周免疫细胞浸润及炎症因子升高,患者CNS中运动区域受到神经炎症干扰而功能受损。小胶质细胞是CNS系统中主动免疫防御系统的主要方式,激活的小胶质细胞释放一系列促炎症因子(如TNF-α、IL-1β、IL-12、IFN-γ等)、促有丝分裂因子(如MCP-1、M-CSF)、神经营养因子(如IGF-1)、抗炎因子(如TGF-β)以及趋化因子(如CCL5)[13],并损伤运动神经元。当小胶质细胞不足以清除细胞内毒性物质时,将进一步募集星形胶质细胞以及少突胶质细胞,激活的小胶质所分泌的细胞因子进一步诱导A1型激活的星形胶质细胞,从而引发持续的炎症反应,导致ALS中神经元死亡。
1.6 轴突运输障碍轴突运输对运动神经元细胞生理活动的进行是非常关键的。在sALS以及fALS患者中有神经丝网络破坏的报道,且ALS患者轴突运输的初始阶段被发现具有轴突肿胀现象,肿胀的成分包括线粒体、囊泡、神经丝以及溶酶体等[14]。ALS患者及动物模型中均存在逆向轴突运输障碍,是ALS最早期的病理变化之一,并且明显早于临床症状。综上,轴突运输障碍会影响运动神经元线粒体代谢以及变性、蛋白质降解以及RNA转运等众多过程,在ALS疾病发生进展中发挥一定作用。
2 ALS药物研究进展
2.1 已上市药物鉴于ALS疾病的复杂性、患者数量有限以及临床前研究模拟受限等原因,目前仅有3种药物通过了美国食品及药品管理局(Food and Drug Administration,FDA)批准,应用于ALS治疗,分别为利鲁唑、依达拉奉和Relyvrio。
利鲁唑于1995年12月获得FDA批准应用于ALS的治疗,成为第一个获得FDA批准应用于治疗ALS的药物。利鲁唑抑制谷氨酸释放、增加电压依赖型钠离子通道失活、抑制蛋白激酶C、干扰递质与兴奋性氨基酸受体结合后所产生的各种细胞响应[15]。
依达拉奉作为一款抗氧化的神经保护药物,最初应用于脑梗死急性期治疗,2015年在日本和韩国被批准应用于ALS治疗,2017年被FDA批准,2019年被我国药品监督管理局(National Medical Products Administration,NMPA)批准。在随机、双盲的临床Ⅲ期试验中,与安慰剂组相比,依达拉奉治疗可显著改善ALS功能评估量表(amyotrophic lateral sclerosis functional rating scale,ALSFRS-R)评分,但程度有限[16]。近日,FDA批准三菱田边制药公司开发的依达拉奉口服混悬剂用于治疗ALS成人患者。同时此公司正在开发另一款口服依达拉奉制剂,处于临床Ⅲb阶段。依达拉奉可有效清除受损细胞膜释放的大量过氧自由基,抑制小胶质细胞过度激活,清除ONOO-以及·OH,保护健康神经元[17]。近年来,我国在ALS药物研发方面也取得了很大进展。2022年9月,北京天坛医院与南京百鑫愉医药有限公司合作研发的依达拉奉舌下片获NMPA批准上市。
Relyvrio是由苯丁酸钠和牛磺酸二醇组成的复方口服制剂,由Amylyx Pharmaceuticals公司研发,2022年9月FDA批准上市。Relyvrio通过改善细胞内质网和线粒体功能紊乱而延缓神经元死亡,临床研究显示其能显著延缓ALS疾病进展并延长患者生存期[18]。
甲磺酸马赛替尼为AB Science公司研发的一款口服酪氨酸激酶抑制剂,对集落刺激因子1受体、c-kit以及血小板衍生生长因子受体等均表现出抑制作用,可通过抑制肥大细胞活性、小胶质细胞激活以及中性粒细胞浸润而发挥抗炎作用,并改善轴突病理。马赛替尼可减缓SOD1-G93A转基因大鼠的神经炎症并减缓ALS疾病进展[19]。FDA以及欧洲药物管理局(European Medicines Agency,EMA)均授予马赛替尼治疗ALS孤儿药资格,并先后于西班牙、丹麦、法国和德国等国家开展Ⅲ期临床试验,EMA于2022年8月批准其附条件上市。
此外,NeuroNATA-R是韩国Corestem公司提供的干细胞疗法,为自体骨髓间充质干细胞,已于韩国上市。
Tofersen是Ionis Pharmaceuticals公司研发的一类反义寡核苷酸类药物(antisense oligonucleotides,ASOs)药物,是一款SOD1表达抑制剂,Ⅰ/Ⅱ期临床试验结果表明,Tofersen可降低SOD1-ALS患者CNS中SOD1水平、脑脊液中磷酸化神经丝蛋白重链水平,并且可使患者获得更好的ALSFRS-R评分[20],Tofersen已于2021年在澳大利亚、比利时和巴西等国家开展Ⅲ期临床试验,虽然渤健公布此项研究没有达到主要终点,但在生物活性和临床功能的多个次要终点和探索性测定中发现了有利于Tofersen的趋势[21]。2022年7月,FDA已接受Tofersen的新药上市申请且授予其优先审评资格,用于治疗SOD1-ALS。
2.2 临床研究药物
2.2.1抗氧化应激损伤 氧化应激损伤是很多神经退行性疾病包括ALS共同存在的致病机制,其很可能作为重要病理机制参与到ALS发病以及进展中,因此靶向氧化应激损伤是ALS药物研发的一个重要方向。
RT-001是一款Retrotope公司研发的化学稳定不饱和脂肪酸类药物,具有抗氧化作用,可减少线粒体损伤以及脂质过氧化损伤。该药物于2021年在爱沙尼亚、荷兰和瑞典等国家开展ALS的临床Ⅱ期试验。Cu(Ⅱ)-ATSM是一款神经调节剂,同时具有抗氧化作用,可改善SOD1-G37R小鼠运动功能并延长其生存期,正在开展治疗ALS的Ⅲ期临床研究。Verdiperstat是一款髓过氧化物酶抑制剂,可改善中枢神经系统病理性氧化应激损伤和炎症,目前处于治疗ALS的Ⅲ期临床状态。
应用于帕金森病(Parkinson’s disease,PD)治疗的多巴胺受体拮抗剂类药物在ALS中同样展现出一定治疗作用。普拉克索在动物以及细胞实验中可减少氧化应激损伤并发挥神经保护作用,在Ⅱ期临床试验中可显著降低sALS患者氧自由基产生。右旋普拉克索作为普拉克索的光学异构体,对多巴胺受体亲和力低于普拉克索,并可显著延长SOD1-G93A转基因小鼠生存期,但在Ⅲ期临床试验中并未使患者明显获益。另外一款多巴胺受体拮抗剂溴麦角环肽具有较强的自由基清除能力,在SOD1-H46R ALS动物模型中可减少氧化应激损伤,并且在临床Ⅱa试验结果中对患者运动神经功能有所改善,后续将展开临床Ⅱb或者Ⅲ期试验。另外一款应用于PD治疗的药物雷沙吉兰,属于单胺氧化酶-B抑制剂,具有明显的抗氧化以及抗凋亡活性,单独使用或与利鲁唑协同使用时均可改善SOD1-G93A转基因小鼠的运动功能及生存期,但在临床Ⅱ期试验中未能显著提高患者生存期。
甲钴胺是一种活性维生素B12,被认为可降低同型半胱氨酸的神经毒性,已完成ALS临床Ⅲ期试验,尽管关键次要终点并无改善,但对早期ALS患者ALSFRS-R下降有一定减缓作用[22]。此外,Crisdesalazine也可通过抗氧化产生保护作用,目前处于临床Ⅰ期试验状态。
2.2.2靶向蛋白聚集体 SOD1、TDP43、FUS/TLS以及C9orf72造成的相关ALS病理均与错误折叠蛋白聚集有关。因此,靶向降低错误折叠蛋白水平是一大研究方向。
ION-363为Ionis Pharmaceuticals公司研发的ASOs药物,是一款FUS表达抑制剂,该药物减缓了FUS-ALS小鼠模型中运动神经元的退行性变化,目前处于临床Ⅲ期试验状态。此外,WAVE Life Sciences公司研发的WVE-004是抑制C9orf72(突变体)表达的ASOs药物(单链,RNA),已在多个国家开展临床Ⅱ期研究,应用于ALS以及FTD的治疗。Apic Bio公司研发的微小RNA单链寡核苷酸类基因疗法APB-102,机制为SOD1抑制剂,已于2021年在美国开展Ⅰ期临床试验。
共济失调蛋白2(ataxin-2,ATXN2)中间重复序列的扩增会增加ALS的风险。由Biogen研发的ASOs药物BIIB105可结合ATXN2的mRNA,介导ATXN2的降解,有望降低其蛋白水平并可能减缓ALS人群的疾病进展,目前正处于临床Ⅱ期阶段。二甲双胍能抑制蛋白激酶R的水平,从而降低C9-ALS/FTD小鼠机体中由C9orf72重复扩增突变产生的重复相关的非AUG蛋白的表达水平并改善疾病症状,目前已开展对C9-ALS/FTD患者的临床Ⅱ期试验。
研究发现,mTOR抑制剂可调节自噬小体的形成、促进自噬,有利于毒性蛋白聚集体的清除。雷帕霉素可激活自噬通路,减少错误折叠蛋白介导的毒性作用,在ALS细胞、动物模型中表现出明显的保护作用,目前已进入治疗ALS的临床Ⅱ期试验阶段。海藻糖是Seelos Therapeutics公司开发设计的一款药理伴侣类药物,可通过激活自噬促进TDP-43细胞模型中毒性蛋白聚集体的清除,可减少SOD1-G93A动物模型中突变型SOD1的表达并减轻小鼠早期运动功能障碍[23],2020年FDA授予海藻糖ALS孤儿药资格,于2022年在美国开展Ⅲ期临床试验。锂是一款靶向糖原合成酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)并已应用于治疗抑郁症的药物,在SOD1-G93A小鼠模型中可激活自噬并改善小鼠存活,但在临床试验中未能提高利鲁唑疗效。丙戊酸钠主要应用于癫痫的治疗,在ALS细胞以及动物模型中均表现出一定保护作用,但在临床试验中未能使ALS患者明显受益。然而锂与丙戊酸钠合并用药却能改善患者存活、表现出神经保护作用。已有研究证明,GSK-3β抑制剂可减少TDP-43的异常磷酸化,帮助恢复这种核蛋白的内稳态。Tideglusib是由Noscira研发的一种内部设计的非ATP竞争性GSK-3β抑制剂,在不同的神经退行性模型中显示出神经保护、抗炎等作用。目前该药物于2021年在瑞士开展临床Ⅱ期试验。
热休克蛋白(heat shock protein,HSP)诱导剂可减轻蛋白聚集体的毒性损伤。Arimoclomol是一款HSP70诱导剂,可显著延缓SOD1-G93A小鼠发病、提高SOD1-G93A小鼠生存期并提高其神经-肌肉相关功能,在治疗SOD1突变型ALS的临床Ⅱ期实验中取得较好的疗效,于2018年第2次开展Ⅲ期临床试验,数据暂未披露。秋水仙碱可提高HSP8表达水平,在sALS中可减少错误折叠导致的TDP-43蛋白聚集,并减少运动神经元死亡,于2019年在意大利开展临床Ⅱ期试验。RNS-60是由Revalesio研发的一种HSP90调节剂和G蛋白偶联受体调节剂,目前正处于治疗ALS的临床Ⅱ期阶段。
2.2.3靶向线粒体障碍 奥利索西是一款由罗氏开发的神经保护剂,可通过连接线粒体通透性转换孔,促进神经元存活,提高SOD1-G93A转基因小鼠运动功能,延缓其发病,延长其生存期,但在Ⅲ期临床试验中失败。氢溴酸右美沙芬与硫酸奎尼丁是由Avanir Pharma公司研发的一种复方药物,目前临床应用于假性延髓麻痹治疗。据报道,氢溴酸右美沙芬可维持ATP含量以及线粒体膜电位、减少ROS带来的细胞损伤,具有线粒体保护作用,同时作为一款NMDA受体拮抗剂,有利于减少谷氨酸兴奋性毒性损伤,减少神经细胞死亡。单独使用氢溴酸右美沙芬未能改善ALS患者存活率,但与硫酸奎尼丁联合用药可以改善患者假性延髓症状以及延髓症状[24],目前该联合药物处于Ⅱ期临床研究阶段。Cutamesine hydrochloride是一款神经Sigma-1受体激动剂,可结合至内质网和细胞膜的离子通道及蛋白,稳定线粒体并调节钙流,维持细胞能量平衡,并在SOD1-G93A转基因小鼠中表现出稳定线粒体、减少神经细胞凋亡的保护作用,目前该药物应用于治疗ALS处于Ⅰ期临床研究阶段。硝酮嗪是一款由暨南大学和广州喜鹊医药有限公司研发的小分子药物,硝酮嗪具有高效的自由基清除能力,可提高线粒体抗氧化功能,增加ATP产生,保护线粒体,同时减少SOD1表达,延缓SOD1-G93A小鼠发病,提高其运动功能,减缓神经元丢失,减少胶质细胞激活并改善骨骼肌退行改变。该药物已于2020年在中国开展Ⅱ期临床试验,2021年在美国开展Ⅰ期临床试验。盐酸曲美他嗪是一款用于治疗心绞痛和梅埃症的小分子药物。目前有研究表明,盐酸曲美他嗪可延缓SOD1-G93A小鼠运动功能,改善其肌肉表现和代谢,并显著延长总生存期。此外,曲美他嗪还可预防神经肌肉连接的变性,减少运动神经元的丢失,减少脊髓和周围神经的神经炎症。其治疗作用可能是基于改善骨骼肌和脊髓线粒体功能。盐酸曲美他嗪于2021年在澳大利亚、荷兰和英国等国家开展Ⅱ期临床试验,用于治疗ALS和运动神经元病。丁苯酞是石药集团与中国医学科学院药物研究所合作开发的抗缺血性脑卒中一类新药,2005年上市后取得了显著的临床效果。丁苯酞具有改善线粒体功能、抑制氧化损伤的作用,于2018年2月28日通过FDA ALS孤儿药资格认定,临床前数据表明,丁苯酞可改善ALS动物生存,减缓神经元丢失,并减少胶质细胞激活。目前丁苯酞正在进行ALS的Ⅱ期临床研究。
2.2.4抵抗谷氨酸介导的兴奋性毒性 他仑帕奈是一款非竞争型AMPA受体阻滞剂。在SOD1-G93A转基因小鼠发病早期阶段具有一定治疗作用,可降低升高的Ca2+水平和兴奋性毒性[25]。该药物目前处于Ⅱ期临床阶段,他仑帕奈对于ALSFRS-R及肌肉力量降低具有减缓趋势,且具有较好的耐受性。另一款AMPA受体阻滞剂吡仑帕奈,在ALS动物模型中可延缓疾病进展,提高前角细胞数目,但该药物在开放标签的临床试验中与副作用事件的发生具有相关性。在一项临床Ⅱ期试验研究中,给予吡仑帕奈治疗可改善ALSFRS-R评分,但伴随少量副作用的发生[26]。
某些β-内酰胺类抗生素在ALS治疗中表现出一定的改善作用,其中头孢曲松可通过上调谷氨酸转运体GLT1活性,降低谷氨酸浓度,减少运动神经元损伤,延长SOD1-G93A小鼠生存期,但未能在Ⅲ期临床试验中表现出有效性。
美西律是一种钠离子通道阻滞剂,主要应用于心律失常以及肌强直的治疗,可减少SOD1-G93A蛋白介导的运动神经元损伤,有效控制ALS中的肌肉痉挛症状。钙离子通道阻滞剂可通过控制Ca2+内流进入受损伤的运动神经元而减少谷氨酸兴奋性毒性,但两款该类药物维拉帕米和尼莫地平都未能在临床试验中通过药效学验证。
2.2.5减少神经炎症 异丁司特是巨噬细胞移动抑制因子抑制剂、白三烯受体拮抗剂,可抑制小胶质细胞激活,减少神经细胞死亡,具有抗炎作用。此外,研究结果表明异丁司特可促进TDP-43蛋白以及SOD1蛋白聚集体的清除,该药物应用于ALS治疗已进入Ⅲ期临床研究阶段。NP001是一款新型小分子药物,具有抗炎作用,目前该药物处于Ⅱ期临床研究状态。伊曲茶碱是一种腺苷受体2A拮抗剂,2013年全球批准上市,用于治疗PD,2022年在美国开展ALS的Ⅱ期临床试验。受体相互作用丝氨酸/苏氨酸-蛋白激酶1(receptor interacting serine threonine kinase 1,RIPK1)可调节全身组织中的炎症和细胞死亡。在ALS和多发性硬化症的临床前模型中,抑制RIPK1活性可以延缓疾病进展。由赛诺菲和Denali公司研发的SAR443820是一种新型的CNS渗透性小分子RIPK1抑制剂,具有穿越血脑屏障的潜力。目前已在全球和中国开展临床Ⅱ期试验,且美国FDA已经授予SAR443820治疗ALS的快速通道资格。ANX-005是一种单克隆抗体,通过静脉给药可抑制C1q和整个经典补体途径,目前正处于治疗ALS的临床Ⅱ期阶段。Latozinemab、Atibuclimab、Tegoprubart也同样属于抗体类药物,目前均处于临床Ⅱ期试验阶段。此外,已作为治疗阵发性血红蛋白尿症的Pegcetacoplan是一种补体C3抑制剂,旨在调节补体的过度激活,目前已由Apellis Pharmaceuticals Inc在澳大利亚、比利时和法国等国家和地区开展治疗ALS的临床Ⅱ期试验。
2.2.6靶向轴突运输以及轴突退行性改变 Rho激酶(Rho kinase,ROCK)对于高水平肌动蛋白的形成以及减少肌动蛋白更新起重要作用,可破坏细胞生长与轴突再生。甲磺酸法舒地尔是一款ROCK抑制剂,可延缓SOD1-G93A转基因小鼠发病、延长其生存期并减少其运动神经元丢失,该药物应用于ALS治疗目前已进入临床Ⅱ期阶段,于2021年在美国和澳大利亚开展。盐酸法舒地尔是由旭化成株式会社研发的是一种小分子药物,是一款ROCK2抑制剂、ROCK1抑制剂和PKC抑制剂,于2019年在法国、德国和瑞士等国家和地区开展ALS治疗的Ⅱ期临床试验。
2.2.7抵抗骨骼肌萎缩 ALS中骨骼肌萎缩是重要的病理改变。快速骨骼肌型肌钙蛋白复合体激活剂(fast skeletal muscle troponin activators,FSTA)可通过刺激调节性肌钙蛋白复合物,增加其对Ca2+的敏感性,增强肌肉的收缩能力[27-28]。Tirasemtiv属于FSTA类药物,临床前数据表明该药物可提高SOD1-G93A小鼠的运动能力,但Ⅲ期临床试验结果显示,Tirasemtiv对慢肺活量检查的下降以及肌肉力量并未表现出明显的改善作用。Reldesemtiv是另一款FSTA类药物,并且在临床Ⅱ期试验中表现出一定的治疗效果,包括改善SVC、ALSFRS-R评分以及肌肉力量等,但未达到显著差异。Cytokinetics公司已于2021年在加拿大、澳大利亚和比利时等国家开展Reldesemtiv的Ⅲ期临床试验。
2.2.8其他治疗手段 干细胞治疗作为新兴的治疗手段,受到越来越多的关注。NeuroNATA-R疗法作为首个间充质干细胞分泌神经营养因子(MSC-NTF)治疗ALS的药物,在Ⅰ/Ⅱ期临床试验中证实其具有一定的疗效以及安全性[29],目前已在美国完成Ⅲ期临床试验,虽未达到主要终点,但对于神经炎症、神经变性具有一定改善作用,研究者认为未达到主要终点的原因可能与部分受试者病情太过晚期有关,因此仍需要进一步研究。自体间充质干细胞治疗是由Hadassah Medical Organization研发的一种干细胞疗法,目前已完成Ⅱ期临床试验,结果表明,反复鞘内注射自体间充质干细胞对ALS患者是安全的,并提供了短期/中期的临床疗效,但需要更大规模的研究来证实这些观察结果。Wharton′s Jelly源间充质干细胞疗法由Medical University Of Warsaw研发,目前处于治疗ALS的临床Ⅱ期阶段。
此外,关于ALS的细胞疗法的研究也在迅速发展中。COYA-101、自体杂合TREG/Th2 细胞作为T淋巴细胞替代物,角质限制性前体细胞作为细胞替代物,以及自体脂肪来源的间充质干细胞治疗均处于治疗ALS的临床Ⅱ期阶段。
目前已有多种基因治疗方法进入临床前研究,其中进展最快的是Helixmith和Reyon Pharmaceuticals合作开发的一款质粒DNA药物VM202,已完成美国的临床Ⅰ/Ⅱ期试验。
目前将进入至Ⅲ期临床研究(Tab 1)和Ⅱ期临床研究(Tab 2)的ALS药物汇总如下:
3 小结
ALS是最常见的运动神经元疾病,进展快且致死性高,缺乏有效治疗药物。关于ALS发病机制目前研究仍不明确,本文围绕错误折叠蛋白聚集、氧化应激损伤、线粒体功能障碍、谷氨酸兴奋性毒性、神经炎症、轴突损伤等相关学说以及TDP-43、SOD1、FUS、C9orf72蛋白病理对ALS发病机制进行综述,并根据上述学说对正在进行ALS临床研究的药物进行分类总结。由于ALS具有异质性以及复杂性的特点,众多学说只能解释ALS的部分病理机制。因此,亟需探究ALS发病机制、开发新型有效的ALS治疗药物。
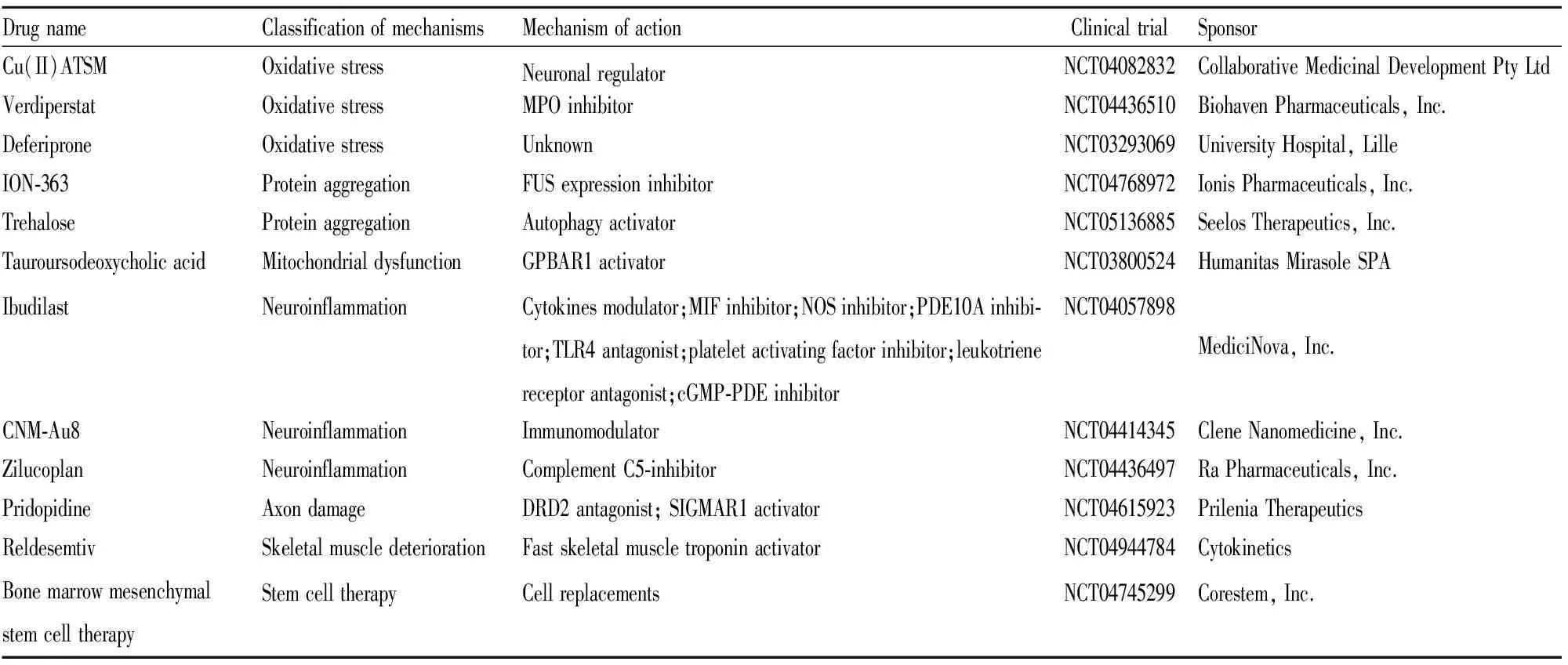
Tab 1 Drugs for ALS in Phase 3 clinical trials
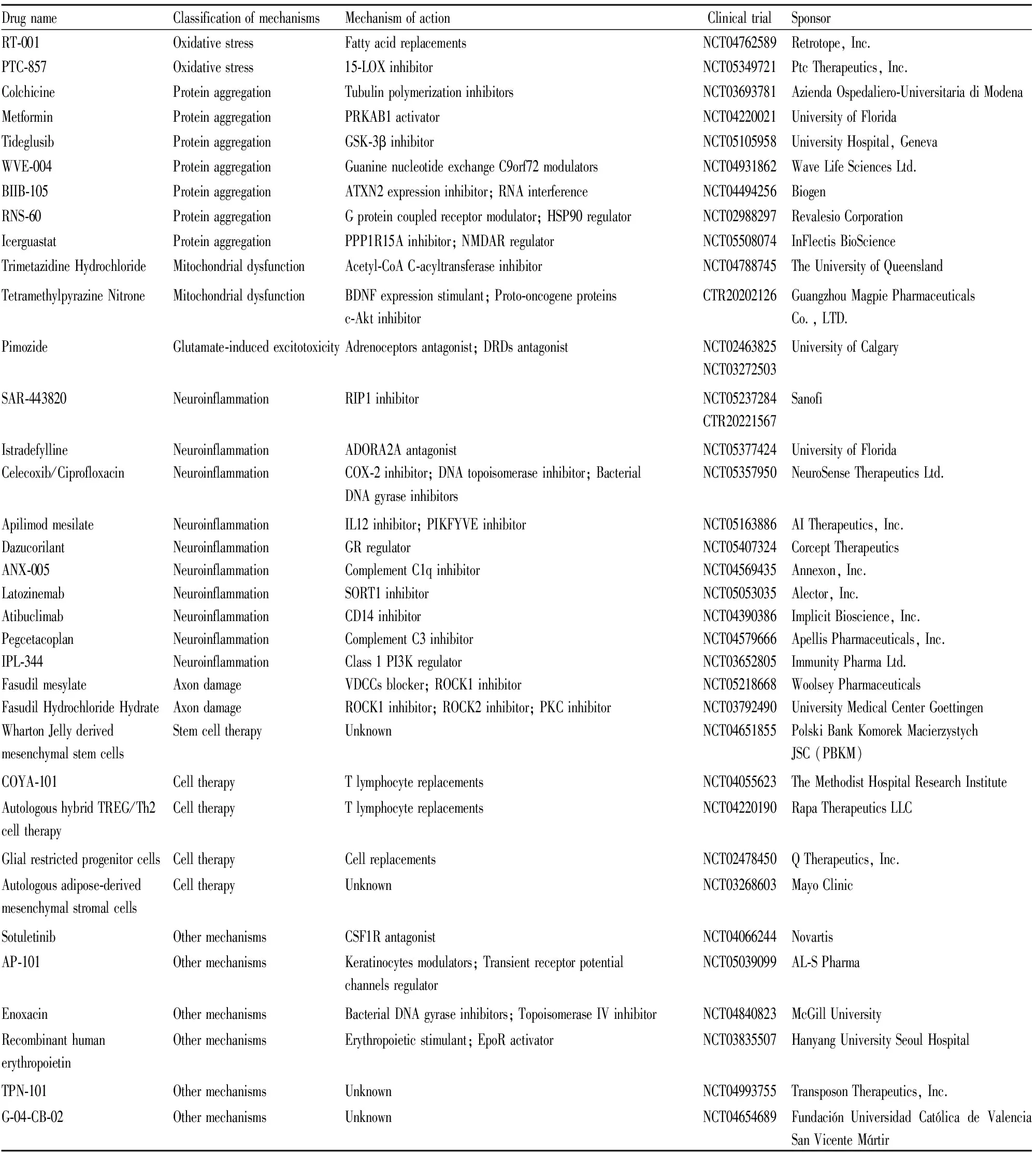
Tab 2 Drugs for ALS in Phase 2 clinical trials
