生长分化因子11激活PI3K/Akt信号途径促进糖尿病小鼠ADSCs体外矿化的研究
2024-02-03党瑞杰
龚 闽,朱 彪,李 欣,梅 美,党瑞杰,陈 晔
近半个世纪以来,2型糖尿病患病人数大幅增长[1, 2],严重危害人类的生存健康,已成为人类面对的严峻公共卫生问题。高血糖微环境显著阻碍脂肪间充质干细胞(adipose-der ived stem cells,ADSCs)的成骨分化,是导致糖尿病性骨质疏松发生、发展的重要原因。临床实践中也观察到2型糖尿病患者口腔种植手术成功率远低于健康人[3]。生长分化因子11(growth differentiation factor 11,GDF11)是一种具有“返老还童”作用的细胞因子,能延缓间充质干细胞衰老并逆转老龄性骨丢失[4],缓解代谢综合征小鼠的胰岛素抵抗状态[5],提高胰岛β细胞分泌胰岛素的功能同时减少细胞凋亡缓解2型糖尿病的高血糖状态[6],还能通过促进内皮祖细胞归巢成血管改善糖尿病足血运循环状态[7]。GDF11对2型糖尿病及其并发症的这些保护作用与激活磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路相关联[5-7]。但GDF11能否促进糖尿病小鼠ADSCs成骨分化及具体机制尚不清楚,本研究将对该课题进行探讨。
1 材料与方法
1.1 主要试剂与仪器 10只5周龄雄性无特定病原体级C57BL/6J小鼠与D12492高脂饲料(湖南斯莱克景达实验动物有限公司)。重组人GDF11(PEPROTECH,美国);培养基、胎牛血清(Gibco,美国);成骨诱导培养液相关试剂:β-甘油磷酸钠、抗坏血酸、地塞米松、L-谷氨酰胺(赛业生物,中国);胰蛋白酶、二甲基亚砜、链脲佐菌素(streptozotocin,STZ)、青霉素、链霉素(Sigma,美国);Trizol(Invitrogen,美国);碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(碧云天生物,上海);兔抗人PI3K抗体,磷酸化PI3K(p-PI3K)抗体、兔抗鼠Akt抗体,磷酸化Akt(p-Akt)抗体、山羊抗兔二抗(CST,美国);碘化丙啶PI(Sigma,美国);BCA测定试剂盒(翊圣生物,上海);聚偏二氟乙烯膜(PVDF)(Millipore,美国)。MCO-15AC型二氧化碳恒温培养箱(SANYO,日本);BCV-1360型生物净化工作台(哈东联,北京);血糖仪(强生公司,美国);7500 型荧光定量PCR仪(ABI,美国);VT型酶联仪(BioTek Instruments,美国);FACScan型流式细胞仪(BD Biosciences,美国);BX-53型正置荧光显微镜(奥林巴斯,日本)。
1.2 糖尿病小鼠造模 糖尿病小鼠造模方法:高脂饲料喂养8 周小鼠,连续5 d腹腔注射小剂量(60 mg/kg)链脲佐菌素(STZ)。注射完后尾静脉采血检测随机血糖,认为2次随机血糖≥16.7 mmol/L为糖尿病造模成功的标准,成功造模6只糖尿病小鼠。糖尿病小鼠造模成功后继续采用高脂饲料喂养8周。
1.3 细胞周期检测 无菌条件下切取小鼠腹部皮下白色脂肪组织,酶消化后过滤获取细胞混悬液离心(1000 r/min,5 min),接种于培养瓶原代培养。待细胞长满瓶底面积的90%时,开始传代。取第3代ADSCs,加入(GDF11组)或者不加(对照组)20 g/ml GDF11培养24 h后检测GDF11对ADSCs细胞周期的影响。
1.4 ALP活性定量 将ADSCs接种于96孔板上[8, 9],待细胞85%融合后进行成骨诱导。在成骨诱导液加入20 g/ml、40 g/ml GDF11或者20 g/ml GDF11+50 μmol/l LY294002(PI3K特异性抑制剂),并设空白对照组,在特定时间点(成骨诱导培养第1、3、5、7 d)收集细胞,按试剂盒要求检测ALP活性。
1.5 qPCR检测成骨相关基因 各组ADSCs成骨诱导培养3 d后Trizol抽提总RNA,在逆转录酶的作用下反转录为cDNA[10],SYBR Premix EX Taq进行基因定量,再以cDNA为模板扩增目的基因,2-ΔΔCt方法计算目的基因的相对表达量并用β-肌动蛋白(β-actin)对靶基因进行标准化。基因引物由上海英杰合成,引物序列见表1。

表1 小鼠成骨相关基因引物序列
1.6 Western blot检测PI3K/Akt信号通路 对照组,GDF11组和GDF11+LY294002(50 μmol/l)组细胞成骨诱导后(每组5个复孔)进行药物干预:先加LY294002 预处理30 min后加药GDF11,加药完成后继续使用成骨诱导培养72 h。冰上收获各组细胞的总蛋白。BCA法进行定量后,参照Western blot常规方法[8]以相对表达表示PI3K和Akt的磷酸化水平。

2 结 果
2.1 GDF11对ADSCs细胞周期的影响 取P3代ADSCs,加入20 g/ml GDF11培养24 h后检测GDF11对ADSCs细胞周期的影响,设计空白对照组。结果显示,ADSCs处于G0/G1期的比例无统计学差异(P>0.05),说明20 g/ml 浓度的GDF11对ADSCs的增殖潜能无影响(图1)。

图1 GDF11对小鼠脂肪间充质干细胞细胞周期的影响A. 对照组;B.生长分化因子组11;C.统计条图;GDF11,生长分化因子11。
2.2 GDF11对ALP活性的影响 在干预时间方面,ADSCs成骨分化的前5天,ALP酶活性逐渐增强。第5天后ALP酶活性开始变弱。在干预剂量方面,由于在≤40 g/ml GDF11干预剂量时,ALP酶活性呈剂量依赖性增加且具有饱和性,故将本研究中GDF11的干预剂量设置为20 g/ml(表2)。
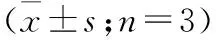
表2 GDF11对糖尿病小鼠ALP活性的影响
2.3 GDF11对成骨基因表达的影响 PCR结果表明,与对照组比较,GDF11明显促进成骨相关基因Runx2、Osx和ALP的转录表达,差异有统计学意义(P<0.05,表3)。
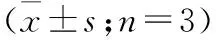
表3 各组糖尿病小鼠脂肪间充质干细胞成骨相关基因转录水平
2.4 GDF11对PI3K/Akt信号通路的影响 Western blot结果显示,与对照组相比,GDF11显著提高PI3K[(2.84±0.19)vs.(1.00±0.11)]和Akt[(4.58±0.20)vs.(1.00±0.19)]的磷酸化水平(P<0.05);当加入LY294002后,GDF11升高p-PI3K[(1.21±0.15)vs.(2.84±0.19)]和p-Akt[(1.03±0.11)vs.(4.58±0.20)]表达的作用部分消失(P<0.05)。这说明在BMSCs成骨分化的过程中,GDF11能激活PI3K/Akt信号通路(图2)。
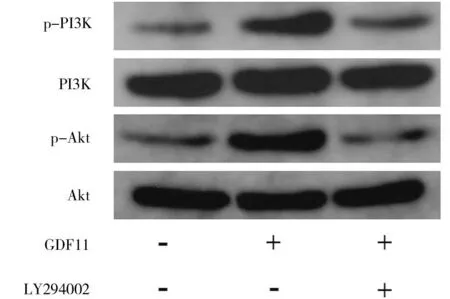
图2 GDF11对PI3K/Akt信号通路的影响GDF11.生长分化因子11。
2.5 PI3K/Akt信号通路在GDF11促进ADSCs成骨转录因子表达中的作用 与GDF11组相比,当加入PI3K抑制剂LY294002后,成骨相关基因Runx2、Osx、ALP和OCN的转录明显下调(P<0.05,表4)。PI3K/Akt信号通路至少部分介导了GDF11促进糖尿病小鼠ADSCs成骨转录因子表达的作用。
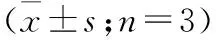
表4 PI3K/Akt信号通路在GDF11促进糖尿病小鼠ADSCs成骨转录因子表达中的作用
2.6 PI3K/Akt信号通路在GDF11促进ALP活性中的作用 在ADSCs成骨分化的过程中,抑制PI3K/Akt信号通路后,GDF11促进ALP活性的作用明显减弱。结果提示,PI3K/Akt信号通路至少部分介导了GDF11升高ALP活性的作用(表5)。
3 讨 论
GDF11是近年来发现的一种具有“返老还童”作用的细胞因子,通过提高血循环中GDF11的水平能够降低心[11]、脑[12]和骨骼肌[13]等多种组织发生老年性功能障碍。GDF11对干细胞分化也有影响,比如:促进BMSCs向内皮细胞分化并成血管[14],提高缺氧状态下干细胞线粒体功能[15]。2型糖尿病是一种衰老相关性疾病,GDF11也能缓解和改善2型糖尿病及其并发症[5-7]。本实验在这些研究的基础上进一步证实GDF11能促进2型糖尿病小鼠ADSCs成骨分化。与Zhang等[16]的研究结果一致,GDF11通过抑制过氧化物酶体增殖物激活受体-γ的激活促进成骨细胞生成。但是GDF11在干细胞成骨分化中的作用依然有争议,例如,在骨质疏松发展过程中,GDF11抑制间充质干细胞成骨分化[17],通过激活Smad2/3信号通路抑制ADSCs成骨分化[18],抑制骨生成[19]等。在2型糖尿病住模型中,抑制GDF11表达才能促进拔牙窝骨愈合和BMSCs成骨分化[20]。这些研究结果与本实验结论相反,差异可能是由于研究对象、遗传背景、实验模型和观察方法等不同造成的。
PI3K/Akt信号通路是细胞中一个经典的与磷脂酰肌醇有关的信号转导通路,也是RTK介导衍生的信号通路。在胰岛素刺激及发挥生理功能时发挥主导作用,同时也参与间充质干细胞成骨分化的信号转导[10]。PI3K/Akt信号通路始于RTK和细胞因子受体的活化,产生磷酸化的酪氨酸残基,从而为募集PI3K向膜上转位提供锚定位点。PI3K在被激活后会产生多种与膜结合的PI-3-P,Akt可以利用其PH结构域结合到这些锚定位点上,进而完成下游信号的转导。本实验结果表明,在ADSCs成骨分化中的过程中,GDF11能激活PI3K/Akt信号通路;当特异性地阻断PI3K/Akt信号通路后,GDF11促进糖尿病小鼠ADSCs成骨分化的作用部分消失,但未完全消失。与本研究结果类似,GDF11通过激活PI3K/Akt信号通路正向调节人牙髓干细胞的牙源性分化与矿化[21]。虽然,本研究发现GDF11通过激活PI3K/Akt信号通路促进2型糖尿病小鼠ADSCs成骨分化,但并不能排除其他的信号通路也可能参与信号转导。例如,Wnt/β-catenin也是间充质干细胞成骨分化的重要信号转导途径[22, 23],而GDF11促进2型糖尿病小鼠ADSCs成骨分化的过程中是否也能激活Wnt/β-catenin信号通路需要进一步探讨。
Runx2和Osx是干细胞成骨分化过程中特异性表达的重要转录因子[24],ALP是成骨早期的表达产物,OCN是成骨进入矿化期的标志物[25]。本研究发现,在成骨分化过程中,GDF11促进2型糖尿病小鼠ADSCs细胞Runx2、Osx和ALP转录表达,而对Gla转录表达无影响。这可能是由于本实验抽提RNA的时段尚处于ADSCs成骨分化的早期阶段,而此时晚期成骨分化标志物Gla的转录表达却不明显。GDF8与GDF11的氨基酸序列90%具有同源性[6],相似的氨基酸序列就决定了GDF8与GDF11可能具有相似的生物学功能。因此,GDF8能否促进2型糖尿病小鼠ADSCs成骨分化需要在后续实验中深入探讨。GDF11及相关信号干预靶点可成为2型糖尿病患者种植区骨量不足治疗的一种潜在手段。
