川麦冬多糖的结构特征及对过度运动小鼠肝损伤的改善作用
2024-02-02任东根龚婷王丽娟关涛
任东根,龚婷,王丽娟,关涛
1(河南科技学院 体育学院,河南 新乡,453000)2(河南中医药大学 药学院,河南 郑州,450046)
运动对机体的影响是双向的,适宜的运动能够提高机体的代谢能力、改善心肺功能,同时还能提高免疫调节能力,然而当运动强度或运动量超出了机体的承受范围,出现过度运动时,易诱发机体出现运动疲劳症状[1]。此时,机体内会产生大量的活性氧(reactive oxygen species,ROS),使细胞内氧化和抗氧化平衡被打破,导致细胞出现严重的氧化应激,对机体的代谢功能和组织细胞造成一定程度损伤,进而产生继发性疾病。肝脏作为人体最大的新陈代谢器官,也是最主要的排毒器官,研究表明,肝脏易受外源刺激,同时在自身的排毒过程中易受到副代谢产物的氧化应激作用[2],另外,较多学者研究认为,机体在受到外源刺激后,体内积累的ROS是导致肝脏功能紊乱和肝脏组织细胞受损的主要原因[3-4]。因此,通过添加外源活性物质降低肝脏组织的氧化应激水平是缓解因过度运动导致肝损伤的有效方法之一。
肝脏组织内有着较复杂的抗氧化应激反应系统,以平衡细胞内的氧化和抗氧化,这些抗氧化应激反应系统里起着关键作用的是一些抗氧化蛋白和各种反应酶类。核转录因子E2相关因子2(NF-E2-related factor 2,Nrf2)是机体内抗氧化应激反应系统中的枢纽,其主导的氧化应激信号通路是较多学者研究的主要通路[5]。研究表明,在降低细胞内氧化应激水平作用上,Nrf2介导的信号通路起着关键作用,该信号通路是保护肝脏免受外源刺激损害的重要靶点[6-7]。腺苷酸活化蛋白激酶(adenylate-activated protein kinase,AMPK)是机体能量代谢中的一种关键酶,研究表明,AMPK可被外源物质诱导产生的ROS激活,进而参与调节细胞内抗氧化蛋白、氧化应激酶水平,在氧化应激系统中同样起着重要作用[8]。AMPK被激活后可以诱导细胞质中Nrf2与Kelch样环氧氯丙烷相关蛋白1解偶联,Nrf2则进入细胞核中与抗氧化应答元件(antioxidant response element,ARE)结合,进而启动该应答元件调控下游抗氧化蛋白和反应酶基因mRNA的高表达[9],从而降低细胞的氧化应激水平,缓解外源物质诱导的损伤。
麦冬(Ophiopogonjaponicus),百合科(Liliaceae),沿阶草属(Ophiopogon)植物,其干燥块根入药,为我国传统中药。目前,麦冬的主要产区为四川和浙江,而以四川三台县的川麦冬产量最大[10]。现代药理研究表明,麦冬含有多糖、多酚、皂苷、氨基酸等活性成分,具有保肝护肝[11]、免疫调节[12]、抑制炎症[13]、改善心肺功能[14]、抗氧化[15]、抑制细胞凋亡[16]等作用。目前,已有研究表明,麦冬多糖可以通过提高体内抗氧化酶活性来缓解外源物质对机体组织的损伤作用[17],然而关于川麦冬多糖对过度运动诱导的小鼠肝损伤的保护作用还未见文献报道,且对其具体的作用机制还不清晰,因此,本研究以AMPK/Nrf2/HO-1信号通路及氧化应激作用为切入点,通过建立小鼠的过度运动疲劳模型,观察肝脏组织的病理变化,并检测相关生化指标和AMPK/Nrf2/HO-1信号通路上的相关抗氧化蛋白和反应酶mRNA的表达量,探讨川麦冬多糖对过度运动引起小鼠肝损伤的改善作用及其作用机制。
1 材料与方法
1.1 材料与试剂
川麦冬:四川省农业科学院经作所提供,采集自四川省绵阳市三台县花园镇,采集块根清洗干净后,室内晾干,切片,厚度在0.5 mm~1 cm,然后在50 ℃烘箱中烘干,烘干至恒重,经中药材粉碎机粉碎,过0.15 mm筛后,4 ℃冷藏备用。样地环境概述如下:年均温度为16.4 ℃,样地海拔486 m,年无霜期为283 d,年降雨量为882.2 mm,年日照时间共计1 290 h。
SPF级昆明小鼠:65只[雄性,4周龄,体重14~16 g,许可证:SCXK(豫)2019-0002]:郑州市惠济区华兴实验动物养殖场,小鼠运动疲劳试验在河南中医药大学附属医院开展,伦理委员会批准文号:syzx202112-012;小鼠普通饲料(D12450B):成都达硕实验动物有限公司。
葡萄糖(glucose,Glc)、甘露糖(mannose,Man)、半乳糖(galactose,Gal)、木糖(xylose,Xyl)、阿拉伯糖(arabinose,Ara)、岩藻糖(fucose,Fuc)、葡萄糖醛酸(glucuronic acid,GlcUA)、鼠李糖(rhamnose,Rha)等单糖标准品,Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒,上海碧云天生物技术有限公司;天冬氨酸氨基转移酶(aspartic transaminase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、蛋白质羰基化(protein carbonylation,PCO)测定试剂盒,南京建成生物工程研究所;Invitrogen TRIzol试剂,赛默飞公司;其余试剂均为分析纯。
1.2 仪器与设备
WF-20中药材粉碎机,中国佛山麦可酷;Delta 1-24 LCS真空冷冻干燥机,德国Christ公司;MS-TS分析天平,瑞士METTLER TOLEDO公司;MCO-15AC CO2细胞培养箱,日本SANYO公司;N-1210BS-WB旋转蒸发仪,日本Eyela公司;CKX53倒置显微镜,日本Olympus公司;Forma 3111 CO2细胞培养箱,美国Thermo公司;SpectraMax L酶标仪,美国Molecular Devices公司;傅立叶红外光谱仪,美国Nicolet公司。
1.3 实验方法
1.3.1 川麦冬多糖提取与纯化
采用传统水提醇沉法获得川麦冬粗多糖[18]。准确称取100 g川麦冬粉末,加入1 L体积分数为95%的乙醇过夜脱脂,后离心(5 000 r/min)去除乙醇,样品置于37 ℃烘箱中烘干。干燥后的川麦冬粉末加入900 mL的蒸馏水,95 ℃水浴2 h,5 000 r/min离心5 min,分离滤液,重复操作2次,合并滤液,旋转蒸发仪减压浓缩滤液后加入9倍体积的95%乙醇,4 ℃静置12 h。离心收集沉淀,风干后加入37 ℃蒸馏水,使沉淀全部溶解。采用Sevag法除去溶液中的蛋白,获得的溶液经7 500 Da分子质量透析袋流水透析3 d,截留透析液,后用真空冷冻干燥机冷冻干燥得到川麦冬粗多糖。
准确称取2 g川麦冬粗多糖,加入20 mL蒸馏水,振荡溶解。0.45 μm的滤膜过滤,滤液上样于DE-52纤维素柱(4.5 cm×80.0 cm),洗脱分离,洗脱条件设定为:洗脱液为氯化钠溶液,浓度0.5 mol/L,洗脱速度设定为1.0 mL/min,每管收集洗脱液5 mL。采用苯酚硫酸法检测监测多糖含量,合并洗脱峰浓缩透析,冷冻干燥,得到川麦冬多糖的半纯品。准确称取半纯品100 mg并用蒸馏水溶解,溶液上样于Sephadex G-100凝胶柱(2.6 cm×100 cm)洗脱分离,洗脱检测条件同粗多糖的分离,收集洗脱峰,浓缩并冷冻干燥,得到川麦冬多糖(Ophiopogonjaponicuspolysaccharides,POJ)。
1.3.2 POJ分子质量测定
准确称取纯化后冻干的POJ粉末0.5 g,加入带刻度的5 mL样品瓶中,加入用无菌蒸馏水配制的0.1 mol/L的NaNO3溶液,至5 mL刻度线,经0.45 μm滤膜过滤。样品溶液在超声波分散器下处理3 min,待测。参考标准SH/T 1759—2007用凝胶渗透色谱法测定POJ样品分子质量。
1.3.3 POJ单糖组成测定
采用PMP-柱前衍生法测定POJ的单糖组成[19]。通过2 mol/L的硫酸酸解POJ,得到POJ的单糖水解溶液。POJ的单糖水解溶液中加入PMP试剂,进行柱前衍生,0.45 μm的滤膜过滤,获得上机液。HPLC的色谱条件设定为:流动相A为0.1 mol/L磷酸盐(KH2PO4-NaOH,pH 7.4)缓冲液,流动线B为色谱纯乙腈,体积比为A∶B=80∶20,柱温设定为35 ℃,检测波长250 nm,单针进样量为20 μL,反应过程中流速设定为1 mL/min。
1.3.4 POJ红外光谱检测
通过傅立叶红外光谱仪测定POJ的红外光谱并比对分析其所含有的功能基团。精确称取POJ冻干粉末5 mg,置于干燥的研钵中,称取1 g溴化钾加入研钵,充分研磨后进行压片,最后上机扫描。扫描参数设定为:共扫描32次,分辨率设定为4 cm-1,扫描范围限定为4 000~400 cm-1。
1.3.5 POJ电镜扫描
取上述冻干的POJ粉末1 g,在60 ℃烘箱进行干燥1 h,然后在真空镀膜仪中对样品进行喷金镀上一层导电层,固定在样品台上,扫描电子显微镜在5 000倍下自动观察。
1.3.6 POJ抗氧化活性测定
通过测定POJ对超氧阴离子自由基、羟自由基以及DPPH自由基的清除率来评价其抗氧化能力。依据OKTAY等[20]的方法完成上述测定,准确称取10 mg POJ置于试管,加入2 mL无菌水,振荡溶解,获得并稀释成0、0.25、0.50、1.00、2.00、4.00、6.00、8.00 mg/mL的工作液备用。采用质量浓度为1 mg/mL的维生素C作为阳性对照,同一质量浓度重复测定3次,计算清除率。
1.3.7 小鼠分组与建模
65只小鼠适应性饲养1周后,通过不负重游泳训练,淘汰不合格的小鼠,将剩余小鼠60只,随机分为5组,每组12只。依次设定为安静对照组(control group,CG)、运动模型组(model group,MG)、川麦冬多糖运动组(POJ,低、中、高剂量依次对应50、100、200 mg/kg,记作POJ-L、POJ-M和POJ-H)。灌胃体积5 mL/kg,安静对照组和运动模型组灌胃等量的无菌生理盐水。
CG组不进行游泳干预,MG、POJ-H,POJ-M和POJ-L组每天进行游泳训练,实验期间,小鼠游泳训练之前分别进行称重,具体的训练方案为第1周每天进行不负重游泳30 min;第2周开始每天进行负重游泳,负重3%小鼠体质量的铅块,游泳训练30 min;第3周每天负重3%小鼠体质量的铅块,游泳40 min;第4周每天负重5%小鼠体质量的铅块,全部游泳至力竭。在4周游泳期间如有小鼠无法训练达到规定时间,则训练至力竭即可。在过度运动游泳时间期间,MG组小鼠死亡2只,POJ-M和POJ-L组各死亡1只,剩余小鼠满足实验要求。
1.3.8 生理生化指标检测
末次游泳训练结束12 h后,引颈法处死小鼠,摘取小鼠眼球并取血,6 000 r/min离心8 min收集血清。完整剥离肝脏并称重,将小鼠肝脏组织部分制成100 g/L的匀浆。按照试剂盒给出的方法测定小鼠血清中ALT、AST的含量,测定匀浆组织中SOD、CAT和GSH-Px的活性,同时测定肝脏组织中MDA和PCO的含量。参考曹智[21]的方法进行肝脏组织染色制片,配制苏木精染液、伊红染液及体积分数为1%的盐酸乙醇分化液,选定肝脏组织,在同一位置上切取组织块,修整成合适大小,流水冲洗12 h,依次进行脱水透明,包埋修块,脱蜡复水、染色封片后,于光学显微镜下观察。
1.3.9 肝脏组织AMPK/Nrf2/HO-1信号通路上相关基因mRNA的表达分析
采用Invitrogen TRIzol试剂,按照说明书方法提取小鼠肝脏组织RNA,按照TaKaRa试剂反转录成cDNA,参考文献王僮[22]进行三步法RT-PCR检测AMPKα、Nrf2、HO-1、SOD、GSH-Px、CAT的mRNA表达水平,以β-actin为内参,采用2-△△Ct法对目的基因进行定量分析。具体的引物序列见表1。

表1 RT-PCR引物序列Table 1 RT-PCR primer sequences
1.4 数据分析

2 结果与分析
2.1 POJ的分离纯化和分子质量测定
通过水提醇沉法从100 g的川麦冬粉末中,提取出川麦冬粗多糖14.48 g,得率为14.48%。2 g川麦冬粗多糖通过DE-52纤维素柱以及Sephadex G-100凝胶柱的分离洗脱,最终冻干获得POJ干粉108 mg,计算出从川麦冬粗多糖粉末中提取到纯多糖的得率为5.4%。
通过GPC软件分析得到POJ的相对分子质量,结果见图1,其Z均分子质量(Mz)为21 755 Da,z+1均分子质量(Mz+1)为24 138 Da,重均分子质量(Mw)为19 315 Da,最高峰值处的分子质量(Mp)为18 140 Da,数均分子质量(Mn)为17 005 Da。分散度D(Mw/Mn)为1.14。研究表明,不同的提取方法所得的多糖分子质量会有较大的差异,王小梅等[23]通过不同超声波功率提取麦冬多糖,发现提取的麦冬多糖分子质量分布在几千到几十万间,这与本研究通过热水浸提的多糖分子质量差距较大,可能原因是超声波的能量较大,能将大分子多糖全部提取出来,而通过热水浸提时难以提出大分子多糖,还可能是热水可以使大分子多糖链断裂变成较多的短链分子多糖。另外,周彬等[24]通过不同温度浸提麦冬多糖时,发现随着浸提温度的提高,麦冬多糖的浸出率显著升高,多糖的分子质量随着浸提温度的升高而变小,通过热水浸提的麦冬多糖分子质量分布为4 000~19 000 Da,这与本研究提取的多糖分子质量分布差异较小。
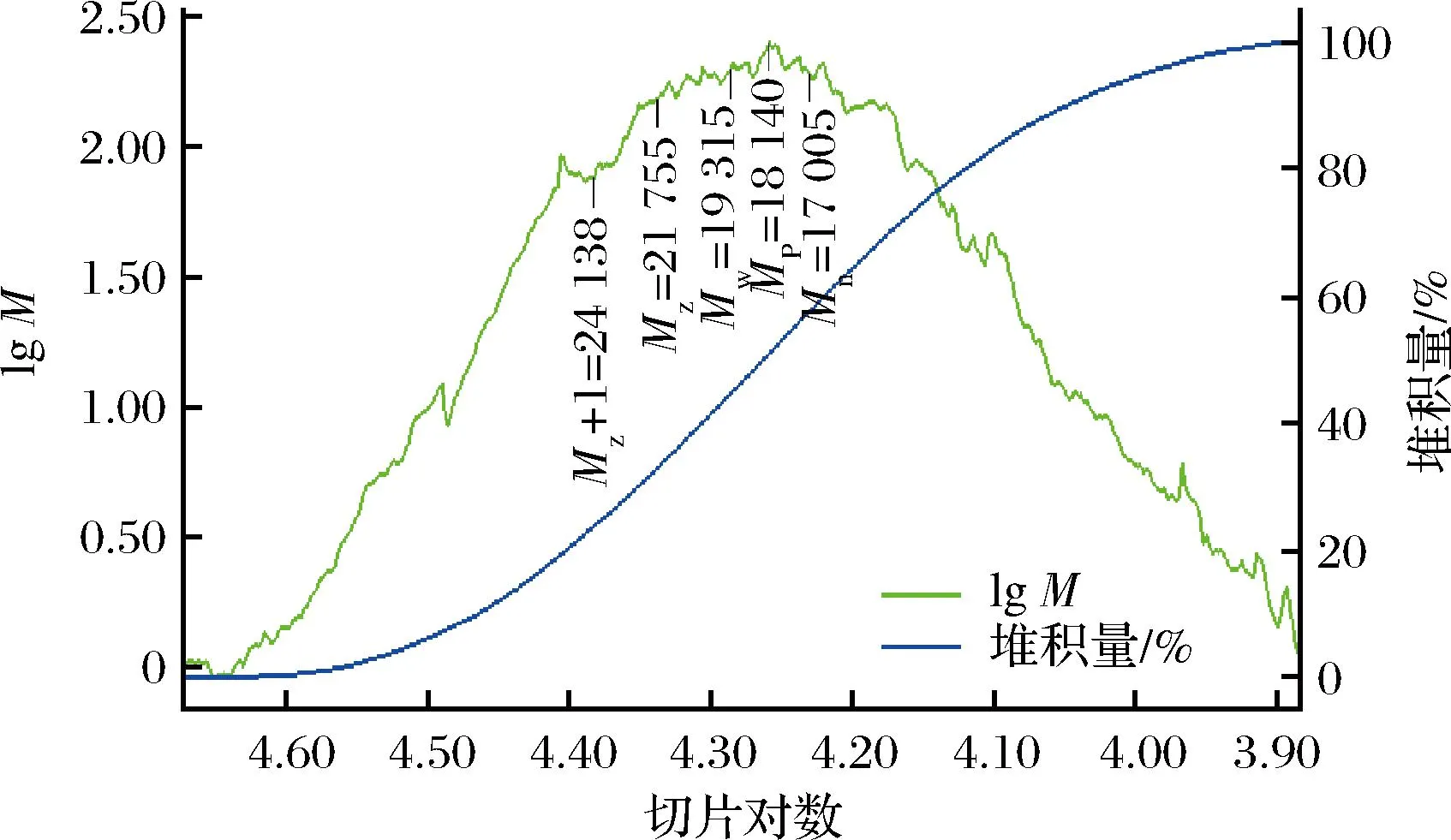
图1 POJ分子质量Fig.1 Molecular weight of POJ
2.2 POJ单糖组分分析
准确称取Glc、Man、Gal、Xyl、Ara、Fuc、GlcUA、Rha各100 mg,分别配制质量浓度为0.05、0.1、0.2、0.5、1、2 mg/mL的8种单糖标准液,各上样品20 μL,以各单糖浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归,回归方程见表2。

表2 各单糖的线性回归Table 2 Linear regression of monosaccharides
通过PMP柱前衍生法测定了POJ的单糖组成(图2)。图2-A为8种单糖标准品的HPLC图,可以看出8种单糖能够很好得被分开,图2-B为POJ的HPLC图,通过与标准单糖比较,结果表明,POJ主要由Glc、Man、Gal以及少量Xyl组成,通过标准单糖的线性回归方程,计算得出POJ的水解产物中Glc∶Man∶Gal∶Xyl摩尔比为4.35∶5.21∶1.34∶1。王小梅等[25-26]在对产地为浙江的浙麦冬多糖单糖分析时发现浙多糖样品只含有葡萄糖,然而其在2013年时对其他浙江麦冬多糖的单糖组成分析时发现主要由葡萄糖、甘露糖、半乳糖、木糖、阿拉伯糖组成,这一结果与本研究的川麦冬多糖的单糖组成较相似,可见,不同产地麦冬多糖的单糖组成有一定差异。
2.3 POJ的红外光谱


A-8种单糖-PMP衍生物色谱分离图; B-POJ-PMP衍生物色谱分离图图2 样品PMP衍生化产物色谱图Fig.2 Chromatograms of PMP derivatization for the samples

图3 POJ红外光谱吸收图谱Fig.3 Infrared absorption spectra of POJ
2.4 POJ扫描电镜
POJ的扫描电镜见图4,POJ在2 000倍电镜下,多糖呈现不规则颗粒状,颗粒表面不平整且颗粒分散不粘连。在5 000倍电镜下,多糖颗粒上有叠加层,凹凸不平,颗粒周围部分呈现锯齿状,另外,表面有裂纹,呈交联式的立体结构,说明,POJ颗粒并不只是多糖片层的叠加而是通过某种结构连接成的立体形态。
2.5 POJ的抗氧化活性

A-2 000倍;B-5 000倍图4 POJ电镜图Fig.4 Electron microscope image of POJ

2.6 POJ对小鼠肝组织氧化指标的影响
如表3所示,MG组小鼠的内源性抗氧化酶系(SOD、CAT、GSH-Px)的活性相较于CG组均出现极显著的下降(P<0.01),而MDA和PCO的含量却极显著的升高(P<0.01)。与MG相比,POJ-L、POJ-M、POJ-H组SOD、CAT、GSH-Px的活性均逐渐显著升高(P<0.05),MDA、PCO含量则逐渐显著降低(P<0.05),可见,小鼠灌胃POJ后,提高了肝脏组织抗氧化酶活性,并降低了细胞的脂质过氧化,从而缓解了细胞的氧化应激损伤。与POJ-L相比,POJ-M的SOD、CAT、GSH-Px的酶活性均显著升高(P<0.05),MDA、PCO的含量进一步显著降低(P<0.05),POJ-H组SOD、CAT、GSH-Px的酶活性均极显著升高(P<0.01),MDA、PCO的含量极显著降低(P<0.01),由此可见,在提高肝脏组织抗氧化酶活性上,POJ质量的浓度越高,细胞内抗氧化酶活性越强。

A-POJ对DPPH自由基的清除能力;B-POJ对·OH的清除能力;C-POJ对的清除能力图5 POJ对DPPH自由基的清除能力Fig.5 Scavenging capacity of POJ to DPPH, ·OH, and

表3 POJ对小鼠肝组织氧化损伤的影响Table 3 Effects of POJ on oxidative damage of liver tissue in mice
2.7 POJ对小鼠血清转氨酶ALT、AST的影响
血清中ALT、AST是临床上常用于反映肝功能异常的指标,ALT、AST存在于肝脏组织中,当肝脏受到损伤后,则会渗透到血液,血清中转氨酶的活性越高说明肝脏受损程度越高[28]。表4统计了小鼠血清中ALT和AST的浓度。与CG相比,MG组血清ALT和AST的含量显著升高,说明过度运动造成了小鼠肝脏严重损伤。与MG相比,POJ-L,POJ-M、POJ-H组小鼠血清ALT分别显著降低了47.90%、51.16%、66.17%(P<0.05),AST分别显著降低了20.46%、32.38%、39.69%(P<0.05)。另外与POJ-L相比,POJ-H组ALT、AST分别极显著降低了35.07%和24.18%(P<0.01)。结果表明,POJ缓解了过度运动对小鼠肝脏造成的损伤,且随着POJ质量浓度的增加,其缓解损伤效果随之增强。
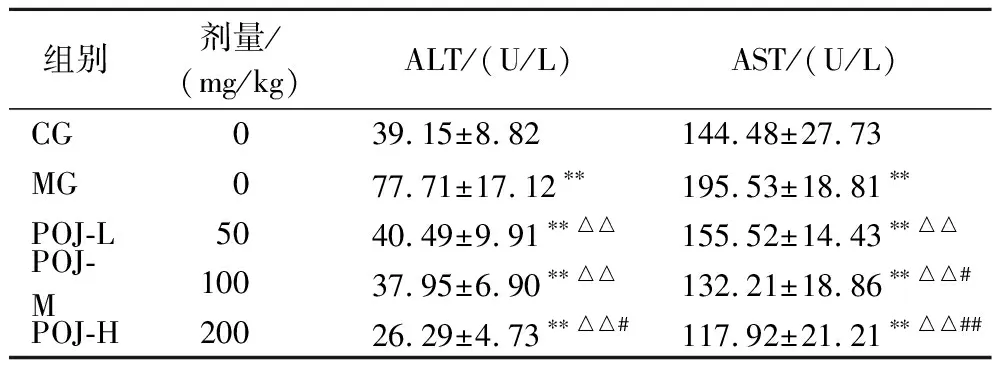
表4 POJ对小鼠肝功能的影响Table 4 Effects of POJ on the liver function of mice
2.8 POJ对小鼠肝脏的影响
结果如图6所示,CG组的小鼠肝脏组织结构、细胞形态完整(图6-A),细胞核清晰可见,细胞质均匀。MG组小鼠肝细胞发生肿胀(图6-B,箭头1),细胞核偏移(图6-B,箭头2),细胞间隔模糊,细胞内出现大量的脂肪变性空泡,有大量脂质颗粒(图6-B,箭头3),可见,运动模型组肝脏细胞损伤较为严重。小鼠灌胃POJ后,POJ-L组小鼠肝细胞核移位明显减少(图6-C,箭头1),胞核裂变减少(图6-C,箭头2),但细胞肿胀还是较多,空泡现象较严重;POJ-M组小鼠肝细胞核逐渐清晰(图6-D,箭头1),核移位进一步减少(图6-D,箭头2),但仍然存在一定的空泡现象;POJ-H组小鼠肝细胞形态逐步恢复正常,胞浆丰富,空泡和浊肿变性明显减少(图6-E,箭头1、2)。
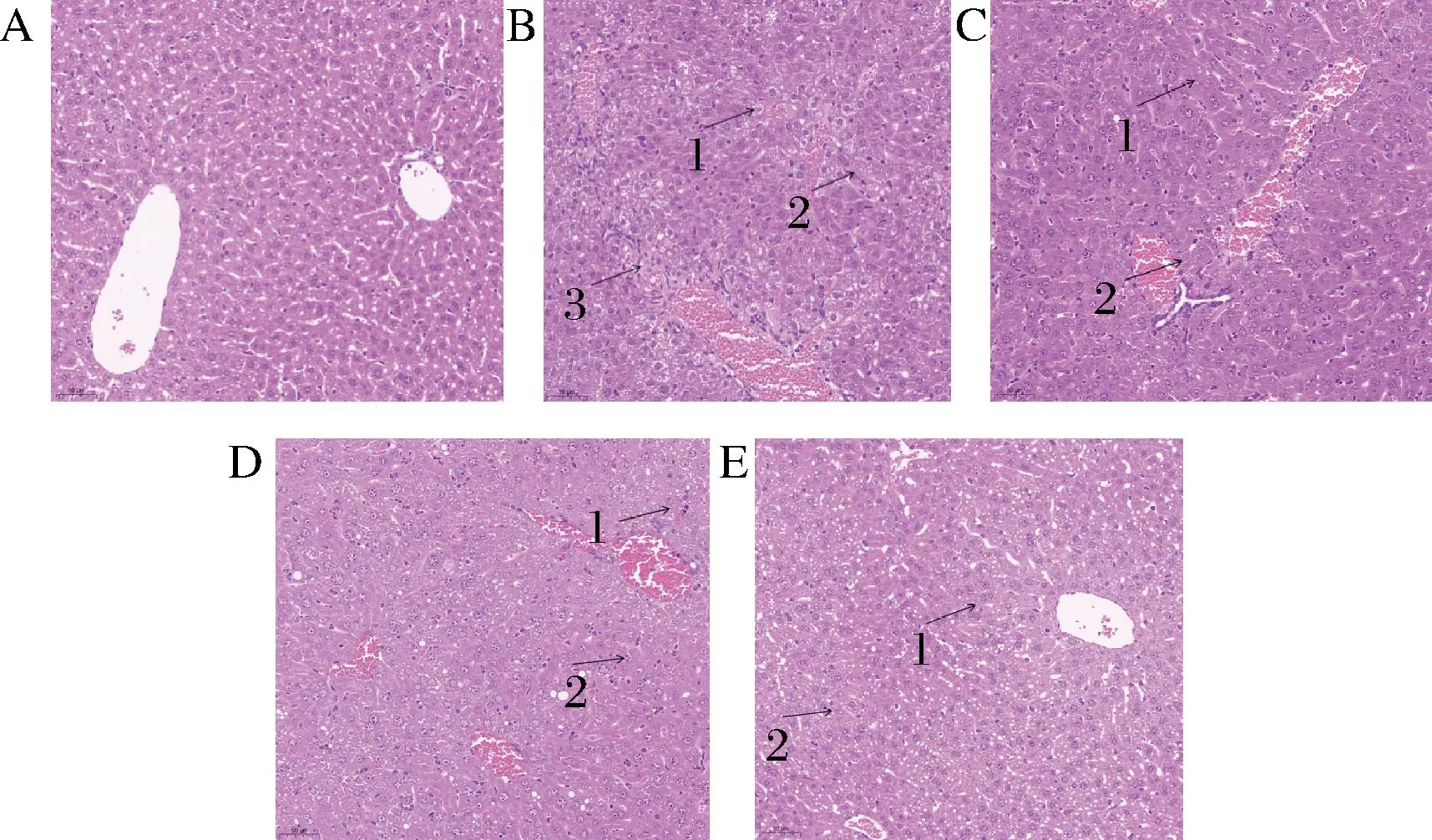
A-安静对照组(CG);B-运动模型组(MG); C-POJ低剂量运动组(POJ-L);D-POJ中剂量 运动组(POJ-M);E-POJ高剂量运动组(POJ-H)图6 小鼠肝脏组织病理学变化Fig.6 Pathology changes of liver in mice注:比例尺=50 μm。
2.9 POJ对肝脏组织AMPK/Nrf2/HO-1信号通路上相关基因mRNA表达的影响
AMPK/Nrf2/HO-1信号通路是研究肝脏氧化损伤的重要通路,共检测了该信号通路上AMPKα、Nrf2、HO-1、SOD、GSH-Px、CAT六种mRNA相对表达水平(图7)。由图7可知,与CG相比,过度运动组(MG、POJ-L、POJ-M、POJ-H)组中AMPKα、Nrf2、HO-1的mRNA表达量均极显著升高(P<0.01),表明过度运动使肝脏细胞内产生了较多的ROS,从而激活了该信号通路,使下游相关基因出现高表达;与MG相比,POJ-L、POJ-M、POJ-H组中AMPKα、Nrf2、HO-1的mRNA表达量均极显著升高,表明POJ可进一步提高该信号通路上相关基因的表达;与POJ-L相比,POJ-M、POJ-H组中AMPKα、Nrf2、HO-1的mRNA表达量均出现不同程度的提高,可见,POJ提高AMPK/Nrf2/HO-1信号通路上相关基因的表达与浓度成正比。

A-POJ对AMPKα的mRNA表达的影响;B-POJ对Nrf2的mRNA表达的影响;C-POJ对HO-1的mRNA表达的影响图7 POJ对AMPKα、Nrf2、HO-1的mRNA表达的影响Fig.7 The effect of POJ on the mRNA expression of AMPKα, Nrf2 and HO-1注:与CG相比,*表示P<0.05,**表示P<0.01;与MG相比,△表示P<0.05,△△表示P<0.01;与POJ-L相比,#表示P<0.05,##表示P<0.01;下同。
2.10 POJ对肝脏组织抗氧化酶基因mRNA表达的影响
SOD、GSH-Px、CAT为AMPK/Nrf2/HO-1信号通路的下游抗氧化酶基因,该信号通路的激活可以促进下游抗氧化酶相关基因的高表达,从而清除细胞内过多的ROS,维持细胞的氧化抗氧化平衡。由图8可知,与CG相比,MG组中SOD、GSH-Px、CAT的mRNA的表达水平均略低,但不存在显著差异(P>0.05),可见,过度运动产生的大量ROS抑制了抗氧化酶基因的表达,从而使肝脏组织细胞处于氧化应激状态,该结果与上述抗氧化酶活性结果相应证;与MG相比,POJ-L、POJ-M、POJ-H组中3种抗氧化酶mRNA的表达水平均极显著升高(P<0.01),且随着POJ质量浓度的升高,3种抗氧化酶mRNA的表达水平均随之显著升高,结果表明,POJ可提高AMPK/Nrf2/HO-1信号通路的下游抗氧化酶(SOD、GSH-Px、CAT)基因的表达。

A-POJ对SOD的mRNA表达的影响;B-POJ对GSH-Px的mRNA表达的影响;C-POJ对CAT的mRNA表达的影响图8 POJ对SOD、GSH-Px、CAT的mRNA表达的影响Fig.8 The effect of POJ on the mRNA expression of SOD, GSH-Px and CAT
3 讨论
多糖是一类由一种或几种单糖聚合而成的多聚物,明确其单糖组成及异头碳的构型对其生理活性的研究十分必要。ZHANG等[29]、金鑫等[30]研究认为,多糖的单糖组成中含有少量木糖时,其抗氧化活性更强。本研究中分离纯化后POJ的单糖组成包括葡萄糖、甘露糖、半乳糖以及少量木糖,通过抗氧化活性分析表明POJ具有较高的清除自由基能力。结合红外光谱中3 365 cm-1处的吸收峰论证出O—H的存在,可以推测POJ具有一定的还原性,具有抗氧化活性[31]。此外,相关研究证实,强化免疫是多糖的一个重要的生理活性,而β-型异头碳是保证此活性的重要条件之一,889 cm-1左右较小的特征吸收峰证明POJ具有β-构型的异头碳,说明POJ可能具有免疫强化的活性[32]。另有研究表明,多糖的抗氧化活性除了与多糖的单糖组成、分子构象有关,还与其分子质量紧密相关。SU等[33]、YANG等[34]研究表明,纯化后多糖的分子质量与其生物活性之间存在密切关系,分子质量越高,多糖的生物活性越强,其清除自由基的能力越高,本研究提取纯化后的POJ重均分子质量为19 315 Da,数均分子质量为17 005 Da,本研究提取纯化后的POJ分子质量相对较大,其可能具有较高的生物活性。
研究表明,过度运动作为外应激源,易诱发机体发生氧化应激[7]。肝是人体最大的脏器,也是人体新陈代谢的中心,在过度运动疲劳状态下,肝细胞中会产生大量的代谢产物如ROS和一氧化氮(nitric oxide,NO),这些代谢产物被认为是导致肝功能紊乱的主要元凶。细胞内积累的ROS会攻击体内脂肪产生脂质过氧化产物MDA,MDA则会使细胞膜发生氧化损伤,从而改变细胞膜的通透性,另外,ROS还会直接作用于肽键,使蛋白质发生氧化损伤出现PCO,因此,MDA和PCO是机体氧化损伤的重要标志[35]。SOD、GSH-Px、CAT作为机体重要的抗氧化酶系,可以清除体内过多的ROS,降低细胞的氧化应激水平,保护细胞免受氧化应激损伤。本研究结果表明,过度运动导致小鼠肝脏组织内MDA和PCO含量显著升高,而抗氧化酶(SOD、CAT、GSH-Px)活性显著降低,在补充POJ后,肝脏组织内MDA、PCO含量显著降低,抗氧化酶活性则显著升高,另外,还发现补充的POJ剂量越高,细胞内抗氧化酶活性越强,这一研究结果与李明[36]、SUN等[37]的研究结果相似。此外,FAN等[38]研究发现POJ能够提高大鼠血清和心肌细胞中抗氧化酶活性,从而缓解心脏组织的氧化损伤,ZHANG等[39]研究发现POJ能够提高糖尿病大鼠心脏组织抗氧化酶活性,降低MDA含量,维持机体内抗氧化酶水平,从而改善心血管功能。这些研究和本研究结果均显示,补充POJ后能明显提高体内抗氧化酶活性,保护机体免受氧化应激损伤。
AMPK/Nrf2/HO-1信号通路在抗氧化、抗炎、提高免疫、保护细胞免受损伤等作用上,均发挥着重要作用。研究表明,该信号通路是机体细胞内调节氧化应激水平的重要信号途径[40-41]。在肝脏的氧化应激作用上,已有较多学者研究发现,该信号通路上的Nrf2转录因子不仅能被外源物质激活还能被AMPK激活,激活后的Nrf2能从二聚体中解离进入细胞核并出现高表达,继而与抗氧化应答元件ARE结合,诱导下游抗氧化酶基因的高表达,从而降低肝细胞的氧化应激反应[42-43],LEE等[44]研究表明,激活肝脏组中AMPK/Nrf2/HO-1信号通路有利于缓解细胞的氧化应激作用。本研究结果显示,运动模型组小鼠肝脏组织中AMPKα、Nrf2、HO-1的mRNA的均出现了高表达,可见,过度运动作为外源物质激活了AMPK/Nrf2/HO-1信号通路,与运动模型组相比,在补充POJ后,AMPKα、Nrf2、HO-1的mRNA的表达量进一步显著提高。此外,运动模型组中AMPK/Nrf2/HO-1信号通路下游抗氧化酶(SOD、GSH-Px、CAT)基因的mRNA表达量出现了一定程度的下降,说明此时的肝脏组织处于较严重的氧化应激中,推测大量激增的ROS导致肝脏抗氧化水平不足以应对,抗氧化酶活性均低于正常水平。补充POJ后,肝脏中抗氧化酶(SOD、GSH-Px、CAT)基因的mRNA表达量均出现了显著提高,说明,POJ可大大的激活AMPK/Nrf2/HO-1信号通路,促进下游SOD、GSH-Px、CAT的mRNA的高表达。近年来较多的研究表明,机体处于疲劳状态时,不仅肝脏组织会受到一定程度损伤,还常常伴随着肠道菌群紊乱,肠道和肝脏看上去是体内2个作用完全不同的器官,然而当肠道菌群紊乱时,会增加肠道的通透性,使肠道内的一些毒素向外渗,其经过血液循环流向肝脏,进一步加剧了肝脏组织的损伤[45-46]。因此,下一步将会研究POJ是否会改善过度运动疲劳状态下小鼠的肠道菌群,以期进一步解析POJ对运动疲劳小鼠的具体作用机制。
4 结论
本研究通过热水浸提并纯化得到POJ,凝胶渗透色谱分析显示POJ重均分子质量为19 315 Da,数均分子质量为17 005 Da。经单糖组成分析发现,POJ是由葡萄糖、甘露糖、半乳糖、木糖组成,摩尔比为4.35∶5.21∶1.34∶1,红外光谱显示POJ的异头碳为β构型,体外抗氧化结果表明,在一定范围内,POJ清除自由基的能力随着质量浓度的增加而显著提高。肝脏损伤模型结果显示,POJ能显著提高肝脏组织抗氧化酶活性,同时还具有修复肝脏细胞损伤的作用;此外,还发现POJ能激活AMPK/Nrf2/HO-1信号通路,提高该信号通路上抗氧化蛋白和酶基因mRNA的表达;结果表明,POJ具有改善过度运动引起小鼠肝脏氧化损伤的作用。由此可见,川麦冬多糖可作为运动添加剂应用于功能食品上。
