选择性COX-2抑制剂引起心血管风险的研究进展
2024-02-01冉娅娟雷筱梅综述审校
黄 勇,李 頔,王 娜,冉娅娟,雷筱梅 综述 钱 妍 审校
重庆医科大学附属第二医院药学部(重庆 400010)
目前临床上广泛使用的抗炎药物主要有两种,甾体抗炎药(steroidal anti-inflammatory drugs,SAIDs)和非甾体抗炎药[1](non-steroid anti-inflammatory drugs,NSAIDs)。其中NSAIDs 是最常用的抗炎药物[2],全世界每天有上亿人服用[3]。2019 年全球NSAIDs 市场规模为155.8 亿美元,预计在2027 年将达到243.5 亿美元[4]。所有NSAIDs 通过抑制环氧合酶(cyclooxygenase,COX)的亚型COX-1 和/或COX-2 发挥作用,该酶参与疼痛和炎症有关的前列腺素的形成[5]。NSAIDs通过抑制COX-1 和/或COX-2,抑制前列腺素的合成,产生抗炎、解热和镇痛的作用,常用于调节炎症、发热和疼痛,但也会引起一系列的不良反应,比如损害胃肠道粘膜,升高血压,损害肾功能,并导致不良心血管事件,尤其是对老年人和心血管疾病患者来说风险更高[6-7]。越来越多的证据表明,长期服用NSAIDs,尤其是选择性的COX-2抑制剂,不论是在有已知疾病的患者中还是健康人群中,将显著增加心血管疾病的风险[8-9]。我们就选择性COX-2 抑制剂引起心血管风险的研究进行综述,以期为临床合理用药提供参考,减少不良反应,提高用药安全性。
1 NSAIDs的分类与发展
NSAIDs 最早的类型是从柳树皮中提取的口服水杨酸酯类化合物[10],在19 世纪中叶被用来缓解疼痛、发热和炎症反应。对这类天然化合物的研究,促成了世上第一个NSAIDs——阿司匹林于1898 年诞生[11]。至今阿司匹林仍然是世界上最常用的药物之一,每年大约消耗4万吨[12]。非阿司匹林类NSAIDs例如布洛芬于20 世纪60 年代初推出[13],此后种类迅速增多,发展至今已有上百种药物[14],按化学结构主要可分为以下几类:水杨酸类药物(如阿司匹林)、邻氨基苯甲酸衍生物(如甲芬那酸)、乙酸衍生物(如吲哚美辛、双氯芬酸醋、酮咯酸、舒林酸)、丙酸衍生物(如布洛芬、萘普生、酮洛芬和氟比洛芬)和烯酸衍生物(如吡罗昔康、美洛昔康)[15-18]。而根据其对COX 的选择性可以将其分成COX-1 选择性抑制剂(如小剂量阿司匹林)、COX 非选择性抑制剂(如布洛芬、萘普生)和COX-2选择性抑制剂。COX-2 选择性抑制剂又可分为COX-2 倾向性抑制剂(如美洛昔康、尼美舒利)和高选择性COX-2抑制剂(此类药物又称为考昔类,代表药有塞来考昔、罗非考昔等)[19-20]。
2 COX-2选择性抑制剂
2.1 COX-2选择性抑制剂的发展
COX-1 在胃肠组织中广泛表达,因此NSAIDs 对COX-1的抑制作用,会导致一系列胃肠道反应(如恶心呕吐,胃或十二指肠出血或穿孔),这也是非选择NSAIDs 最常见的不良反应[21],而NSAIDs 的抗炎镇痛作用主要来自对COX-2 的抑制作用[22]。开发COX-2抑制剂是克服NSAIDs 介导的胃肠道副作用的首要策略,这样做的目的是希望NSAIDs提供抗炎镇痛作用的同时,减少胃肠道毒性[23]。1999 年第一个COX-2 抑制剂塞来考昔在美国获批上市,几个月后罗非考昔也在美国获批上市,这两个药物分别于2000年和2001年引入我国。2001 伐地考昔在美国获批上市,但我国并未引入。2002年依托考昔和帕瑞考昔(伐地考昔的前药)在欧洲上市,2008年引入我国。2003年双氯芬酸的类似物——罗美考昔首次在墨西哥上市,我国未引入。艾瑞昔布是我国自主研发的1.1类创新药,于2011年6月在我国获批上市。
2.2 抑制COX-2的心血管风险
临床研究表明,长期使用COX-2 抑制剂可能会促进心血管疾病的发生,包括动脉粥样硬化(冠心病)、高血压、心肌梗死、中风、心力衰竭、心律失常和心源性猝死等[24-25]。2001 年发表的VIGOR(Vioxx Gastrointestinal Outcomes Research)研究是表明NSAIDs 会造成心血管疾病风险的最早试验之一。该研究发现,罗非考昔组心肌梗死事件的发生次数是萘普生组的近5倍[26],同 期 的CLASS(Celecoxib Long-Term Arthritis Safety Study)试验没有观察到塞来考昔、双氯芬酸和布洛芬导致心血管事件的差异[27]。2004年,默克公司宣布,由于心血管风险增加,罗非考昔撤市。这项决定是基于APPROVe(Adenomatous Polyp Prevention on Vioxx)试验,在这项研究中,2 586名患者随机接受罗非考昔或安慰剂治疗,原本计划进行为期3 年的6 项研究,最终由于罗非考昔组心血管事件的增加,试验提前2 个月终止[8]。1年后,伐地考昔也因心肌梗死和中风等严重心血管事件而撤市[28]。罗美考昔也因心血管风险未能在美国上市[29]。2006 年 发 布 的MEDAL(Multinational Etoricoxib and Diclofenac Arthritis Long-Term)试验的主要目的是评估选择性COX-2 抑制剂与传统NSAIDs 的血栓栓塞风险,这项研究在2002年至2006年间纳入了34 701 名患者,患者被随机分配服用依托考昔或双氯芬酸,结果表明依托考昔组和双氯芬酸组血栓栓塞的发生率无差异[30]。这项研究的局限性在于没有设计安慰剂组,而且当时认为双氯芬酸是传统NSAIDs,但现在普遍认为双氯芬酸更倾向于抑制COX-2[31],这也很好的解释了双氯芬酸和依托考昔有近似的心血管风险。
随着研究的深入,越来越多的研究发现非选择性的NSAIDs也能引起心血管风险。2012年,OLSEN等发布了一项全国性的队列研究,该研究跟踪了1997年至2009 年首次入院治疗心肌梗死的99 187 名患者,其中43 608 例患者在心肌梗死后服用了NSAIDs(其中最常用的非选择性NSAIDs 是布洛芬、双氯芬酸和萘普生,最常用的COX-2 抑制剂是罗非考昔和塞来考昔),研究发现,服用NSAIDs不仅会增加既往冠心病患者的心血管风险,而且与未服用NSAIDs 的患者相比,在心肌梗死5年后继续使用NSAIDs仍会增加心血管风险[32]。
2014 年BAVRY 等发布的一项研究调查随访了1993 年至1998 年间,来自美国40 个临床中心的161 808名年龄在50~79岁的绝经后女性,她们被分成了常规使用或者不适用NSAIDs两类,其中53 142例受试者报告在某个时间点定期使用NSAIDs,与未使用NSAIDs 相比,定期使用选择性COX-2 抑制剂,以及使用对COX-2 抑制作用更强的非选择性抑制剂的人群中,心血管事件的风险增加[33]。2016 年发布的PRECISION(Prospective Randomized Evaluation of Celecoxib Integrated Safety Versus Ibuprofen or Naproxen)试验[34]在8年的时间里共纳入24 081名患者,随机分配患者服用塞来昔布、布洛芬或萘普生。结果表明塞来昔布、布洛芬和萘普生引起心血管事件的比例组间无显著差异。引起该结果可能与试验中,69%的患者停用了研究药物,27%的患者停止了随访,另外塞来昔布的处方剂量(平均209±32 mg)比以往随机研究中使用的剂量低,萘普生(平均剂量852 ± 103 mg)和布洛芬(2 045±246 mg)的剂量与以往随机研究中使用的剂量相似或更高等因素有关。这些试验也说明非选择性的NSAIDs也能引起心血管事件,这其中的机制还需进一步研究。
与非选择性NSAIDs相比,选择性COX-2抑制剂对胃肠道更安全。但有明确的证据表明,COX-2 抑制剂具有显著的心血管风险,且大多心血管不良事件发生在风险增加的患者中[35]。与其他非选择性NSAIDs 或选择性COX-2抑制剂相比,萘普生是心血管风险最低的NSAIDs。2006 年KEARNEY 等发布的一项meta 分析显示,COX-2 抑制剂和高剂量的布洛芬与严重的心血管事件(主要是心肌梗死)的风险增加有关,但与萘普生无关[36]。2011 年TRELLE 等发布的另一项meta分析验证了这一发现,该研究显示,COX-2 抑制剂增加了心肌梗死的风险,萘普生可能危害最小[37]。2013年BHALA等发表的一项meta分析结果表明,与安慰剂相比,使用COX-2 抑制剂心血管事件(主要是冠状动脉事件)增加约1/3,塞来昔布的心血管风险呈现出了剂量相关性,布洛芬和萘普生均采用的高剂量,无法比较它们的剂量依赖性,但是研究结果表明高剂量布洛芬的心血管风险可能与选择性的COX-2抑制剂相当,而高剂量萘普生与其他NSAIDs 相比,心血管风险较小[38]。另外,在GISLASON 等发布的一项针对107 092名心衰患者的观察性研究中,罗非考昔、塞来考昔、双氯芬酸、布洛芬、萘普生等常见的NSAIDs 呈现出了不良结局的剂量相关性[39]。在FOSBØL 等发布的一项针对1 028 437 名没有心血管疾病的健康个体的回顾性队列研究中,选择性COX-2 抑制剂如罗非考昔、塞来考昔、双氯芬酸的心血管风险呈剂量相关性[40]。本文中有关NSAIDs心血管风险的RCT结果、观察性研究结果和meta分析结果分别见表1、表2、表3。

表1 本文中有关NSAIDs心血管风险的RCT结果Table 1 Results of RCTs on cardiovascular risks of NSAIDs in this paper
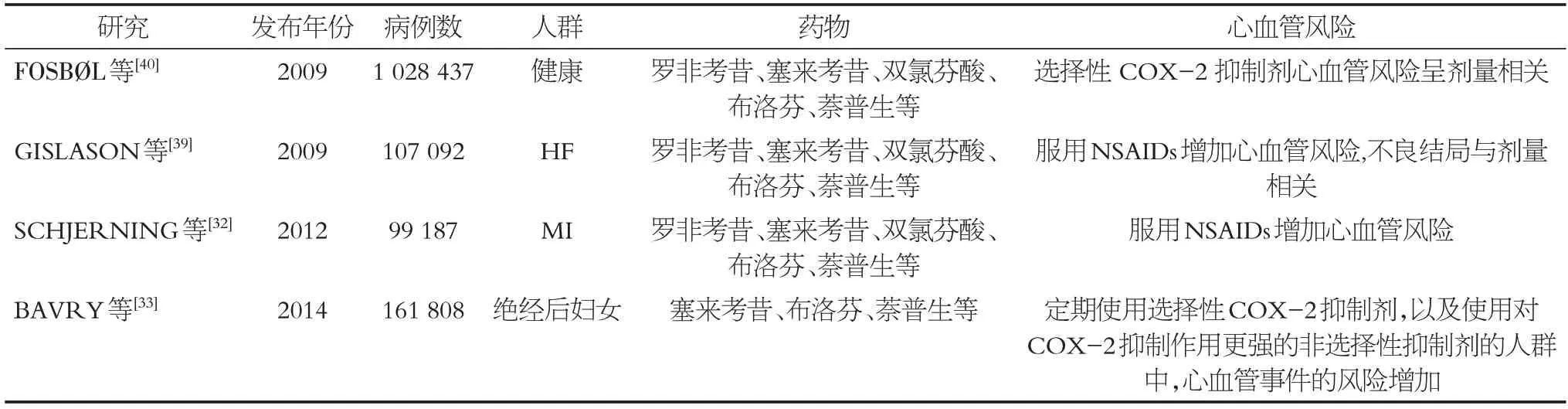
表2 本文中有关NSAIDs心血管风险的观察性研究结果Table 2 Observational study results on cardiovascular risks of NSAIDs in this paper

表3 本文中有关NSAIDs心血管风险的meta分析结果Table 3 Meta-analysis results on cardiovascular risks of NSAIDs in this paper
3 COX的特性
3.1 COX的生理学性质
NSAIDs 的主要作用机制是通过抑制COX 进而阻断花生四烯酸转化为前列腺素类化合物:前列腺素E2(prostaglandin E2,PGE2)、前列腺素D2(prostaglandin D2,PGD2)、前列腺素F2a(prostaglandin F2a,PGF2a)、前列环素(prostacyclin,PGI2)和血栓素A2(thromboxane A2,TXA2)[41-42]。COX 也被称为前列腺素类过氧化物合成酶,是催化花生四烯酸转化为前列腺素H2(prostaglandin H2,PGH2)的第一种酶,PGH2 被下游的合成酶进一步代谢成上述的一系列前列腺素类化合物[43]。COX 以3 种亚型存在:COX-1、COX-2 和COX-3。目前认识到的功能酶只有COX-1 和COX-2[44],而COX-1和COX-2是同源二聚体,氨基酸序列相似性超过60%,尽管其整体结构相似,但具有不同的生物学功能[45-47]。COX 是一种构成酶[48],在胃、肾脏和血小板等多种组织中合成[49],通常参与多种动态平衡,如调节周围血管阻力,血小板聚集,维持肾血流量,保护胃粘膜等[50]。COX-2是一种诱导酶[51],它在炎症、癌症和组织损伤部位表达明显上升[52-53],但有研究发现,COX-2在肾、某些血管、脑、肠道、胸腺等特定结构和区域也有结构性表达,且内皮细胞中结构性表达的COX-2具有保护心血管系统的作用[54-55]。而诱导产生的COX-2会诱发疼痛、发热和肿胀,甚至与各种癌症、过敏、关节炎和中风有关[56]。COX-3 是COX-1 的剪接变体,其与COX-1 基因相似,但内含子不同,主要表达于大脑,仅占COX-1活性的20%,且功能尚不清楚[57-58]。
3.2 抑制COX-1和COX-2的作用
COX-1和COX-2是心血管系统中极其重要的酶,具有一系列不同的,甚至是相反的功能[54]。TXA2主要由COX-1 在血小板中合成,导致血小板聚集、血管收缩、平滑肌增厚[59]。相反,在血管内皮细胞中,PGI2 的合成在很大程度上是由COX-2介导的,可抑制血小板聚集,舒张血管,抵抗平滑肌增殖,对心血管有显著的保护作用[60]。PGI2 还可以与作用于血小板PGI2 受体(prostacyclin I2 receptor,IP 受体)相互作用,这是一种G 蛋白偶联受体,当被PGI2 结合时,能延缓血小板聚集[61]。TXA2 和PGI2 对血栓形成和动脉粥样硬化具有拮抗作用,因此,两者的平衡对良好的心血管健康和维持血管内环境稳定至关重要[12]。抑制COX-1 可以降低血栓形成的风险,但也会抑制PGE2 的胃保护作用,从而容易导致胃溃疡和出血,抑制COX-2可以减轻疼痛和炎症,但也能阻断血管壁的血管扩张和抗血小板作用[60]。随着典型COX抑制剂NSAIDs的广泛使用,这些药物已显示出一系列不良反应的风险[62]。
3.3 COX-2引起心血管风险的作用机制
虽然COX-2 引起心血管风险的机制还不是很清楚,但目前的研究认为,主要还是影响血管和肾脏结构性表达的COX-2 引起的。在一定范围内,一个健康、受保护的心血管系统是PGI2活性超过TXA2活性的系统。COX 通过调节PGI2 与TXA2 的比值,起着调节心血管稳态的重要作用,不平衡的TXA2/PGI2 比值改变了心血管稳态,导致各种心血管并发症。COX-2 在心血管系统中是一种有益的蛋白,抑制或敲除小鼠的COX-2基因会导致小鼠血栓形成增加、血压升高、出血时间缩短等,在临床上也会增加患者动脉粥样硬化的负担[63-65]。COX-2 还具有心肌保护作用,可以减轻心肌缺血再灌注损伤,促进心肌缺血后左室压的恢复[66]。
COX-1和COX-2在肾脏中均有表达,且它们对肾功能的影响是相反的。抑制肾脏COX-1 表达可通过增加钠排泄来降低血压,而抑制肾脏COX-2表达可导致钠和水潴留,从而使血压升高[16]。抑制肾脏COX-2表达还会诱导血管收缩因子的产生,如血管加压素和内皮素-1,这也会导致水潴留,使总血量增加,并导致收缩压和舒张压的改变,这些改变最终会导致心脏并发症发生[67]。因此NSAIDs 的选择性将干扰肾功能和体液调节平衡,引起体液潴留和血压升高,这些改变对血压正常患者影响较小,但是会升高高血压患者的血压,并削弱降压药物的作用,进而引起严重的并发症[16,68]。
4 小结与建议
对于有心血管风险的患者使用NSAIDs,目前没有专家共识作为指导。美国食品药品监督管理局对所有NSAIDs发出了心血管风险的警告,但没有禁止在已知的心血管疾病患者中使用;欧洲药品管理局也对NSAIDs提出了心血管风险警告,且禁止在已有心血管疾病的患者中使用COX-2抑制剂;美国心脏协会和欧洲心脏病学会都建议给有心血管事件或心血管事件高危的患者优先使用低剂量的非选择性NSAIDs(萘普生≤500 mg/d 或布洛芬≤1 200 mg/d)[20]。亚太地区多学会联合建议对于心血管风险高的患者,如果不能避免使用NSAIDs,可考虑萘普生或塞来昔布[69]。国内推荐对低心血管风险的患者使用最低有效剂量的NSAIDs,对高心血管风险并合用小剂量阿司匹林的患者,禁止使用选择性COX-2 抑制剂,建议使用萘普生[70]。处方医生在开具COX-2抑制剂前有必要对患者心血管风险进行仔细评估,对高心血管风险的患者应谨慎开具NSAIDs,必要时应尽量选择COX-2抑制作用较低的药物,如萘普生。
