小胶质细胞PTGS2/Hepcidin炎症通路在神经元铁死亡中的作用机制
2024-02-01杨晓玲何宗源章琦鑫王鱼浩李雪莲段晓霞
杨晓玲,何宗源,章琦鑫,王鱼浩,李雪莲,段晓霞
1.西南医科大学附属医院麻醉科(泸州646000);2.麻醉与重症医学泸州市重点实验室(泸州646000);3.西南医科大学麻醉学系(泸州 646000)
铁死亡(ferroptosis)是一种由活性氧(reactive oxygen species,ROS)和游离铁驱动的调节性非凋亡性细胞死亡形式,其主要特征包括线粒体功能失调和脂质过氧化等[1-2]。神经元铁死亡参与多种病理生理状态下的神经退行性改变进程,介导认知功能障碍等多种症状发展。在衰老过程中,铁蛋白功能失调导致神经元Fe2+积累,增加细胞发生铁死亡的风险[3-4]。既往的研究提示,小胶质细胞可能是神经炎症过程中神经元铁代谢的重要参与者[5-8],但神经炎症是否促进铁死亡目前尚不清楚。
小胶质细胞源于中胚层,是中枢神经系统的主要免疫细胞,能对各种病理生理刺激做出反应[9],是调节中枢神经系统疾病最合适的靶点[10]。在静息状态下,小胶质细胞呈现梭形或椭圆形,有数条树枝样突起。而在衰老[11]、手术麻醉[12]和神经退行性疾病[13]过程中,小胶质细胞可发生极化激活,胞体变大呈现阿米巴样,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达水平显著上升,导致ROS和促炎细胞因子爆发性释放[14],在神经炎症的发生发展中起重要作用[15]。此外脂多糖(lipopolysaccharide,LPS)处理的小胶质细胞将显著增加共培养条件神经元细胞的铁含量[6],腹腔注射LPS 可破坏小鼠中枢神经系统铁稳态,促进神经元发生铁死亡,并最终损害认知功能[16-17],提示神经元处于炎症条件下,可以增加其对铁死亡诱导剂的易感性。
炎症条件下铁稳态的主要调节者是铁调素(hepcidin),通过完全阻断铁外排途径以抑制铁运输,被认为是全身铁稳态的主要调节器[18]。hepcidin 表达增加可诱导SH-SY5Y 细胞内铁输出蛋白(ferroportin1,FPN1)的内化,并增加二价金属转运蛋白1(recombinant divalent metal transporter1,DMT1),铁蛋白重链(ferritin heavy chain,FTH)和线粒体铁蛋白(mitochondrial ferritin,FTMT)的水平,抑制细胞内铁输出,增加铁蓄积,扰乱神经元铁稳态[5]。前列腺素内过氧化物合酶2(prostaglandin-endoperoxidesynthase2,PTGS2)是 病 理情况下合成前列腺素的关键基因,被认为是铁死亡的标志物之一[19],并参与炎症级联反应,增加TNF-α、IL-1β、IL-6 等炎症因子的释放[20],增强STAT3 磷酸化[21],而p-STAT3 易位到细胞核中,促进hepcidin 基因(HAMP)的表达[7]。塞来昔布等选择性PTGS2 抑制剂可以抑制炎症级联反应,改善神经退行性改变所导致的认知功能损伤。然而小胶质细胞PTGS2能否通过调节hepcidin影响神经元铁代谢进而调节神经元铁死亡,目前仍不清楚。本研究旨在通过体外实验,运用BV2、HT22细胞探讨小胶质细胞PTGS2/hepcidin炎症轴对神经元铁死亡的作用机制与影响。
1 材料与方法
1.1 主要试剂
组织铁测试盒、丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所,中国),TNF-α、IL-1β Elisa 检测试剂盒及MTT 试剂盒(索莱宝科技有限公司,中国),高糖DMEM 培养基以及胎牛血清(Gibco,美国),LPS(From Escherichia coli 055:B5,索莱宝科技有限公司,中国)。BCA 试剂盒(碧云天生物技术有限公司,中国)。
1.2 细胞培养
BV2 的培养:BV2 细胞在含有10% FBS、1%青霉素/链霉素双抗的DMEM普通高糖培养基中进行培养,24 h换液一次,待细胞处于对数生长期,进行后续实验。
HT22的培养:HT22细胞在含有10%FBS、1%青霉素/链霉素双抗的DMEM 普通高糖培养基中培养,24 h换液一次,待细胞处于对数生长期,进行后续实验。
塞来昔布预处理BV2 细胞:将BV2 细胞接种于100 mm 培养皿,至汇合度达30%左右,以2.5 μmol/L 塞来昔布预处理24 h后,进行后续实验。
1.3 实验分组
待BV2 小胶质细胞进入对数生长期后,将其分为模型组(CELE 组、CELE+LPS 组和LPS 组)与对照组(Control 组),Control 组继续常规培养,CELE 组和CELE+LPS组加入2.5 μmol/L塞来昔布,LPS组加入等体积完全培养基。24 h后换液,LPS组和CELE+LPS组给予LPS(100 ng/mL)孵育12 h。收集各组培养液上清,以1∶1比例与完全培养基混合培养对应各组HT22细胞24 h。
1.4 MTT法检测细胞活性
建模完成后BV-2、HT22细胞每孔加入10 μL MTT溶液,孵育4 h,弃去上清,每孔加入110 μL Formazan溶解液,充分溶解后在490 nm处测定吸光度,即A490值。细胞存活率=(A490 实验组-A490 空白组)/(A490 对照组-A490空白组)×100%。
1.5 PTGS2、IBA-1、STAT3、p-STAT3蛋白检测
Western blotting 法检测目标蛋白。建模完成后,收集BV-2、HT22细胞,使用RIPA裂解液充分裂解,11 000×g离心10 min后收集上层清液作为样品,使用BCA法测定细胞蛋白含量,使用浓度为5%的上层胶和浓度为10%的下层胶进行SDS-PAGE凝胶电泳。湿法转膜、5%脱脂牛奶封闭,加入一抗4 ℃孵育过夜,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。洗膜3 次,加入二抗37 ℃孵育2 h,洗膜3次,保存于TBST 中。使用ECL 化学发光法显影。
1.6 GPX4、FTH1、DMT1、PTGS2 mRNA 相对表达量测定
实时荧光定量PCR 法检测。建模完成后,收集BV-2、HT22 细胞,使用Trizol 试剂提取细胞总RNA。将RNA反转录为cDNA后立即进行实时荧光定量PCR检测。根据试剂盒说明书制备20 μL 反应体系。同一样品设置3 个重复孔,GAPDH 为内参基因。使用到的基因特异性引物序列见表1所示。使用三步法进行扩增反应,具体条件为:95 ℃预变性120 s,95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸10 s,40 个循环后72 ℃延伸10 min。

表1 目的基因特异性引物序列Table 1 Primer Sequences of Target Genes
1.7 TNF-α、IL-1β含量检测
上述各组细胞建模完成后,收集各组BV2及HT22细胞培养上清及细胞,酶标板洗板后加入标准品及样品,置于37 ℃孵育90 min,加生物素化抗体37 ℃孵育60 min。加入TMB 显色后测定吸光度A450,绘制标准曲线并根据样本吸光度计算各组TNF-α、IL-1β含量。
1.8 ROS含量检测
配置浓度为10 μmol/L 的2,7-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFHDA)荧光探针孵育细胞20 min。使用激光共聚焦显微镜直接观察。回收细胞并使用不含血清的细胞培养液清洗细胞3次,充分去除细胞外的DCFH-DA。荧光酶标仪激发波长设置为488 nm,发射波长设置为525 nm检测荧光的强度。以对照组计算各组相对ROS含量。
1.9 细胞内铁水平的检测
采用比色法,各组细胞处理完成后,收集并使用PBS重悬BV-2、HT22细胞,超声破碎后,2 500×g离心10 min,收集上清液,加入检测试剂后,沸水浴5 min,测量各组样品在波长520 nm的吸光度,即A520。
采用比色法检测细胞内铁水平。各组细胞处理完成后,收集并使用PBS 重悬BV-2、HT22 细胞。超声破碎后,2 500×g 离心10 min,收集上清液,使用BCA 法检测细胞蛋白浓度。加入铁检测试剂后,沸水浴5 min,测量各组样品在波长520 nm 的吸光度,即A520。使用公式计算细胞内铁含量:铁含量(mg/g)=(A 实验组-A空白组)/(A标准组-A空白组)×C标准(mg/L)/带测定样本蛋白浓度(g/L)。
1.10 统计学分析
使用Graphpadprism 9.0 进行统计分析并绘制统计图表。所有研究数据均使用均数± 标准差(x ± s)表示,多个组比较采用单因素方差分析(one-way ANOVA),两两比较采用Sidak检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 LPS、塞来昔布对BV2细胞活力的影响
4 个组BV2 细胞活力比较差异具有统计学意义(F=633.5,P<0.001)。与对照组相比,LPS 处理组其BV2 小胶质细胞活力比值为0.87 ± 0.04,明显降低(P<0.001)。塞来昔布(CELE,25 μmol/L)单独处理的BV2细胞活力比值为0.98±0.02,不能引起小胶质细胞活力明显变化,差异无统计学意义(P>0.05)。CELE+LPS 组细胞活力比值为0.85 ± 0.06,CELE 可在一定程度改善LPS 导致的BV2 小胶质细胞活力下降(P<0.001),见图1。
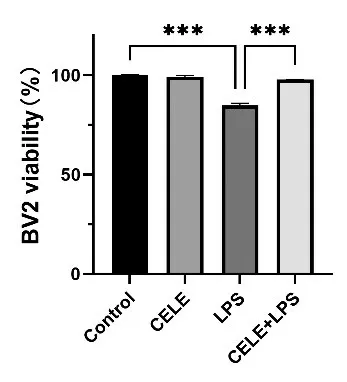
图1 BV2细胞活力检测结果(n=5)Figure 1 Viability of BV2 Cells(n=5)
2.2 LPS、塞来昔布对BV2细胞活化的影响
Western blotting 检测结果显示,与对照组比较,LPS 组BV2 细胞Iba-1 及PTGS2 蛋白表达显著上升(P<0.001)。与LPS 组相比,CELE+LPS 组BV2 细胞Iba-1 及PTGS2 蛋白表达下降(P<0.001,P <0.05),见图2。
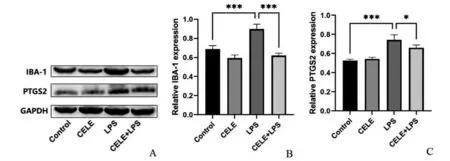
图2 BV2细胞IBA-1,PTGS2蛋白水平比较(n=3)Figure 2 Protein expression level of IBA-1 and PTGS2 in BV2 Cells(n=3)
2.3 LPS、塞来昔布对BV2细胞炎症因子的影响
Elisa结果显示,与对照组细胞相比,LPS组BV2细胞TNF-α、IL-1β表达水平显著升高(P<0.001)。CELE组无显著变化(P>0.05)。与LPS组相比,CELE+LPS组TNF-α、IL-1β表达水平显著下降(P<0.001),见表2。
表2 各组BV2细胞上清液炎症因子含量比较(n=5,)Table 2 Inflammatory factors in BV2 cell supernatant(n=5,)
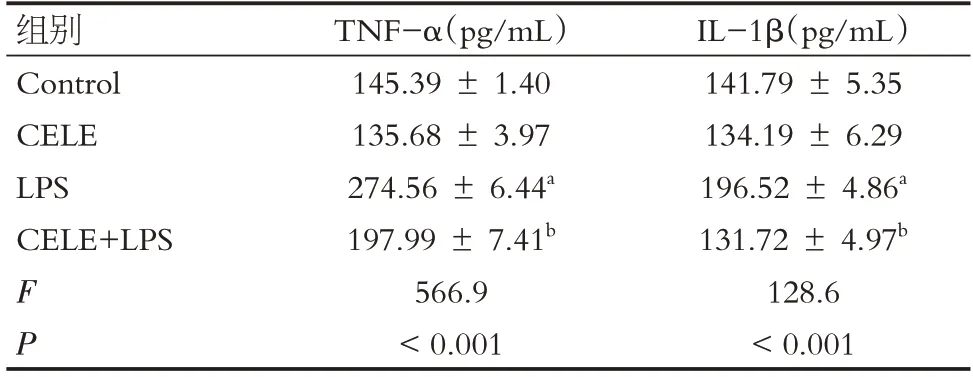
表2 各组BV2细胞上清液炎症因子含量比较(n=5,)Table 2 Inflammatory factors in BV2 cell supernatant(n=5,)
注:a 表示Control 组与LPS 组比较,P <0.001。b 表示Control组与CELE+LPS组比较,P <0.001。
2.4 炎症暴露对HT22细胞活力的影响
收集各组BV2细胞上层清液用于培养对应组小鼠海马神经元系HT22细胞。结果显示:4个组HT22细胞活力比较差异具有统计学意义(F=303.4,P<0.001)。与对照组相比,LPS 组HT22 细胞活力比值为0.80 ±0.05,明显降低,差异具有统计学意义(P<0.001)。CELE组HT22细胞活力比值为0.96±0.04,神经元细胞活力未出现明显变化(P>0.05)。CELE+LPS组细胞活力比值为0.90±0.06,神经元细胞活力显著下降(P<0.001),但与LPS组相比,细胞活力下降程度明显减轻,差异具有统计学意义(P <0.001),见图3。

图3 HT22细胞活力检测结果(n=5)Figure 3 Viability of HT22 Cells(n=5)
2.5 炎症暴露对HT22细胞铁死亡影响
检测各组HT22细胞铁死亡相关指标。qPCR结果显示LPS 组PTGS2、DMT1、FTH1 mRNA 水平升高(P<0.001,P=0.005,P<0.001),GPX4 mRNA 表达下调(P=0.002),氧化应激ROS 水平升高(P<0.001)。CELE组HT22细胞各指标未见显著差异。与LPS组相比,qPCR 结果 显 示CELE+LPS 组PTGS2、DMT1、FTH1mRNA 水 平 降 低(P=0.015,P=0.026,P=0.003),GPX4 mRNA表达上调(P=0.037),ROS水平降低(P<0.001),见图4、图5。

图4 HT22细胞GPX4、FTH1、DMT1、PTGS2 mRNA表达情况(n=3)Figure 4 mRNA expression levels of GPX4,FTH1,DMT1 and PTGS2 in HT22 cells(n=3)
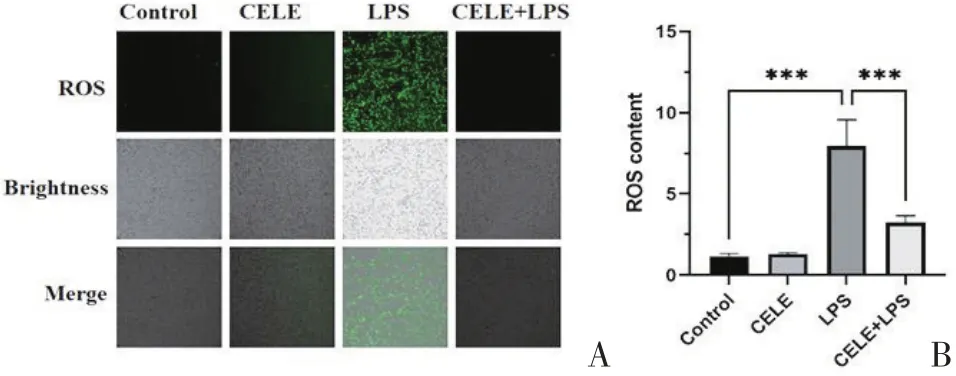
图5 各组HT22细胞ROS荧光检测(n=3)Figure 5 ROS detection of HT22 cells(n=3)
2.6 BV2细胞PTGS2对HT22细胞铁稳态影响
4个组HT22细胞铁含量比较差异具有统计学意义(F=88.84,P<0.001)。与对照组比较,LPS组HT22细胞内铁水平升高,差异具有统计学意义(P<0.001)。与LPS 组相比,CELE+LPS 组细胞内铁水平显著降低(P<0.001),见图6。提示神经炎症参与神经元铁稳态失衡,而抑制小胶质细胞PTGS2 将改善铁稳态失衡。Western blotting 检测结果显示:与对照组比较,LPS 组HT22 细胞hepcidin、p-STAT3 显著上调(P=0.005,P<0.001),FPN1显著下调(P<0.001),总STAT3无显著差异;CELE组hepcidin、p-STAT3无显著差异(P>0.05)。与LPS 组比较,CELE+LPS 组HT22 细胞hepcidin、p-STAT3 显著下调(P<0.001,P=0.005),FPN1 上调(P<0.001),总STAT3无显著差异(P>0.05),见图7。
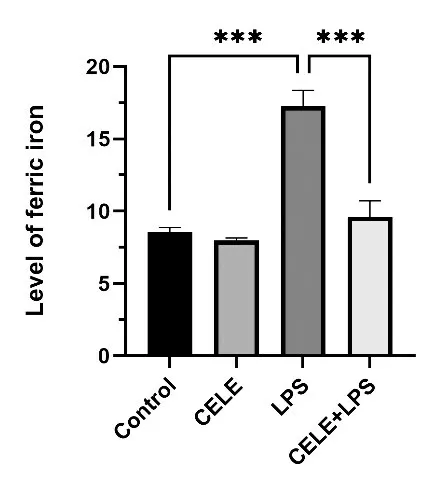
图6 HT22细胞Fe2+含量(n=3)Figure 6 Fe2+levels in HT22 cells(n=3)

图7 HT22细胞蛋白表达情况(n=3)Figure 7 Protein expression levels in HT22 cells(n=3)
3 讨论
神经退行性改变常导致认知能力下降等后果,极大降低人们的社会参与度和生活幸福感,增加社会和家庭的经济负担。神经炎症是研究较为广泛的神经退行性疾病防治靶点[22],在神经退行性疾病中,广泛存在的神经炎症与神经元铁死亡的联系[23-24]。目前研究多认可神经炎症与神经元铁稳态呈双向调节,但大多集中在铁超载诱发氧化应激,促进小胶质细胞活化等方面[25-26]。本课题组研究结果显示:小胶质细胞PTGS2导致神经元铁稳态失衡,进而促进神经炎症条件下的神经元铁死亡。
本研究首先建立了LPS诱导BV2的小胶质细胞神经炎症模型。BV2 细胞是常用的小胶质细胞模型,其高度纯化且基本具备了原代小胶质细胞的形态及功能,是一种相对容易培养的永生化小胶质细胞系。实验中常用LPS 诱导BV2 细胞活化进行神经炎症的建模[27-28]。与既往报道一致,本实验结果证明,LPS 导致BV2小胶质细胞活化,产生大量炎症因子,而BV2细胞活力并未明显降低,证实LPS 诱导的神经炎症模型适宜进行下一步研究。
塞来昔布是选择性PTGS2 抑制剂,能迅速穿过血脑屏障,到达中枢神经系统发挥PTGS2抑制效应、减少小胶质细胞活化和炎症因子释放[29]。我们使用LPS和塞来昔布构建了神经炎症模型和PTGS2抑制的神经炎症下调模型。塞来昔布是PTGS2 的活性抑制剂,本身不直接减少PTGS2 的表达量,然而我们观察到PTGS2在塞来昔布+LPS处理后的BV2细胞中表达下降,这提示在BV2 细胞中,极有可能存在神经炎症的正反馈途径。
使用上述模型的培养基上清液干预HT22 神经元细胞。与细胞凋亡、自噬和焦亡不同的是,铁死亡是新近发现的氧化应激依赖性的程序性细胞死亡,由铁积累导致脂质过氧化引起[1]。因此,我们检测了氧化应激指标ROS、GSH、SOD和脂质过氧化指标MDA。结果显示LPS组神经元铁死亡增加,而CELE+LPS组神经元铁死亡减少,这提示神经炎症促进神经元铁死亡发生,而通过塞来昔布抑制PTGS2后,神经炎症减轻,神经元铁死亡随之降低。
为了探索神经元铁死亡的机制,进一步检测了铁代谢相关蛋白hepcidin 和FPN1。结果提示,神经炎症可促进hepcidin 蛋白的表达,抑制FPN 表达。hepcidin是一种抗菌肽,主要由肝脏在铁超载和炎症的条件下合成分泌,也广泛分布于不同的脑区,包括皮层、嗅球、丘脑、下丘脑及海马等区域,hepcidin 与FPN1 结合,完全阻断铁外排途径以抑制铁运输[30]。hepcidin 受到磷酸化STAT3调节[31],因此,继续探索神经炎症对STAT3磷酸化的影响。Western blotting 检测结果显示,STAT3总量不受影响,然而神经炎症提升STAT3磷酸化水平,即p-STAT3 增加,PTGS2 抑制剂塞来昔布可以降低STAT3的磷酸化水平。
本研究也存在一些不足,首先本研究仅在细胞水平探讨了BV2小胶质细胞与神经元铁死亡的关系。机体环境复杂,受到多种体内外因素调控,因此在活体动物层面的继续深入研究有助于进一步揭示小胶质细胞在神经元铁死亡中的作用机制。本研究设计上也存在一定缺陷,使用LPS 诱导BV2 细胞产生炎症因子以干预HT22 细胞,但LPS 对HT22 细胞的潜在影响不能完全排除。因此,寻找合适的分离技术去除LPS 或增加实验对照的方式将更好的指导未来进行深入的研究。
4 结论与启示
在神经炎症条件下,小胶质细胞活化促进神经元铁死亡,可能与小胶质细胞PTGS2 通过增加STAT3 磷酸化影响神经元hepcidin 表达有关,造成神经元铁蓄积,导致神经元铁死亡。抑制PTGS2 可能是治疗神经退行性改变的潜在靶点,有待更充分、更深入的研究探讨和最终实现临床转化。
