基于铕离子-四环素-草甘膦荧光增强体系结合分子印迹固相萃取测定环境样品中草甘膦的残留量
2024-02-01沈晓峰全红花
袁 宁,沈晓峰,全红花,曾 诚,李 明*
(1.扬州大学 环境科学与工程学院,扬州 225127;2.扬州海关,扬州 225100)
草甘膦(Glyp)在农业上被广泛用作非选择性除草剂[1-2]。随着Glyp的大量使用,其对环境产生的毒性作用逐渐被人们所熟知。Glyp在环境中主要是通过生物降解产生氨甲基膦酸;当Glyp吸附到土壤上时,它不再容易被生物降解,从而造成了其在土壤中残留量的持续增加[3-4]。此外,吸附在土壤颗粒上的Glyp在被降解之前可通过悬浮在地表径流的途径发生迁移,因此Glyp在地表水甚至地下水中也能够被检测到。
由于Glyp及其相关代谢物极性高、水溶性强、挥发性低以及其分子结构中缺乏生色团,检测Glyp的常用方法主要是高效液相色谱法[5]、毛细管电泳法[6]、配氢火焰离子化检测器或质谱检测器的气相色谱法[7]。虽然这些方法可对实际样品中的Glyp进行高灵敏定量分析,但均需要使用大型仪器,分析成本较高。文献[8]采用化学衍生化-光谱法测定Glyp,得到了良好的结果,然而该衍生化反应需要加热,操作繁琐,并且检出限较高。
稀土金属离子络合物常被作为荧光探针。四环素(Tc)是一种含有β-二酮酸的分子,可以与稀土金属离子如Eu3+配位形成Eu3+-Tc络合物,将其激发能转移到Eu3+发射5D0→7F2跃迁(以615 nm为中心的强发射带)[9-15]。该络合物的特点是荧光量子产率高、斯托克斯位移大、发射带窄。然而,由于水分子的猝灭作用,Eu3+-Tc络合物通常显示出较弱的荧光。在一些辅助配体的作用下,其可以取代Eu3+配位球上的水分子,形成Eu3+-Tc-辅助配体三元络合物,表现出荧光增强的现象[16-19]。鉴于此,本工作基于Eu3+-Tc-Glyp荧光增强体系,建立了一种简单、灵敏、选择性高的测定Glyp含量的方法;同时,为了准确测定实际环境样品中Glyp的残留量,采用溶胶-凝胶法[20]制备了Glyp分子印迹固相萃取膜,以进一步扩大Eu3+-Tc-Glyp荧光增强体系在实际环境样品中的应用范围。
1 试验部分
1.1 仪器与试剂
F97XP13001型荧光分光光度计;CHI800D型电化学仪;Spectra Academy SV-2100型紫外-可见分光光度计;MX-S型振荡器;LX-100型微型离心机;PHS-3C型酸度计。
三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液(50 mmol·L-1,pH 8.0):将50 mL 0.1 mol·L-1三羟甲基氨基甲烷溶液与29.2 mL 0.1 mol·L-1盐酸溶液混合,再用水稀释并定容至100 mL。
EuCl3的纯度为99.9%;正硅酸乙酯(TEOS)的纯度为98%;Tc的纯度为96%;铁氰化钾的纯度大于98%;17种氨基酸(丙氨酸、精氨酸、天冬氨酸、胱氨酸、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸、缬氨酸)混合标准品的纯度为99%;Glyp、草铵膦标准品的纯度大于99.5%,氨甲基膦酸标准品的纯度大于97%;试验用水为蒸馏水。
灌溉水样品及土壤样品采集自江苏昆山某镇农田水沟。
1.2 试验方法
1.2.1 Glyp分子印迹固相萃取膜的制备
将3.0 mL TEOS加入至含有2.5 mL无水乙醇和12 mL水的试剂瓶中,超声振荡,并用0.1 mol·L-1盐酸溶液将其酸度调节至pH 1.0,搅拌2 h。分取1.0 mL,加入0.1 mL 1.0×10-2mol·L-1Glyp标准溶液,搅拌60 min。分取100 μL,转移至4 mL平底试管中,将试管置于80 ℃加热干燥60 min。向试管中加入1.0 mL水,浸泡45 min,洗脱出Glyp,得到Glyp分子印迹固相萃取膜。
1.2.2 样品处理和测定
采集的灌溉水样品经0.45 μm的尼龙膜针式过滤器过滤,并置于4 ℃冰箱中保存备用。采集距离地表0~20 cm的耕层土壤样品,风干后过0.850 mm筛,分取5.0 g于50 mL塑料离心管中,加入20 mL 0.5 mol·L-1氢氧化钾溶液,涡旋混匀,超声30 min,振荡30 min,以转速5 000 r·min-1离心5 min。取上清液,用浓度为0.5~3.0 mol·L-1的盐酸溶液或氢氧化钠溶液将其酸度调节至pH 7.0,然后加入100 μL三乙醇胺,用水定容至25.0 mL,置于4 ℃冰箱中保存备用。将Glyp分子印迹固相萃取膜置于上述处理后的水样或土壤样品中浸泡60 min,然后将其转移至离心管中,加入1.5 mL水浸泡45 min用于脱附Glyp。脱附后的Glyp分子印迹固相萃取膜于25 ℃干燥,保存备用。
将1.5 mL脱附溶液或不同浓度的Glyp标准溶液与1.0 mL 1.5×10-2mol·L-1EuCl3溶液、1.0 mL 3.0×10-3mol·L-1Tc溶液和3.0 mL 100 mmol·L-1硼酸盐缓冲溶液(pH 10.0)混合,用水定容至10 mL,静置反应3 min。设置荧光分光光度计狭缝宽度为10 nm,光电倍增管(PMT)电压为500 V,激发波长(λex)为403 nm,测定体系在615 nm发射波长处的荧光强度增加值ΔF(ΔF=F-F0,F和F0表示添加和未添加Glyp时的体系荧光强度)。
1.2.3 有机磷水解酶电极的制备
参考文献[21]制备有机磷水解酶(OHP)电极,用于验证Glyp分子印迹溶胶的性能。取500 mL聚磷菌培养液(106个·mL-1),以转速4 000 r·min-1离心30 min,去除上清液,沉淀中加入5 mL 0.2 mg·L-1Glyp标准溶液,于4 ℃静置1 h;以转速8 000 r·min-1离心10 min,取上清液,加入60%(质量分数)硫酸铵溶液,于4 ℃静置2 h;以转速10 000 r·min-1离心20 min,去除上清液,将剩余沉淀溶解于10 mL 50 mmol·L-1Tris-HCl缓冲溶液(pH 8.0)中。烧杯中加入相同的Tris-HCl缓冲溶液,将上述硫酸铵析出的粗酶溶液放入透析袋(透析袋在使用前用水反复冲洗)中进行透析。每隔12 h更换一次Tris-HCl缓冲溶液,重复3次后,将透析袋放入30%(质量分数)聚乙二醇溶液中,得到OHP溶液。分取20 μL,与2 μL 10%(质量分数)牛血清白蛋白溶液和5 μL 2.5%(质量分数)戊二醛溶液混合后滴加到尼龙膜表面,置于4 ℃冰箱中过夜。利用氨气敏电极套管将尼龙膜固定在pH玻璃电极上,得到OHP电极。
取1.0 mL Glyp分子印迹溶胶洗脱液,与1.0 mL 50 mmol·L-1Tris-HCl缓冲溶液(pH 8.0)混合,于45 ℃水浴加热60 s,水解出Glyp,待溶液冷却后,用OHP电极记录电位差。
2 结果与讨论
2.1 荧光光谱
Eu3+、Eu3+-Tc和Eu3+-Tc-Glyp体系的荧光光谱见图1,其中Tc浓度为1.0×10-4mol·L-1,Eu3+浓度为5.0×10-4mol·L-1,Glyp浓度为5.0×10-6mol·L-1,体系酸度为pH 10.0,λex为403 nm。

1-Eu3+-Tc-Glyp;2-Eu3+-Tc;3-Eu3+图1 不同体系的荧光光谱Fig.1 Fluorescence spectra of different systems
结果表明:在Eu3+溶液中加入Tc后,Eu3+与Tc形成二元络合物,分别在590 nm和615 nm处发射荧光,对应于Eu3+的5D0→7F1跃迁和5D0→7F2跃迁;在Eu3+-Tc体系中添加Glyp后,615 nm处的荧光强度显著增强(是Eu3+-Tc体系荧光强度的1.5倍),表明Glyp与Eu3+-Tc络合物形成稳定的Eu3+-Tc-Glyp三元络合物,使Eu3+-Tc体系的荧光通过分子内能量转移得到增强。Glyp是一种高亲水性的氨基酸类化合物,含有胺基、羧酸和膦酸等官能团,在碱性环境中可与金属离子形成强配位的二元或三元络合物[22-23]。Eu3+-Tc络合物的物质的量比为1…1,在水溶液中Eu3+的配位是不饱和的(Eu3+的配位数通常为8)[13],因此水分子容易与Eu3+-Tc络合物的剩余空轨道配位。在碱性条件下,Glyp可以通过取代水分子配体,与Eu3+-Tc络合物形成稳定的双五元环结构(图2)。随着水分子配体的释放,水分子O-H振动引起的非辐射能量损失减小,使得Eu3+-Tc-Glyp体系的荧光强度增大。

图2 Eu3+-Tc-Glyp络合物的双五元环预测构型Fig.2 Expected bi-five-ring configuration of Eu3+-Tc-Glyp complex
2.2 测定条件的优化
2.2.1 体系酸度
为考察Eu3+-Tc-Glyp体系的最佳反应酸度,使用酸度分别为pH 7.0,8.0,10.0,11.0的缓冲溶液[24]测定了体系的ΔF值,结果见图3。

图3 酸度对体系ΔF值的影响Fig.3 Effect of acidity on ΔF value of the system
结果表明:在pH 7.0,8.0条件下,体系的ΔF值较小,可能是Glyp部分解离,只能与Eu3+-Tc络合物形成一元或二元络合物,因此不能有效阻止非辐射能量损失;在pH 9.0,10.0条件下,体系的ΔF值明显增强,这是因为在较强碱性条件下Glyp分子全部解离生成阴离子(Glyp的pKa3=10.25)[4],从而能够形成稳定的双五元环构型络合物,有效地减少了非辐射能量损失,使荧光强度得到增强;随着pH继续增大,ΔF值开始下降,这是因为溶液中的OH-产生竞争性配位。因此,试验选择的体系酸度为pH 10.0。
2.2.2 Eu3+与Tc的物质的量比
固定Glyp浓度为1.0×10-5mol·L-1,考察了Eu3+与Tc的物质的量比分别为0.1…1,2…1,4…1,6…1,8…1,10…1,20…1时对体系ΔF值的影响,结果如图4所示。

图4 Eu3+与Tc的物质的量比对体系ΔF值的影响Fig.4 Effect of molar ratio of Eu3+ to Tc on ΔF value of the system
结果表明:当Eu3+与Tc物质的量比为0.1…1~6…1时,体系的ΔF值先增大后基本保持不变;当Eu3+与Tc物质的量比大于6…1时,体系的ΔF值降低。试验选择Eu3+与Tc物质的量比为5…1,进一步对Eu3+和Tc浓度进行了优化。结果发现:Tc浓度过高,易发生PMT饱和;Tc浓度过低,体系荧光强度较低,导致ΔF值变化不明显,影响测定灵敏度。因此,试验最终选择的Eu3+浓度为1.5×10-2mol·L-1,Tc浓度为3.0×10-3mol·L-1。
2.3 干扰试验
为考察灌溉水中可能存在的干扰物,如草铵膦、氨甲基膦酸、结构类似的氨基酸以及水环境中常见的金属离子和阴离子对Glyp测定的影响,在上述最佳测定条件下,向若干组1.0×10-6mol·L-1Glyp标准溶液中加入了不同浓度的干扰物,测定了加入后体系荧光强度与加入前体系荧光强度的比值(相对荧光强度),结果见表1。

表1 干扰物对体系相对荧光强度的影响

2.4 Glyp分子印迹固相萃取膜制备条件的优化
用0.1 mol·L-1盐酸溶液将TEOS、无水乙醇和水的混合溶液酸度调节至pH 1.0,2.0,3.0,得到不同酸度的Glyp分子印迹溶胶,同时考察了洗脱时间分别为0,15,30,45,60 min时Glyp分子印迹溶胶的电位变化,结果如图5所示。
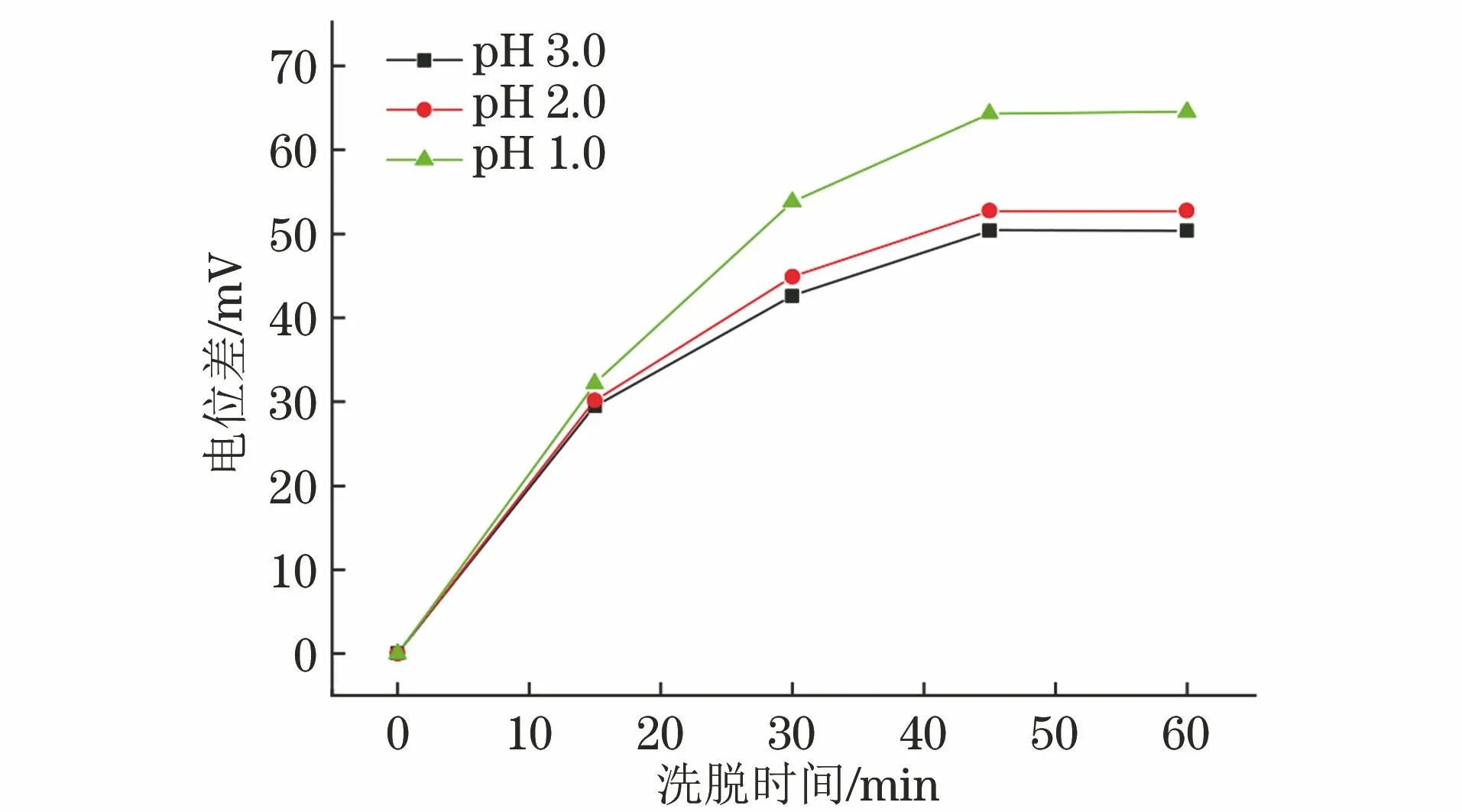
图5 酸度和洗脱时间对电位差的影响Fig.5 Effects of acidity and elution time on the potential difference
结果表明:随着pH的减小和洗脱时间的延长,电位差逐渐增大;在pH 1.0条件下洗脱不小于45 min,电位差较大且基本保持稳定。因此,试验选择制备Glyp分子印迹溶胶的酸度为pH 1.0,洗脱时间为45 min。
2.5 Glyp分子印迹固相萃取膜的重复性和稳定性
用1.0×10-5mol·L-1Glyp标准溶液浸泡45 min Glyp分子印迹固相萃取膜,利用OHP电极测定浸泡液的电位差;然后将Glyp分子印迹固相萃取膜脱附并干燥处理后,再次浸泡在Glyp标准溶液中,重复上述过程5次,计算电位差的相对标准偏差(RSD)。结果显示,电位差的RSD为3.2%,表明Glyp与分子印迹固相萃取膜上的空穴的结合是一个可逆过程,Glyp分子印迹固相萃取膜可以重复多次使用。
按照同样的方法,对使用两周前后的Glyp分子印迹固相萃取膜的浸泡液进行测定。结果显示,电位差仅降低了4.4%,表明Glyp分子印迹固相萃取膜的稳定性良好。
2.6 标准曲线和检出限
按照1.2.2节试验方法测定浓度为1.0×10-8,5.0×10-8,5.0×10-7,1.0×10-7,2.0×10-6,5.0×10-6,1.0×10-5,1.5×10-4,1.0×10-4,1.0×10-3,3.0×10-3mol·L-1的Glyp标准溶液系列,以Glyp浓度对数为横坐标,对应的体系ΔF值为纵坐标绘制标准曲线。结果表明:线性回归方程为ΔF=260.5×lgc+211 3,线性范围为5.0×10-8~1.5×10-4mol·L-1,相关系数为0.999 8。
以3s/k(其中s为3次空白信号的标准偏差,k为线性回归方程的斜率)计算检出限,结果为1.0×10-8mol·L-1。
2.7 样品分析和回收试验
按照1.2.2节试验方法分析3份灌溉水样品和3份土壤样品,并与电化学法[26]进行比较,结果见表2。

表2 样品分析和比对结果
由表2可知,本方法和电化学法的测定结果基本一致。试验进一步采用标准加入法对灌溉水样品1进行了加标浓度水平为1.69 μg·kg-1的回收试验,结果显示Glyp回收率为101%,表明该方法准确度较高。
本工作基于Glyp作为辅助配体与Eu3+-Tc生成三元络合物表现的荧光增强现象,结合Glyp分子印迹固相萃取前处理技术,建立了Glyp的荧光分析方法。该方法的检出限低,线性范围较宽,抗干扰能力强,能够应用于环境水及土壤中草甘膦残留量的测定。
