奶牛产后急性子宫内膜炎血液氧化脂质组变化特征
2024-02-01王瑞玲王雪妍王菲菲孔维怡毛永霞许立华郭延生
王瑞玲,王雪妍,王菲菲,孔维怡,毛永霞,刘 欣,丁 辉,许立华,郭延生
(宁夏大学动物科技学院,银川 750021)
奶牛围产期(产前21 d~产后21 d)代谢机能会发生显著改变,大约50%产后奶牛在围产期会经历一种或多种生殖道系统炎症或代谢病,如奶牛胎衣不下、子宫内膜炎和酮病等[1]。奶牛子宫内膜炎是奶牛围产期常见的生殖系统疾病,也是奶牛饲养管理中常见的疾病,可导致奶牛不孕,产奶量降低,繁殖力和生产效益下降[2],对畜牧业造成严重的经济损失。奶牛子宫内膜炎在病程上分为急性和慢性子宫内膜炎,而大多数产后子宫内膜炎都是急性子宫内膜炎[3]。造成奶牛产后急性子宫内膜炎发生的病因复杂,至今尚无有效的预防手段,其发生机制也有待于进一步深入研究。Putman等[4]研究发现氧化脂质与产后奶牛炎性疾病的高发密切相关。氧化脂质是多不饱和脂肪酸的氧化产物,是有效的可溶性炎症介质,在炎症反应、免疫防御和代谢应激等生命活动中起着非常重要的调控作用[5],衍生自ω-6(n-6系列)不饱和脂肪酸(PUFA)的氧化脂质,如花生四烯酸可促进炎性反应。相反,来源于ω-3(n-3系列)PUFA的氧化脂质,包括二十碳五烯酸和二十二碳六烯酸,与抗炎作用有关[6]。Luo等[7]采用广靶代谢组技术对奶牛血液代谢物的变化规律进行了研究,发现与氧化脂质相关的亚油酸、花生四烯酸和γ-亚麻酸等代谢产物在产后明显上调,但氧化脂质的变化是否与产后急性子宫内膜炎的发生密切相关,还有待于进一步验证。脂质组学是基于分析化学和质谱联用的方法,寻找与代谢调控密切相关的脂质标志物,可以通过研究生物体脂代谢物的变化,揭示机体内不同脂质与疾病的关系,进而探讨其可能的作用机制[8]。目前尚未见到采用脂质组学技术研究产后急性子宫内膜炎奶牛血浆氧化脂质水平变化的相关报道。因此本试验采用UPLC-MS/MS脂质组学技术研究产后急性子宫内膜炎奶牛血浆氧化脂质的变化规律,并通过通路富集分析探讨了氧化脂质参与产后急性奶牛子宫内膜炎发生的可能机制,以期从氧化脂质角度揭示产后奶牛子宫内膜炎的发生机制。
1 材料与方法
1.1 主要试剂与仪器
甲醇(Merck,色谱纯,济南泽盛化工有限公司)、乙腈(Merck,色谱纯,南京鑫旭生物科技有限公司)、乙酸(Merck,色谱纯,南京鑫旭生物科技有限公司)、异丙醇(Merck,色谱纯,南京鑫旭生物科技有限公司)、LC-MS/MS(QTRAP 6500+,SCIEX)、离心机(5424R,Eppendorf)、超声清洗仪(KQ5200E,昆山舒美)、ELISA试剂盒(江苏晶美生物科技有限公司)。
1.2 实验动物的选择与分组
奶牛产后子宫内膜炎的痊愈标准:奶牛子宫角大小对称,无病理性子宫分泌物、阴道中有少量透明黏液[9]。诊断标准:阴道黏液中含有50%左右黏脓性物质;细胞学检查时阴道黏液中的中性粒细胞比例大于18%。排除标准:试验开始前一个月有用药记录;患有其他产后疾病,例如胎衣不下、产后阴门炎与阴道炎、子宫内翻及脱出、乳房炎、酮病等。依据上述标准选取7头产后7 d患有子宫内膜炎的奶牛,治疗前视为试验组(E),治疗痊愈后视为对照组(C)。
患有子宫内膜炎的奶牛临床症状表现为体温升高,食欲减退,精神萎靡,反刍减弱,常做排尿姿势,阴门流出灰白色黏液,并带有臭味,卧地时排出量增多,子宫颈黏膜充血,子宫角增大。广谱土霉素静脉注射治疗子宫内膜炎,剂量3 g,隔日一次,连用2~3次。经治疗14 d后奶牛体温恢复正常,食欲和精神状况良好,子宫分泌物透明无异味。
1.3 血浆样本采集与预处理
在产后7 d晨饲前用含肝素钠的一次性真空采血管对奶牛尾根静脉采血10 mL,4 ℃、3 000 r·min-1离心15 min,吸取上清;在奶牛痊愈后的第7天,用同样方法采集健康奶牛的血液,将收集到的两组血液用干冰低温送到武汉迈特维尔生物科技有限公司进行脂质组学分析。首先将100 μL的血浆样品(均匀的旋涡)加入200 μL的甲醇进行萃取;样品涡旋5 min之后低温放置沉淀蛋白;在每个样品中添加1 μmol·L-1的内标混合溶液20 μL,涡旋10 min;在4 ℃条件下5 000 r·min-1离心10 min;用相同条件提取两次,收集上清液混合;将固相萃取柱活化平衡后、进行上样、淋洗、洗脱、再进行收集洗脱液;最后将洗脱液浓缩干燥,再将其与100 μL的甲醇/水(1∶1)溶液混合,并在涡旋30 s后,将上清液提取出来,进行UPLC-MS/MS分析。
1.4 炎性因子的测定
采用酶联免疫吸附法(ELISA)测定血浆中炎性细胞因子TNF-α、IL-1、IL-6、IL-8、IL-10的水平,所有试验步骤分别按TNF-α、IL-1、IL-6、IL-8、IL-10 ELISA检测试剂盒说明书进行。
1.5 色谱质谱条件
1.5.1 超高效液相(UPLC)色谱条件 色谱柱采用Waters ACQUITY UPLC HSS T3 C18柱(1.8 μm,100 mm×2.1 mm),柱温设为40 ℃,进样量为10 μL;流动相A:乙腈/水(60/40),含0.002%乙酸;流动相B:乙腈/异丙醇(50/50);梯度洗脱条件见表1。
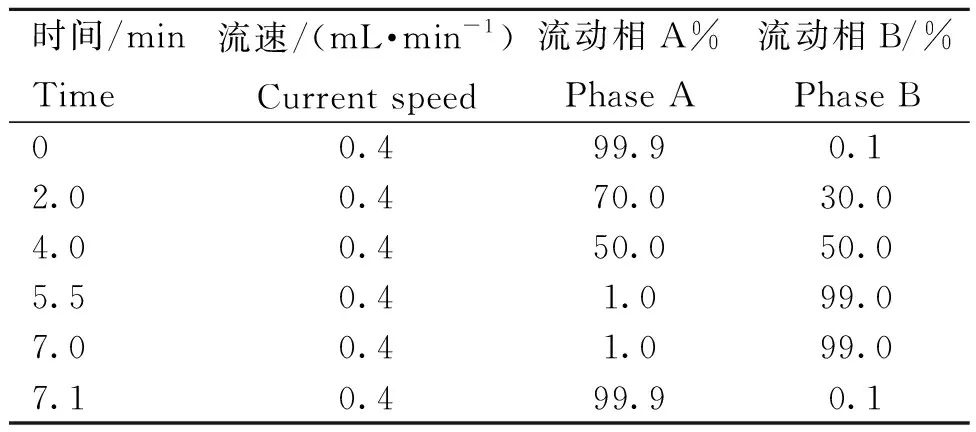
表1 UPLC洗脱梯度Table 1 UPLC elution gradient
1.5.2 串联质谱(MS/MS)采集条件 电喷雾离子源(electrospray ionization,ESI)温度设为550 ℃,质谱电压为-4 500 V,帘气(curtain gas, CUR)为35 psi,根据去簇电压和碰撞能扫描检测每个离子对。
1.6 数据处理与分析

1.6.2 氧化脂质的定性和样本质控分析 购买标准品构建氧化脂质质谱数据库,对血浆样品中的氧化脂质进行定性分析。质控样本(quality control,QC)由样本提取物混合制备而成,在分析过程中,每隔10个检测分析样本插入一个质控样本,分析QC样本的离子流(TIC)重叠图,以监测分析过程的重复性。
1.6.3 氧化脂质的定量分析 通过三重四级杆质谱的多反应监控模式(multiple reaction monitoring,MRM)对样品中氧化脂质进行定量分析。配制0.01、0.02、0.04、0.1、0.2、0.4、1、2、4、10、20、40、100、200、400 nmol·L-1氧化脂质标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据;以外标与内标浓度比(concentration ratio)为横坐标,外标与内标峰面积比(area ratio)为纵坐标,绘制各氧化脂质的标准曲线。将检测到的所有样本的积分峰面积比值代入标准曲线线性方程进行计算,获得积分峰面积比值浓度值,将该浓度值代入氧化脂质含量计算公式,最终得到实际样本中各氧化脂质的绝对含量。氧化脂质含量计算:X=c*V/V0,其中X为样本中氧化脂质的含量(nmol·L-1),c为样本中积分峰面积比值代入标准曲线得到的浓度值(nmol·L-1),V为复溶时所用溶液的体积(μL),V0为称取的样本体积(μL)。
1.6.4 血浆差异氧化脂质的筛选与通路富集分析 获得各氧化脂质在每个样品中的含量数据后,采用主成分分析(principal component analysis, PCA)法判断两组血浆氧化脂质的代谢轮廓的差异,在此基础上,采用正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)法筛选差异氧化脂质,根据OPLS-DA模型中变量重要性投影(variable importance in projection, VIP)值,选取VIP≥1的代谢物,同时结合单变量分析的差异倍数值(fold change, FC),进一步筛选FC≥2或FC≤0.5且P<0.05的氧化脂质视为两组差异氧化脂质,将差异氧化脂质导入MetaboAnalyst 5.0软件进行聚类分析以验证所筛选的差异氧化脂质的可靠性,并通过脂质代谢数据库(https://lipea.biotec.tu-dresden.de/analyze)进行通路富集分析。
2 结 果
2.1 血浆中炎性细胞因子测定
如图1所示,与对照组相比,试验组奶牛血浆中TNF-α、IL-1、IL-8、IL-10的含量极显著升高(P<0.01),IL-6水平显著升高(P<0.05)。
2.2 血浆样本定性及质控分析
血浆样品MRM多峰图见图2,展示了样本中能够检测到的物质,不同颜色的色谱峰代表检测到的不同氧化脂质。通过与氧化脂质标准品数据库比对,两组奶牛血浆中共鉴定出43种脂质代谢物,其中花生四烯酸及其代谢物23个,亚油酸及其衍生物5个,亚麻酸及其衍生物6个,二十碳五烯酸及其代谢物6个,二十二碳六烯酸有3个(表3)。由血浆样本质谱检测TIC重叠图(图3)可知,氧化脂质检测总离子流的曲线重叠性高,表明检测期间仪器分析系统稳定可靠,可为后续的分析提供保证。
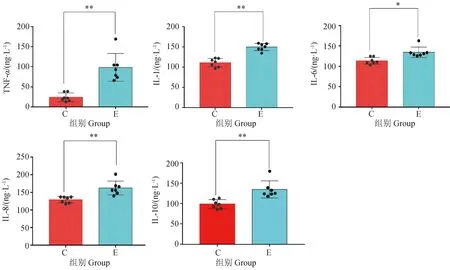
*. P<0.05,**. P<0.01图1 炎性细胞因子测定结果Fig.1 Measurement results of inflammatory cytokines
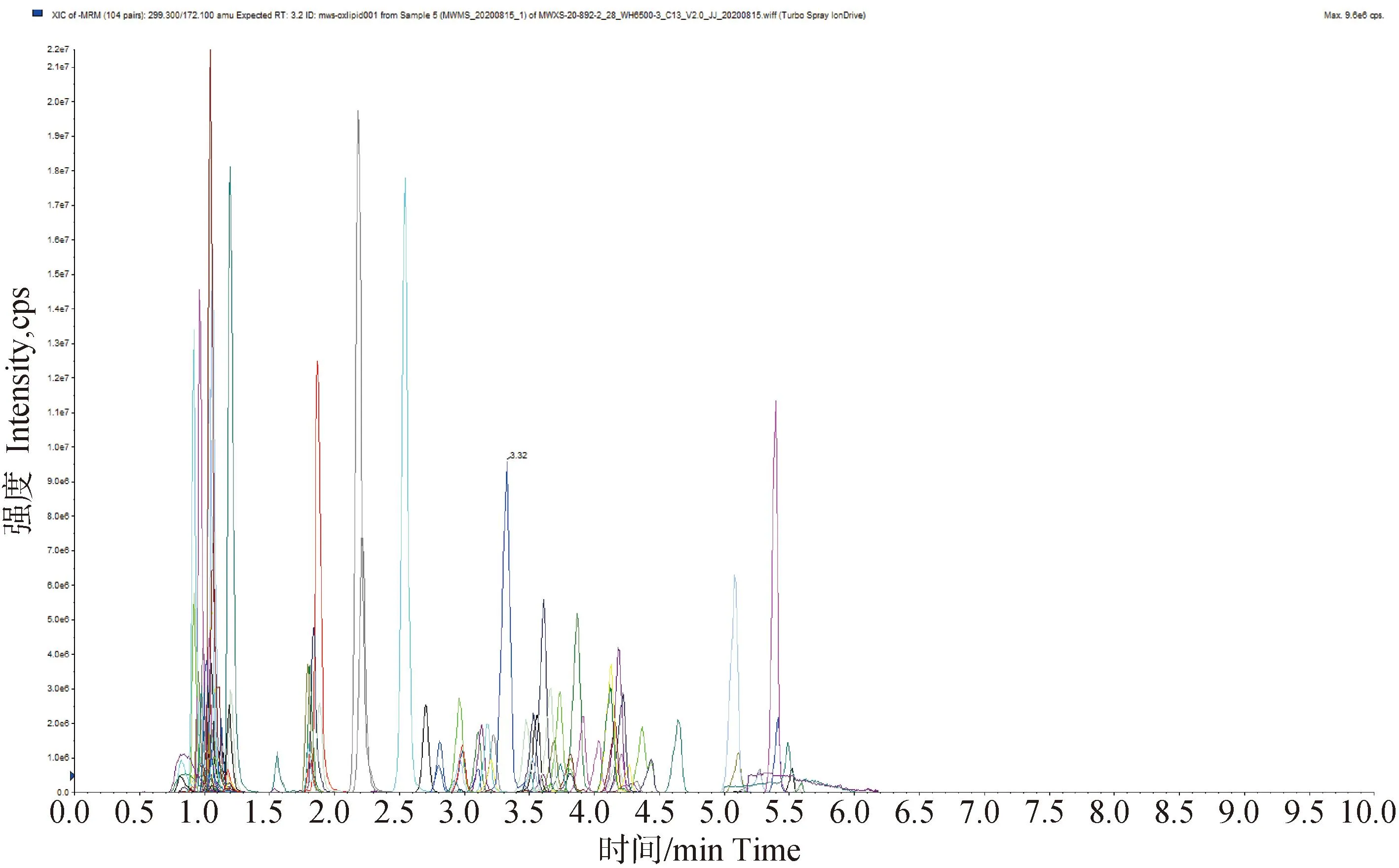
图2 血浆MRM代谢物检测多峰图Fig.2 Multimodal diagram of plasma MRM metabolite detection

图3 奶牛血浆样本质谱检测TIC重叠图Fig.3 Overlay of TIC detected by mass spectrometry in dairy cow plasma samples

表2 43种血浆代谢物标准曲线Table 2 Standard curves of 43 plasma metabolites

(续表2 Continued)

(续表2 Continued)
2.3 子宫内膜炎奶牛血浆氧化脂质代谢轮廓和差异氧化脂质的筛选
采用PCA法对C、E两组奶牛血浆样本进行氧化脂质代谢轮廓分析,如图4所示,C组与E组代谢轮廓存在明显差异,这说明产后急性子宫内膜炎奶牛血浆氧化脂质水平发生了显著变化。为了进一步筛选两组差异氧化脂质,建立了OPLS-DA模型,模型评价参数Q2=0.538,R2Y=0.722(Q2≥0.4且R2Y≤1,表明模型具有可靠性),表明模型可靠,可用于筛选差异代谢物。如图5所示,OPLS-DA模型能明显将C,E两组区分开。将OPLS-DA模型中VIP≥1的氧化脂质,视为候选差异氧化脂质,通过差异倍数(fold change, FC)进一步筛选FC≥2或FC≤0.5且P<0.05的氧化脂质,视为两组最终的血浆差异氧化脂质。共筛选出了10个差异氧化脂质,其中4种含量上调,6种含量下调。差异氧化脂质的名称、含量、平均含量、VIP值、P值、FC值及变化趋势见表3和图6。各氧化脂质在两组中的变化趋势见图7。

图4 对照组(C组)对试验组(E组)血浆总体样本PCA得分图Fig.4 The control group (C group) versus the experimental group (E group) plasma total sample PCA score chart
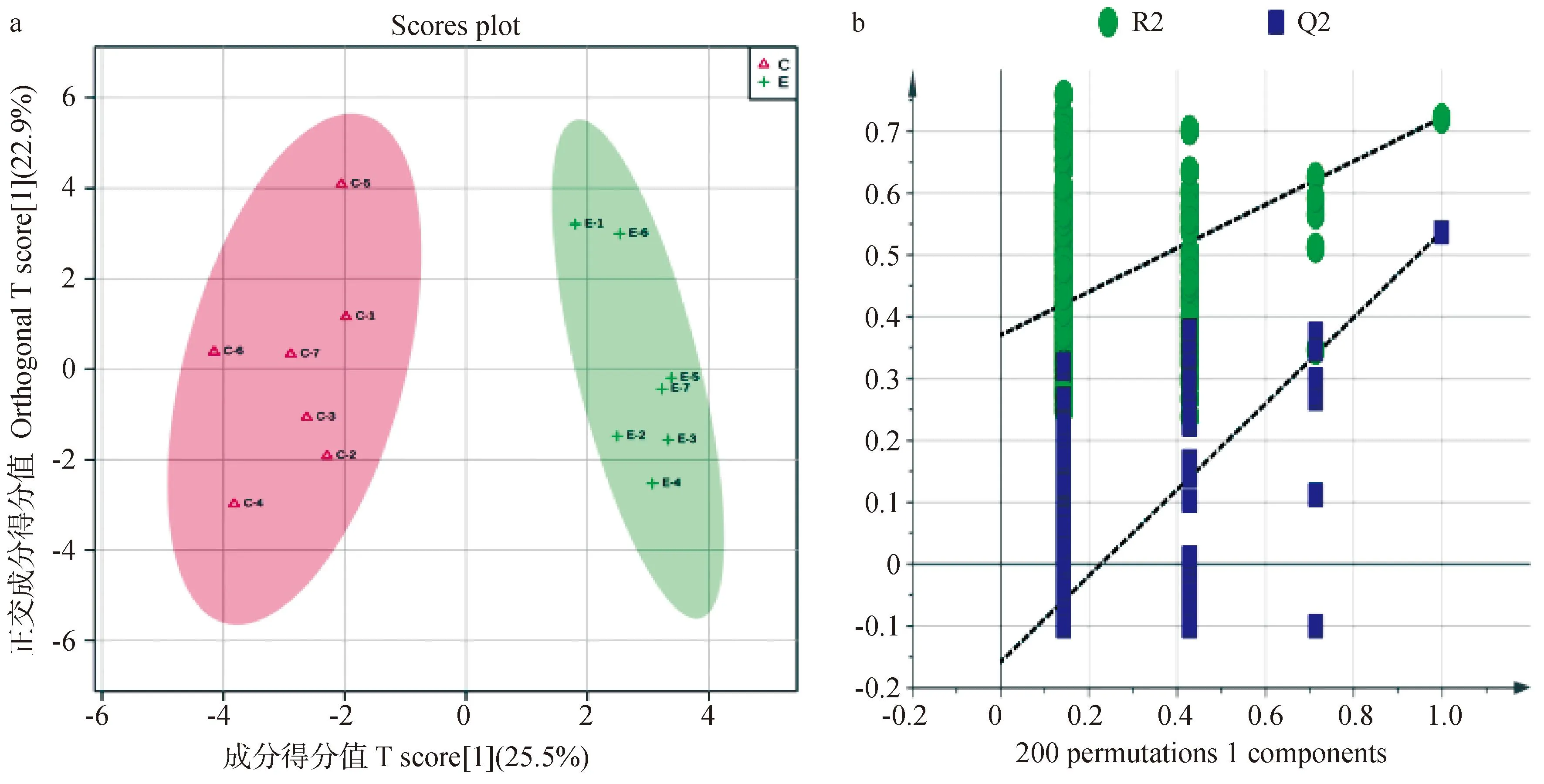
图5 血浆总体样本OPLS-DA得分图(a)和验证图(b)Fig.5 Plasma total sample OPLS-DA score chart (a) and verification plot (b)

图中每一个点表示一种脂质代谢物,蓝点代表下调的差异脂质代谢物,红点代表上调的差异脂质代谢物,灰色的点则代表差异不显著的脂质代谢物 Each point in the figure represents a type of oxidized lipid, blue dots represent down-regulated differential lipid metabolites, red dots represent upregulated differential lipid metabolites, and the gray dots represent lipid metabolites that are not significantly different图6 血浆氧化脂质代谢物火山图Fig.6 Volcanic chart of plasma oxidized lipid metabolites
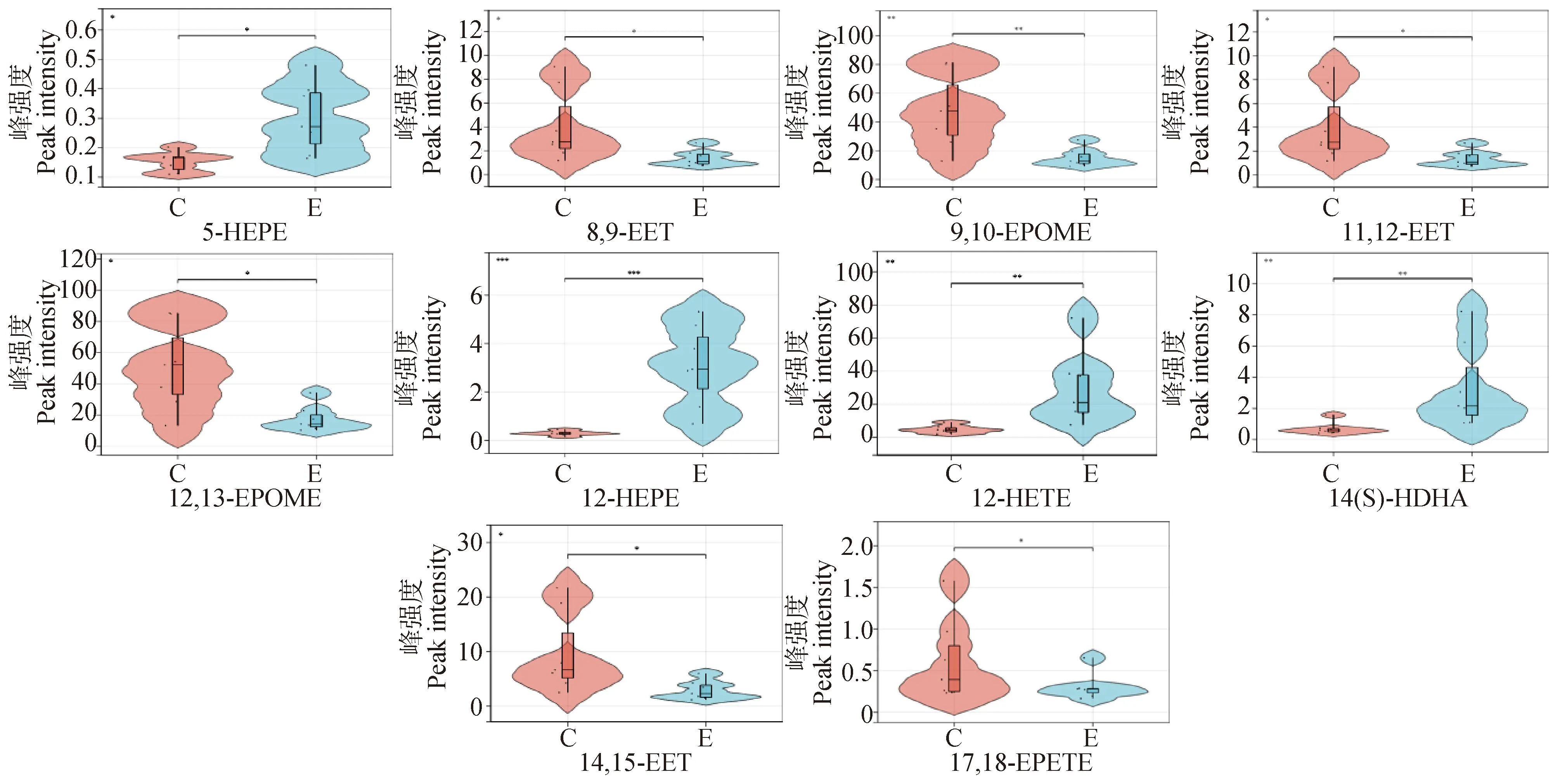
图7 血浆差异脂质代谢物小提琴图Fig.7 Violin diagram of plasma differential lipid metabolites
2.4 差异氧化脂质的聚类验证与通路富集
将筛选出的10种差异氧化脂质进行聚类分析,绘制热图(图8),结果显示筛选出的10种差异氧化脂质能明显区分C组和E组,说明筛选出的差异氧化脂质有较强的可靠性。将10种差异氧化脂质通过脂质代谢库进行通路富集分析(图9),结果显示这10中差异氧化脂质参与了花生四烯酸代谢通路、TRP通道的炎症介质调节通路、PPAR信号通路、血管平滑肌收缩通路、醛固酮的合成与分泌通路和血清素能突触通路。虽然花生四烯酸代谢通路和TRP通道的炎症介质调节通路为显著富集通路[-lg(P)>0.5且pathway impact>0.05],但通过文献查阅发现PPAR信号通路和血管平滑肌收缩通路也都参与了炎症的发生。
3 讨 论
3.1 产后急性子宫内膜炎奶牛炎性因子的变化
细菌感染是导致奶牛发生子宫内膜炎发生的主要原因。研究表明大多数炎性细胞因子在子宫内膜炎奶牛血清中表达水平明显升高[10-11]。本试验研究结果显示产后急性子宫内膜炎奶牛血浆中IL-1、IL-6、IL-8含量显著升高,这与Sakai等[12]研究结果一致。TNF-α可用作奶牛子宫内膜炎诊断标志物[13],当TNF-α的表达量升高时,会对子宫内膜上皮细胞产生直接的影响,造成内皮细胞的损伤,引起子宫内膜炎的发生[14]。同时,高水平的TNF-α可促进IL-1、IL-6和IL-8的释放[14]。IL-1具有较强的促炎活性,可诱导细胞因子和趋化因子等促炎介质,导致炎症事件的发生。在局部,IL-1信号的结果可导致粘附分子上调,促进淋巴细胞募集,随后免疫细胞被激活,炎症进一步放大[15],另外,增多的IL-1还可间接增强子宫的收缩能力,促进子宫内分泌物的排出。子宫内膜上皮细胞和基质细胞分泌IL-6,将巨噬细胞聚集到感染部位,诱导子宫内膜炎的发生。而IL-8是中性粒细胞的重要趋化剂,与多种炎症性疾病(如子宫内膜炎)相关[16]。
IL-10是最重要的抗炎细胞因子,由单核细胞、巨噬细胞、树突状细胞和T细胞的各种亚群产生[17]。IL-10的主要生物学功能是抑制单核细胞和/或巨噬细胞来源的肿瘤坏死因子TNF-α、IL-1、IL-6和IL-8[18]。Justyna等[19]研究报道子宫内膜炎患者的血清中IL-10水平升高,Islam等[20]证明围产期胎衣不下、子宫炎、子宫内膜炎奶牛血清中IL-10浓度明显高于健康奶牛,可作为上述疾病早期诊断的指标。本试验研究结果也显示产后急性子宫内膜炎奶牛血浆中IL-10的表达水平显著增高,与Islam等研究报道一致。
3.2 产后急性子宫内膜炎奶牛花生四烯酸代谢通路的变化
在许多疾病中,氧化脂质被证明可以通过影响氧化应激的发展而调节炎症的发生、发展与转归[21]。研究表明奶牛子宫内膜炎发病率随抗氧化能力的减弱而增加,患子宫内膜炎的奶牛,子宫分泌物中有大量自由基产生,会造成机体的氧化损伤[22-23]。围产期奶牛体内氧化应激的逐步发展是导致炎症反应功能障碍的重要潜在因素,因此围产期奶牛由于能量负平衡而导致的脂质大量动员参与了氧化应激的发展[22]。本试验结果显示试验组奶牛血浆中氧化脂质8,9-EET、11,12-EET、14,15-EET的含量均显著低于对照组。8,9-EET、11,12-EET、14,15-EET是环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)的三种同分异构体,而EETs是花生四烯酸(arachidonic acid,AA)代谢产生的主要活性物质,AA和它的衍生物参与了机体的营养代谢、免疫、炎症反应以及氧化应激[24-25]。Mavangira和Sordillo[21]发现11,12-EET可阻断TNF-α诱导的人脐静脉内皮细胞(HUVEC)氧化应激和凋亡,这主要归因于EETs可介导抗氧化调节剂核因子相关红细胞因子2(NrF2)来减少TNFα诱导的活性氧(ROS)产生。Yu等[26]研究报道,14,15-EET也通过抑制血红素加氧酶抗氧化剂蛋白(HO-1)的转录抑制物的表达来降低氧化应激。此外,Sacerdoti等[27]研究表明,8,9-EET、11,12-EET和14,15-EET增加胰高血糖素释放,而患子宫内膜炎的奶牛血浆中胰岛素含量较健康奶牛低[28]。Li等[29]报道EETs可以通过阻断核转录因子κB(NF-κB)介导的钠-葡萄糖协同转运蛋白2(SGLT2)转录改善葡萄糖稳态,充分说明葡萄糖稳态与氧化脂质代谢紊乱密切相关。因此本试验中试验组奶牛血中8,9-EET、11,12-EET、14,15-EET水平的降低提示奶牛产后急性子宫内膜炎的发生可能与围产期奶牛氧化应激的增强密切相关,同时氧化应激的增强还影响到了围产期奶牛葡萄糖的稳态。
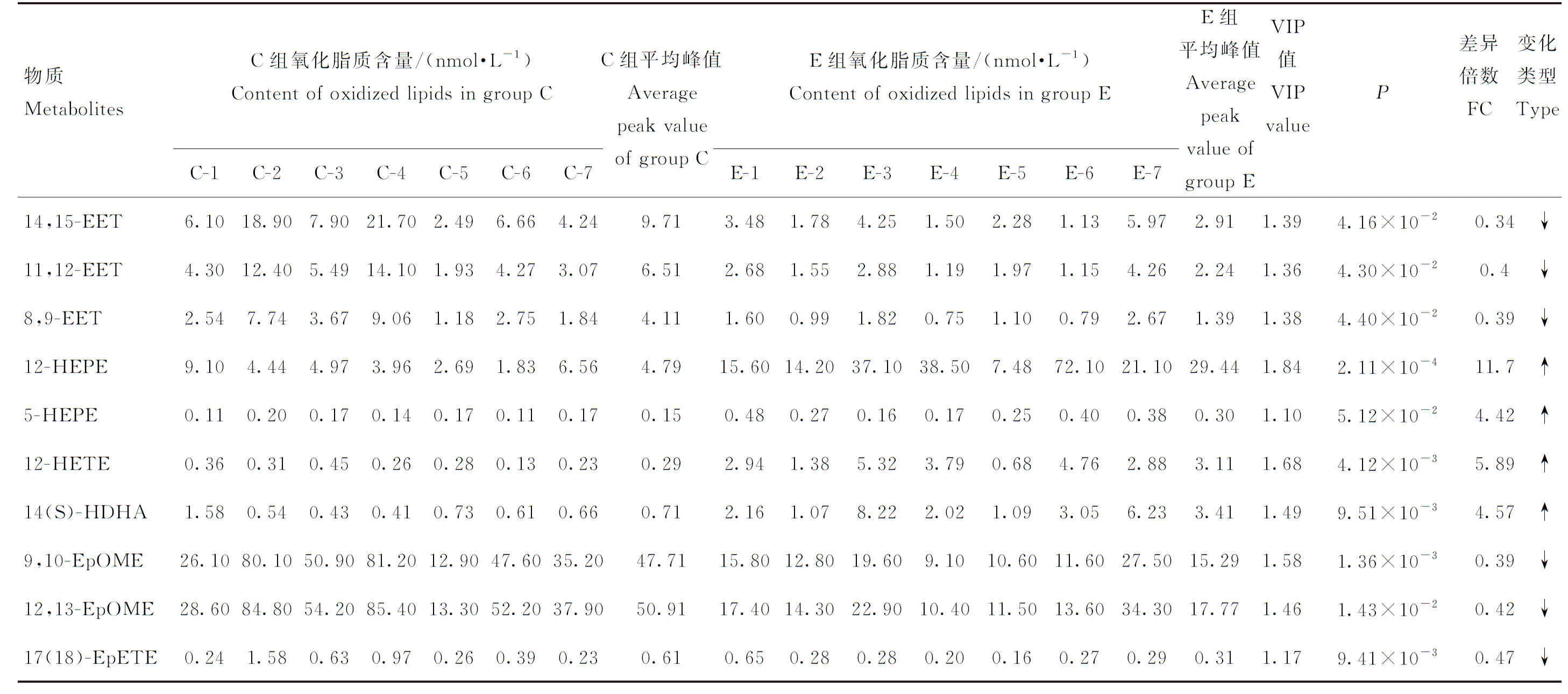
表3 两组血浆差异脂质代谢物及相关参数Table 3 Differential lipid metabolites and related parameters between two groups of plasma
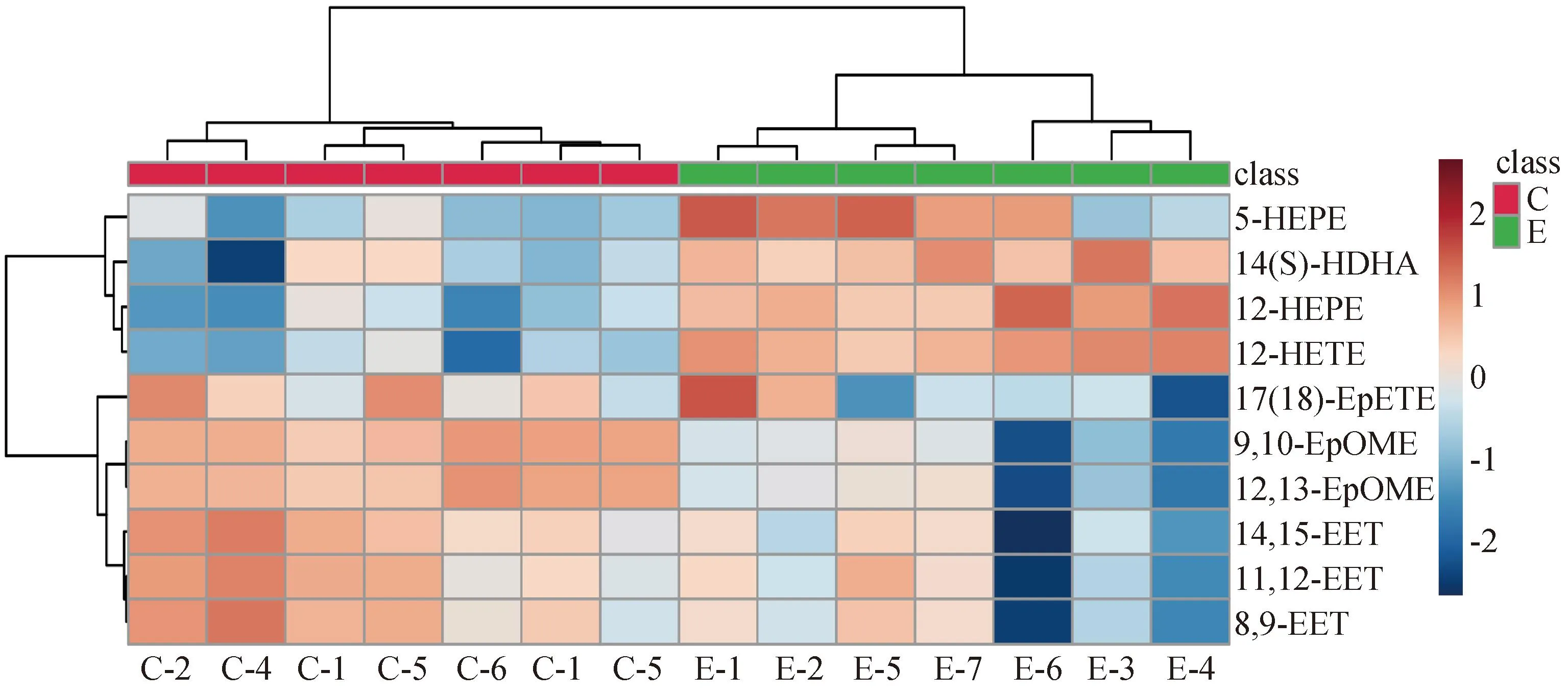
图8 血浆差异脂质代谢物聚类热图Fig.8 Clustering hat map of plasma differential lipid metabolites
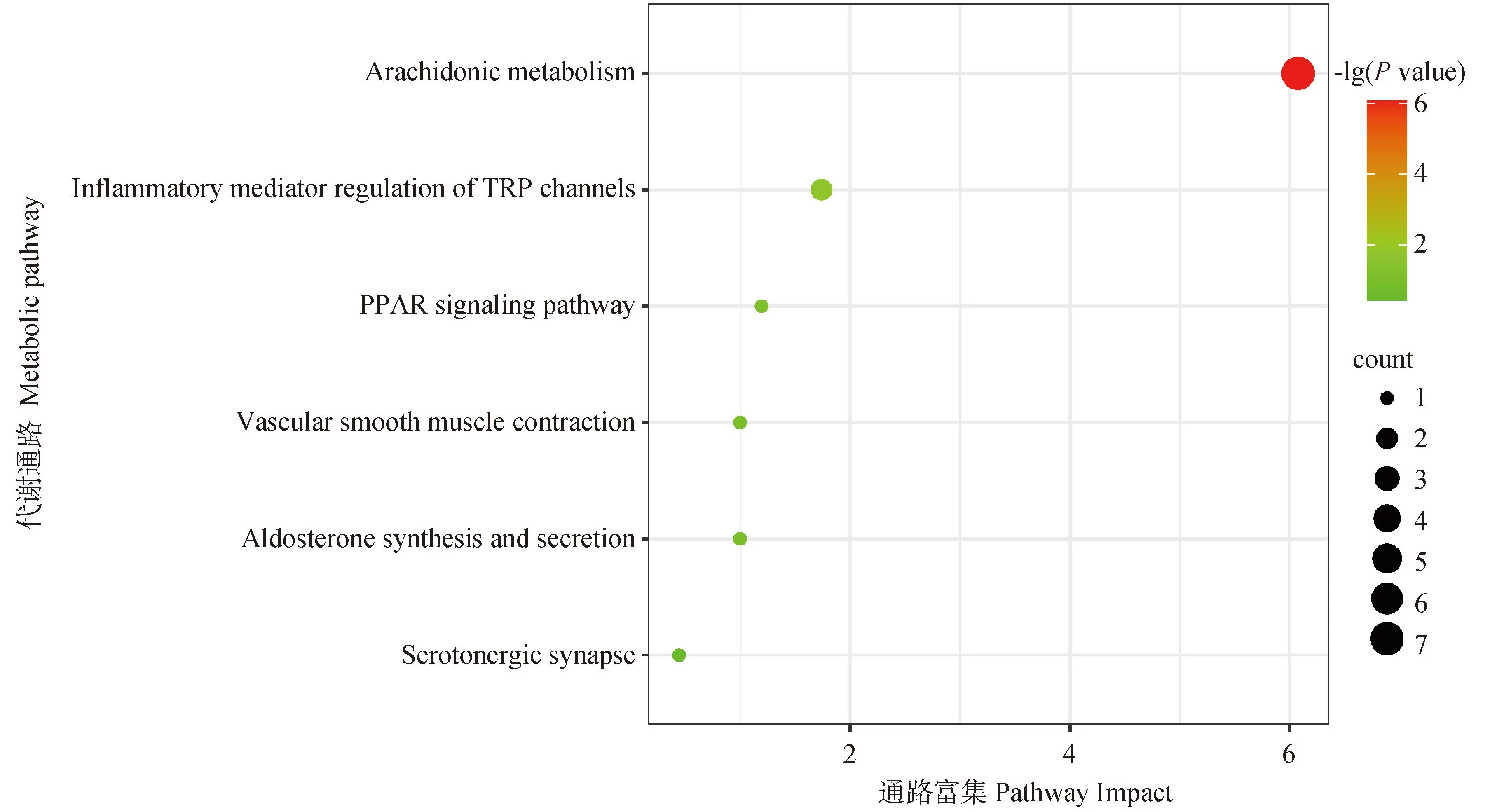
图9 差异脂质代谢物通路富集图Fig.9 Enrichment map of differential lipid metabolite pathways
3.3 产后急性子宫内膜炎奶牛TRP通道的炎症介质调节的变化
本试验富集结果进一步显示,在产后急性子宫内膜炎奶牛下调的8,9-EET和11,12-EET还参与了TRP通道的炎症介质调节通路,瞬时受体电位(TRP)通道已被证明是参与脂质代谢和能量稳态过程的关键调节蛋白,参与疾病的调节、氧化应激和炎症介质的产生[30]。TRP通道可介导氧化应激参与细胞增殖和细胞周期进程,通过氧化应激调节TRP通道激活的治疗方法可以显著减少许多疾病过程中的组织损伤[31]。脂类物质既可与靶向TRP通道直接作用,又可与G蛋白偶联受体结合,从而间接调控TRP通道的功能,因此,TRP通道是一种重要的脂类感受器,可以将输入到各种脂类代谢通路中的信号进行整合并解读[32]。脂质信号、花生四烯酸以及其他类似的多不饱和脂肪酸通过酶促或非酶促氧化反应,产生的类花生酸信号分子,激活瞬时受体电位香草酸亚型通道(TRPV),TRPV的激活可减轻炎症反应[33-34]。Thomson等[35]发现11,12-EET可以激活大鼠脑动脉平滑肌细胞中的TRPV4通道,8,9-EET可以激活人内皮细胞中的TRPV4通道。本试验结果显示,试验组奶牛血浆中8,9-EET和11,12-EET的含量均显著低于对照组,提示奶牛产后急性子宫内膜炎的发生可能与产后脂质代谢紊乱,间接调控TRP通道有关。
3.4 产后急性子宫内膜炎奶牛PPAR信号通路的变化
富集结果显示,在产后急性子宫内膜炎奶牛下调的14,15-EET还参与了PPAR信号通路。过氧化物酶体增殖物激活受体(PPAR)是作为配体激活转录因子发挥作用的核受体,有PPAR-α、PPAR-β/δ和PPAR-γ三种亚型。PPAR与葡萄糖和脂质代谢以及炎症密切相关,并且在能量稳态中起到调节作用[36]。PPAR还在免疫细胞中表达,对免疫细胞的分化具有关键作用。如PPAR-γ通过调控T淋巴细胞的分化,参与机体的免疫应答[37-38]。另有研究报道指出,PPAR-γ可作为抗氧化剂,通过逆转胆固醇的转运,进而抑制氧化应激的启动[39-40]。PPAR配体包括多种脂肪酸,环氧合酶途径的代谢物可以激活PPAR受体。Zhang等[41]已证明PPAR的所有亚型通过抑制促炎细胞因子如TNF-α、IL-1和IL-6的基因表达发挥抗炎作用,从而改善炎症介导的疾病。大量研究还表明PPAR介导的EETs的作用,在炎症相关疾病中至关重要[42-44]。因此本试验结果提示产后急性子宫内膜炎的发生还可能与氧化脂质介导的PPAR信号通路的变化相关。
3.5 产后急性子宫内膜炎血管平滑肌收缩的变化
富集结果显示,在产后急性子宫内膜炎奶牛下调的14,15-EET还参与了血管平滑肌收缩通路。血管平滑肌细胞具有显著的可塑性,可在复杂的炎症过程中与内皮细胞和免疫细胞的细胞间串扰中发挥作用,并且血管平滑肌细胞的收缩能力在维持血管张力方面发挥着关键作用,其收缩能力的减弱、异常的增殖和迁移参与了多种疾病发生与发展的病理过程[45-46]。EETs被假设为内皮衍生的超极化因子,因为它们通过Ca2+依赖性K+通道的激活来超极化和松弛血管平滑肌细胞,而且EETs可增加血管平滑肌细胞的细胞内钙浓度,14,15-EET在一定条件下诱导的细胞外Ca2+流入与血管收缩有关[47]。本试验结果显示试验组奶牛血浆中14,15-EET的含量均显著低于对照组,提示产后急性子宫内膜炎奶牛血管平滑肌细胞的细胞内钙浓度较健康牛低。因此产后急性子宫内膜炎的发生还可能与氧化脂质介导的血管平滑肌收缩的变化相关。
4 结 论
本试验采用脂质组学技术分析产后7 d 急性子宫内膜炎奶牛血浆氧化脂质的变化特征,结果表明产后7 d 急性子宫内膜炎奶牛血浆氧化脂质代谢轮廓发生了显著变化,10种氧化脂质发生了显著变化,其中6种上调,4种下调。研究结果提示氧化脂质可以通过调节花生四烯酸代谢通路、TRP通道的炎症介质调节、PPAR信号通路、血管平滑肌收缩等代谢通路参与产后急性子宫内膜炎的发生与发展。
