脂肪间充质干细胞对小型猪肝缺血再灌注合并肝切除组织细胞焦亡的影响
2024-02-01马亚军焦智慧刘笑凝陆翔羽朴晨曦王洪斌
马亚军,焦智慧,刘笑凝,陆翔羽,刘 涛,王 月,朴晨曦,王洪斌*
(1.东北农业大学动物医学学院,哈尔滨 150030; 2.黑龙江省普通高等学校动物普通疾病防治重点实验室,哈尔滨 150030)
肝IRI是一种病理生理应激状态,指的是肝的血液供应被中断,一定时间后重新恢复血供应所引起的损伤。肝IRI发生后,低氧诱导中性粒细胞和巨噬细胞被激活并在肝中积聚,这些细胞通过旁分泌和自分泌方式分泌活性氧(reactive oxygen species, ROS)和炎性细胞因子来加剧肝IRI[1]。细胞焦亡是一种炎性相关的细胞死亡[2],与其他形式的细胞死亡不同,它是一种由NLRP3炎症小体和caspase-1介导的溶解型细胞死亡。其特征在于质膜被GSDMD透化,导致随后释放细胞内容物[3-4]。研究发现,NLRP3炎症小体作为炎症的关键介质,被组织损伤时细胞内外产生的“危险”信号激活,从而快速启动免疫反应[5]。肝IRI期间,肝细胞、肝窦内皮细胞以及免疫细胞等受到损伤并释放大量的损伤相关分子模式(damage-associated molecular patterns, DAMPs)[6-7]。近几年,NLRP3炎症小体已成为抗炎治疗的新靶点,通过抑制NLRP3炎症小体的激活和下调细胞焦亡能够有效降低炎症反应,改善损伤[8]。已有研究表明NLRP3炎症小体的激活与肝IRI有着密切联系[9]。
间充质干细胞(mesenchymal stem cells, MSCs)是一种可以自我更新的祖细胞,可在特定条件下分化成各种细胞类型。MSCs来自不同来源的成体干细胞,包括骨髓、脂肪组织、脐带、外周血,甚至肿瘤[10]。尽管存在许多MSCs来源,但可以被采取的组织量是有限的,且每次分离培养收获的细胞量也相对较少。相比于其他MSCs,ADSCs可以通过非常微小的侵入性程序(例如吸脂术)重复获得,此获取途径具有低发病率和高产量的MSCs[11]。此外,ADSCs具有比骨髓间充质干细胞更强的细胞分裂能力且同样具有很好的再生能力,可以分化成多种细胞,包括肝细胞,因此ADSCs在细胞治疗和组织工程中具有更大潜力[10,12]。除此之外,ADSCs在抗炎和免疫调节方面也具有调节作用,目前已被发现在多种疾病治疗中拥有很好的发展前景,尤其是免疫性疾病[13]。近些年,许多研究者用ADSCs对IRI的治疗作用进行了大量研究,这里也包括很多ADSCs对肝IRI修复的研究[14-16]。为探究ADSCs对肝IRI损伤的修复机制,作者建立了小型猪肝IRI合并肝切除模型,研究ADSCs对细胞焦亡的调节作用,为ADSCs应用到临床提供新的理论依据。
1 材料与方法
1.1 实验动物
广西巴马小型猪:4~6月龄,重20~25 kg。所有动物均在相同且适宜的环境下饲养,试验前均经过临床和实验室健康检测。
1.2 试验仪器与试剂
气腹机、腹腔镜器械、腹腔镜(日本Olympus公司)、冷光源、高清内窥镜摄像系统(深圳市神州医疗设备有限公司)、实时荧光定量PCR仪(上海罗氏制药有限公司)、二氧化碳培养箱(德国Eppendorf公司)。
注射用丙泊酚(西安力邦制药有限公司)、异氟烷(河北一品制药有限公司)、胎牛血清(美国CLARK公司)、1%青链霉素,1%谷氨酰胺(Solarbio, China)、L-DMEM培养基(美国Invitrogen生命技术有限公司)、IL-1β、IL-18 ELISA试剂盒(江苏晶美生物科技有限公司)、RNA抽提试剂盒(广州美基生物科技有限公司)、β-actin抗体(Cell Signaling Technology),IL-1β抗体(ABmart),IL-18、Caspase1、NLRP3抗体(万类生物),ASC、p-NF-κBp65抗体(Santa Cruz Biotechnology),GSDMD抗体(Affinity Biosciences),NF-κBp65抗体(Proteintech)。
1.3 ADSCs分离与培养
采集小型猪腹股沟处脂肪块,经PBS清洗,剔除血管、筋膜组织,剪碎,然后经0.01%Ⅰ型胶原酶消化、终止、过滤、离心。最终将细胞沉淀重悬于配有10% FBS,1%青链霉素,1%谷氨酰胺的L-DMEM培养液中置于37 ℃、5%CO2的培养箱中进行培养。ADSCs培养至第4代时进行流式鉴定以及诱导分化鉴定。小型猪ADSCs流式鉴定结果显示,CD29、CD90和CD44阳性表达(>95%),CD34阴性(<2%),符合国际细胞治疗学会的定义。标准培养条件下的体外分化培养,ADSCs能够分别分化为成骨细胞、脂肪细胞和肝细胞[17]。
1.4 手术流程
健康巴马小型猪18头被随机分为Sham组、IRI组和ADSCs组,每组6头猪。如前所述,应用腹腔镜技术建立手术模型,进行左半肝切除,右半肝缺血60 min[18]。Sham组只建立气腹,翻动肝叶;IRI组与ADSCs组进行上述手术操作,其中,IRI组和ADSCs组分别在术后即刻通过肝实质注射生理盐水和ADSCs(1×106·kg-1)。于术后1、3、7 d应用腹腔镜技术进行肝组织样本采集。
1.5 血清样本分析
按照使用的试剂盒说明书对血清中的IL-1β和IL-18进行含量检测。
1.6 Real-time PCR
根据制造商说明书提取肝总RNA。然后反转录为cDNA。用SYBR Green 三步法实时荧光定量RT-qPCR检测基因IL-1β、IL-18、NLRP3、ASC、capase1、GSDMD、NF-κBp65以及内参β-actin的表达量。反应程序:95 ℃预变性15 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,最后进行熔解反应。引物由吉林省库美生物科技有限公司合成,引物序列见表1。

表1 PCR引物序列Table 1 PCR Primer sequences
1.7 Western blot
向肝组织样品中加入蛋白裂解液,使用组织匀浆机进行研磨,并在4 ℃下裂解30 min,最后经离心(12 000 r·min-1,4 ℃,5 min)获得含有组织总蛋白的上清液。应用BCA法测定蛋白浓度。使用Buffer(5×)进行蛋白样本处理。通过电泳、转膜、封闭、一抗孵育、二抗孵育、曝光检测样本相应目的蛋白相对表达量。经检测的目的蛋白包括:IL-1β、IL-18、NLRP3、ASC、capase1、GSDMD、NF-κBp65、p-NF-κB以及内参β-actin,使用图像处理应用程序ImageJ对目的条带进行分析。
1.8 统计分析
使用GraphPad Prism 7.0(GraphPad Software, USA)对所有数据进行分析。所有数值均表示为“平均值±SD(标准偏差)”。各组之间的比较通过ANOVA(单向方差分析)进行评估。P<0.05表示差异显著。
2 结 果
2.1 ADSCs对肝IRI合并肝切除诱导的促炎因子分泌的影响
如图1所示,术后1 d时,IRI组与sham组相比,血清中IL-18、IL-1β含量显著增加(P<0.01),肝组织中IL-18、IL-1β基因和蛋白表达水平显著性升高(P<0.01);ADSCs组与sham组相比,血清中IL-18、IL-1β含量显著性增加(P<0.05或P<0.01),肝组织中IL-18、IL-1β基因和蛋白表达水平显著性升高(P<0.01或P<0.05);ADSCs组与IRI组相比,血清中的IL-18、IL-1β含量显著性减少(P<0.01),肝组织中IL-18、IL-1β基因和蛋白表达水平显著性降低(P<0.05或P<0.01)。术后3 d时,IRI组与sham组相比,血清中IL-18、IL-1β含量显著性增加(P<0.01),肝组织中IL-18、IL-1β基因和蛋白表达水平显著性升高(P<0.01);ADSCs组与sham组相比,血清中IL-1β含量显著性增加(P<0.05),肝组织中IL-1β基因和IL-18蛋白表达水平显著性升高(P<0.01);ADSCs与IRI组相比,血清中的IL-18、IL-1β含量显著性减少(P<0.01),肝组织中IL-18、IL-1β基因和蛋白表达水平显著性降低(P<0.01)。术后7 d时,各组血清和肝组织IL-18、IL-1β表达量无显著差异(P>0.05)。以上结果表明,肝IRI合并肝切除损伤能够促进促炎因子IL-18、IL-1β分泌,而ADSCs的干预可有效抑制促炎因子的表达。相关机制研究发现,细胞焦亡可促进炎性因子IL-18、IL-1β的成熟与释放,因此本次研究进一步探究了ADSCs对肝IRI合并肝切除引起的组织细胞焦亡的影响。
2.2 ADSCs对肝IRI合并肝切除诱导的细胞焦亡的影响
如图2所示,术后1 d时,IRI组与sham组相比,细胞焦亡相关因子NLRP3、ASC、Caspase-1和GSDMD基因和蛋白表达水平显著性升高(P<0.01);ADSCs组与sham组相比,基因NLRP3、ASC和Caspase-1转录水平显著性升高(P<0.05),GSDMD无显著性差异(P>0.05),蛋白ASC和Caspase-1呈显著性升高(P<0.01),NLRP3和GSDMD无显著变化(P>0.05);ADSCs组与IRI组相比,NLRP3、ASC、Caspase-1和GSDMD基因与NLRP3、ASC蛋白表达量显著性降低(P<0.01),GSDMD蛋白表达显著(P<0.05)降低。术后3 d时,IRI组与sham组相比,细胞焦亡相关因子NLRP3、ASC、Caspase-1和GSDMD基因和蛋白表达水平显著性升高(P<0.01或P<0.05);ADSCs组与sham组相比,基因ASC、Caspase-1和GSDMD转录水平均显著性升高(P<0.05),NLRP3无显著变化(P>0.05),蛋白NLRP3、ASC和Caspase-1表达水平均显著性升高(P<0.01或P<0.05),GSDMD无显著变化(P>0.05);ADSCs组与IRI组相比,NLRP3、ASC、Caspase-1和GSDMD基因和蛋白表达量均显著性降低(P<0.01或P<0.05)。术后7 d时,IRI组与sham组相比,细胞焦亡相关基因Caspase-1和GSDMD转录水平仍呈显著性升高(P<0.01或P<0.05),细胞焦亡相关蛋白ASC和Caspase-1表达呈显著性升高(P<0.01),其他因子均无显著差异(P>0.05);ADSCs组与sham组无显著差异(P>0.05)。ADSCs组与IRI组相比,基因GSDMD、蛋白ASC、Caspase-1显著降低(P<0.05或P<0.01),基因NLRP3、ASC和蛋白NLRP3、GSDMD均无显著差异(P>0.05)。以上结果表明,肝IRI合并肝切除激活了NLRP3炎症小体,进一步促进GSDMD的切割,ADSCs可抑制NLRP3炎症小体的激活,减少GSDMD的切割,降低NLRP3、ASC、caspase1和GSDMD的表达,抑制肝组织细胞焦亡的发生。
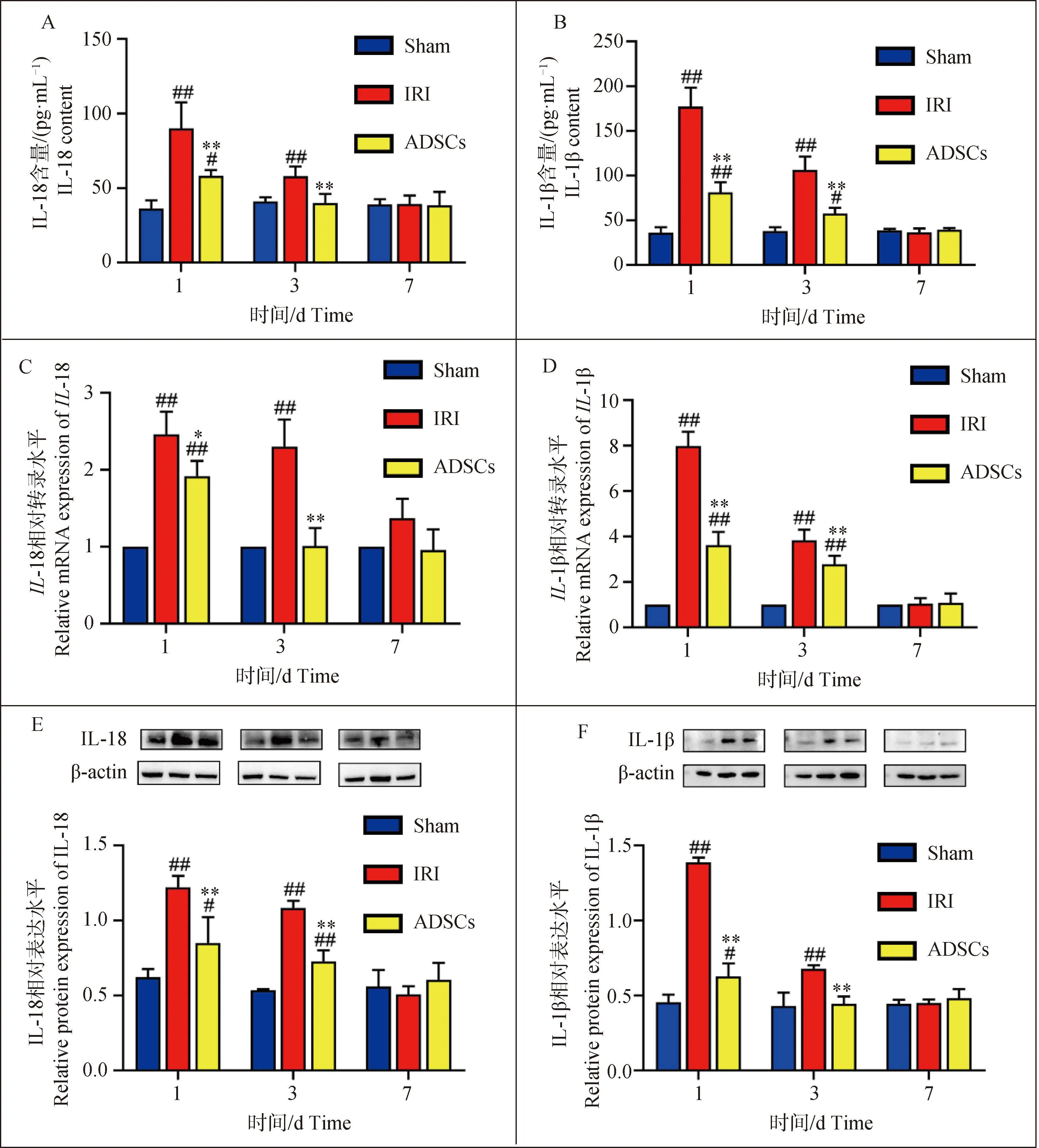
A、B. 促炎因子血清学检测结果;C、D. 促炎因子在肝组织中的基因检测结果;E、F. 促炎因子在肝组织中的蛋白检测结果。与sham组相比,#.P<0.05,##.P<0.01;ADSCs与IRI组相比,*.P<0.05,**.P<0.01 A, B. Serological test results of pro-inflammatory factors; C, D. Genetic testing results of proinflammatory factors in liver tissue; E, F. Protein detection results of pro-inflammatory factors in liver tissue. Compared with the sham group, #.P<0.05, ##.P<0.01; ADSCs compared with the IRI group, *.P<0.05,**.P<0.01图1 促炎因子分泌水平Fig.1 Pro-inflammatory factor secretion level
2.3 ADSCs对肝IRI合并肝切除中的炎症调节因子NF-κB的影响
如图3所示,术后1 d时,IRI组与sham组相比,基因NF-κBp65和蛋白p-NF-κBp65/NF-κBp65呈显著性升高(P<0.01);ADSCs与sham组相比,NF-κBp65基因呈显著性升高(P<0.05),p-NF-κBp65/NF-κBp65无显著性差异(P>0.05);ADSCs组与IRI组相比,基因NF-κBp65和蛋白p-NF-κBp65/NF-κBp65呈显著性降低(P<0.01或P<0.05)。术后3 d时,IRI组与sham组相比,基因NF-κBp65和蛋白p-NF-κBp65/NF-κBp65呈显著性升高(P<0.01);ADSCs与sham组相比,基因NF-κBp65和蛋白p-NF-κBp65/NF-κBp65无显著性差异(P>0.05);ADSCs组与IRI组相比,基因NF-κBp65和蛋白p-NF-κBp65/NF-κBp65呈显著性降低(P<0.01)。术后7 d时,各组之间无显著性差异。NF-κB作为调节炎症反应的主要因子,与NLRP3炎症小体的激活密切相关。以上结果表明,肝IRI合并肝切除后,NF-κBp65相关基因与蛋白明显增加,ADSCs干预后明显抑制了NF-κBp65的表达。结合细胞焦亡相关检测结果发现,ADSCs对于肝IRI合并肝切除引起的肝组织细胞焦亡的抑制作用可能与NF-κBp65信号通路相关。

(图2续 Continued)
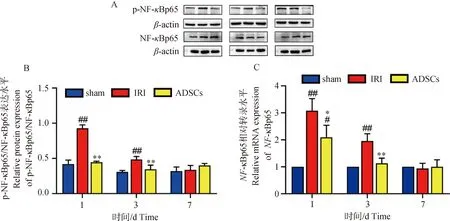
A. NF-κB相关蛋白图;B. p-NF-κB/NF-κB在肝组织中的蛋白表达结果;C. NF-κB在肝组织中的基因表达结果。与sham组相比,#.P<0.05,##.P<0.01;ADSCs与IRI组相比,*.P<0.05,**.P<0.01 A. NF- κ B-related protein map; B. The protein expression results of P-NF-κB/NF-κB in liver tissue; C. The gene expression results of NF- κ B in liver tissue. Compared with the sham group, #.P<0.05, ##.P<0.01; ADSCs compared with the IRI group, *.P<0.05,**.P<0.01图3 NF-κBp65基因与蛋白表达水平Fig.3 NF- κBp65 gene and protein expression levels
3 讨 论
肝IRI是肝切除和肝移植手术不可避免的并发症,对于术后肝功能障碍具有不利影响。目前,肝IRI的损伤机制涉及多个方面,包括微循环功能障碍、缺氧、氧化应激、炎症等[19]。肝内存有多种免疫细胞,肝损伤通常伴有强烈的炎症反应,这是导致肝细胞大量死亡及肝损伤严重的重要因素[20]。作者之前的研究发现,小型猪肝IRI合并肝切除术能够引发严重炎症反应,进一步造成肝损伤[21]。细胞焦亡是一种炎症性程序性细胞死亡模式,参与IRI的发生与发展[22-24]。焦亡发生时,NLRP3作为一种细胞内的模式识别受体(pattern recognition receptor, PRR)能够直接或通过ASC募集 caspase-1前体,从而形成蛋白复合体,即炎性体[25]。当受到刺激时,这些炎性体诱导caspase-1活化,活化后的caspase-1能够促进IL-1β和IL-18的成熟和释放。此外,激活的caspase-1导致GSDMD蛋白裂解并释放其N端结构域,后者聚合并在质膜上形成孔,进而引发细胞炎性死亡。本研究发现,小型猪肝IRI合并肝切除后,NLRP3炎症小体被激活,caspase-1活化,GSDMD表达量增加,炎性细胞因子IL-1β、IL-18大量释放。
MSCs是一种具有再生潜力与免疫调节特性的基质细胞,作为一种特殊的免疫调节物被广泛应用于多种炎症相关疾病的治疗研究[26-29]。在肝IRI小鼠模型中发现,细胞焦亡在肝损伤修复中起着至关重要的作用[30]。Li等[31]发现,肝巨噬细胞的焦亡是肝IRI损伤炎症调节的重要机制。MSCs能够表达多种趋化因子和黏附蛋白来募集免疫细胞并通过直接细胞接触调节免疫,抑制炎症反应[32]。MSCs还能够分泌多种免疫调节因子,包括转化生长因子(transforming growth factor beta,TGF-β)、肝再生增强因子(hepatocyte growth factor, HGF)、白介素10(interleukin-10, IL-10)、白介素1受体拮抗剂(interleukin-1 receptor antagonist, IL-1Ra)等[33]。对此,一项小鼠心肌梗塞模型的研究证明,MSCs通过旁分泌作用抑制血管内皮细胞焦亡,降低心肌梗塞引起的炎症反应[34]。作者以前的研究发现,ADSCs能够减轻肝IRI合并肝切除导致的炎症反应,促进肝再生[35]。为进一步探究ADSCs对小型猪肝IRI合并肝切除引起的细胞焦亡的影响,作者在术后对细胞焦亡相关基因和蛋白进行了检测。结果发现,ADSCs的干预后NLRP3炎症体被抑制,炎性细胞因子(IL-1β、IL-18)释放量显著减少。
NF-κB形成一系列转录因子,在多种生理和病理过程中起重要作用。NF-κB家族有5个成员,p65(RelA)、RelB、c-Rel、p105/p50和p100/p52,所有这些都共享一个共同的氨基末端REL同源结构域RHD[36]。核因子NF-κB作为一种炎症和免疫稳态的主要调节因子,一直被认为是新型抗炎药物的重要靶点[37]。NF-κB 活化增加NLRP3炎性小体相关蛋白编码基因的转录[38],从而激活casapse-1并分离GSDMD的N端和C端以诱导焦亡[39]。因此,作者假设肝IRI诱导NLRP3炎症小体活化与细胞焦亡受NF-κB信号通路调节。针对这一假设,作者对NF-κBp65相关蛋白与基因进行检测发现,与细胞焦亡结果基本一致,肝IRI损伤发生后,NF-κBp65的表达水平显著升高,而ADSCs干预后,其表达被明显抑制。上述结果表明,ADSCs可能通过NF-κB通路降低小型猪肝IRI合并肝切除诱导的细胞焦亡。
4 结 论
小型猪腹腔镜肝IRI合并肝切除术激活了NLRP3炎性体,诱导细胞焦亡发生,而ADSCs的干预能够有效降低细胞焦亡损伤,减少焦亡相关炎性因子的释放,且修复机制可能与炎症重要调节因子NF-κB的抑制有关。
