枯草芽孢杆菌细菌素的分离、表达及稳定性分析
2024-02-01于秀菊张敏爱胡燕姣朱芷葳王海东杨丽华范阔海
于秀菊,张敏爱,胡燕姣,朱芷葳,王海东,杨丽华,范阔海
(1.山西农业大学动物医学学院,太谷 030801;2.太原海关技术中心,太原 030000; 3.山西农业大学生命科学学院,太谷 030801;4.山西农业大学实验动物管理中心,太谷 030801)
近年来,因抗生素残留问题导致耐药菌在卫生、食品、养殖等领域不断出现[1],开发新型抗生素具有重要的实际意义。细菌素是由某些细菌核糖体合成的一类肽[2],乳酸链球菌素(Nisin)是目前研究最深入的细菌素,其在酸性环境下有很强的活性,但在中性和碱性环境时,活性丧失,这个特征限制了其应用[3]。芽孢杆菌细菌素是继乳酸菌细菌素之后的又一大类细菌素[4],至今被发现的枯草芽孢杆菌细菌素已有几十种[5],芽孢杆菌细菌素不仅具有无毒无害、高效抑菌、不易残留、不易产生耐药性[6]等特点,且与乳酸菌细菌素相比,其抗菌谱较广,且具有耐高温、耐酸碱特性[7-9]。加之不同细菌素的氨基酸组成、空间构象、等电点、疏水亲水性存在很大的差异,细菌素多样性特征为其在抗菌领域的应用提供了丰富的选择材料[10]。因此,细菌素成为最有可能替代抗生素的物质之一。
细菌素是细菌的天然产物,往往与多种物质混合存在,成分复杂,存在功效不明确、机制不清楚等问题,从而限制了其应用。目前,研究者主要通过盐析法、有机溶剂沉淀法、吸附法等从培养上清中提取细菌素粗品,随后利用层析柱去除粗品中的杂质,用于SDS-PAGE分析纯度,质谱分析获得细菌素样品中的全部或部分氨基酸残基,结合数据库和分析工具确定生物合成细菌素的基因簇[11-13]。研究表明,细菌素的分子量虽小,但其合成需要一簇基因的共同表达才可完成,还受生长条件等多种因素的影响[14-16]。因此,利用基因工程技术生产细菌素是一条高效、低成本的途径。
羊驼原产于安第斯高原地区的恶劣环境下,具有抗寒抗旱、抗病力强且可产生天然单域抗体等优良特性[17],这些优良特性可能与其肠道特定菌群有关。面对当前我国全面禁止饲料中添加抗生素的形势,充分发挥畜禽种质资源优势,积极筛选高产细菌素的益生菌及其所产细菌素具有重要的意义。本研究采用牛津杯扩散法对羊驼粪便中的产细菌素芽孢杆菌进行分离和筛选,通过形态学观察和16S rRNA对分离菌株进行鉴定,并通过蛋白分离纯化和质谱分析获得分离菌株所产细菌素的氨基酸序列,利用大肠杆菌表达、KTATMpure纯化和活性鉴定获得具有良好抑菌活性和稳定性的重组类细菌素,以期为细菌素产品的开发及其在畜牧养殖、药物治疗等方面的应用奠定理论基础。
1 材料与方法
1.1 指示菌株
金黄色葡萄球菌(Staphylococcusaureus)CMCC26003、表皮葡萄球菌(Staphylococcusepidermidis)CMCC(B) 26069、藤黄微球菌(Micrococcusluteus)CMCC(B) 28001,单增李斯特菌(Listeriamonocytogenes)ATCC19111,大肠杆菌(Escherichiacoli)CMCC 44102、沙门菌(SalmonellaparatyphiA)CMCC(B) 50001保存于山西农业大学羊驼生物工程实验室。
1.2 产细菌素芽孢杆菌的筛选和鉴定
在山西农业大学羊驼繁育基地,随机采取10头羊驼的粪便,按参考文献[9]的方法进行菌的分离,取0.2 g·头-1用100 mL PBS将其制成悬液,37 ℃培养箱孵育1 h后,10倍梯度稀释,取100 μL悬液涂布于LB平板上,37 ℃培养过夜,根据菌落形态、大小和颜色等特征,结合革兰染色,挑选菌落并进行编号。划线进化纯化,牛津杯扩散法测定挑选菌株上清液的抑菌活性。
通过抑菌活性的比较,得到抑菌活性最佳的1株菌,将其送至北京六合华大基因科技有限公司进行16S rRNA 菌种鉴定。运用NCBI的BLAST进行核苷酸序列的比对,使用Cluster Omega 在线分析软件,构建系统发育树,分析目标菌株的同源性和菌种归属。
1.3 细菌素的分离纯化和质谱分析
按照前期研究的方法[18],对B.subtilisSXAU18的无细胞培养液中的细菌素进行分离纯化,获得细菌素溶液。步骤如下:1)室温下,用饱和度为30%~70%的硫酸铵对上清液进行盐析后,10 000×g、4℃离心20 min,PBS重悬蛋白沉淀;2)将蛋白重悬液与氯仿按照1∶1体积比进行混合,震荡15 min,静止15 min,4 500×g、4℃离心10 min,收集中间相,真空浓缩仪干燥,PBS重悬氯仿抽提物;3)将抽提后的重悬液通过10 ku和3 ku超滤离心管进行分子截留,获得>10 ku以上、3~10 ku和<3 ku的蛋白液。以金黄色葡萄球菌为指示菌,检测分离纯化过程细菌素的抑菌活性。蛋白液通过4%~20% SDS-PAGE电泳进行分析,一个泳道进行考马斯亮蓝染色,另4个泳道用0.1% Tween 80清洗3次,30 min·次-1,MilliQ水清洗30 min除去SDS,两个泳道的整胶和两个泳道的条带胶放置到LB固体平板上,分别在上层倾倒含有107CFU·mL-1金黄色葡萄球菌或单增李斯特菌的0.75%TSA软固体培养基,37℃培养过夜,测定其抑菌活性。
将具有抑菌活性的SDS电泳条带送至华大基因进行质谱分析。通过UltiMate3000 (Dionex)和Q Exactive (Thermo Fisher Scientific, Millipore, Massachusetts, USA) LC-MS/MS 质谱仪系统进行蛋白序列分析。获得序列运用Mascot软件(Matrix Science)进行UniProt分析。通过NCBI、APD数据库和ExPASy-ProtParam tool对质谱结果进行分析,预测细菌素的氨基酸序列。
1.4 重组蛋白的表达与纯化
重组质粒的构建:根据大肠杆菌密码子偏好性,将获得的细菌素氨基酸序列进行优化合成,并设计构建原核表达载体的特异性引物,上游和下游引物分别引入HamH I和SalI酶切位点(下划线所示)。BLIS SXAU181引物序列为:F:5′-TAACGGGATCCCCGGTGGATAATACCGCCGT-3′,R:5′- TTGATGTCGACTGCCTGCGGATGAATCATAT-3′;BLIS SXAU182引物序列为:F:5′-TAACGGGATCCGTTGATCCGTATATGTTCGC-3′,R:5′-TTGATGTCGACGAAGCTGCAGCTCACCACAT-3′。以优化序列质粒为模板,PCR扩增目的基因并进行胶回收,用HamH I和SalI分别对胶回收产物和pCold-I表达质粒进行双酶切后进行连接反应,将连接产物转化至DH5α细胞中,通过含Amp的LB平板培养获得阳性单克隆,随机挑取单克隆进行基因测序,将鉴定为阳性的单克隆接种于含有Amp的LB中,培养后提取重组质粒。
蛋白表达:将重组质粒转入BL21(DE3)感受态细胞中,并通过菌液PCR鉴定阳性转化子。将阳性菌按1∶100的体积比转接至含Amp的LB培养基中,37 ℃培养至OD600≈0.6时,加入诱导剂IPTG,同时设定对照组,15 ℃,150 r·min-1,诱导培养12 h。离心收集菌体,用PBS重悬菌体,吹打均匀,超声破碎,离心收集超声后的上清和沉淀,进行SDS-PAGE分析。
蛋白纯化:Ni-IDA-Sepharose Cl-6B亲和层析柱用Ni-IDA Binding-Buffer预平衡后,将超声上清液进行上样,首先,用平衡缓冲液(20 mmol·L-1Tris-HCl,20 mmol·L-1咪唑,0.15 mol·L-1NaCl,pH=8.0)洗脱杂蛋白,之后,用洗脱缓冲液(20 mmol·L-1Tris-HCl,250 mmol·L-1咪唑,0.15 mol·L-1NaCl,pH=8.0)洗脱目的蛋白。收集洗脱峰的蛋白溶液加入透析袋后,PBS透析过夜。纯化样品进行SDS-PAGE和Western blot分析。
1.5 重组细菌素的活性鉴定
以金黄色葡萄球菌和单增李斯特菌作为指示菌,采用牛津杯扩散法对重组细菌素的活性进行鉴定。同时设定氨苄青霉素为阳性对照,PBS为阴性对照。分别在孔中加入180 μL的待测样品,将平板放入培养箱培养过夜,观察并分析抑菌效果。
1.6 重组BLIS SXAU182对温度、pH、人工胃液和人工肠液的耐受性测定
将重组BLIS SXAU182(recombinant-BLIS SXAU182,r-BLIS SXAU182)溶液,分别在70、80、90、100 ℃和121 ℃高压处理30 min,4 ℃条件下放置6 个月。通过牛津杯扩散法测定冷却后的各处理组溶液的抑菌活性,并以未经处理的r-BLIS SXAU182溶液作为对照。
将r-BLIS SXAU182溶液pH分别调至2.0~12.0,37 ℃处理6 h后,将其pH调至7.0,通过牛津杯扩散法检测其处理后溶液的抑菌活性,以pH=7.0的r-BLIS SXAU182溶液作为对照。
参考中华人民共和国兽药典的方法[19],配置人工胃液(simulated gastric fluid, SGF)和人工肠液(simulated intestinal fluid, SIG)[20]。取10 mL的r-BLIS SXAU182溶液分别与90 mL的不同pH的人工胃液或不同浓度胆盐的人工肠液混合,37 ℃条件下处理6 h,通过牛津杯扩散法测定其处理后溶液的抑菌活性,r-BLIS SXAU182溶液与PBS按照体积比1∶9混合作为对照。
2 结 果
2.1 产细菌素芽孢杆菌的筛选和鉴定
通过菌落形态特征和革兰染色初筛到20株疑似芽孢杆菌菌株(编号为F1~20),其无细胞上清液的抑菌活性显示:F15对大肠杆菌具有抑制作用,但作用不显著;F2、F3、F8、F18和F20对金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和单增李斯特菌均具有不同程度的抑制活性。F18与F20的抑菌圈直径均大于15 mm,且F18的抑菌效果优于F20(表1)。因此,将F18作为分离细菌素的目标菌株进行研究。
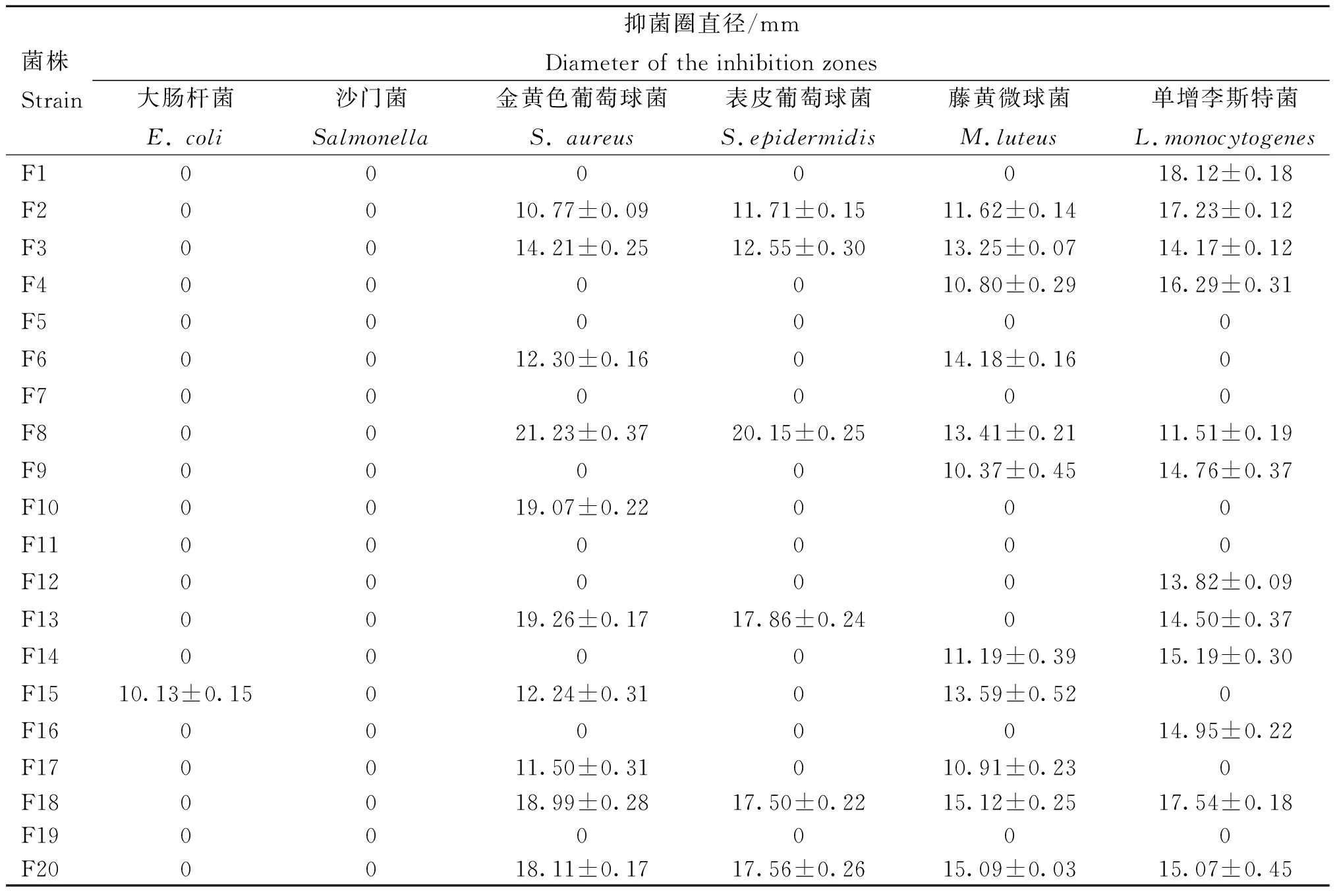
表1 分离菌的抑菌活性测定Table 1 Quantification of the antibacterial activity of isolated strains
经划线培养获得的F18的单克隆菌落呈乳白色,菌落边缘较整齐、扁平、菌落表面光滑不透明,干燥、中等大小,形成“皱醭”,且在液体培养时也会有皱醭形成,为需氧菌(图1A)。革兰染色菌体呈紫色的短杆状,单个或成对排列(图1B)。经16S rRNA通用引物扩增的PCR产物大小为1 446 bp(图1C),与预期的大小一致;F18在系统发育进化树上与枯草芽孢杆菌为同一簇(图1D),且相似度高达99.57%。因此,将其命名为枯草芽孢杆菌SXAU18(B.subtilisSXAU18)。
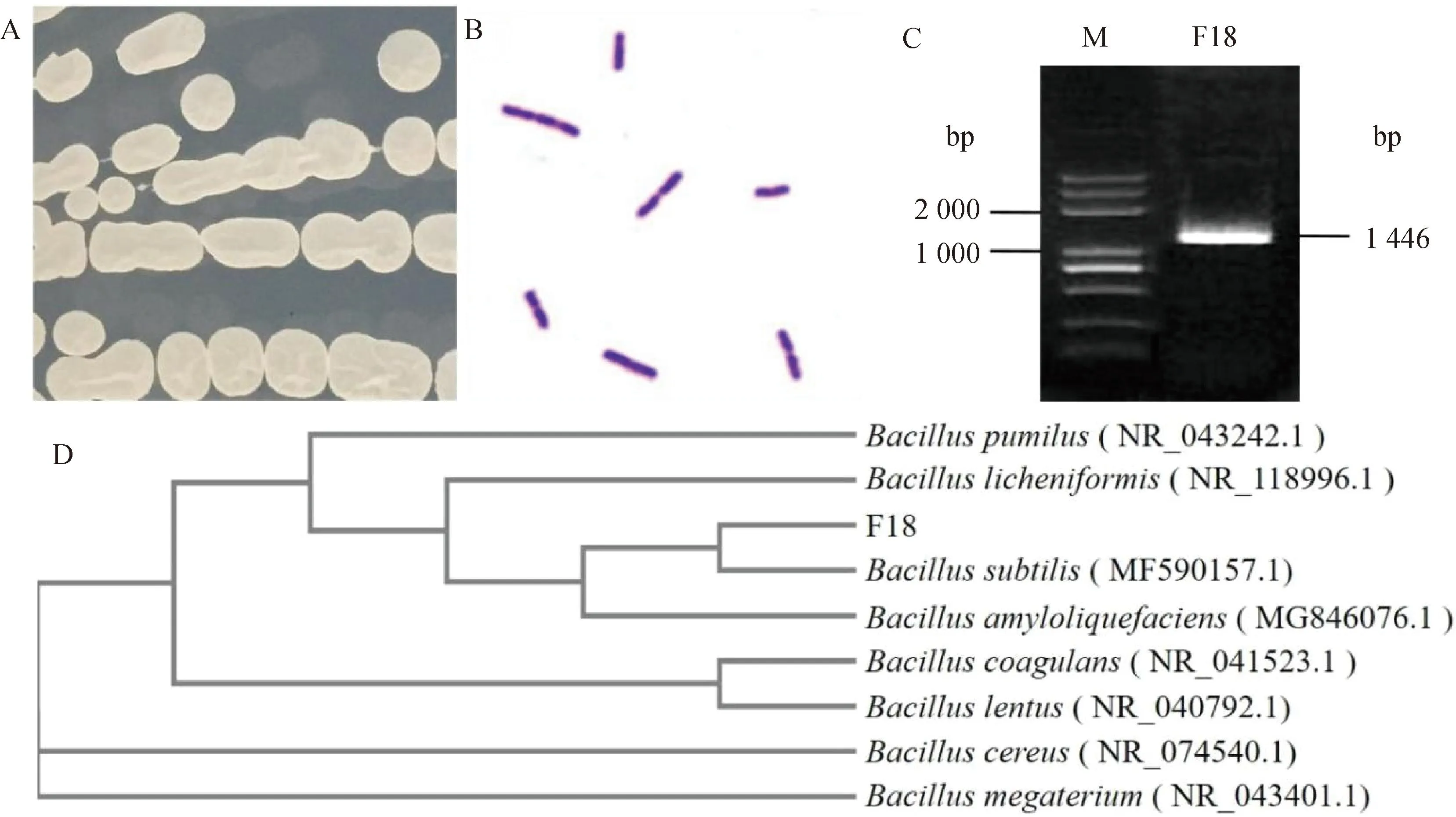
A. 菌落形态;B. 革兰染色;C. 16S rRNA 扩增电泳图;D. 系统发育进化树 A. Growth morphology; B. Gram staining morphology; C. 16S rRNA amplification electrophoresis; D. Evolutionary tree图1 分离株的鉴定结果Fig.1 The identification of the isolate strain
2.2 B. subtilis SXAU18细菌素的分离纯化和氨基酸序列预测
B.subtilisSXAU18无细胞上清液用饱和30%~70%硫酸铵进行盐析后,30%、30%~50%、50%~70%分段蛋白粗提液均具有抑菌活性(图2A、2B);蛋白粗提液通过氯仿抽提和分子截留,分子量>10 ku的蛋白液产生明显的抑菌圈(图2C);将>10 ku的蛋白液进行SDS-PAGE分析,结果显示,在15 ku左右产生明显的抑菌区域(图2D)。具有抑菌活性的SDS胶通过LC-MS/MS质谱分析得到2 447个肽,通过Mascot软件(Matrix Science)对获得的序列进行UniProt分析获得71种蛋白质,结合SDS-PAGE电泳和胶条的抑菌活性鉴定对应的蛋白分子量(10~20 ku),进一步筛选出3种与其分子量大小相符的蛋白质。
将预测的3种蛋白序列在抗菌肽数据库(the Antimicrobial Peptide Database, APD)进行比对,其中两种蛋白没有与其匹配的序列,为未知蛋白,一种蛋白与DarA蛋白(c-di-AMP receptor A)序列一致,DarA蛋白晶体结构已经被解析,该蛋白会形成同源三聚体,从而结合三个环二腺嘌呤核苷酸(PDB: 4RLE)[21]。前期研究证明,DarA蛋白具有抑制金黄色葡萄球菌和单增李斯特菌等革兰阳性菌的活性[18]。根据细菌素分子结构特点,芽孢杆菌细菌素可分为3类[4]:I类为修饰后细菌素,又称羊毛硫细菌素,为小分子多肽(<5 ku);II类为无修饰细菌素,为线性小分子多肽(0.77~10 ku);III类为蛋白质样细菌素(>10 ku),为高分子质量的无修饰蛋白质,其中包括由于遗传、分子或氨基酸结构等方面数据不全,无法进行分类的抗菌蛋白(即类细菌素)。按照芽孢杆菌细菌素的分类方法,这两种未知抑菌蛋白属于芽孢杆菌III类细菌素中类细菌素的范畴,因此将它们命名为类细菌素SXAU181(BLIS SXAU181)和类细菌素SXAU182(BLIS SXAU182)。运用ExPASy-ProtPara工具对这两种未知蛋白进行预测分析,结果显示:BLIS SXAU181有203个的氨基酸残基,预测分子量为22.414 ku,等电点为4.33,分子式为C1 009H1 559N243O321S7,该蛋白较稳定,氨基酸序列为:MKKTFVKKAMLTTAAMTSAALLTFGPDAASAKTPVDNTAVQLQHQAS-TNEDLNTFIDILNQCIYEQDGVYYFDSEKAVE-LGMTKEEAQVIATLWESTSEFFSIVSQCVYLE-DGNYKFDTEKAVELGFTEKEALALEQFFSAV-SLKIHILQAAIVLQDDVYSYDKDAALQAGAT-PLQADVYEKLFSALSQEQLAAIYDMIHPQA;BLIS SXAU182有196个氨基酸残基,预测分子量为20.059 ku,等电点为8.95,分子式为C932H1335N241O251S4,该蛋白较稳定。氨基酸序列为:MYYVDPYMFAGHFYEPWPAFEYEYRYPWPGIGSGAVPGSGGGSGPGIGGGAVPGFGGG-SGPGIGGGAVPGFGGGSGPGIGGGAVPGFGG-SSGPGIGSGASPGFGGAPQGPPPSQIPAKPPKP-QGSQGAVLLVEPITIRPCLFRFTYVWLTNGR-SFWFYPIILGRRSVGGFYWDSSRRRWVYFAL-DTNHIDVVSCSF。

A~B. 硫酸铵盐析后的抑菌活性;C. 氯仿抽提和超滤后各个组分的抑菌活性;D. >10 ku蛋白液的SDS电泳和抑菌活性分析:a.SDS条带对金黄色葡萄球菌(1)和单增李斯特菌(2)具有明显的抑菌活性;b. SDS-PAGE:3. 低分子蛋白marker (40~1.7 ku);4. >10 ku蛋白样品。c. 10~15 ku大小的条带对金黄色葡萄球菌(5)和单增李斯特菌(6)具有明显的抑菌活性 A-B. Antibacterial activity of ammonium sulfate precipitation; C. Antibacterial activity of Chloroform extraction and ultrafiltration collection; D. SDS-PAGE analysis of purified >10 ku protein solution and detection of antibacterial activity on gel: a. Gel overlaid with S. aureus (1) or L. monocytogenes (2) showing a clearing inhibitory zone indicating antibacterial activity associated with over>10 ku band. b. SDS-PAGE: 3. Low-range protein ladder (40-1.7 ku); 4. >10 ku protein sample. c. SDS Gel overlaid with S. aureus (5) or L. monocytogenes(6) showing a clearing inhibitory zone indicating antibacterial activity associated with over 10-15 ku band图2 枯草芽孢杆菌SXAU18所产抑菌物质在分离纯化过程中的抑菌活性检测Fig.2 Antibacterial activity assay of purification process of bacterocin-like substance produced by B. subtilis SXAU18
2.3 类细菌素SXAU181和182的原核表达和纯化
密码子优化合成的基因序列经扩增、酶切、连接构建重组表达质粒。对重组质粒进行双酶切和测序检测目的基因成功连接至pCold-I载体。将阳性重组质粒转化至BL21(DE3),低温条件下经IPTG诱导表达,表达产物经SDS-PAGE分析得出:BLIS SXAU181和182均可通过原核表达系统实现重组表达,裂解后获得的上清和沉淀物中均含有目的蛋白,且产物大部分以可溶性蛋白的形式存在,少量形成包涵体(图3A和图4A)。r-BLIS SXAU181和182大小分别约为25和19 ku;利用镍柱对重组蛋白进行纯化,纯化后的r-BLIS SXAU181和182经SDS-PAGA检测无杂带,均为单一条带,具有较高的浓度和纯度(图3B和图4B)。Western blot分析表明,r-BLIS SXAU181和r-BLIS SXAU182可与鼠抗His单克隆抗体特异性结合,其蛋白大小均与预计大小大致相符(图3C和图4C)。
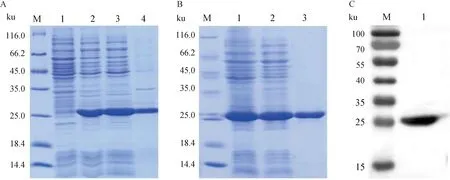
A. 重组BLIS SXAU181蛋白原核表达SDS电泳图:M. 蛋白marker;1. 未诱导组;2. 诱导组;3. 诱导组超声波破碎后上清;4.诱导组超声波破碎后沉淀。B. 重组BLIS SXAU181纯化的SDS电泳图:M. 蛋白marker;1. 超声波破碎后的样品;2. 流出;3. 洗脱。C. 纯化后r-BLIS SXAU 181的Western blot结果:M. 蛋白marker;1. 纯化样品 A. SDS-PAGE of r-BLIS SXAU 181 expression: M. Protein marker; 1. Non-induced group; 2. Induced group; 3. Supernatant after induction of fragmentation; 4. Precipitation after induction of fragmentation. B. SDS-PAGE analysis of r-BLIS SXAU181 purification: M. Protein Marker; 1. Samples after Ultrasonic breaking; 2. Flow-through; 3. Elution. C. Western blot analysis of r-BLIS SXAU181 purification: M. Protein Marker; 1. Purified sample图3 r-BLIS SXAU181表达纯化的SDS-PAGE和Western blot分析Fig.3 SDS-PAGE and Western blot analysis of r-BLIS SXAU181 protein expression and purification

A. 重组BLIS SXAU 182蛋白原核表达SDS电泳图:M. 蛋白marker;1. 未诱导组;2. 诱导组;3.诱导组超声波破碎后上清;4. 诱导组超声波破碎后沉淀。B. 重组BLIS SXAU 182纯化的SDS电泳图:M. 蛋白marker;1. 超声波破碎后的样品;2. 流出;3. 洗脱;C. 纯化后r-BLIS SXAU 182的Western blot结果:M. 蛋白marker;1. 纯化样品 A. SDS-PAGE of r-BLIS SXAU 182 expression: M. Protein marker; 1. Non-induced group; 2. Induced group; 3. Supernatant after induction of fragmentation; 4. Precipitation after induction of fragmentation. B. SDS-PAGE analysis of r-BLIS SXAU182 purification: M. Protein Marker; 1. Samples after Ultrasonic breaking; 2. Flow-through; 3. Elution. C. Western blot analysis of r-BLIS SXAU182 purification: M. Protein Marker; 1. Purified sample图4 r-BLIS SXAU182表达纯化的SDS-PAGE和Western blot分析Fig.4 SDS-PAGE and Western blot analysis of r-BLIS SXAU182 protein expression and purification
2.4 重组类细菌素的活性鉴定
r-BLIS SXAU181没有抑制金黄色葡萄球菌和单增李斯特菌生长的活性(图5A和5E);r-BLIS SXAU182具有抑制金黄色葡萄球菌和单增李斯特菌生长的活性(图5B和5F),r-BLIS SXAU182对金黄色葡萄球菌和单增李斯特菌的抑菌圈直径分别为21.95±0.32和16.30±0.51(表2)。同时,Amp阳性对照孔周围的细菌生长受到了明显的抑制(图5C和5G),Amp对金黄色葡萄球菌和单增李斯特菌产生的抑菌圈直径分别为28.05±0.14和24.71±0.39(表2);PBS阴性对照孔周围的细菌生长未受抑制(图5D和5H),结果表明,通过原核表达系统获得的r-BLIS SXAU181无抑菌活性,r-BLISSXAU182具有良好的抑菌活性。

图5 重组BLIS SXAU182蛋白的抑菌活性分析Fig.5 Antibacterial activity of r-BLIS SXAU182

表2 重组BLIS SXAU182的抑菌活性测定Table 2 Determination of the antibacterial activity of r-BLIS SXAU182
2.5 r-BLIS SXAU182对高温、pH、人工胃液和肠液的稳定性
r-BLIS SXAU182具有较好的热稳定性和pH稳定性(表3)。该细菌素在100 ℃条件下处理30 min后抑菌活性为75%以上,121 ℃处理30 min后抑菌活性仍达60%左右,4 ℃放置6个月对其抑菌活性基本没有影响;该细菌素在pH=2.0~12.0条件下,抑制活性保持在60%以上,最适pH是8.0。该细菌素具有较强的耐胆碱和耐胃蛋白酶能力,在pH=2.0条件下胃蛋白酶作用6 h后抑菌活性保持45%以上,抑菌活性随着pH的上升而增加。在0.9%胆盐浓度条件下作用6 h后抑菌活性仍维持在30%以上,抑菌活性随着胆盐浓度的下降而增加。
3 讨 论
芽孢杆菌属是革兰阳性菌中一个十分多样的菌属,有200多个亚种[22]。芽孢杆菌属产生的细菌素具有不同的分子大小、序列、结构和抗菌活性。芽孢杆菌细菌素是继乳酸菌细菌素后的又一大类细菌素,由于其具有抗菌谱广、无毒无害、耐受性强、不易引起病原菌耐药等特征,因此,近年来芽孢杆菌细菌素的筛选和应用更加备受研究者的关注[5]。随着蛋白质分离纯化技术的快速发展,越来越多的枯草芽孢杆菌的活性物质被认知和应用。例如:Wei等[23]从B.subtilisJS-4中分离到可抑制李斯特菌生长的枯草杆菌素JS-4;Pinontoan等[24]从纳豆中分离到具有纤溶活性的B.subtilisG8;Watanakij等[25]从发酵的谷物中分离到具有降解黄曲霉毒素活性的B.subtilisBCC 42005。本研究从羊驼粪便中分离到20株芽孢杆菌,其中16株菌对指示菌具有不同的抑菌活性。通过对抑菌活性的分析比较,筛选抗菌谱较广、抑菌活性较高的枯草芽孢杆菌SXAU18进行细菌素的分离纯化,质谱分析说明B.subtilisSXAU18产生多种的抑菌蛋白,与研究报道的“绝大多数细菌可产生至少一种细菌素”[26]论述一致。目前已报道的枯草芽孢杆菌细菌素有subtilin、sublancin、subtilosin A、TasA等,但仍有许多抑菌蛋白由于缺少DNA和蛋白的序列信息还没有被分类。本研究分析预测的3种抑菌,其中一种蛋白为DarA蛋白,为已知蛋白,另外两种为未知的蛋白。根据这两种未知蛋白的分子量大小和氨基酸序列特点,并结合芽孢杆菌细菌素分类方法,属于芽孢杆菌III类细菌素中的类细菌素的范畴,从而命名为细菌素SXAU181和182。
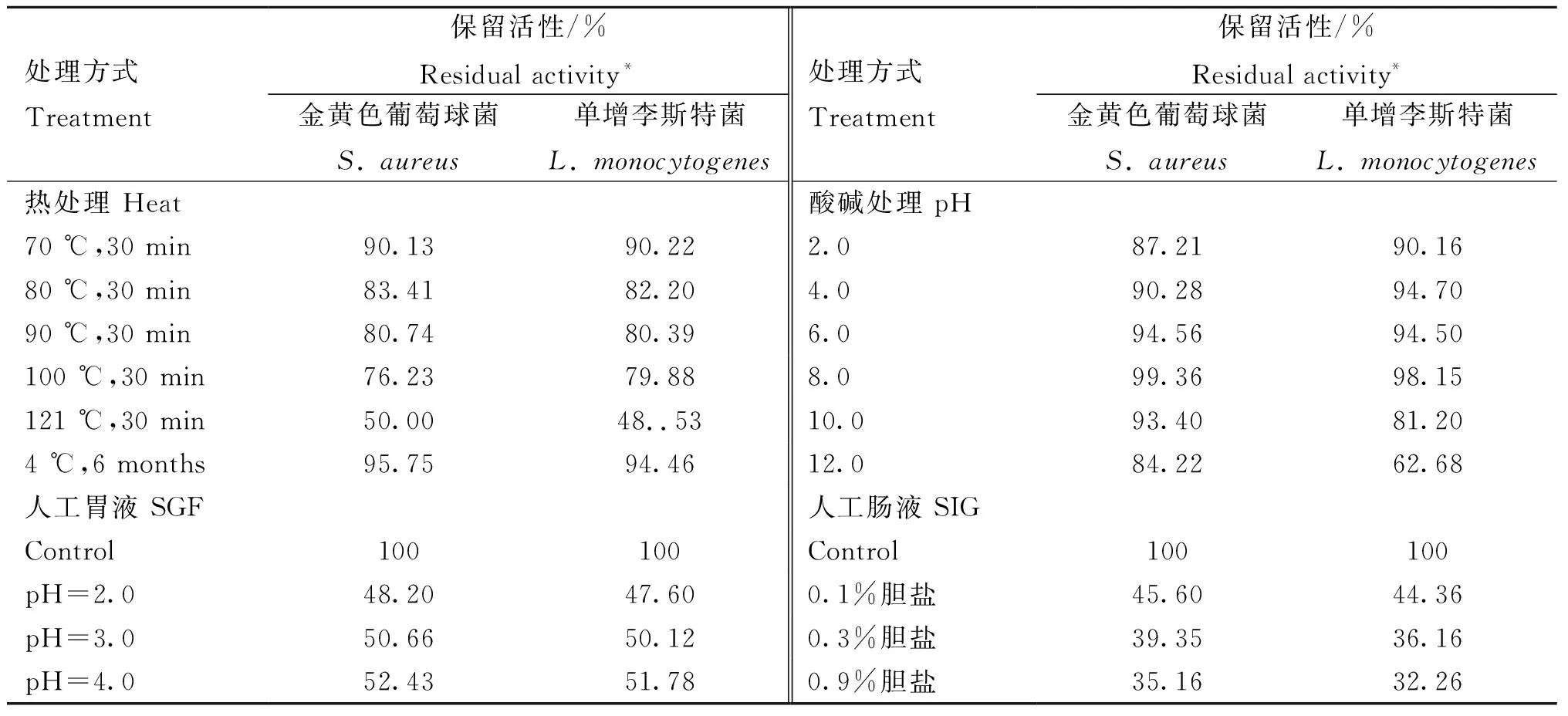
表3 温度和pH对B. Subtilis SXAU18所产细菌素抑菌活性的影响Table 3 Effects of heat, pH on the antimicrobial activity of bactericin from B. Subtilis SXAU18
细菌素虽小,但由一簇基因编码[14-16],且与众多物质混合,提取困难、操作繁琐、产量低。通过蛋白分离和质谱分获得B.subtilisSXAU18所产细菌素的氨基酸序列,分子量大小为10~20 ku,为通过基因工程技术获得重组细菌素提供了基因序列。加之,B.subtilisSXAU18的抗菌谱显示,所产细菌素对金黄色葡萄球菌、藤黄微球菌和单增李斯特杆菌等革兰阳性菌具有抑制其生长的活性,但对于大肠杆菌没有抑制活性。根据这些特点,本研究选择大肠杆菌表达系统作为类细菌素的体外表达系统[27]。大量研究证明,根据表达体系的特性进行密码子的优化可以提高重组蛋白的表达量[28],低温诱导可改变折叠动力学,降低中间折叠体的产生,从而增加可溶性蛋白的表达比例[29]。因此,本研究按照大肠杆菌的密码子偏好性对BLIS SXAU181和182的基因序列进行优化,并选择pCold-I作为表达质粒,进行低温诱导,实现了BLIS SXAU181和182的可溶性表达。最终获得了抑菌活性良好的r-BLIS SXAU182。为BLIS SXAU182功能解析及其应用奠定了理论基础。
细菌素的稳定性极大限制了其应用。乳酸链球菌素(Nisin)在酸性环境下有很强的活性,但在中性和碱性环境下,活性丧失[3]。Lee等[30]从贝氏芽孢杆菌BS2分离到的细菌素Bacbs2,在pH=4~9条件下完全稳定,在pH=1~3时活性减半;在80 ℃处理15 min保持完全活性,但90℃处理15 min或100℃处理10 min活性减半。r-BLIS SXAU182具有较高的稳定性,在暴露121℃高温30 min后保持45%的抑菌活性,pH=2.0~12.0条件下,仍保持60%以上的活性,且具耐胆碱的生物特性。这些优良特性使得BLIS SXAU182在饲料加工、药物治疗等方面具有潜在的应用前景。
4 结 论
从羊驼粪便中筛选到产细菌素的枯草芽孢杆菌SXAU18,从其培养液中分离纯化细菌素,预测获得两种类细菌素的氨基酸序列,并通过大肠杆菌表达系统获得具有抑制金黄色葡萄球菌和单增李斯特杆菌生长且稳定性良好的r-BLIS SXAU182。
